A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מדידת תגובת האכלה מושרה גלוטתיון בהידרה
In This Article
Summary
Here we describe a simple assay for the quantification of the feeding response in hydra induced by the reduced form of glutathione. This assay relies on measuring the distance between the apical end of the tentacle and mouth of hydra.
Abstract
Hydra is among the most primitive organisms possessing a nervous system and chemosensation for detecting reduced glutathione (GSH) for capturing the prey. The movement of prey organisms causes mechanosensory discharge of the stinging cells called nematocysts from hydra, which are inserted into the prey. The feeding response in hydra, which includes curling of the tentacles to bring the prey towards the mouth, opening of the mouth and consequent engulfing of the prey, is triggered by GSH present in the fluid released from the injured prey. To be able to identify the molecular mechanism of the feeding response in hydra which is unknown to date, it is necessary to establish an assay to measure the feeding response. Here, we describe a simple method for the quantitation of the feeding response in which the distance between the apical end of the tentacle and mouth of hydra is measured and the ratio of such distance before and after the addition of GSH is determined. The ratio, called the relative tentacle spread, was found to give a measure of the feeding response. This assay was validated using a starvation model in which starved hydra show an enhanced feeding response in comparison with daily fed hydra.
Introduction
Hydra is the most primitive organism possessing a nervous system and chemosensation for detecting reduced glutathione (GSH) for capturing the prey1. It feeds on a variety of animals such as nematode, crustacea, insect larvae, tadpoles and newly hatched fish1. The movement of these prey organisms causes mechanosensory discharge of the stinging capsules called nematocysts from hydra, which are inserted into the prey2. GSH present in the fluid released from the injured prey subsequently activates the feeding response in hydra which includes curling of the tentacles to bring the prey towards the mouth, opening of the mouth, and consequent engulfing of the prey. Multiple molecules, such as dopamine3, glutamate4, GABA, glycine5, NMDA receptors6, and allatotropin7, have been shown to be involved in the feeding response in hydra. It has also been shown that the chemosensory response induced by GSH is modulated by the feeding status of the animal such that starved hydra exhibited enhanced feeding response1. Such an increase in the GSH sensitivity is biologically relevant since under starvation hydra need to find its prey at higher sensitivity.
Although the feeding response induced by GSH can be clearly observed under microscope, the methods typically used for measuring the feeding response observations are non-quantitative. In most of the cases, the time during which the mouth of the hydra remains open was taken as a measure of the feeding response8,9; whereas in another case, quantitation was based on the number of hydra out of a population showing the feeding response10. However, observing the mouth opening time of the hydra polyps is cumbersome and subject to variation induced by uncontrollable parameters such as the direction of the mouth orientation during observations. Similarly, since the feeding response is a quantitative parameter, population-based approaches are subject to variations/errors caused by the opinion or observational bias of the individual observer. To circumvent these issues we have developed a method for the relative quantification of the feeding response in hydra (Hydra vulgaris Ind-Pune11) based on the distance of the apical end of the tentacle from the mouth of the hydra polyp.
Protocol
1. הידרה תרבות ומדידה של תגובת ההאכלה
- לשמור על פוליפים מפלצת בתרבות על ידי האכלה להם מדי יום עם הארטמיה ולשמור אותם במדיום (חיץ 1 מ"מ טריס-HCl, pH 7.6, 1 מ"מ NaCl, 1 מ"מ CaCl 2, 0.1 מ"מ KCl, ו0.1 מ"מ MgSO 4) הכלולים ב קערת זכוכית על 18 מעלות צלזיוס תחת מחזורים כהים שעות אור-12 12 שעות כפי שתוארה קודם לכן 12.
- למדידת תגובת ההאכלה, להעביר את אחד להבשיל פוליפ מפלצת שיש 5 עד 6 זרועות ולבודדות של צלחת 24 גם. הסר את מדיום השייר מהבאר על ידי הטיית אותו, ולאחר מכן להוסיף באופן מיידי 500 μl של מדיום חדש.
- הכן פתרון גלוטתיון 9 מיקרומטר במדיום מפלצת. מאז פתרון גלוטתיון הוא נוטה לחמצון, תמיד להשתמש בפתרון גלוטתיון מוכן טרי עבור כל ניסוי.
- העבר את הצלחת לפלטפורמת ההדמיה של מיקרוסקופ שיש הפרשות להקלטת תמונה. השתמש ברקע כהה באופן שo ההתנהגותפוליפ מפלצת F ניתן הדמיה בבירור על הרקע המנוגד.
- החדר המשמש לצפייה והדמית ההתנהגות חופשית מפלצת מאורות בעוצמות משתנות, זרמי אוויר ורעש. הפרעות כאלה עלולות לגרום גם פוליפ המפלצת להראות התכווצות של זרועות - גם בהיעדרו של גלוטתיון.
- לאפשר פוליפ להירגע במשך 5 דקות.
- ודא שפוליפ ממוקם לאורך האזור המרכזי של הבאר, כך שההתנהגות ניתן הדמיה ברורה. אם פוליפ הוא בקצה של הבאר, להביא אותה למרכז על ידי שטיפה הבינוני באמצעות פיפטה ושוב לאפשר לו להירגע.
- ללכוד תמונה של מפלצת במצב רגוע. זה יהיה תצפית נקודת אפס-הזמן.
- להוסיף במהירות 9 מיקרומטר פתרון גלוטתיון להגיע לריכוז סופי של 3 מיקרומטר בבאר. בהתאם לצורך של הניסוי והתגובה מוצג על ידי מפלצת, לבדוק מגוון של ריכוזים שונים של גלוטתיון וChoose הריכוז המתאים הנדרש.
- להפעיל את הטיימר מייד לאחר הוספת פתרון גלוטתיון וללכוד תמונות אחרי כל שניות 15-30 ל4-5 דקות. אין לשנות את הגדרות ההגדלה במהלך ההדמיה הזמן לשגות.
- מוסיף את פתרון גלוטתיון בעדינות ובזרימה אחידה כך שעמדתו של בעל החיים ובתהיה מוטרדת מינימאלית בשדה הראייה של המיקרוסקופ. עם זאת, אם פוליפ נע בהרחבה לאחר הוספת פתרון גלוטתיון, להזיז את הצלחת בעדינות רבה כדי להביא את פוליפ בשדה הראייה ללכידת תמונה.
- בניסוי השליטה, להשתמש במדיום חסר גלוטתיון תוך שמירה על כל הפרמטרים האחרים זהים.
- הקפד לבצע את כל שלבי ניסוי מעל במחצית הראשונה של היום - לפני 13:00 להימנע ההשפעה האפשרית של קצב היממה על מידת היענות האכלה.
- פתח כל אחת מהתמונות שנתפסו באמצעות תכנית GNU תמונת מניפולציה (GIMP).
- השתמש בכלי "מדוד" זמין מתפריט> כלים> למדוד כדי לקבוע את המרחק בין קצה קודקוד של כל אחד מהזרועות וhypostome. אם פתיחת הפה הוא ציין בכל אחת מהתמונות, לקבוע את המרחק בין המרכז של הפה נפתח וסוף הפסגה של הזרוע. עיין במרחק זה כמו התפשטות הזרוע.
- לחשב את התפשטות הזרוע הממוצעת לכל פוליפ לפני ואחרי חשיפת גלוטתיון. לחשב את היחס של התפשטות זרוע ממוצעת בנקודת אפס זמן לזה שבכל אחד מנקודתי הזמן שלאחר מכן. יחס זה נקרא התפשטות זרוע היחסית.
- חזור על מדידות לפחות 20 פוליפים.
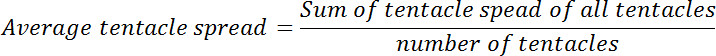

2. שיטת אימות באמצעותדגם רעב
- לרעב, להעביר כמה פוליפים הידרה לקערת זכוכית נפרדת ולא להאכיל אותם במשך 5 ימים. להאכיל את קבוצת הביקורת של כמה פוליפים יומיים עם הארטמיה בקערה בגודל דומה. לשנות את המדיום משני ניסויי קערות יומיים, כדי למנוע צמיחת פטרייה במדיום.
- ביום של הניסוי, להאכיל את קבוצת הביקורת של מפלצת עם הארטמיה עבור שעה 1 ולהשתמש בהידרה אלה לניסויים הבאים לאחר הסרת כל הארטמיה לא נאכלה ומת מהמדיום.
- למדוד את תגובת ההאכלה של המפלצת הרעבה בהשוואה למפלצת מקבוצת ביקורת בשיטה שתוארה קודם לכן בשלב 1. כדי למנוע כל הטיה בשל זמן של התבוננות, להחליף את המידות של כל אחד מרעב ולשלוט פוליפים מפלצת.
תוצאות
גלוטתיון גורם מפלצת להציג סלסול של זרועות לכיוון הפה לצורך שוטף את הטרף. סלסול כזה של זרועות מביא קצות הפסגה של זרועות קרובה יותר לhypostome. התוצאה היא ההפחתה במרווח הזרוע, או את המרחק ליניארי בין סוף הפסגה של הזרוע וhypostome (איור 1). ההתפשטות היחסית הזרוע, או היחס ש?...
Discussion
התנהגות אכילה בהידרה מייצגת את אחת ממערכות chemosensory האבות ביותר בmetazoans. למרות הנוכחות של GSH בנוזל הסרטנים שוחרר לאחר לכידת טרף בסיוע nematocyst זוהתה מזמן 1, לא חלבון GSHR ולא את גן הקידוד המשוער / s מתאפיינת ממפלצת עד כה. ניסיונות מעטים שנעשו לאפיין GSH מחייב חלבונים במפלצת...
Disclosures
The authors declare no competing financial interests.
Acknowledgements
Authors are thankful to K. P. Madhu, Nita Beliappa and staff of the Media Centre of Indian Institute of Science Education and Research, Pune for their help in the video production. The work was supported by funding under the Centre of Excellence program of Department of Biotechnology, Government of India to SG and postdoctoral fellowship by Department of Science and Technology, Government of India to RK.
Materials
| Name | Company | Catalog Number | Comments |
| Cooled Incubator | Panasonic | MIR-254-PE | |
| Microscope | Leica | S8AP0 | |
| Camera for the microscope | Leica | EC3 | |
| Reduced glutathione | Sigma | G4251 | Stored at 4 °C. Bring the bottle to room temperature before opening to avoid oxidation |
| Image editing program | GIMP | Version 2.8 |
References
- Loomis, W. F. Glutathione control of the specific feeding reactions of hydra. Ann. Ny. Acad. Sci. 62, 209-228 (1955).
- Beckmann, A., Ozbek, S. The Nematocyst: a molecular map of the Cnidarian stinging organelle. Int. J. Dev. Biol. 56, 577-582 (2012).
- Venturini, G., Carolei, A. Dopaminergic receptors in Hydra. Pharmacological and biochemical observations. Comp. Biochem. Phys. C. 102, 39-43 (1992).
- Kass-Simon, G., Scappaticci, A. A. Glutamatergic and GABAnergic control in the tentacle effector systems of Hydra vulgaris. Hydrobiologia. 530-531, 67-71 (2004).
- Pierobon, P., Tino, A., Minei, R., Marino, G. Different roles of GABA and glycine in the modulation of chemosensory responses in Hydra vulgaris (Cnidaria, Hydrozoa). Hydrobiology. 178, 59-66 (2004).
- Pierobon, P., Sogliano, C., Minei, R., Tino, A., Porcu, P., Marino, G., Tortiglione, C., Concas, A. Putative NMDA receptors in Hydra: a biochemical and functional study. Eur. J. Neurosci. 20, 2598-2604 (2004).
- Alzugaray, M. E., Adami, M. L., Diambra, L. A., Hernandez-Martinez, S., Damborenea, C., Noriega, F. G., Ronderos, J. R. Allatotropin: An ancestral myotropic neuropeptide involved in feeding. PLoS ONE. 8, (2013).
- Bellis, S. L., Laux, D. C., Rhoads, D. E. Affinity purification of Hydra glutathione binding proteins. FEBS Lett. 354, 320-324 (1994).
- Lenhoff, H. M., Shaw, C. A. The discovery of the GSH receptor in Hydra and its evolutionary significance. Glutathione in the Nervous System. , 25-43 (1998).
- Venturini, G. The hydra GSH receptor. Pharmacological and radioligand binding studies. Comp. Biochem. Phys. C. 87, 321-324 (1987).
- Reddy, P. C., Barve, A., Ghaskadbi, S. Description and phylogenetic characterization of common hydra from India. Curr. Sci. 101, 736-738 (2011).
- Horibata, Y., et al. Unique catabolic pathway of glycosphingolipids in a hydrozoan, Hydra magnipapillata. Involving endoglycoceramidase. J. Biol. Chem. 279, 33379-33389 (2004).
- Koizumi, O., Maeda, N. Rise of feeding threshold in satiated Hydra. J. Comp. Physiol. 142, 75-80 (1981).
- Bellis, S. L., Kass-Simon, G., Rhoads, D. E. Partial characterization and detergent solubilization of the putative glutathione chemoreceptor from hydra. Biochemistry. 31, 9838-9843 (1992).
- Morita, H., Hanai, K. Taste receptor proteins in invertebrates - with special reference to glutathione receptor of hydra. Chem. Senses. 12, 245-250 (1987).
- Colasanti, M., Venturini, G., Merante, A., Musci, G., Lauro, G. M. Nitric oxide involvement in Hydra vulgaris very primitive olfactory- like system. Journal of Neurosci. 17, 493-499 (1997).
- Kuhn, A., Tsiairis, C. D., Williamson, M., Kalbacher, H., Grimmelikhuijzen, C. J., Holstein, T. W., Gründer, S. Three homologous subunits form a high affinity peptide-gated ion channel in Hydra. J. Biol. Chem. 285, 11958-11965 (2010).
- Wang, M., Yao, Y., Kuang, D., Hampson, D. R. Activation of family C G-protein-coupled receptors by the tripeptide glutathione. J. Biol. Chem. 281, 8864-8870 (2006).
- Ruggieri, R. D., Pierobon, P., Kass-Simon, G. Pacemaker activity in hydra is modulated by glycine receptor ligands. Comp. Biochem. Phys. C. 138, 193-202 (2004).
- Ramazani, R. B., Krishnan, H. R., Bergeson, S. E., Atkinson, N. S. Computer automated movement detection for the analysis of behavior. J. Neurosci. Meth. 162, 171-179 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved