Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hydra Glutatyon kaynaklı Besleme Tepki Ölçüm
Bu Makalede
Özet
Here we describe a simple assay for the quantification of the feeding response in hydra induced by the reduced form of glutathione. This assay relies on measuring the distance between the apical end of the tentacle and mouth of hydra.
Özet
Hydra is among the most primitive organisms possessing a nervous system and chemosensation for detecting reduced glutathione (GSH) for capturing the prey. The movement of prey organisms causes mechanosensory discharge of the stinging cells called nematocysts from hydra, which are inserted into the prey. The feeding response in hydra, which includes curling of the tentacles to bring the prey towards the mouth, opening of the mouth and consequent engulfing of the prey, is triggered by GSH present in the fluid released from the injured prey. To be able to identify the molecular mechanism of the feeding response in hydra which is unknown to date, it is necessary to establish an assay to measure the feeding response. Here, we describe a simple method for the quantitation of the feeding response in which the distance between the apical end of the tentacle and mouth of hydra is measured and the ratio of such distance before and after the addition of GSH is determined. The ratio, called the relative tentacle spread, was found to give a measure of the feeding response. This assay was validated using a starvation model in which starved hydra show an enhanced feeding response in comparison with daily fed hydra.
Giriş
Hydra is the most primitive organism possessing a nervous system and chemosensation for detecting reduced glutathione (GSH) for capturing the prey1. It feeds on a variety of animals such as nematode, crustacea, insect larvae, tadpoles and newly hatched fish1. The movement of these prey organisms causes mechanosensory discharge of the stinging capsules called nematocysts from hydra, which are inserted into the prey2. GSH present in the fluid released from the injured prey subsequently activates the feeding response in hydra which includes curling of the tentacles to bring the prey towards the mouth, opening of the mouth, and consequent engulfing of the prey. Multiple molecules, such as dopamine3, glutamate4, GABA, glycine5, NMDA receptors6, and allatotropin7, have been shown to be involved in the feeding response in hydra. It has also been shown that the chemosensory response induced by GSH is modulated by the feeding status of the animal such that starved hydra exhibited enhanced feeding response1. Such an increase in the GSH sensitivity is biologically relevant since under starvation hydra need to find its prey at higher sensitivity.
Although the feeding response induced by GSH can be clearly observed under microscope, the methods typically used for measuring the feeding response observations are non-quantitative. In most of the cases, the time during which the mouth of the hydra remains open was taken as a measure of the feeding response8,9; whereas in another case, quantitation was based on the number of hydra out of a population showing the feeding response10. However, observing the mouth opening time of the hydra polyps is cumbersome and subject to variation induced by uncontrollable parameters such as the direction of the mouth orientation during observations. Similarly, since the feeding response is a quantitative parameter, population-based approaches are subject to variations/errors caused by the opinion or observational bias of the individual observer. To circumvent these issues we have developed a method for the relative quantification of the feeding response in hydra (Hydra vulgaris Ind-Pune11) based on the distance of the apical end of the tentacle from the mouth of the hydra polyp.
Protokol
Besleme Tepki 1. Hydra Kültür ve Ölçüm
- Bir yer alan (1 mM Tris-HCI tamponu, pH 7.6, 1 mM NaCI, 1 mM CaCI2, 0.1 mM KCI ve 0.1 mM MgSO 4) Artemia ile bunların günlük olarak beslemek ve bir ortam içinde tutarak kültürde hidra polipler korumak 12 saat ışık-12 saat karanlık döngüsü altında 18 ° C'de cam kase daha önce 12 açıklandığı gibi.
- Beslenme yanıtının ölçülmesi için bir 24 oyuklu plaka tek bir kuyusuna 5-6 dokunaçlarını sahip hidra polip olgun aktarın. Eğerek kuyudan kalan ortamı çıkarın, sonra hemen taze orta 500 ul ekleyin.
- Hidra ortamda 9 iM glutatyon çözeltisi hazırlayın. Glutatyon çözüm oksidasyona eğilimli olduğundan, her zaman, her deney için taze hazırlanmış glutatyon çözümü kullanın.
- Görüntü kaydı için hükme sahip bir mikroskop görüntüleme platformu için plaka aktarın. Davranış o böyle karanlık bir arka plan kullanınf hydra polip açıkça zıt arka plan karşı görüntülü olabilir.
- Oda gözlem ve dalgalanan şiddetleri, hava akımları ve gürültü ışıklar hydra serbest davranışını görüntülenmesinde kullanılan. Hatta glutatyon yokluğunda - Bu tür bozukluklar arasında ayrıca hidra polip dokunaçlarıyla daralma gösterir neden olabilir.
- Polip 5 dakika dinlenmek için izin verin.
- Polip davranışı açıkça görüntülü olabilir ki iyi böyle bir merkez bölgesi boyunca yer olduğundan emin olun. Polip kuyunun kenarında ise, bir pipet kullanarak orta kızarma tarafından merkeze getirmek ve tekrar dinlenmek için izin verir.
- Rahat bir durumda hidra'nin bir görüntü yakalayın. Bu sıfır zaman noktasında gözlem olacaktır.
- Hızlı bir şekilde de 3 uM'lik bir son konsantrasyon elde etmek üzere 9 uM glutation çözeltisi ekleyin. Hidra'yla gösterilen deney ve yanıtın amacına bağlı olarak, glütatyon ve Choo farklı konsantrasyonları bir dizi testiGerekli uygun konsantrasyona se.
- Hemen 4-5 dakika boyunca her 15-30 saniye sonra glutatyon çözüm ve yakalama görüntüleri ekledikten sonra Sayacı başlatmak. Time-lapse görüntüleme sırasında büyütme ayarlarını değiştirmeyin.
- Yumuşak ve kuyudaki hayvanın konumu minimal mikroskop görüş alanında rahatsız ki, bu tür homojen akımı ile glutation solüsyonu ekleyin. Polip glutatyon çözüm ekledikten sonra yoğun hareket Ancak, görüntü yakalama için görüş alanındaki polip getirmek için çok yavaşça plakasını taşıyın.
- Kontrol deneyinde, benzer diğer tüm parametreleri tutarken orta glutatyon eksik kullanımı.
- 13:00 önce beslenme yanıtının ölçüde sirkadiyen ritmin olası etkisini önlemek için - günün ilk yarısında yukarıdaki deney tüm adımları gerçekleştirmek için emin olun.
- GNU Image Manipulation Program (GIMP) kullanılarak çekilen görüntülerin her açın.
- Tentacles ve hypostome her apikal ucu arasındaki mesafeyi belirlemek için ölçün> Menü> Araçlar edinilebilir "Tedbir" aracını kullanın. Ağız açıklığı herhangi bir görüntü gözlenmesi durumunda, açılan ağız merkezi ve tentacle apikal ucu arasındaki mesafeyi belirler. Tentacle yayılması gibi bu mesafeye bakın.
- Öncesi ve glutatyon maruz kaldıktan sonra her polip için ortalama tentacle yayılmasını hesaplayın. Sonraki zaman noktalarında her birinde edilene sıfır zaman noktasında ortalama dokunaçlı yayılma oranı hesaplanır. Bu oran göreceli dokunaçlı yayılması çağrılır.
- En az 20 polip ölçümleri tekrarlayın.
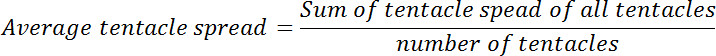

2. Yöntem Doğrulama kullanarakAçlık Modeli
- Açlık için ayrı bir cam kase için birkaç hydra polip aktarmak ve 5 gün boyunca onları beslemek yok. Benzer bir büyüklükte bir kapta artemia ile günde birkaç polip kontrol doyur. Hem deneysel ortamda mantar üremesini önlemek için günlük kase gelen orta değiştirin.
- Deney gününde, 1 saat süre ile Artemia ile Hydra kontrol grubu besleme ve ortam tüm meyvelerin ve ölü Artemia çıkarılmasından sonra, daha sonraki deneyler için, bu Hidra kullanır.
- Nedeniyle gözlem süresi için bir eğilim önlemek için önceki adım 1 'de tarif edilen yöntemle kontrol grubundan hidra ile karşılaştırıldığında aç Hydra besleme yanıtını ölçen aç her ölçümleri alternatif ve Hydra polipler kontrol eder.
Sonuçlar
Glutatyon Hidra av içine çeken amacıyla ağzına doğru dokunaçlarıyla buruşmasına sergilemeye neden olur. Dokunaçlarıyla böyle kıvırma yakın hypostome için dokunaçlarıyla apikal uçlarını getiriyor. Bu Hücrelerin yayılması azalma veya Hücrelerin ve hypostome (Şekil 1), apikal ucu arasındaki doğrusal mesafe ile sonuçlanmaktadır. Göreceli tentacle yayılması, ya da ortalama ahtapotun kollarından oranı önce yayılmış ve glutatyon ekledikten sonra, zamanla azaltan çoklu p...
Tartışmalar
Hydra davranışı Beslenme Metazoan'da en atalarının duyusal sistemlerinden birini temsil eder. Nematosist destekli av yakalama sonra yayımlanan kabuklu sıvısında GSH varlığı uzun zaman önce 1 tespit edildi, ancak GSHR protein ne de olası kodlayan gen / ler ne hidra bugüne kadar karakterize edilmiştir. Birkaç deneme GSH hidra 8, 14, 15, bağlama proteinleri karakterize etmek için yapılmıştır. Ancak, bu farazi reseptör proteinlerin kimlik besleme reaksiyona katkıda bulunmas...
Açıklamalar
The authors declare no competing financial interests.
Teşekkürler
Authors are thankful to K. P. Madhu, Nita Beliappa and staff of the Media Centre of Indian Institute of Science Education and Research, Pune for their help in the video production. The work was supported by funding under the Centre of Excellence program of Department of Biotechnology, Government of India to SG and postdoctoral fellowship by Department of Science and Technology, Government of India to RK.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Cooled Incubator | Panasonic | MIR-254-PE | |
| Microscope | Leica | S8AP0 | |
| Camera for the microscope | Leica | EC3 | |
| Reduced glutathione | Sigma | G4251 | Stored at 4 °C. Bring the bottle to room temperature before opening to avoid oxidation |
| Image editing program | GIMP | Version 2.8 |
Referanslar
- Loomis, W. F. Glutathione control of the specific feeding reactions of hydra. Ann. Ny. Acad. Sci. 62, 209-228 (1955).
- Beckmann, A., Ozbek, S. The Nematocyst: a molecular map of the Cnidarian stinging organelle. Int. J. Dev. Biol. 56, 577-582 (2012).
- Venturini, G., Carolei, A. Dopaminergic receptors in Hydra. Pharmacological and biochemical observations. Comp. Biochem. Phys. C. 102, 39-43 (1992).
- Kass-Simon, G., Scappaticci, A. A. Glutamatergic and GABAnergic control in the tentacle effector systems of Hydra vulgaris. Hydrobiologia. 530-531, 67-71 (2004).
- Pierobon, P., Tino, A., Minei, R., Marino, G. Different roles of GABA and glycine in the modulation of chemosensory responses in Hydra vulgaris (Cnidaria, Hydrozoa). Hydrobiology. 178, 59-66 (2004).
- Pierobon, P., Sogliano, C., Minei, R., Tino, A., Porcu, P., Marino, G., Tortiglione, C., Concas, A. Putative NMDA receptors in Hydra: a biochemical and functional study. Eur. J. Neurosci. 20, 2598-2604 (2004).
- Alzugaray, M. E., Adami, M. L., Diambra, L. A., Hernandez-Martinez, S., Damborenea, C., Noriega, F. G., Ronderos, J. R. Allatotropin: An ancestral myotropic neuropeptide involved in feeding. PLoS ONE. 8, (2013).
- Bellis, S. L., Laux, D. C., Rhoads, D. E. Affinity purification of Hydra glutathione binding proteins. FEBS Lett. 354, 320-324 (1994).
- Lenhoff, H. M., Shaw, C. A. The discovery of the GSH receptor in Hydra and its evolutionary significance. Glutathione in the Nervous System. , 25-43 (1998).
- Venturini, G. The hydra GSH receptor. Pharmacological and radioligand binding studies. Comp. Biochem. Phys. C. 87, 321-324 (1987).
- Reddy, P. C., Barve, A., Ghaskadbi, S. Description and phylogenetic characterization of common hydra from India. Curr. Sci. 101, 736-738 (2011).
- Horibata, Y., et al. Unique catabolic pathway of glycosphingolipids in a hydrozoan, Hydra magnipapillata. Involving endoglycoceramidase. J. Biol. Chem. 279, 33379-33389 (2004).
- Koizumi, O., Maeda, N. Rise of feeding threshold in satiated Hydra. J. Comp. Physiol. 142, 75-80 (1981).
- Bellis, S. L., Kass-Simon, G., Rhoads, D. E. Partial characterization and detergent solubilization of the putative glutathione chemoreceptor from hydra. Biochemistry. 31, 9838-9843 (1992).
- Morita, H., Hanai, K. Taste receptor proteins in invertebrates - with special reference to glutathione receptor of hydra. Chem. Senses. 12, 245-250 (1987).
- Colasanti, M., Venturini, G., Merante, A., Musci, G., Lauro, G. M. Nitric oxide involvement in Hydra vulgaris very primitive olfactory- like system. Journal of Neurosci. 17, 493-499 (1997).
- Kuhn, A., Tsiairis, C. D., Williamson, M., Kalbacher, H., Grimmelikhuijzen, C. J., Holstein, T. W., Gründer, S. Three homologous subunits form a high affinity peptide-gated ion channel in Hydra. J. Biol. Chem. 285, 11958-11965 (2010).
- Wang, M., Yao, Y., Kuang, D., Hampson, D. R. Activation of family C G-protein-coupled receptors by the tripeptide glutathione. J. Biol. Chem. 281, 8864-8870 (2006).
- Ruggieri, R. D., Pierobon, P., Kass-Simon, G. Pacemaker activity in hydra is modulated by glycine receptor ligands. Comp. Biochem. Phys. C. 138, 193-202 (2004).
- Ramazani, R. B., Krishnan, H. R., Bergeson, S. E., Atkinson, N. S. Computer automated movement detection for the analysis of behavior. J. Neurosci. Meth. 162, 171-179 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır