Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mess Glutathion-induzierte Fütterung Antwort in Hydra
In diesem Artikel
Zusammenfassung
Here we describe a simple assay for the quantification of the feeding response in hydra induced by the reduced form of glutathione. This assay relies on measuring the distance between the apical end of the tentacle and mouth of hydra.
Zusammenfassung
Hydra is among the most primitive organisms possessing a nervous system and chemosensation for detecting reduced glutathione (GSH) for capturing the prey. The movement of prey organisms causes mechanosensory discharge of the stinging cells called nematocysts from hydra, which are inserted into the prey. The feeding response in hydra, which includes curling of the tentacles to bring the prey towards the mouth, opening of the mouth and consequent engulfing of the prey, is triggered by GSH present in the fluid released from the injured prey. To be able to identify the molecular mechanism of the feeding response in hydra which is unknown to date, it is necessary to establish an assay to measure the feeding response. Here, we describe a simple method for the quantitation of the feeding response in which the distance between the apical end of the tentacle and mouth of hydra is measured and the ratio of such distance before and after the addition of GSH is determined. The ratio, called the relative tentacle spread, was found to give a measure of the feeding response. This assay was validated using a starvation model in which starved hydra show an enhanced feeding response in comparison with daily fed hydra.
Einleitung
Hydra is the most primitive organism possessing a nervous system and chemosensation for detecting reduced glutathione (GSH) for capturing the prey1. It feeds on a variety of animals such as nematode, crustacea, insect larvae, tadpoles and newly hatched fish1. The movement of these prey organisms causes mechanosensory discharge of the stinging capsules called nematocysts from hydra, which are inserted into the prey2. GSH present in the fluid released from the injured prey subsequently activates the feeding response in hydra which includes curling of the tentacles to bring the prey towards the mouth, opening of the mouth, and consequent engulfing of the prey. Multiple molecules, such as dopamine3, glutamate4, GABA, glycine5, NMDA receptors6, and allatotropin7, have been shown to be involved in the feeding response in hydra. It has also been shown that the chemosensory response induced by GSH is modulated by the feeding status of the animal such that starved hydra exhibited enhanced feeding response1. Such an increase in the GSH sensitivity is biologically relevant since under starvation hydra need to find its prey at higher sensitivity.
Although the feeding response induced by GSH can be clearly observed under microscope, the methods typically used for measuring the feeding response observations are non-quantitative. In most of the cases, the time during which the mouth of the hydra remains open was taken as a measure of the feeding response8,9; whereas in another case, quantitation was based on the number of hydra out of a population showing the feeding response10. However, observing the mouth opening time of the hydra polyps is cumbersome and subject to variation induced by uncontrollable parameters such as the direction of the mouth orientation during observations. Similarly, since the feeding response is a quantitative parameter, population-based approaches are subject to variations/errors caused by the opinion or observational bias of the individual observer. To circumvent these issues we have developed a method for the relative quantification of the feeding response in hydra (Hydra vulgaris Ind-Pune11) based on the distance of the apical end of the tentacle from the mouth of the hydra polyp.
Protokoll
1. Hydra, Kultur und Messung der Fütterung Antwort
- Aufrechtzuerhalten Hydra Polypen in Kultur durch tägliche Fütterung mit Artemia und halten sie in einem Medium (1 mM Tris-HCl-Puffer, pH 7,6, 1 mM NaCl, 1 mM CaCl 2, 0,1 mM KCl und 0,1 mM MgSO 4) in ein enthaltenes Glasschale bei 18 ° C unter 12 Stunden Licht-12 h Dunkel-Zyklen wie zuvor 12 beschrieben.
- Zur Messung der Fütterung Antwort übertragen Älterer Hydra Polypen mit 5 bis 6 Tentakeln zu einem einzelnen Well einer 24-Well-Platte. Entfernen Sie die Restmittel aus dem Brunnen durch Kippen und dann sofort hinzuzufügen 500 ml frisches Medium.
- Bereiten 9 uM Glutathion-Lösung in Hydra Medium. Da die Glutathion-Lösung ist anfällig für Oxidation, immer frisch zubereitet Glutathion-Lösung für jedes Experiment.
- Übertragen Sie die Platte an der Imaging-Plattform eines Mikroskops mit Bestimmungen für die Bildaufzeichnung. Verwenden Sie einen dunklen Hintergrund, so dass das Verhalten of Hydra Polypen deutlich gegen den kontrastierenden Hintergrund abgebildet werden.
- Der Raum für die Beobachtung und Abbildung des Verhaltens von Hydra frei von Lichtern von schwankenden Intensitäten, Luftströmungen und Lärm gewöhnt. Solche Störungen könnten auch dazu führen, die Hydra Polypen zu einer Kontraktion der Tentakeln zeigen - auch in Abwesenheit von Glutathion.
- Lassen Sie die Polypen zu 5 min zu entspannen.
- Sicherzustellen, dass der Polyp ist entlang der zentralen Region der Vertiefung, so daß das Verhalten deutlich abgebildet werden entfernt. Wenn der Polyp ist am Rand des Brunnens, bringen Sie es in die Mitte durch Spülen des Mediums mit einer Pipette und wieder erlauben zu entspannen.
- Aufnehmen eines Bildes von Hydra im entspannten Zustand. Dies wird die Null-Zeitpunkt Beobachtung stehen.
- Hinzuzufügen schnell 9 uM Glutathion-Lösung bis zu einer Endkonzentration von 3 & mgr; M in dem Bohrloch zu erreichen. Je nach dem Zweck des Experiments und der Reaktion von Hydra gezeigt, testen eine Reihe von verschiedenen Konzentrationen von Glutathion und ChooSE Die geeignete Konzentration erforderlich.
- Starten Sie den Timer unmittelbar nach dem Hinzufügen Glutathion-Lösung und die Aufnahmen nach jedem 15 bis 30 sec für 4-5 min. Die Vergrößerungseinstellungen während der Zeitraffer-Bildgebung nicht verändern.
- Hinzufügen des Glutathion-Lösung schonend und gleichförmige Strömung, so dass die Position des Tieres in der gut wäre minimal in das Sichtfeld des Mikroskops gestört werden. Allerdings, wenn der Polyp bewegt ausgiebig nach Zugabe Glutathion-Lösung, bewegen Sie die Platte sehr vorsichtig, um die Polypen in das Blickfeld für die Bilderfassung zu bringen.
- Im Kontrollexperiment verwenden Medium ohne Glutathion und gleichzeitig alle anderen Parameter gleich.
- Achten Sie darauf, alle der oben genannten experimentellen Schritte in der ersten Hälfte des Tages durchzuführen - vor 13.00 Uhr, um die möglichen Auswirkungen der zirkadianen Rhythmus auf das Ausmaß der Fütterung Reaktion zu vermeiden.
- Öffnen Sie jedes der aufgenommenen Bilder unter Verwendung der GNU Image Manipulation Program (GIMP).
- Verwenden Sie die "Messen" Werkzeug von Menü> Extras> Messen Sie den Abstand zwischen apikalen Ende von jedem der Tentakeln und Hypostom bestimmen. Wenn die Mündungsöffnung in einem der Bilder beobachtet, den Abstand zwischen der Mitte des geöffneten Mund und dem apikalen Ende der Tentakel. Beziehen sich auf diese Distanz als die Tentakel Verbreitung.
- Berechnen Sie die durchschnittliche Tentakel Spread für jeden Polypen vor und nach Glutathion Exposition. Berechnen des Verhältnisses der durchschnittlichen Tentakel Ausbreitung bei Null-Zeitpunkt an, dass an jedem der folgenden Zeitpunkte. Dieses Verhältnis wird relativ Tentakel Spread bezeichnet werden.
- Wiederholungsmessungen für mindestens 20 Polypen.
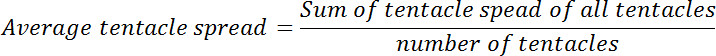

2. Methodenvalidierung mit Hilfe derStarvation Modell
- Für Hunger, übertragen einige Hydra Polypen zu einer separaten Glasschale und sie nicht für 5 Tage zu ernähren. Führen Sie das Kontrollgruppe von wenigen Polypen täglich mit Artemia in einem ähnlich großen Schüssel. Ändern Sie das Medium aus experimentellen Schalen täglich Pilzwachstum im Medium zu vermeiden.
- Am Tag des Experiments, füttern die Kontrollgruppe von Hydra mit Artemia für 1 Stunde und verwenden Sie diese Hydra für die nachfolgenden Experimente nach dem Entfernen aller uneaten und toten Artemia aus dem Medium.
- Messung der Vorschub Reaktion des Hydra ausgehungert im Vergleich mit der Kontrollgruppe Hydra aus der zuvor in Schritt 1 beschrieben, um jegliche Verzerrungen zu vermeiden Verfahren aufgrund Beobachtungszeit, abwechselnd die Messungen jedes der ausgehungert und steuern Hydra Polypen.
Ergebnisse
Glutathion bewirkt Hydra, um ein Kräuseln der Tentakeln zur Mündung zum Zwecke der engulfing die Beute zeigen. Solche Curling von Tentakeln bringt apikalen Enden der Tentakeln näher am Hypostom. Dies resultiert in der Reduktion der Tentakel zu verbreiten, oder der lineare Abstand zwischen apikalen Ende des Tentakel und Hypostom (Abbildung 1). Die relative Tentakel Ausbreitung, oder das Verhältnis der durchschnittlichen Tentakel vor verbreitet und nach Zugabe von Glutathion, gemittelt über mehrere P...
Diskussion
Fressverhalten in Hydra stellt eines der Vorfahren chemosensory Systeme der Metazoen. Obwohl die Anwesenheit von GSH in der nach nematocyst gestützte Beutefang freigegeben Krustentier Flüssigkeit wurde schon vor langer Zeit erkannt 1, haben weder die GSHR Proteine noch die mutmaßlichen kodierenden Gens / s von Hydra bisher geprägt. Einige Versuche wurden unternommen, um zu charakterisieren GSH-bindende Proteine in Hydra 8, 14, 15. Jedoch bleibt die Identität dieser putativen Rezept...
Offenlegungen
The authors declare no competing financial interests.
Danksagungen
Authors are thankful to K. P. Madhu, Nita Beliappa and staff of the Media Centre of Indian Institute of Science Education and Research, Pune for their help in the video production. The work was supported by funding under the Centre of Excellence program of Department of Biotechnology, Government of India to SG and postdoctoral fellowship by Department of Science and Technology, Government of India to RK.
Materialien
| Name | Company | Catalog Number | Comments |
| Cooled Incubator | Panasonic | MIR-254-PE | |
| Microscope | Leica | S8AP0 | |
| Camera for the microscope | Leica | EC3 | |
| Reduced glutathione | Sigma | G4251 | Stored at 4 °C. Bring the bottle to room temperature before opening to avoid oxidation |
| Image editing program | GIMP | Version 2.8 |
Referenzen
- Loomis, W. F. Glutathione control of the specific feeding reactions of hydra. Ann. Ny. Acad. Sci. 62, 209-228 (1955).
- Beckmann, A., Ozbek, S. The Nematocyst: a molecular map of the Cnidarian stinging organelle. Int. J. Dev. Biol. 56, 577-582 (2012).
- Venturini, G., Carolei, A. Dopaminergic receptors in Hydra. Pharmacological and biochemical observations. Comp. Biochem. Phys. C. 102, 39-43 (1992).
- Kass-Simon, G., Scappaticci, A. A. Glutamatergic and GABAnergic control in the tentacle effector systems of Hydra vulgaris. Hydrobiologia. 530-531, 67-71 (2004).
- Pierobon, P., Tino, A., Minei, R., Marino, G. Different roles of GABA and glycine in the modulation of chemosensory responses in Hydra vulgaris (Cnidaria, Hydrozoa). Hydrobiology. 178, 59-66 (2004).
- Pierobon, P., Sogliano, C., Minei, R., Tino, A., Porcu, P., Marino, G., Tortiglione, C., Concas, A. Putative NMDA receptors in Hydra: a biochemical and functional study. Eur. J. Neurosci. 20, 2598-2604 (2004).
- Alzugaray, M. E., Adami, M. L., Diambra, L. A., Hernandez-Martinez, S., Damborenea, C., Noriega, F. G., Ronderos, J. R. Allatotropin: An ancestral myotropic neuropeptide involved in feeding. PLoS ONE. 8, (2013).
- Bellis, S. L., Laux, D. C., Rhoads, D. E. Affinity purification of Hydra glutathione binding proteins. FEBS Lett. 354, 320-324 (1994).
- Lenhoff, H. M., Shaw, C. A. The discovery of the GSH receptor in Hydra and its evolutionary significance. Glutathione in the Nervous System. , 25-43 (1998).
- Venturini, G. The hydra GSH receptor. Pharmacological and radioligand binding studies. Comp. Biochem. Phys. C. 87, 321-324 (1987).
- Reddy, P. C., Barve, A., Ghaskadbi, S. Description and phylogenetic characterization of common hydra from India. Curr. Sci. 101, 736-738 (2011).
- Horibata, Y., et al. Unique catabolic pathway of glycosphingolipids in a hydrozoan, Hydra magnipapillata. Involving endoglycoceramidase. J. Biol. Chem. 279, 33379-33389 (2004).
- Koizumi, O., Maeda, N. Rise of feeding threshold in satiated Hydra. J. Comp. Physiol. 142, 75-80 (1981).
- Bellis, S. L., Kass-Simon, G., Rhoads, D. E. Partial characterization and detergent solubilization of the putative glutathione chemoreceptor from hydra. Biochemistry. 31, 9838-9843 (1992).
- Morita, H., Hanai, K. Taste receptor proteins in invertebrates - with special reference to glutathione receptor of hydra. Chem. Senses. 12, 245-250 (1987).
- Colasanti, M., Venturini, G., Merante, A., Musci, G., Lauro, G. M. Nitric oxide involvement in Hydra vulgaris very primitive olfactory- like system. Journal of Neurosci. 17, 493-499 (1997).
- Kuhn, A., Tsiairis, C. D., Williamson, M., Kalbacher, H., Grimmelikhuijzen, C. J., Holstein, T. W., Gründer, S. Three homologous subunits form a high affinity peptide-gated ion channel in Hydra. J. Biol. Chem. 285, 11958-11965 (2010).
- Wang, M., Yao, Y., Kuang, D., Hampson, D. R. Activation of family C G-protein-coupled receptors by the tripeptide glutathione. J. Biol. Chem. 281, 8864-8870 (2006).
- Ruggieri, R. D., Pierobon, P., Kass-Simon, G. Pacemaker activity in hydra is modulated by glycine receptor ligands. Comp. Biochem. Phys. C. 138, 193-202 (2004).
- Ramazani, R. B., Krishnan, H. R., Bergeson, S. E., Atkinson, N. S. Computer automated movement detection for the analysis of behavior. J. Neurosci. Meth. 162, 171-179 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten