È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Misurazione glutatione indotta risposta alimentazione a Hydra
In questo articolo
Riepilogo
Here we describe a simple assay for the quantification of the feeding response in hydra induced by the reduced form of glutathione. This assay relies on measuring the distance between the apical end of the tentacle and mouth of hydra.
Abstract
Hydra is among the most primitive organisms possessing a nervous system and chemosensation for detecting reduced glutathione (GSH) for capturing the prey. The movement of prey organisms causes mechanosensory discharge of the stinging cells called nematocysts from hydra, which are inserted into the prey. The feeding response in hydra, which includes curling of the tentacles to bring the prey towards the mouth, opening of the mouth and consequent engulfing of the prey, is triggered by GSH present in the fluid released from the injured prey. To be able to identify the molecular mechanism of the feeding response in hydra which is unknown to date, it is necessary to establish an assay to measure the feeding response. Here, we describe a simple method for the quantitation of the feeding response in which the distance between the apical end of the tentacle and mouth of hydra is measured and the ratio of such distance before and after the addition of GSH is determined. The ratio, called the relative tentacle spread, was found to give a measure of the feeding response. This assay was validated using a starvation model in which starved hydra show an enhanced feeding response in comparison with daily fed hydra.
Introduzione
Hydra is the most primitive organism possessing a nervous system and chemosensation for detecting reduced glutathione (GSH) for capturing the prey1. It feeds on a variety of animals such as nematode, crustacea, insect larvae, tadpoles and newly hatched fish1. The movement of these prey organisms causes mechanosensory discharge of the stinging capsules called nematocysts from hydra, which are inserted into the prey2. GSH present in the fluid released from the injured prey subsequently activates the feeding response in hydra which includes curling of the tentacles to bring the prey towards the mouth, opening of the mouth, and consequent engulfing of the prey. Multiple molecules, such as dopamine3, glutamate4, GABA, glycine5, NMDA receptors6, and allatotropin7, have been shown to be involved in the feeding response in hydra. It has also been shown that the chemosensory response induced by GSH is modulated by the feeding status of the animal such that starved hydra exhibited enhanced feeding response1. Such an increase in the GSH sensitivity is biologically relevant since under starvation hydra need to find its prey at higher sensitivity.
Although the feeding response induced by GSH can be clearly observed under microscope, the methods typically used for measuring the feeding response observations are non-quantitative. In most of the cases, the time during which the mouth of the hydra remains open was taken as a measure of the feeding response8,9; whereas in another case, quantitation was based on the number of hydra out of a population showing the feeding response10. However, observing the mouth opening time of the hydra polyps is cumbersome and subject to variation induced by uncontrollable parameters such as the direction of the mouth orientation during observations. Similarly, since the feeding response is a quantitative parameter, population-based approaches are subject to variations/errors caused by the opinion or observational bias of the individual observer. To circumvent these issues we have developed a method for the relative quantification of the feeding response in hydra (Hydra vulgaris Ind-Pune11) based on the distance of the apical end of the tentacle from the mouth of the hydra polyp.
Protocollo
1. Hydra Cultura e misura della risposta alimentazione
- Mantenere polipi idra in coltura somministrando loro giornalmente con artemia e tenerli in un mezzo (buffer 1 mM Tris-HCl, pH 7,6, 1 mM NaCl, 1 mM CaCl 2, 0.1 mM KCl, e 0,1 mM MgSO4) contenuta in un ciotola di vetro a 18 ° C in 12 hr luce-12 hr cicli scuri come descritto in precedenza 12.
- Per misurare la risposta di alimentazione, trasferire matura polipo Hydra avere da 5 a 6 tentacoli di un unico pozzetto di una piastra da 24 pozzetti. Rimuovere la quantità residua dal pozzo inclinandolo, e quindi aggiungere immediatamente 500 ml di terreno fresco.
- Preparare la soluzione glutatione 9 micron di media idra. Poiché la soluzione glutatione è incline all'ossidazione, utilizzare sempre soluzione glutatione appena preparata per ciascun esperimento.
- Trasferire la piastra alla piattaforma di imaging di un microscopio avente disposizioni per la registrazione di immagini. Utilizzare uno sfondo scuro in modo tale che il comportamento of polipo Hydra è chiaramente ripreso sullo sfondo contrastante.
- La sala utilizzata per l'osservazione e l'imaging del comportamento di idra privo di luci di intensità fluttuante, correnti d'aria e rumore. Tali disturbi possono anche causare il polipo idra per mostrare la contrazione dei tentacoli - anche in assenza di glutatione.
- Lasciare che il polipo per rilassarsi per 5 minuti.
- Assicurarsi che il polipo si trova lungo la regione centrale del pozzo in modo che il comportamento può essere ripreso in modo chiaro. Se il polipo è al bordo del pozzo, portarlo al centro irrigando il mezzo con una pipetta e ancora permettergli di rilassarsi.
- Scattare una foto di idra nello stato di rilassamento. Questo sarà il punto di osservazione zero tempo.
- Aggiungere rapidamente 9 mM soluzione glutatione per raggiungere una concentrazione finale di 3 micron nel pozzo. A seconda dello scopo dell'esperimento e la risposta dimostrato da idra, testare una gamma di diverse concentrazioni di glutatione e chooSE la concentrazione appropriata richiesta.
- Avviare il timer immediatamente dopo l'aggiunta di soluzione di glutatione e catturare immagini dopo ogni 15-30 secondi per 4-5 min. Non modificare le impostazioni di ingrandimento durante il time-lapse imaging.
- Aggiungere la soluzione glutatione delicatamente e con un flusso uniforme tale che la posizione dell'animale nel pozzo sarebbe minimamente disturbato nel campo visivo del microscopio. Tuttavia, se il polipo muove ampiamente dopo l'aggiunta di soluzione di glutatione, spostare la piastra delicatamente per portare il polipo nel campo di vista per la cattura delle immagini.
- Nell'esperimento di controllo, utilizzare mezzo privo glutatione mantenendo tutti gli altri parametri identici.
- Assicurarsi di eseguire tutte le fasi sperimentali di cui sopra durante la prima metà della giornata - prima di 1:00 per evitare il possibile effetto del ritmo circadiano del grado di risposta di alimentazione.
- Aprire ciascuna delle immagini acquisite utilizzando il GNU Image Manipulation Program (GIMP).
- Utilizzare lo strumento "Misura" disponibile dal Menu> Strumenti> Misura per determinare la distanza tra l'estremità apicale di ciascuno dei tentacoli e ipostoma. Se l'apertura della bocca è osservata in qualsiasi delle immagini, determinare la distanza tra il centro della bocca aperta e l'estremità apicale del tentacolo. Fare riferimento a questa distanza come la diffusione tentacolo.
- Calcolare lo spread medio tentacolo per ogni polipo prima e dopo l'esposizione glutatione. Calcolare il rapporto di spread medio tentacolo al punto zero tempo a quella in ciascuno dei successivi punti temporali. Questo rapporto si chiamerà relativa diffusione tentacolo.
- Ripetere le misurazioni per almeno 20 polipi.
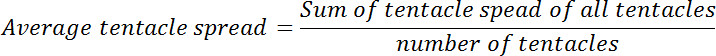

2. Metodo di convalida utilizzando ilLa fame Modello
- Per fame, trasferire alcuni polipi Hydra in una ciotola di vetro separata e non dar loro da mangiare per 5 giorni. Inserire il gruppo di controllo di alcuni polipi al giorno con Artemia in una ciotola di dimensioni simili. Modificare il supporto sia sperimentale ciotole giorno per evitare la crescita di funghi nel mezzo.
- Il giorno dell'esperimento, alimentare il gruppo di controllo di idra con artemia per 1 ora e utilizzare questi hydra per gli esperimenti successivi dopo aver rimosso tutti artemia non consumati e morti dal mezzo.
- Misurare la risposta alimentazione del idra fame in confronto con l'idra dal gruppo di controllo con il metodo descritto in precedenza al punto 1. Per evitare qualsiasi distorsione dovuta al tempo di osservazione, alternare le misurazioni di ciascuno degli fame e controllare polipi idra.
Risultati
Glutatione provoca idra esporre arricciamento dei tentacoli verso la bocca al fine di inghiotte la preda. Tale arricciatura di tentacoli porta estremità apicale dei tentacoli più vicino alla ipostoma. Ciò comporta la riduzione dello spread tentacolo, o la distanza lineare tra l'estremità apicale del tentacolo e ipostoma (Figura 1). La diffusione tentacolo relativa, o il rapporto tra tentacolo media si sviluppa prima e dopo l'aggiunta di glutatione, la media su più polipi riduce nel tempo. L...
Discussione
Comportamento alimentare in idra rappresenta uno dei sistemi chemosensoriali più ancestrali dei metazoi. Sebbene la presenza di GSH nel fluido crostaceo rilasciato dopo la cattura la preda nematocisti-assistita è stato rilevato da tempo 1, né la proteina GSHR né le putativo gene codifica / s sono stati caratterizzati da idra ad oggi. Alcuni tentativi sono stati fatti per caratterizzare GSH proteine leganti in idra 8, 14, 15. Tuttavia, l'identità di queste proteine recettori put...
Divulgazioni
The authors declare no competing financial interests.
Riconoscimenti
Authors are thankful to K. P. Madhu, Nita Beliappa and staff of the Media Centre of Indian Institute of Science Education and Research, Pune for their help in the video production. The work was supported by funding under the Centre of Excellence program of Department of Biotechnology, Government of India to SG and postdoctoral fellowship by Department of Science and Technology, Government of India to RK.
Materiali
| Name | Company | Catalog Number | Comments |
| Cooled Incubator | Panasonic | MIR-254-PE | |
| Microscope | Leica | S8AP0 | |
| Camera for the microscope | Leica | EC3 | |
| Reduced glutathione | Sigma | G4251 | Stored at 4 °C. Bring the bottle to room temperature before opening to avoid oxidation |
| Image editing program | GIMP | Version 2.8 |
Riferimenti
- Loomis, W. F. Glutathione control of the specific feeding reactions of hydra. Ann. Ny. Acad. Sci. 62, 209-228 (1955).
- Beckmann, A., Ozbek, S. The Nematocyst: a molecular map of the Cnidarian stinging organelle. Int. J. Dev. Biol. 56, 577-582 (2012).
- Venturini, G., Carolei, A. Dopaminergic receptors in Hydra. Pharmacological and biochemical observations. Comp. Biochem. Phys. C. 102, 39-43 (1992).
- Kass-Simon, G., Scappaticci, A. A. Glutamatergic and GABAnergic control in the tentacle effector systems of Hydra vulgaris. Hydrobiologia. 530-531, 67-71 (2004).
- Pierobon, P., Tino, A., Minei, R., Marino, G. Different roles of GABA and glycine in the modulation of chemosensory responses in Hydra vulgaris (Cnidaria, Hydrozoa). Hydrobiology. 178, 59-66 (2004).
- Pierobon, P., Sogliano, C., Minei, R., Tino, A., Porcu, P., Marino, G., Tortiglione, C., Concas, A. Putative NMDA receptors in Hydra: a biochemical and functional study. Eur. J. Neurosci. 20, 2598-2604 (2004).
- Alzugaray, M. E., Adami, M. L., Diambra, L. A., Hernandez-Martinez, S., Damborenea, C., Noriega, F. G., Ronderos, J. R. Allatotropin: An ancestral myotropic neuropeptide involved in feeding. PLoS ONE. 8, (2013).
- Bellis, S. L., Laux, D. C., Rhoads, D. E. Affinity purification of Hydra glutathione binding proteins. FEBS Lett. 354, 320-324 (1994).
- Lenhoff, H. M., Shaw, C. A. The discovery of the GSH receptor in Hydra and its evolutionary significance. Glutathione in the Nervous System. , 25-43 (1998).
- Venturini, G. The hydra GSH receptor. Pharmacological and radioligand binding studies. Comp. Biochem. Phys. C. 87, 321-324 (1987).
- Reddy, P. C., Barve, A., Ghaskadbi, S. Description and phylogenetic characterization of common hydra from India. Curr. Sci. 101, 736-738 (2011).
- Horibata, Y., et al. Unique catabolic pathway of glycosphingolipids in a hydrozoan, Hydra magnipapillata. Involving endoglycoceramidase. J. Biol. Chem. 279, 33379-33389 (2004).
- Koizumi, O., Maeda, N. Rise of feeding threshold in satiated Hydra. J. Comp. Physiol. 142, 75-80 (1981).
- Bellis, S. L., Kass-Simon, G., Rhoads, D. E. Partial characterization and detergent solubilization of the putative glutathione chemoreceptor from hydra. Biochemistry. 31, 9838-9843 (1992).
- Morita, H., Hanai, K. Taste receptor proteins in invertebrates - with special reference to glutathione receptor of hydra. Chem. Senses. 12, 245-250 (1987).
- Colasanti, M., Venturini, G., Merante, A., Musci, G., Lauro, G. M. Nitric oxide involvement in Hydra vulgaris very primitive olfactory- like system. Journal of Neurosci. 17, 493-499 (1997).
- Kuhn, A., Tsiairis, C. D., Williamson, M., Kalbacher, H., Grimmelikhuijzen, C. J., Holstein, T. W., Gründer, S. Three homologous subunits form a high affinity peptide-gated ion channel in Hydra. J. Biol. Chem. 285, 11958-11965 (2010).
- Wang, M., Yao, Y., Kuang, D., Hampson, D. R. Activation of family C G-protein-coupled receptors by the tripeptide glutathione. J. Biol. Chem. 281, 8864-8870 (2006).
- Ruggieri, R. D., Pierobon, P., Kass-Simon, G. Pacemaker activity in hydra is modulated by glycine receptor ligands. Comp. Biochem. Phys. C. 138, 193-202 (2004).
- Ramazani, R. B., Krishnan, H. R., Bergeson, S. E., Atkinson, N. S. Computer automated movement detection for the analysis of behavior. J. Neurosci. Meth. 162, 171-179 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon