É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Medindo alimentação resposta induzida por glutationa em Hydra
Neste Artigo
Resumo
Here we describe a simple assay for the quantification of the feeding response in hydra induced by the reduced form of glutathione. This assay relies on measuring the distance between the apical end of the tentacle and mouth of hydra.
Resumo
Hydra is among the most primitive organisms possessing a nervous system and chemosensation for detecting reduced glutathione (GSH) for capturing the prey. The movement of prey organisms causes mechanosensory discharge of the stinging cells called nematocysts from hydra, which are inserted into the prey. The feeding response in hydra, which includes curling of the tentacles to bring the prey towards the mouth, opening of the mouth and consequent engulfing of the prey, is triggered by GSH present in the fluid released from the injured prey. To be able to identify the molecular mechanism of the feeding response in hydra which is unknown to date, it is necessary to establish an assay to measure the feeding response. Here, we describe a simple method for the quantitation of the feeding response in which the distance between the apical end of the tentacle and mouth of hydra is measured and the ratio of such distance before and after the addition of GSH is determined. The ratio, called the relative tentacle spread, was found to give a measure of the feeding response. This assay was validated using a starvation model in which starved hydra show an enhanced feeding response in comparison with daily fed hydra.
Introdução
Hydra is the most primitive organism possessing a nervous system and chemosensation for detecting reduced glutathione (GSH) for capturing the prey1. It feeds on a variety of animals such as nematode, crustacea, insect larvae, tadpoles and newly hatched fish1. The movement of these prey organisms causes mechanosensory discharge of the stinging capsules called nematocysts from hydra, which are inserted into the prey2. GSH present in the fluid released from the injured prey subsequently activates the feeding response in hydra which includes curling of the tentacles to bring the prey towards the mouth, opening of the mouth, and consequent engulfing of the prey. Multiple molecules, such as dopamine3, glutamate4, GABA, glycine5, NMDA receptors6, and allatotropin7, have been shown to be involved in the feeding response in hydra. It has also been shown that the chemosensory response induced by GSH is modulated by the feeding status of the animal such that starved hydra exhibited enhanced feeding response1. Such an increase in the GSH sensitivity is biologically relevant since under starvation hydra need to find its prey at higher sensitivity.
Although the feeding response induced by GSH can be clearly observed under microscope, the methods typically used for measuring the feeding response observations are non-quantitative. In most of the cases, the time during which the mouth of the hydra remains open was taken as a measure of the feeding response8,9; whereas in another case, quantitation was based on the number of hydra out of a population showing the feeding response10. However, observing the mouth opening time of the hydra polyps is cumbersome and subject to variation induced by uncontrollable parameters such as the direction of the mouth orientation during observations. Similarly, since the feeding response is a quantitative parameter, population-based approaches are subject to variations/errors caused by the opinion or observational bias of the individual observer. To circumvent these issues we have developed a method for the relative quantification of the feeding response in hydra (Hydra vulgaris Ind-Pune11) based on the distance of the apical end of the tentacle from the mouth of the hydra polyp.
Protocolo
1. Hydra Cultura e medição da resposta Alimentação
- Manter pólipos hidra em cultura, alimentando-os com diária de artemia e mantendo-os num meio (tampão de 1 mM Tris-HCl, pH 7,6, NaCl a 1 mM, CaCl2 1 mM, KCl 0,1 mM, e 0,1 mM de MgSO4) contida em um tigela de vidro a 18 ° C sob ciclos escuros hr de luz 12 12 h, como descrito anteriormente 12.
- Para a medição da resposta de alimentação, transferir um pólipo amadurecer hidra tendo 5 a 6 tentáculos para um único poço de uma placa de 24 poços. Retirar o meio residual do bem, inclinando-lo, e em seguida, adicione imediatamente 500 mL de meio fresco.
- Preparar a solução de glutationa 9 uM em meio de hidra. Uma vez que a solução de glutationa é propenso a oxidação, usar sempre a glutationa solução preparada de fresco para cada experiência.
- Transferir a placa para a plataforma de imagem de um microscópio tendo disposições para a gravação da imagem. Usar um fundo escuro de tal modo que o comportamentof pólipo hidra pode ser claramente fotografada contra o fundo contrastante.
- A sala utilizada para a observação e imagem do comportamento de hidra livre de luzes de intensidade flutuante, correntes de ar e de ruído. Tais perturbações podem também fazer com que o pólipo hidra para mostrar a contracção dos tentáculos - mesmo na ausência de glutationa.
- Permitir que o pólipo para relaxar por 5 min.
- Certifique-se de que o pólipo está localizado ao longo da região central da cavidade de tal modo que o comportamento pode ser trabalhada de forma clara. Se o pólipo está na borda do poço, trazê-la para o centro, através de lavagem do meio utilizando uma pipeta e novamente permitir que ele relaxe.
- Capturar uma imagem da hidra no estado relaxado. Este será o ponto de observação de tempo zero.
- Rapidamente adicionar 9 uM solução glutationa para alcançar uma concentração final de 3 uM no poço. Dependendo da finalidade da experiência e a resposta mostrada por hidra, testar uma gama de diferentes concentrações de glutationa e Chooif a concentração adequada e necessária.
- Inicie o cronômetro imediatamente após a adição de solução de glutationa e capturar imagens após cada 15-30 seg para 4-5 min. Não altere as configurações de ampliação durante a imagiologia de lapso de tempo.
- Adicionar a solução de glutationa suavemente e com um fluxo uniforme de tal modo que a posição do animal no poço seria minimamente perturbado no campo de visão do microscópio. No entanto, se o pólipo se move extensivamente após a adição de solução de glutationa, mover a placa muito suavemente para trazer o pólipo no campo de visão para a captura de imagem.
- No experimento de controle, use meio sem glutationa, mantendo todos os outros parâmetros idênticos.
- Certifique-se de executar todas as etapas experimentais acima durante a primeira metade do dia - antes de 13:00 para evitar o possível efeito do ritmo circadiano sobre a extensão da resposta de alimentação.
- Abra cada uma das imagens capturadas usando o GNU Image Manipulation Program (GIMP).
- Use a ferramenta "Medida", disponível a partir de Menu> Ferramentas> Medida para determinar a distância entre a extremidade apical de cada um dos tentáculos e hypostome. Se a abertura boca é observado em qualquer uma das imagens, determinar a distância entre o centro da boca aberta e a extremidade apical do tentáculo. Consulte a esta distância como a propagação tentáculo.
- Calcule o spread médio tentáculo para cada pólipo antes e depois da exposição a glutationa. Calcular a proporção de spread médio tentáculo no ponto de tempo zero para que em cada um dos pontos de tempo subsequentes. Esta relação será chamado propagação tentáculo relativa.
- Repita as medições por pelo menos 20 pólipos.
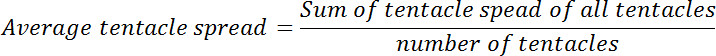

2. método de validação usando oA fome Modelo
- Para a fome, transferir alguns pólipos Hydra para uma tigela de vidro separada e não alimentá-los durante 5 dias. Alimente o grupo de alguns pólipos controle diário com artemia em uma tigela de tamanho similar. Mudar o meio de tanto experimental taças diariamente para evitar crescimento de fungos no meio.
- No dia do experimento, alimentar o grupo de controle hidra com artemia por 1 hr e usá-los hidra para os experimentos posteriores após a remoção de todos artemia não consumidos e mortos a partir do meio.
- Meça a resposta de alimentação da hidra fome em comparação com a hidra do grupo de controle pelo método descrito anteriormente na etapa 1. Para evitar qualquer viés devido ao tempo de observação, alternar as medidas de cada da fome e controlar pólipos hidra.
Resultados
A glutationa faz com que a hidra exibem ondulação dos tentáculos para a boca com a finalidade de engolindo a presa. Essa ondulação de tentáculos traz extremidades apicais dos tentáculos mais perto do hypostome. Isto resulta na redução da propagação tentáculo, ou a distância linear entre a extremidade apical do tentáculo e hipostoma (Figura 1). A propagação tentáculo parente, ou a proporção de tentáculo média espalhar antes e após a adição de glutationa, em média em vários póli...
Discussão
Comportamento alimentar em hidra representa um dos sistemas de quimio mais ancestrais dos metazoários. Embora a presença de GSH no fluido crustáceo libertado após assistida-nematocyst captura de presa foi detectada há muito tempo 1, nem a proteína GSHR nem o gene que codifica putativo / s têm sido caracterizadas a partir da hidra até à data. Poucas tentativas têm sido feitas para caracterizar as proteínas de ligação a GSH na hidra 8, 14, 15. No entanto, a identidade destas proteínas r...
Divulgações
The authors declare no competing financial interests.
Agradecimentos
Authors are thankful to K. P. Madhu, Nita Beliappa and staff of the Media Centre of Indian Institute of Science Education and Research, Pune for their help in the video production. The work was supported by funding under the Centre of Excellence program of Department of Biotechnology, Government of India to SG and postdoctoral fellowship by Department of Science and Technology, Government of India to RK.
Materiais
| Name | Company | Catalog Number | Comments |
| Cooled Incubator | Panasonic | MIR-254-PE | |
| Microscope | Leica | S8AP0 | |
| Camera for the microscope | Leica | EC3 | |
| Reduced glutathione | Sigma | G4251 | Stored at 4 °C. Bring the bottle to room temperature before opening to avoid oxidation |
| Image editing program | GIMP | Version 2.8 |
Referências
- Loomis, W. F. Glutathione control of the specific feeding reactions of hydra. Ann. Ny. Acad. Sci. 62, 209-228 (1955).
- Beckmann, A., Ozbek, S. The Nematocyst: a molecular map of the Cnidarian stinging organelle. Int. J. Dev. Biol. 56, 577-582 (2012).
- Venturini, G., Carolei, A. Dopaminergic receptors in Hydra. Pharmacological and biochemical observations. Comp. Biochem. Phys. C. 102, 39-43 (1992).
- Kass-Simon, G., Scappaticci, A. A. Glutamatergic and GABAnergic control in the tentacle effector systems of Hydra vulgaris. Hydrobiologia. 530-531, 67-71 (2004).
- Pierobon, P., Tino, A., Minei, R., Marino, G. Different roles of GABA and glycine in the modulation of chemosensory responses in Hydra vulgaris (Cnidaria, Hydrozoa). Hydrobiology. 178, 59-66 (2004).
- Pierobon, P., Sogliano, C., Minei, R., Tino, A., Porcu, P., Marino, G., Tortiglione, C., Concas, A. Putative NMDA receptors in Hydra: a biochemical and functional study. Eur. J. Neurosci. 20, 2598-2604 (2004).
- Alzugaray, M. E., Adami, M. L., Diambra, L. A., Hernandez-Martinez, S., Damborenea, C., Noriega, F. G., Ronderos, J. R. Allatotropin: An ancestral myotropic neuropeptide involved in feeding. PLoS ONE. 8, (2013).
- Bellis, S. L., Laux, D. C., Rhoads, D. E. Affinity purification of Hydra glutathione binding proteins. FEBS Lett. 354, 320-324 (1994).
- Lenhoff, H. M., Shaw, C. A. The discovery of the GSH receptor in Hydra and its evolutionary significance. Glutathione in the Nervous System. , 25-43 (1998).
- Venturini, G. The hydra GSH receptor. Pharmacological and radioligand binding studies. Comp. Biochem. Phys. C. 87, 321-324 (1987).
- Reddy, P. C., Barve, A., Ghaskadbi, S. Description and phylogenetic characterization of common hydra from India. Curr. Sci. 101, 736-738 (2011).
- Horibata, Y., et al. Unique catabolic pathway of glycosphingolipids in a hydrozoan, Hydra magnipapillata. Involving endoglycoceramidase. J. Biol. Chem. 279, 33379-33389 (2004).
- Koizumi, O., Maeda, N. Rise of feeding threshold in satiated Hydra. J. Comp. Physiol. 142, 75-80 (1981).
- Bellis, S. L., Kass-Simon, G., Rhoads, D. E. Partial characterization and detergent solubilization of the putative glutathione chemoreceptor from hydra. Biochemistry. 31, 9838-9843 (1992).
- Morita, H., Hanai, K. Taste receptor proteins in invertebrates - with special reference to glutathione receptor of hydra. Chem. Senses. 12, 245-250 (1987).
- Colasanti, M., Venturini, G., Merante, A., Musci, G., Lauro, G. M. Nitric oxide involvement in Hydra vulgaris very primitive olfactory- like system. Journal of Neurosci. 17, 493-499 (1997).
- Kuhn, A., Tsiairis, C. D., Williamson, M., Kalbacher, H., Grimmelikhuijzen, C. J., Holstein, T. W., Gründer, S. Three homologous subunits form a high affinity peptide-gated ion channel in Hydra. J. Biol. Chem. 285, 11958-11965 (2010).
- Wang, M., Yao, Y., Kuang, D., Hampson, D. R. Activation of family C G-protein-coupled receptors by the tripeptide glutathione. J. Biol. Chem. 281, 8864-8870 (2006).
- Ruggieri, R. D., Pierobon, P., Kass-Simon, G. Pacemaker activity in hydra is modulated by glycine receptor ligands. Comp. Biochem. Phys. C. 138, 193-202 (2004).
- Ramazani, R. B., Krishnan, H. R., Bergeson, S. E., Atkinson, N. S. Computer automated movement detection for the analysis of behavior. J. Neurosci. Meth. 162, 171-179 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados