JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
히드라의 글루타티온 유도 먹이 반응을 측정
요약
Here we describe a simple assay for the quantification of the feeding response in hydra induced by the reduced form of glutathione. This assay relies on measuring the distance between the apical end of the tentacle and mouth of hydra.
초록
Hydra is among the most primitive organisms possessing a nervous system and chemosensation for detecting reduced glutathione (GSH) for capturing the prey. The movement of prey organisms causes mechanosensory discharge of the stinging cells called nematocysts from hydra, which are inserted into the prey. The feeding response in hydra, which includes curling of the tentacles to bring the prey towards the mouth, opening of the mouth and consequent engulfing of the prey, is triggered by GSH present in the fluid released from the injured prey. To be able to identify the molecular mechanism of the feeding response in hydra which is unknown to date, it is necessary to establish an assay to measure the feeding response. Here, we describe a simple method for the quantitation of the feeding response in which the distance between the apical end of the tentacle and mouth of hydra is measured and the ratio of such distance before and after the addition of GSH is determined. The ratio, called the relative tentacle spread, was found to give a measure of the feeding response. This assay was validated using a starvation model in which starved hydra show an enhanced feeding response in comparison with daily fed hydra.
서문
Hydra is the most primitive organism possessing a nervous system and chemosensation for detecting reduced glutathione (GSH) for capturing the prey1. It feeds on a variety of animals such as nematode, crustacea, insect larvae, tadpoles and newly hatched fish1. The movement of these prey organisms causes mechanosensory discharge of the stinging capsules called nematocysts from hydra, which are inserted into the prey2. GSH present in the fluid released from the injured prey subsequently activates the feeding response in hydra which includes curling of the tentacles to bring the prey towards the mouth, opening of the mouth, and consequent engulfing of the prey. Multiple molecules, such as dopamine3, glutamate4, GABA, glycine5, NMDA receptors6, and allatotropin7, have been shown to be involved in the feeding response in hydra. It has also been shown that the chemosensory response induced by GSH is modulated by the feeding status of the animal such that starved hydra exhibited enhanced feeding response1. Such an increase in the GSH sensitivity is biologically relevant since under starvation hydra need to find its prey at higher sensitivity.
Although the feeding response induced by GSH can be clearly observed under microscope, the methods typically used for measuring the feeding response observations are non-quantitative. In most of the cases, the time during which the mouth of the hydra remains open was taken as a measure of the feeding response8,9; whereas in another case, quantitation was based on the number of hydra out of a population showing the feeding response10. However, observing the mouth opening time of the hydra polyps is cumbersome and subject to variation induced by uncontrollable parameters such as the direction of the mouth orientation during observations. Similarly, since the feeding response is a quantitative parameter, population-based approaches are subject to variations/errors caused by the opinion or observational bias of the individual observer. To circumvent these issues we have developed a method for the relative quantification of the feeding response in hydra (Hydra vulgaris Ind-Pune11) based on the distance of the apical end of the tentacle from the mouth of the hydra polyp.
프로토콜
먹이 응답 1. 히드라 문화 및 측정
- 에 포함 (1 mM 트리스 - 염산 완충액, pH를 7.6, 1 ㎜의 NaCl, 1 mM의 염화칼슘 2, 0.1 mM의 KCl을, 0.1 mM의 황산을) 아테 매일 그들을 먹이 매체를 유지하여 문화의 히드라 폴립을 유지 12 시간 빛-12 시간 어두운 사이클에서 18 ° C에서 유리 그릇은 이전 12 설명 된대로.
- 급전 반응을 측정하기위한, 하나의 24- 웰 플레이트의 한 웰에 5-6 촉수를 갖는 히드라 폴립 성숙 옮긴다. 를 기울여 우물에서 잔류 매체를 제거하고 즉시 신선한 매체의 500 μl를 추가합니다.
- 히드라 매체에 9 μm의 글루타티온 솔루션을 준비합니다. 글루타티온 솔루션이 산화하는 경향이 있기 때문에, 항상 각 실험에 대한 새로 제조 된 글루타티온 솔루션을 사용합니다.
- 화상 기록을위한 규정을 가지는 현미경의 이미징 플랫폼에 전송 플레이트. 행동 O 그 같은 어두운 배경을 사용하여F 히드라 폴립 명확하게 대비되는 배경 이미지를 만들 수 있습니다.
- 방은 관찰하고 변동 강도, 공기 흐름 및 소음의 조명에서 히드라 무료의 동작을 이미징에 사용됩니다. 심지어 글루타티온의 부재 - 이러한 장애는 히드라 폴립은 촉수의 수축을 보여 발생할 수 있습니다.
- 용종이 5 분 동안 휴식을 취할 수 있습니다.
- 용종이 문제가 명확하게 영상화 할 수 있음을 잘 같은의 중심 지역을 따라 위치하고 있는지 확인합니다. 용종이 우물의 가장자리에있는 경우, 피펫을 사용하여 매체를 세척하여 센터로 가져가 다시 휴식 할 수 있습니다.
- 편안한 상태에서 히드라의 이미지를 캡처합니다. 이것은 제로 시점 관찰 될 것입니다.
- 신속 웰에서 3 μM의 최종 농도에 도달하는 9 μM 글루타치온 용액을 첨가. 히드라로 나타낸 실험과 응답의 목적에 따라, 글루타티온 및 츄 상이한 농도의 범위를 테스트필요한 적절한 농도를 SE는.
- 바로 4 ~ 5 분 동안 모든 15 ~ 30 초 후 글루타티온 솔루션과 캡처 이미지를 추가 한 후 타이머를 시작합니다. 시간 경과 이미징 동안 배율 설정을 변경하지 마십시오.
- 부드럽게 웰에 동물의 위치가 최소 현미경의 시야에 방해 될 것 같은 균일 한 흐름 글루타티온 용액을 추가한다. 용종 글루타티온 용액을 첨가 한 후에 광범위하게 이동하는 경우, 이미지 캡쳐를위한 시야에 폴립을 가지고 매우 부드럽게 플레이트를 이동.
- 대조 실험에서, 동일한 모든 다른 파라미터를 유지하면서 매체 글루타티온 결여 사용.
- 오후 1시 전에 먹이 반응의 정도에 일주기 리듬의 가능한 효과를 방지하기 - 오늘의 상반기 위의 실험 단계를 모두 수행해야합니다.
- GNU 이미지 조작 프로그램 (GIMP)를 사용하여 촬영 된 이미지의 각을 엽니 다.
- 촉수와 hypostome 각각의 정점 끝 사이의 거리를 결정하기 위해 측정> 메뉴> 도구에서 사용할 수있는 "측정"도구를 사용합니다. 입 개구가 이미지 중 관찰되는 경우, 개방 입의 중심과 정점 촉수의 단부 사이의 거리를 결정한다. 촉수 확산 등이 거리를 참조하십시오.
- 이전과 글루타티온 노출 후 각 용종의 평균 촉수 확산을 계산합니다. 이후의 시간 포인트에 각각 것과 제로 시점에서 평균 촉수 확산의 비율을 계산한다. 이 비율은 상대적 촉수 확산 호출됩니다.
- 적어도 20 폴립에 대한 측정을 반복합니다.
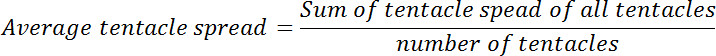

2. 방법 유효성 검사를 사용하여기아 모델
- 기아의 경우, 별도의 유리 그릇에 몇 히드라 폴립을 전송하고 5 일간을 공급하지 않습니다. 비슷한 크기의 그릇에 아테 매일 몇 폴립의 제어 그룹을 피드. 두 실험이 매체에 곰팡이 성장을 방지하기 위해 매일 그릇에서 매체를 변경합니다.
- 실험 날에, 1 시간 동안 아테로 히드라의 대조군을 먹이고 매체로부터 모두 먹지 죽은 아테을 제거한 후 다음의 실험에 대해 이러한 히드라를 사용한다.
- 인해 관찰 시간에 치우침을 방지하기 위해 이전의 단계 1에 기재된 방법에 의해 대조군 히드라 비해 공복 히드라의 공급 응답을 측정 결핍의 각각의 측정을 교번 및 히드라 폴립을 제어한다.
결과
글루타티온은 히드라가 먹이를 집어 삼키고의 목적을 위해 입으로 촉수의 컬링을 전시됩니다. 촉수의 이러한 컬링 가까이 hypostome에 촉수의 혀끝의 끝을 제공합니다. 이것은 촉수 확산의 감소, 또는 촉수와 hypostome (도 1)의 말단 치근단 간의 직선 거리 초래한다. 상대 촉수 확산 또는 평균 촉수의 비율은 이전에 확산 및 글루타티온을 추가 한 후, 시간이 지남에 따라 감소 여러 폴립 걸?...
토론
히드라의 동작을 먹이하면 후생 동물에서 가장 조상의 화학 감각 시스템 중 하나를 나타냅니다. 자포를 이용한 먹이 캡처 이후에 출시 된 갑각류 유체에서 GSH의 존재는 오래 전 일을 발견했지만, GSHR 단백질이나 추정 인코딩 유전자 / S도는 히드라에서 최신 특징으로하고있다. 몇몇 시도 GSH가 히드라 8, 14, 15에 결합 단백질을 특성화하기 위해 이루어지고있다. 그러나, 이러한 추정?...
공개
The authors declare no competing financial interests.
감사의 말
Authors are thankful to K. P. Madhu, Nita Beliappa and staff of the Media Centre of Indian Institute of Science Education and Research, Pune for their help in the video production. The work was supported by funding under the Centre of Excellence program of Department of Biotechnology, Government of India to SG and postdoctoral fellowship by Department of Science and Technology, Government of India to RK.
자료
| Name | Company | Catalog Number | Comments |
| Cooled Incubator | Panasonic | MIR-254-PE | |
| Microscope | Leica | S8AP0 | |
| Camera for the microscope | Leica | EC3 | |
| Reduced glutathione | Sigma | G4251 | Stored at 4 °C. Bring the bottle to room temperature before opening to avoid oxidation |
| Image editing program | GIMP | Version 2.8 |
참고문헌
- Loomis, W. F. Glutathione control of the specific feeding reactions of hydra. Ann. Ny. Acad. Sci. 62, 209-228 (1955).
- Beckmann, A., Ozbek, S. The Nematocyst: a molecular map of the Cnidarian stinging organelle. Int. J. Dev. Biol. 56, 577-582 (2012).
- Venturini, G., Carolei, A. Dopaminergic receptors in Hydra. Pharmacological and biochemical observations. Comp. Biochem. Phys. C. 102, 39-43 (1992).
- Kass-Simon, G., Scappaticci, A. A. Glutamatergic and GABAnergic control in the tentacle effector systems of Hydra vulgaris. Hydrobiologia. 530-531, 67-71 (2004).
- Pierobon, P., Tino, A., Minei, R., Marino, G. Different roles of GABA and glycine in the modulation of chemosensory responses in Hydra vulgaris (Cnidaria, Hydrozoa). Hydrobiology. 178, 59-66 (2004).
- Pierobon, P., Sogliano, C., Minei, R., Tino, A., Porcu, P., Marino, G., Tortiglione, C., Concas, A. Putative NMDA receptors in Hydra: a biochemical and functional study. Eur. J. Neurosci. 20, 2598-2604 (2004).
- Alzugaray, M. E., Adami, M. L., Diambra, L. A., Hernandez-Martinez, S., Damborenea, C., Noriega, F. G., Ronderos, J. R. Allatotropin: An ancestral myotropic neuropeptide involved in feeding. PLoS ONE. 8, (2013).
- Bellis, S. L., Laux, D. C., Rhoads, D. E. Affinity purification of Hydra glutathione binding proteins. FEBS Lett. 354, 320-324 (1994).
- Lenhoff, H. M., Shaw, C. A. The discovery of the GSH receptor in Hydra and its evolutionary significance. Glutathione in the Nervous System. , 25-43 (1998).
- Venturini, G. The hydra GSH receptor. Pharmacological and radioligand binding studies. Comp. Biochem. Phys. C. 87, 321-324 (1987).
- Reddy, P. C., Barve, A., Ghaskadbi, S. Description and phylogenetic characterization of common hydra from India. Curr. Sci. 101, 736-738 (2011).
- Horibata, Y., et al. Unique catabolic pathway of glycosphingolipids in a hydrozoan, Hydra magnipapillata. Involving endoglycoceramidase. J. Biol. Chem. 279, 33379-33389 (2004).
- Koizumi, O., Maeda, N. Rise of feeding threshold in satiated Hydra. J. Comp. Physiol. 142, 75-80 (1981).
- Bellis, S. L., Kass-Simon, G., Rhoads, D. E. Partial characterization and detergent solubilization of the putative glutathione chemoreceptor from hydra. Biochemistry. 31, 9838-9843 (1992).
- Morita, H., Hanai, K. Taste receptor proteins in invertebrates - with special reference to glutathione receptor of hydra. Chem. Senses. 12, 245-250 (1987).
- Colasanti, M., Venturini, G., Merante, A., Musci, G., Lauro, G. M. Nitric oxide involvement in Hydra vulgaris very primitive olfactory- like system. Journal of Neurosci. 17, 493-499 (1997).
- Kuhn, A., Tsiairis, C. D., Williamson, M., Kalbacher, H., Grimmelikhuijzen, C. J., Holstein, T. W., Gründer, S. Three homologous subunits form a high affinity peptide-gated ion channel in Hydra. J. Biol. Chem. 285, 11958-11965 (2010).
- Wang, M., Yao, Y., Kuang, D., Hampson, D. R. Activation of family C G-protein-coupled receptors by the tripeptide glutathione. J. Biol. Chem. 281, 8864-8870 (2006).
- Ruggieri, R. D., Pierobon, P., Kass-Simon, G. Pacemaker activity in hydra is modulated by glycine receptor ligands. Comp. Biochem. Phys. C. 138, 193-202 (2004).
- Ramazani, R. B., Krishnan, H. R., Bergeson, S. E., Atkinson, N. S. Computer automated movement detection for the analysis of behavior. J. Neurosci. Meth. 162, 171-179 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유