Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерение глутатион-индуцированной кормления ответ в Hydra
В этой статье
Резюме
Here we describe a simple assay for the quantification of the feeding response in hydra induced by the reduced form of glutathione. This assay relies on measuring the distance between the apical end of the tentacle and mouth of hydra.
Аннотация
Hydra is among the most primitive organisms possessing a nervous system and chemosensation for detecting reduced glutathione (GSH) for capturing the prey. The movement of prey organisms causes mechanosensory discharge of the stinging cells called nematocysts from hydra, which are inserted into the prey. The feeding response in hydra, which includes curling of the tentacles to bring the prey towards the mouth, opening of the mouth and consequent engulfing of the prey, is triggered by GSH present in the fluid released from the injured prey. To be able to identify the molecular mechanism of the feeding response in hydra which is unknown to date, it is necessary to establish an assay to measure the feeding response. Here, we describe a simple method for the quantitation of the feeding response in which the distance between the apical end of the tentacle and mouth of hydra is measured and the ratio of such distance before and after the addition of GSH is determined. The ratio, called the relative tentacle spread, was found to give a measure of the feeding response. This assay was validated using a starvation model in which starved hydra show an enhanced feeding response in comparison with daily fed hydra.
Введение
Hydra is the most primitive organism possessing a nervous system and chemosensation for detecting reduced glutathione (GSH) for capturing the prey1. It feeds on a variety of animals such as nematode, crustacea, insect larvae, tadpoles and newly hatched fish1. The movement of these prey organisms causes mechanosensory discharge of the stinging capsules called nematocysts from hydra, which are inserted into the prey2. GSH present in the fluid released from the injured prey subsequently activates the feeding response in hydra which includes curling of the tentacles to bring the prey towards the mouth, opening of the mouth, and consequent engulfing of the prey. Multiple molecules, such as dopamine3, glutamate4, GABA, glycine5, NMDA receptors6, and allatotropin7, have been shown to be involved in the feeding response in hydra. It has also been shown that the chemosensory response induced by GSH is modulated by the feeding status of the animal such that starved hydra exhibited enhanced feeding response1. Such an increase in the GSH sensitivity is biologically relevant since under starvation hydra need to find its prey at higher sensitivity.
Although the feeding response induced by GSH can be clearly observed under microscope, the methods typically used for measuring the feeding response observations are non-quantitative. In most of the cases, the time during which the mouth of the hydra remains open was taken as a measure of the feeding response8,9; whereas in another case, quantitation was based on the number of hydra out of a population showing the feeding response10. However, observing the mouth opening time of the hydra polyps is cumbersome and subject to variation induced by uncontrollable parameters such as the direction of the mouth orientation during observations. Similarly, since the feeding response is a quantitative parameter, population-based approaches are subject to variations/errors caused by the opinion or observational bias of the individual observer. To circumvent these issues we have developed a method for the relative quantification of the feeding response in hydra (Hydra vulgaris Ind-Pune11) based on the distance of the apical end of the tentacle from the mouth of the hydra polyp.
протокол
1. Hydra Культура и Измерение кормления ответ
- Поддержание Hydra полипы в культуре путем подачи их в день с Artemia и держать их в среде (буфер 1 мМ Трис-HCl, рН 7,6, 1 мМ NaCl, 1 мМ CaCl 2, 0,1 мМ KCl, и 0,1 мМ MgSO 4), содержащийся в стеклянный шар на 18 ° C при 12 ч света 12 ч темных циклов, как описано ранее 12.
- Для измерения отклика подачи, передать один зрелые гидры полип, имеющую от 5 до 6 щупальца к одному лунку 24-луночного планшета. Снимите остаточной среды из скважины, наклонив его, а затем сразу же добавить 500 мкл свежей среды.
- Подготовьте 9 мкм глутатиона решение в гидры среды. Так как глутатион раствор склонен к окислению, всегда используют свежеприготовленные глутатиона решение для каждого эксперимента.
- Трансфер тарелку с изображения платформе микроскопом, имеющим положения для записи изображения. Используйте темный фон такой, что поведение ое гидра полип может быть четко отображены против контрастном фоне.
- Комната для наблюдения и отображения поведение гидры свободным от огней колебания интенсивности, воздушных потоков и шума. Такие расстройства могут также вызвать гидра полип, чтобы показать сжатие щупалец - даже в отсутствие глутатиона.
- Разрешить полип расслабиться в течение 5 мин.
- Убедитесь, что полип расположен вдоль центральной области хорошо так, что поведение может быть отображена ясно. Если полип на краю колодца, привести его в центр с помощью промывки среду с помощью пипетки и снова позволить ему отдохнуть.
- Записать образ гидры в расслабленном состоянии. Это будет точка наблюдения нулевой раз.
- Быстрое добавление 9 мкМ раствор глутатиона, чтобы достичь конечной концентрации 3 мкМ в скважине. В зависимости от целей эксперимента и ответ, показанной на гидры, испытать ряд различных концентраций глутатиона и Chooсе соответствующую концентрацию, необходимую.
- Запустите таймер сразу после добавления раствора глутатиона и захват изображений после каждого 15-30 сек для 4-5 мин. Не изменить настройки коэффициента увеличения во время покадровой обработки изображений.
- Добавьте глутатиона раствор осторожно и с равномерным потоком таким образом, что положение животного в скважине будет минимально нарушается в поле зрения микроскопа. Тем не менее, если полип перемещает широко после добавления раствора глутатиона, перемещать плиту очень осторожно, чтобы довести полип в поле зрения захвата изображения.
- В контрольном эксперименте, используют среду, не содержащую глутатион, сохраняя при этом все другие параметры идентичны.
- Обязательно выполните все вышеперечисленные экспериментальных шагов в первой половине дня - до 1 вечера, чтобы избежать возможного влияния циркадного ритма на степень реакции кормления.
- Откройте каждый из захваченных изображений с помощью программы Image Manipulation GNU (GIMP).
- Используйте «мера» инструмент, доступный из меню> Инструменты> Измерить для определения расстояния между верхушечной конце каждого из щупалец и гипостомы. Если отверстие рта наблюдается в любом из изображений, определяют расстояние между центром в открытый рот и апикальной конце щупальцу. Обратитесь к этой дистанции, как распространение щупальца.
- Рассчитайте среднее распространение щупальце для каждого полипа до и после воздействия глутатиона. Рассчитывают отношение среднего распространения щупальца на нулевой момент времени в том, что на каждом из последующих временных точках. Это отношение будет называться относительный разброс щупальце.
- Повторите измерения для по меньшей мере, 20 полипов.
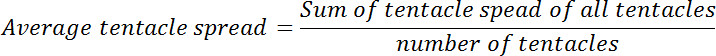

2. Метод Оценка использованияГолодание Модель
- Для голода, передать несколько Hydra полипы в отдельный стеклянный шар и не кормить их в течение 5 дней. Поток контрольную группу из нескольких полипов ежедневно с артемии в аналогичной по размеру миску. Изменение среды от обоих экспериментальная миски ежедневно, чтобы избежать роста грибов в среде.
- В день эксперимента, кормить контрольной группы гидры с артемии в течение 1 часа и использовать эти гидру для последующих экспериментов после удаления все недоеденные и мертвую артемии из среды.
- Измерить реакцию подача голодали гидры по сравнению с гидры из контрольной группы по способу, описанному ранее в пункте 1. Чтобы избежать смещения из-за времени наблюдения, чередовать измерения каждого из голодали и контролировать Hydra полипы.
Результаты
Глутатион вызывает гидра выставлять скручивания щупальца ко рту с целью поглощая добычу. Такое закручивание щупальцами приносит верхушечные концы щупалец ближе к гипостомы. Это приводит к уменьшению распространения щупальца, или линейного расстояния между верхушечной конце щупальц...
Обсуждение
Пищевое поведение в гидры представляет собой один из самых исконных хемосенсорных систем в многоклеточных. Хотя присутствие GSH в ракообразных жидкости, опубликованном после nematocyst при содействии захвата добычи был обнаружен давно 1, ни белок, ни GSHR предполагаемого гена, кодирующе...
Раскрытие информации
The authors declare no competing financial interests.
Благодарности
Authors are thankful to K. P. Madhu, Nita Beliappa and staff of the Media Centre of Indian Institute of Science Education and Research, Pune for their help in the video production. The work was supported by funding under the Centre of Excellence program of Department of Biotechnology, Government of India to SG and postdoctoral fellowship by Department of Science and Technology, Government of India to RK.
Материалы
| Name | Company | Catalog Number | Comments |
| Cooled Incubator | Panasonic | MIR-254-PE | |
| Microscope | Leica | S8AP0 | |
| Camera for the microscope | Leica | EC3 | |
| Reduced glutathione | Sigma | G4251 | Stored at 4 °C. Bring the bottle to room temperature before opening to avoid oxidation |
| Image editing program | GIMP | Version 2.8 |
Ссылки
- Loomis, W. F. Glutathione control of the specific feeding reactions of hydra. Ann. Ny. Acad. Sci. 62, 209-228 (1955).
- Beckmann, A., Ozbek, S. The Nematocyst: a molecular map of the Cnidarian stinging organelle. Int. J. Dev. Biol. 56, 577-582 (2012).
- Venturini, G., Carolei, A. Dopaminergic receptors in Hydra. Pharmacological and biochemical observations. Comp. Biochem. Phys. C. 102, 39-43 (1992).
- Kass-Simon, G., Scappaticci, A. A. Glutamatergic and GABAnergic control in the tentacle effector systems of Hydra vulgaris. Hydrobiologia. 530-531, 67-71 (2004).
- Pierobon, P., Tino, A., Minei, R., Marino, G. Different roles of GABA and glycine in the modulation of chemosensory responses in Hydra vulgaris (Cnidaria, Hydrozoa). Hydrobiology. 178, 59-66 (2004).
- Pierobon, P., Sogliano, C., Minei, R., Tino, A., Porcu, P., Marino, G., Tortiglione, C., Concas, A. Putative NMDA receptors in Hydra: a biochemical and functional study. Eur. J. Neurosci. 20, 2598-2604 (2004).
- Alzugaray, M. E., Adami, M. L., Diambra, L. A., Hernandez-Martinez, S., Damborenea, C., Noriega, F. G., Ronderos, J. R. Allatotropin: An ancestral myotropic neuropeptide involved in feeding. PLoS ONE. 8, (2013).
- Bellis, S. L., Laux, D. C., Rhoads, D. E. Affinity purification of Hydra glutathione binding proteins. FEBS Lett. 354, 320-324 (1994).
- Lenhoff, H. M., Shaw, C. A. The discovery of the GSH receptor in Hydra and its evolutionary significance. Glutathione in the Nervous System. , 25-43 (1998).
- Venturini, G. The hydra GSH receptor. Pharmacological and radioligand binding studies. Comp. Biochem. Phys. C. 87, 321-324 (1987).
- Reddy, P. C., Barve, A., Ghaskadbi, S. Description and phylogenetic characterization of common hydra from India. Curr. Sci. 101, 736-738 (2011).
- Horibata, Y., et al. Unique catabolic pathway of glycosphingolipids in a hydrozoan, Hydra magnipapillata. Involving endoglycoceramidase. J. Biol. Chem. 279, 33379-33389 (2004).
- Koizumi, O., Maeda, N. Rise of feeding threshold in satiated Hydra. J. Comp. Physiol. 142, 75-80 (1981).
- Bellis, S. L., Kass-Simon, G., Rhoads, D. E. Partial characterization and detergent solubilization of the putative glutathione chemoreceptor from hydra. Biochemistry. 31, 9838-9843 (1992).
- Morita, H., Hanai, K. Taste receptor proteins in invertebrates - with special reference to glutathione receptor of hydra. Chem. Senses. 12, 245-250 (1987).
- Colasanti, M., Venturini, G., Merante, A., Musci, G., Lauro, G. M. Nitric oxide involvement in Hydra vulgaris very primitive olfactory- like system. Journal of Neurosci. 17, 493-499 (1997).
- Kuhn, A., Tsiairis, C. D., Williamson, M., Kalbacher, H., Grimmelikhuijzen, C. J., Holstein, T. W., Gründer, S. Three homologous subunits form a high affinity peptide-gated ion channel in Hydra. J. Biol. Chem. 285, 11958-11965 (2010).
- Wang, M., Yao, Y., Kuang, D., Hampson, D. R. Activation of family C G-protein-coupled receptors by the tripeptide glutathione. J. Biol. Chem. 281, 8864-8870 (2006).
- Ruggieri, R. D., Pierobon, P., Kass-Simon, G. Pacemaker activity in hydra is modulated by glycine receptor ligands. Comp. Biochem. Phys. C. 138, 193-202 (2004).
- Ramazani, R. B., Krishnan, H. R., Bergeson, S. E., Atkinson, N. S. Computer automated movement detection for the analysis of behavior. J. Neurosci. Meth. 162, 171-179 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены