Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Medición inducida glutatión-Alimentación Respuesta en Hydra
En este artículo
Resumen
Here we describe a simple assay for the quantification of the feeding response in hydra induced by the reduced form of glutathione. This assay relies on measuring the distance between the apical end of the tentacle and mouth of hydra.
Resumen
Hydra is among the most primitive organisms possessing a nervous system and chemosensation for detecting reduced glutathione (GSH) for capturing the prey. The movement of prey organisms causes mechanosensory discharge of the stinging cells called nematocysts from hydra, which are inserted into the prey. The feeding response in hydra, which includes curling of the tentacles to bring the prey towards the mouth, opening of the mouth and consequent engulfing of the prey, is triggered by GSH present in the fluid released from the injured prey. To be able to identify the molecular mechanism of the feeding response in hydra which is unknown to date, it is necessary to establish an assay to measure the feeding response. Here, we describe a simple method for the quantitation of the feeding response in which the distance between the apical end of the tentacle and mouth of hydra is measured and the ratio of such distance before and after the addition of GSH is determined. The ratio, called the relative tentacle spread, was found to give a measure of the feeding response. This assay was validated using a starvation model in which starved hydra show an enhanced feeding response in comparison with daily fed hydra.
Introducción
Hydra is the most primitive organism possessing a nervous system and chemosensation for detecting reduced glutathione (GSH) for capturing the prey1. It feeds on a variety of animals such as nematode, crustacea, insect larvae, tadpoles and newly hatched fish1. The movement of these prey organisms causes mechanosensory discharge of the stinging capsules called nematocysts from hydra, which are inserted into the prey2. GSH present in the fluid released from the injured prey subsequently activates the feeding response in hydra which includes curling of the tentacles to bring the prey towards the mouth, opening of the mouth, and consequent engulfing of the prey. Multiple molecules, such as dopamine3, glutamate4, GABA, glycine5, NMDA receptors6, and allatotropin7, have been shown to be involved in the feeding response in hydra. It has also been shown that the chemosensory response induced by GSH is modulated by the feeding status of the animal such that starved hydra exhibited enhanced feeding response1. Such an increase in the GSH sensitivity is biologically relevant since under starvation hydra need to find its prey at higher sensitivity.
Although the feeding response induced by GSH can be clearly observed under microscope, the methods typically used for measuring the feeding response observations are non-quantitative. In most of the cases, the time during which the mouth of the hydra remains open was taken as a measure of the feeding response8,9; whereas in another case, quantitation was based on the number of hydra out of a population showing the feeding response10. However, observing the mouth opening time of the hydra polyps is cumbersome and subject to variation induced by uncontrollable parameters such as the direction of the mouth orientation during observations. Similarly, since the feeding response is a quantitative parameter, population-based approaches are subject to variations/errors caused by the opinion or observational bias of the individual observer. To circumvent these issues we have developed a method for the relative quantification of the feeding response in hydra (Hydra vulgaris Ind-Pune11) based on the distance of the apical end of the tentacle from the mouth of the hydra polyp.
Protocolo
1. Hydra Cultura y medición de la respuesta de alimentación
- Mantener pólipos Hydra en cultivo mediante la alimentación diariamente con artemia y mantenerlos en un medio (mM de tampón Tris-HCl 1, pH 7,6, NaCl 1 mM, 1 mM CaCl 2, 0,1 mM KCl, y 0,1 mM MgSO 4) contenida en una tazón de vidrio a 18 ° C por debajo de 12 hr hr luz-12 ciclos oscuros como se describe anteriormente 12.
- Para la medición de la respuesta de alimentación, transferir uno maduro pólipo hidra que tiene de 5 a 6 tentáculos a un solo pocillo de una placa de 24 pocillos. Retire el medio residual del bien por la inclinación, y luego añadir inmediatamente 500 l de medio fresco.
- Prepare la solución de glutatión 9 M en medio hidra. Dado que la solución de glutatión es propenso a la oxidación, siempre utilizar la solución de glutatión recién preparado para cada experimento.
- Transferencia de la placa a la plataforma de imágenes de un microscopio que tiene disposiciones para la grabación de imágenes. Utilice un fondo oscuro de manera que el comportamiento of pólipo hidra puede ser claramente fotografiado contra el fondo de contraste.
- La sala utilizada para observar y obtener imágenes del comportamiento de hidra libre de las luces de intensidades fluctuantes, las corrientes de aire y el ruido. Tales perturbaciones también podrían causar el pólipo hidra para mostrar la contracción de los tentáculos - incluso en ausencia de glutatión.
- Deje que el pólipo se relaje durante 5 min.
- Asegúrese de que el pólipo se encuentra a lo largo de la región central del pozo de manera que el comportamiento se pueden obtener imágenes con claridad. Si el pólipo está en el borde del pozo, llevarlo al centro de lavado del medio utilizando una pipeta y otra vez permitir que se relaje.
- Captura de una imagen de la hidra en el estado relajado. Este será el punto de observación en tiempo cero.
- Añadir rápidamente 9 M solución de glutatión para llegar a una concentración final de 3 mM en el pozo. Dependiendo de la finalidad del experimento y la respuesta mostrada por hydra, ensayar una serie de diferentes concentraciones de glutatión y ChooSE La concentración apropiada requerida.
- Inicie el temporizador inmediatamente después de añadir la solución de glutatión y capturar imágenes después de cada 15-30 segundos durante 4-5 min. No cambie la configuración de ampliación durante el time-lapse.
- Añadir la solución de glutatión suavemente y con flujo uniforme de tal manera que la posición del animal en el pozo se vería perturbado mínimamente en el campo de visión del microscopio. Sin embargo, si el pólipo se mueve ampliamente después de la adición de solución de glutatión, mover muy suavemente la placa para llevar el pólipo en el campo de visión para la captura de imagen.
- En el experimento de control, utilice medio que carece de glutatión, manteniendo todos los demás parámetros idénticos.
- Asegúrese de realizar todos los pasos experimentales anteriores durante la primera mitad del día - antes de 13:00 para evitar el posible efecto del ritmo circadiano de la magnitud de respuesta de alimentación.
- Abra cada una de las imágenes capturadas utilizando el GNU Image Manipulation Program (GIMP).
- Utilice la herramienta de "Medida" disponible en Menú> Herramientas> Medir para determinar la distancia entre el extremo apical de cada uno de los tentáculos y hipostoma. Si se observa la abertura de boca en cualquiera de las imágenes, determinar la distancia entre el centro de la boca abierta y el extremo apical de la tentáculo. Consulte esta distancia como la propagación tentáculo.
- Calcular el diferencial medio tentáculo para cada pólipo antes y después de la exposición glutatión. Calcular la relación de promedio propagación tentáculo en el punto de tiempo cero para que en cada uno de los puntos de tiempo posteriores. Esta relación se denomina propagación tentáculo relativa.
- Repetir las mediciones para al menos 20 pólipos.
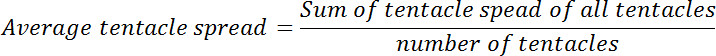

2. Método de validación mediante elEl hambre Modelo
- Para el hambre, transferir unos pólipos hidra a un recipiente de vidrio separada y no darles de comer durante 5 días. Pase el grupo de control de unos pólipos diario con artemia en un recipiente de tamaño similar. Cambie el medio de copas de ambos experimental diaria para evitar el crecimiento de hongos en el medio.
- En el día del experimento, alimentar al grupo de control de hidra con artemia durante 1 hora y utilizar estos hidra para los experimentos posteriores después de la eliminación de todos artemia sin comer y muertos desde el medio.
- Medir la respuesta de alimentación de la hidra de hambre en comparación con la hidra de grupo de control por el método descrito anteriormente en el paso 1. Para evitar cualquier sesgo debido a momento de la observación, alternar las mediciones de cada uno de los hambrientos y controlar pólipos hidra.
Resultados
El glutatión provoca hydra exponer rizado de los tentáculos hacia la boca con el propósito de que envuelve la presa. Tal rizado de tentáculos trae extremos apicales de los tentáculos más cerca de la hipostoma. Esto resulta en la reducción de la propagación tentáculo, o la distancia lineal entre el extremo apical del tentáculo y hipostoma (Figura 1). La propagación tentáculo relativa, o la relación de tentáculo promedio propagan antes y después de la adición de glutatión, promediados a t...
Discusión
La alimentación en el comportamiento hidra representa uno de los sistemas quimiosensoriales más ancestrales en los metazoos. Aunque la presencia de GSH en el fluido crustáceo en libertad después de la captura de presas nematocisto asistida se detectó hace mucho tiempo 1, ni la proteína GSHR ni los genes de codificación putativo / s se han caracterizado desde hidra hasta la fecha. Pocos intentos se han realizado para caracterizar las proteínas de unión GSH en Hydra 8, 14, 15. Sin embargo, l...
Divulgaciones
The authors declare no competing financial interests.
Agradecimientos
Authors are thankful to K. P. Madhu, Nita Beliappa and staff of the Media Centre of Indian Institute of Science Education and Research, Pune for their help in the video production. The work was supported by funding under the Centre of Excellence program of Department of Biotechnology, Government of India to SG and postdoctoral fellowship by Department of Science and Technology, Government of India to RK.
Materiales
| Name | Company | Catalog Number | Comments |
| Cooled Incubator | Panasonic | MIR-254-PE | |
| Microscope | Leica | S8AP0 | |
| Camera for the microscope | Leica | EC3 | |
| Reduced glutathione | Sigma | G4251 | Stored at 4 °C. Bring the bottle to room temperature before opening to avoid oxidation |
| Image editing program | GIMP | Version 2.8 |
Referencias
- Loomis, W. F. Glutathione control of the specific feeding reactions of hydra. Ann. Ny. Acad. Sci. 62, 209-228 (1955).
- Beckmann, A., Ozbek, S. The Nematocyst: a molecular map of the Cnidarian stinging organelle. Int. J. Dev. Biol. 56, 577-582 (2012).
- Venturini, G., Carolei, A. Dopaminergic receptors in Hydra. Pharmacological and biochemical observations. Comp. Biochem. Phys. C. 102, 39-43 (1992).
- Kass-Simon, G., Scappaticci, A. A. Glutamatergic and GABAnergic control in the tentacle effector systems of Hydra vulgaris. Hydrobiologia. 530-531, 67-71 (2004).
- Pierobon, P., Tino, A., Minei, R., Marino, G. Different roles of GABA and glycine in the modulation of chemosensory responses in Hydra vulgaris (Cnidaria, Hydrozoa). Hydrobiology. 178, 59-66 (2004).
- Pierobon, P., Sogliano, C., Minei, R., Tino, A., Porcu, P., Marino, G., Tortiglione, C., Concas, A. Putative NMDA receptors in Hydra: a biochemical and functional study. Eur. J. Neurosci. 20, 2598-2604 (2004).
- Alzugaray, M. E., Adami, M. L., Diambra, L. A., Hernandez-Martinez, S., Damborenea, C., Noriega, F. G., Ronderos, J. R. Allatotropin: An ancestral myotropic neuropeptide involved in feeding. PLoS ONE. 8, (2013).
- Bellis, S. L., Laux, D. C., Rhoads, D. E. Affinity purification of Hydra glutathione binding proteins. FEBS Lett. 354, 320-324 (1994).
- Lenhoff, H. M., Shaw, C. A. The discovery of the GSH receptor in Hydra and its evolutionary significance. Glutathione in the Nervous System. , 25-43 (1998).
- Venturini, G. The hydra GSH receptor. Pharmacological and radioligand binding studies. Comp. Biochem. Phys. C. 87, 321-324 (1987).
- Reddy, P. C., Barve, A., Ghaskadbi, S. Description and phylogenetic characterization of common hydra from India. Curr. Sci. 101, 736-738 (2011).
- Horibata, Y., et al. Unique catabolic pathway of glycosphingolipids in a hydrozoan, Hydra magnipapillata. Involving endoglycoceramidase. J. Biol. Chem. 279, 33379-33389 (2004).
- Koizumi, O., Maeda, N. Rise of feeding threshold in satiated Hydra. J. Comp. Physiol. 142, 75-80 (1981).
- Bellis, S. L., Kass-Simon, G., Rhoads, D. E. Partial characterization and detergent solubilization of the putative glutathione chemoreceptor from hydra. Biochemistry. 31, 9838-9843 (1992).
- Morita, H., Hanai, K. Taste receptor proteins in invertebrates - with special reference to glutathione receptor of hydra. Chem. Senses. 12, 245-250 (1987).
- Colasanti, M., Venturini, G., Merante, A., Musci, G., Lauro, G. M. Nitric oxide involvement in Hydra vulgaris very primitive olfactory- like system. Journal of Neurosci. 17, 493-499 (1997).
- Kuhn, A., Tsiairis, C. D., Williamson, M., Kalbacher, H., Grimmelikhuijzen, C. J., Holstein, T. W., Gründer, S. Three homologous subunits form a high affinity peptide-gated ion channel in Hydra. J. Biol. Chem. 285, 11958-11965 (2010).
- Wang, M., Yao, Y., Kuang, D., Hampson, D. R. Activation of family C G-protein-coupled receptors by the tripeptide glutathione. J. Biol. Chem. 281, 8864-8870 (2006).
- Ruggieri, R. D., Pierobon, P., Kass-Simon, G. Pacemaker activity in hydra is modulated by glycine receptor ligands. Comp. Biochem. Phys. C. 138, 193-202 (2004).
- Ramazani, R. B., Krishnan, H. R., Bergeson, S. E., Atkinson, N. S. Computer automated movement detection for the analysis of behavior. J. Neurosci. Meth. 162, 171-179 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados