A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التطبيق التتابعي من coverslips الزجاج لتقييم الضاغطة تصلب العدسة الفأر: الانفعال والمظهرية تحليلات
In This Article
Summary
Age-related increases in eye lens stiffness are linked to presbyopia. This protocol describes a simple, cost-effective method for measuring mouse lens stiffness. Mouse lenses, like human lenses, become stiffer with age. This method is precise and can be adapted for lenses from larger animals.
Abstract
عدسة العين هي جهاز شفاف ينكسر ويركز الضوء لتكوين صورة واضحة على الشبكية. في البشر، وانقباض العضلات الهدبية لتشويه العدسة، مما يؤدي إلى زيادة في قوة عدسة 'البصرية في التركيز على الأشياء القريبة، وهي عملية تعرف باسم الإقامة. وقد التغيرات المرتبطة بالعمر في عدسة صلابة مرتبطة طول النظر الشيخوخي، انخفاض في قدرة عدسة 'لاستيعاب، واستطرادا، فإن الحاجة لنظارة القراءة. على الرغم من العدسات الماوس لا تستوعب أو تطوير بصر الشيخوخة، يمكن أن نماذج الماوس توفر أداة لا تقدر بثمن الوراثية لأمراض عدسة الفهم، والشيخوخة المتسارعة التي لوحظت في الفئران يمكن دراسة التغيرات المرتبطة بالعمر في العدسة. يوضح هذا البروتوكول طريقة بسيطة ودقيقة، وفعالة من حيث التكلفة لتحديد عدسة الماوس صلابة، وذلك باستخدام coverslips الزجاج لتطبيق بالتتابع زيادة الأحمال الضغط على العدسة. وتؤكد بيانات تمثيلية أن العدسات الماوس تصبح أكثر صلابة مع التقدم في السن، مثلالعدسات الإنسان. هذا الأسلوب هو تكرار للغاية ويحتمل أن يتم زيادتها إلى ميكانيكيا العدسات اختبار من الحيوانات الكبيرة.
Introduction
The lens is a transparent and avascular organ in the anterior chamber of the eye that is responsible for fine focusing of light onto the retina. A clear basement membrane, called the lens capsule, surrounds a bulk of elongated fiber cells covered by an anterior monolayer of epithelial cells1,2. Life-long growth of the lens depends on the continuous proliferation and differentiation of epithelial cells at the lens equator into new fiber cells that are added onto previous generations of fiber cells in a concentric manner2. Over time, lens fiber cells undergo compaction, resulting in a rigid center in the middle of the lens called the nucleus1. Accommodation, defined as a dioptric change in the optical power of the eye, occurs in humans when the ciliary muscles contract to deform the lens and allow a true increase in optical power to focus on near objects3-5. In the unaccommodated eye, the lens is held in a relatively flattened state due to tension from zonular fibers. When the ciliary muscles contract, the tension on the lens is released, leading to decreased lens equatorial diameter and increased axial thickness. Age-related changes in the lens cause presbyopia, a progressive loss of lens accommodation, which leads to the need for reading glasses.
Several studies have linked presbyopia to age-related increase in the intrinsic stiffness of the lens6-11. Stiffness is defined as the resistance of an elastic object to deform under applied load. A variety of methods have been used to examine stiffness of human lenses, including spin compression12-14, actuator compression15, probe indentation16, dynamic mechanical analysis 6,10 and bubble-based acoustic radiation force17. While mouse lenses do not accommodate or develop presbyopia, mouse models for lens pathologies are valuable tools because mice are less expensive than larger animals, well characterized genetically and undergo accelerated age-related changes due to rapid aging. A handful of studies have examined mouse lens stiffness with compression methods and demonstrated changes in lens stiffness due to aging or targeted genetic disruptions18-21. Thus, mouse lenses are good models for studying age-related changes in lens stiffness.
This protocol describes a simple and inexpensive, yet precise and reproducible, compression method for determining mouse lens stiffness based on application of glass coverslips onto the lens in conjunction with photographing the lens through a dissection microscope and mirror. This method yields robust strain and morphometric data with an easily fabricated and assembled apparatus. The representative results confirm that mouse lenses increase in stiffness with age.
Access restricted. Please log in or start a trial to view this content.
Protocol
تم تنفيذ كافة الإجراءات الحيوانية وفقا للتوصيات الواردة في دليل لرعاية واستخدام الحيوانات المختبرية من قبل المعاهد الوطنية للصحة وبموجب البروتوكول الذي وافقت عليه لجنة رعاية واستخدام الحيوان المؤسسي في معهد سكريبس للأبحاث.
1. عدسة تشريح
- الموت ببطء الفئران وفقا لتوصيات في المعاهد الوطنية للصحة "دليل لرعاية واستخدام الحيوانات المختبرية" وافق بروتوكولات استخدام مؤسسة الحيوان.
- استأصل العين من الفئران باستخدام ملقط المنحنية. خفض الأنسجة حول العين مع ملقط لجعل العين من مأخذ، ثم نتف العين من مأخذ مع ملقط. نقل العيون العذبة 1X الفوسفات مخزنة المالحة (PBS) في طبق تشريح.
- قطع العصب البصري وعلى مقربة من مقلة العين وقت ممكن. بلطف وعناية إدراج ملاقط غرامة على التوالي في مقلة العين من خلال وهر حفرةالبريد مخارج العصب البصري الخلفي.
- جعل بعناية شق مع مقص في مقلة العين من الخلفية إلى حافة القرنية. العدسات القوارض تحتل ~ 30٪ من العين. جعل هذه الشقوق بعناية، وعدم إدراج الملقط أو المقص عميق جدا داخل العين لتجنب حدوث تلف العدسة.
- قطع على طول التقاطع بين القرنية والصلبة على الأقل نصف الطريق حول مقلة العين.
- دفع بلطف على القرنية لإزالة العدسة من العين من خلال افتتاح المحرز في خطوات 1.4 و 1.5.
- استخدام غرامة ملقط غيض مباشرة لإزالة بعناية أي الحطام الكبيرة التي لا تزال تعلق على العدسة. تفقد البصر عدسة عن أي ضرر قبل الانتقال إلى قياسات صلابة.
2. قياس صلابة
- وزن لا يقل عن 10 coverslips من المربع نفسه باستخدام الميزان التحليلي. العثور على متوسط وزن لل coverslips. من أجل التناسق، استخدم نفس مربع من coverslips لجميع التجارب. قبل الرطبلل coverslips والزاوية اليمنى مرآة في برنامج تلفزيوني 1X في درجة حرارة الغرفة لمدة 2 ساعة على الأقل قبل بدء التجارب.
- ملء غرفة القياس (انظر الشكل 1) مع 65-75 مل من برنامج تلفزيوني 1X. وجاء في غرفة القياس من زجاجي من قبل آلة متجر في المنزل، وقدمت ديفوتس في الغرفة عن طريق الحفر الصحافة لتعيين العمق المطلوب مع مثقاب المناسب. لا تزال عدسات شفافة في برنامج تلفزيوني 1X في درجة حرارة الغرفة لمدة الاختبارات الميكانيكية.

الشكل 1: تصلب غرفة القياس صورة تظهر أبعاد غرفة قياس صلابة حسب الطلب مع مجموعة متنوعة من ديفوتس من أعماق وأشكال مختلفة. وتستخدم ديفوتس الجولة التي هي 200 ميكرون أو 300 ميكرون عميقة (السهام الصفراء) لقياسات العدسات الماوس. ديفوتس هي 2 ملم وقطرها 13 ~- 14 ملم من على حافة الغرفة الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- وضع مرآة الزاوية اليمنى الى داخل القاعة على مسافة ثابتة من ديفت التي سيتم استخدامها لعقد العدسة. تأكد من أن المرآة لا تتحرك أثناء التجربة.
- نقل العدسات تشريح لغرفة القياس بدقة مع الاستيلاء على ملقط أو ملقط منحنية.
- التقاط صورة من أعلى إلى ضوء عدسة المفرغة من النفقات العامة مباشرة. خذ الماوس صور عدسة في 30X التكبير مع إضاءة من تشريح المجهر (القاع) ومصدر ضوء الألياف البصرية على الجانبين الأيمن والأيسر. تعيين امدادات الطاقة الألياف البصرية إلى 80٪ من الحد الأقصى لشدة الضوء. ضبط الانتاج امدادات الطاقة على أساس الإضاءة المحيطة، وتفضيلات المستخدم وجودة الصورة حسب الحاجة.
- التقاط صورة جانبية نظرا لعدسة المفرغة، وهو ما يمكن ملاحظته من خلال ريمرآة GHT الزاوية. إذا لم يتم معايرة الكاميرا، التقاط صورة من حافة المرآة في التركيز. حافة المرآة هي 5 ملم طويلة، ويمكن في وقت لاحق هذا القياس أن تستخدم لتحديد بكسل / مم، ويكون بمثابة شريط النطاق في الصور.
- مكان العدسة في ديفت، وتؤكد أن عدسة يجلس بشكل آمن ومباشرة في ديفت. التقاط صورة للعدسة قبل التحميل. العدسة يجب أن يستريح في ديفت على الأمامي، أو القطب الخلفي.
- ضع 1 ساترة بلطف على العدسة. الانتظار 2 دقيقة للسماح للزحف، وتأخذ صورة جانبية رأي آخر من عدسة المحملة.
- متابعة إضافة coverslips كما في الخطوة 2.8 واتخاذ جنبا عرض الصور بعد إضافة كل ساترة كما في الخطوة 2.8 حتى يتم تطبيق ما مجموعه 10 coverslips.
- إزالة جميع coverslips. الانتظار 2 دقيقة، والتقاط صورة جانبية نظرا للعدسة (داخل وخارج ديفت) بعد إزالة كافة coverslips.
قياس 3. عدسة نواة
- لdetermالمعهد الوطني للإحصاء حجم نواة العدسة، وتحريك العدسة لطبق بيتري نظيفة مليئة برنامج تلفزيوني 1X.
- decapsulate بلطف العدسة باستخدام ملقط غرامة على التوالي.
- تنصل من خلايا الألياف القشرية من قبل المتداول العدسة بين أصابع القفاز. فإن عدسة النواة المتبقية يشعر وكأنه الرخام الصلب. استخدام هذا الإجراء لعزل نواة على العدسات الكبار ابتداء من الساعة 1 شهر من العمر. منذ نواة معزولة هي هيئة جامدة، وإجراء مزيد من التجارب الميكانيكية للنواة العدسة لا يمكن القيام بها باستخدام هذه الطريقة الموصوفة.
- شطف بلطف نواة العدسة في برنامج تلفزيوني 1X في طبق بيتري.
- وضع نواة العدسة مرة أخرى إلى غرفة القياس (وليس في ديفت)، والتقاط صورة للنواة العدسة من خلال مرآة الزاوية اليمنى.
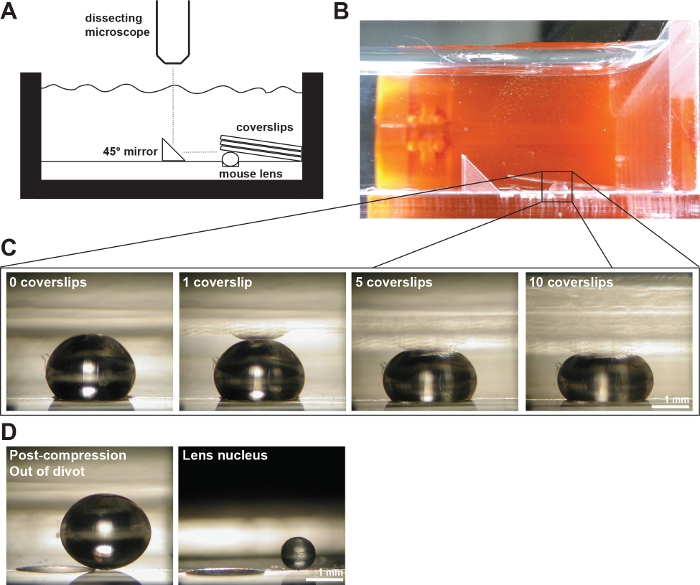
الشكل 2: والعدسات الماوس مضغوط بواسطة Coverslips (A) تخطيطي و (ب) صورة من السابقينالإعداد perimental تظهر عدسة الماوس القديمة 2-أشهر في ديفت 200 ميكرون العميقة في غرفة قياس مليئة برنامج تلفزيوني 1X. استخدمت مرآة زاوية الحق وكاميرا رقمية محمولة على المجهر تشريح لجمع الصور من عدسة خلال ضغط من قبل coverslips. (C) صور وجهات النظر السهمي من عدسة من نوع البرية القديمة 2-أشهر ضغطها أعداد coverslips زيادة تباعا توفير البيانات الخام لقياس أقطار المحورية والاستوائية وحساب سلالات المحورية والاستوائية خلال القائم على ساترة اختبار ضغط. يمكن في بعض الأحيان أن ينظر إلى انعكاس العدسة في لل coverslips (الأكثر وضوحا بشكل واضح في الصورة 1 ساترة). عند إجراء القياسات، تجاهل التفكير وقياس لقمة العدسة. (D) صور وجهات النظر السهمي من العمر 2-أشهر من النوع البري عدسة بعد ضغط وعدسة نواة معزولة. عدسة بعد ضغط ونواة معزولة يجلسون خارج ديفت. الحانات الحجم، 1 مم. تم تعديل هذا الرقم من Gokhفي، وآخرون. بلوس واحد، 2012 19. يرجى النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
تحليل 4. صورة
- قياس أقطار الاستوائية والمحورية من العدسات قبل التحميل وبعد كل خطوة التحميل باستخدام يماغيج أو برامج مماثلة. قياس قطر كل نواة العدسة. نواة عدسة كروية تقريبا حتى قياس في أي اتجاه سوف تكفي 19،21.
- تصحيح العدسة المحورية أقطار عن طريق إضافة عمق ديفت المستخدمة. في غرفة القياس، حجب ديفت 200 ميكرون (العدسات القديمة 2-الشهر الماوس) أو 300 ميكرون (العدسات الماوس عمرها 4 أشهر وعمرها 8 أشهر) من سمك المحوري للعدسة.
- حساب محوري وسلالات الاستوائية من القياسات عدسة قطرها باستخدام المعادلة، ε = (د - د 0) / د 0، حيث ε هو سلالة، د هو محوري أو البريدقطر quatorial في حمولة معينة، ود 0 هو المقابلة قطر المحوري أو الاستوائي في حمولة الصفر.
- رسم محوري وسلالات الاستوائية وظائف من الحمل المفروض (في ملغ).
- رسم محوري، الاستوائية وبأقطار النووية. حساب ورسم نسبة الارتفاع عدسة بقسمة قطر المحوري بواسطة قطر الاستوائية.
- حساب ورسم حجم العدسة باستخدام المعادلة، وحجم = 4/3 × π × ص ض 2 × ص A، حيث r E هو الاستوائية دائرة نصف قطرها وص A هو دائرة نصف قطرها المحوري تقاس من صورة التي مأخوذة في الخطوة 2.6. تفترض هذه المعادلة العدسة هو كروي مفلطح (الإهليلجي) 1،22.
- حساب ورسم حجم النووي باستخدام المعادلة، وحجم = 4/3 × π × ص N 3، حيث r N هو نصف قطر نواة العدسة كما تقاس من صورة التي مأخوذة في الخطوة 3.5. تفترض هذه المعادلة ط عدسة نواةسا المجال 19،21.
- حساب ورسم جزء النووي الذي يشكل نسبة حجم النووي لحجم العدسة.
Access restricted. Please log in or start a trial to view this content.
النتائج
تم قياس صلابة وأبعاد العدسات الماوس القديمة 8 أشهر 2-، 4- و. وكانت الفئران كل البرية من نوع الحيوانات على C57BL6 خلفية سلالة نقية تم الحصول عليها من مرفق تربية TSRI الحيوان، وتحميل كل عدسة مع 1-10 coverslips. حسبت سلالات المحورية والاستوائية بوصفها وظيفة من الحمل ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
هناك العديد من الاعتبارات الرئيسية عند استخدام هذه الطريقة لقياس عدسة صلابة. أولا، يتم تطبيق لل coverslips إلى عدسة بزاوية مائلة قليلا (8-8،5 درجة) فيما يتعلق السفلي من الغرفة (θ). وهذا ينطبق على عنصر صغير جدا من الحمل استوائيا بدلا من محوريا. ومع ذلك، يعتبر هذا الحمل الاستوا?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
This work was supported by National Eye Institute Grant R01 EY017724 (VMF) and National Institute of Arthritis and Musculoskeletal and Skin Diseases Grant K99 AR066534 (DSG).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Fine tip straight forceps | Fine Scientific Tools | 11252-40 | |
| Microdissection scissors, straight edge | Fine Scientific Tools | 15000-00 | |
| Curved forceps | Fine Scientific Tools | 11272-40 | |
| Seizing forceps | Hammacher | HSC 702-93 | Optional |
| Dissection dish | Fisher Scientific | 12565154 | |
| 60 mm Petri dish | Fisher Scientific | 0875713A | |
| 1x phosphate buffered saline (PBS) | Life Technologies | 14190 | |
| 18 x 18 mm glass coverslips | Fisher Scientific | 12-542A | |
| Measurement chamber with divots to hold lenses | Custom-made (see Figure 1) | ||
| Right-angle mirror | Edmund Optics | 45-591 | |
| Light source | Schott/Fostec | 8375 | |
| Illuminated dissecting microscope | Olympus | SZX-ILLD100 | With SZ-PT phototube |
| Digital camera | Nikon | Coolpix 990 |
References
- Lovicu, F. J., Robinson, M. L. Development of the ocular lens. , Cambridge University Press. (2004).
- Piatigorsky, J. Lens differentiation in vertebrates. A review of cellular and molecular features. Differentiation. 19 (3), 134-153 (1981).
- Glasser, A. Restoration of accommodation: surgical options for correction of presbyopia. Clin Exp Optom. 91 (3), 279-295 (2008).
- Keeney, A. H., Hagman, R. E., Fratello, C. J. Dictionary of ophthalmic optics. , Butterworth-Heinemann. (1995).
- Millodot, M. Dictionary of optometry and visual science. 7, Elsevier/Butterworth-Heinemann. (2009).
- Heys, K. R., Cram, S. L., Truscott, R. J. Massive increase in the stiffness of the human lens nucleus with age: the basis for presbyopia. Mol Vis. 10, 956-963 (2004).
- Heys, K. R., Friedrich, M. G., Truscott, R. J. Presbyopia and heat: changes associated with aging of the human lens suggest a functional role for the small heat shock protein, alpha-crystallin, in maintaining lens flexibility. Aging Cell. 6 (6), 807-815 (2007).
- Pierscionek, B. K. Age-related response of human lenses to stretching forces. Exp Eye Res. 60 (3), 325-332 (1995).
- Glasser, A., Biometric Campbell, M. C. optical and physical changes in the isolated human crystalline lens with age in relation to presbyopia. Vision Res. 39 (11), 1991-2015 (1999).
- Weeber, H. A., van der Heijde, R. G. On the relationship between lens stiffness and accommodative amplitude. Exp Eye Res. 85 (5), 602-607 (2007).
- Weeber, H. A., et al. Dynamic mechanical properties of human lenses. Exp Eye Res. 80 (3), 425-434 (2005).
- Fisher, R. F. Elastic properties of the human lens. Exp Eye Res. 11 (1), 143(1971).
- Krueger, R. R., Sun, X. K., Stroh, J., Myers, R. Experimental increase in accommodative potential after neodymium: yttrium-aluminum-garnet laser photodisruption of paired cadaver lenses. Ophthalmology. 108 (11), 2122-2129 (2001).
- Burd, H. J., Wilde, G. S., Judge, S. J. An improved spinning lens test to determine the stiffness of the human lens. Exp Eye Res. 92 (1), 28-39 (2011).
- Glasser, A., Campbell, M. C. Presbyopia and the optical changes in the human crystalline lens with age. Vision Res. 38 (2), 209-229 (1998).
- Pau, H., Kranz, J. The increasing sclerosis of the human lens with age and its relevance to accommodation and presbyopia. Graefes Arch Clin Exp Ophthalmol. 229 (3), 294-296 (1991).
- Hollman, K. W., O'Donnell, M., Erpelding, T. N. Mapping elasticity in human lenses using bubble-based acoustic radiation force. Exp Eye Res. 85 (6), 890-893 (2007).
- Baradia, H., Nikahd, N., Glasser, A. Mouse lens stiffness measurements. Exp Eye Res. 91 (2), 300-307 (2010).
- Gokhin, D. S., et al. Tmod1 and CP49 synergize to control the fiber cell geometry, transparency, and mechanical stiffness of the mouse lens. PLoS One. 7 (11), e48734(2012).
- Sindhu Kumari, S., et al. Role of Aquaporin 0 in lens biomechanics. Biochem Biophys Res Commun. , (2015).
- Fudge, D. S., et al. Intermediate filaments regulate tissue size and stiffness in the murine lens. Invest Ophthalmol Vis Sci. 52 (6), 3860-3867 (2011).
- Kuszak, J. R., Mazurkiewicz, M., Zoltoski, R. Computer modeling of secondary fiber development and growth: I. Nonprimate lenses. Mol Vis. 12, 251-270 (2006).
- Scarcelli, G., Kim, P., Yun, S. H. In vivo measurement of age-related stiffening in the crystalline lens by Brillouin optical microscopy. Biophys J. 101 (6), 1539-1545 (2011).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved