É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Aplicação sequencial de lamelas de vidro para avaliar a compressão Rigidez do Lens Mouse: tensão e morfométricas Análises
Neste Artigo
Resumo
Age-related increases in eye lens stiffness are linked to presbyopia. This protocol describes a simple, cost-effective method for measuring mouse lens stiffness. Mouse lenses, like human lenses, become stiffer with age. This method is precise and can be adapted for lenses from larger animals.
Resumo
A lente do olho é um órgão transparente que refrata e focaliza a luz para formar uma imagem nítida sobre a retina. Nos seres humanos, os músculos ciliares contrato para deformar a lente, levando a um aumento na potência óptica das lentes para focar objetos próximos, um processo conhecido como acomodação. mudanças relacionadas à idade na rigidez da lente têm sido associados a presbiopia, uma redução na capacidade da lente para acomodar, e, por extensão, a necessidade de óculos de leitura. Mesmo que as lentes do mouse não acomodar ou desenvolver presbiopia, modelos de ratos pode fornecer uma ferramenta genética inestimável para patologias lente compreensão, eo envelhecimento acelerado observado em camundongos permite o estudo de mudanças relacionadas à idade na lente. Este protocolo demonstra um método simples, precisa e de custo eficaz para determinar a rigidez da lente do mouse, utilizando lamelas de vidro para aplicar sequencialmente crescente cargas de compressão na lente. Os dados representativos confirmar que as lentes do mouse se tornar mais rígida com a idade, comolentes humanas. Este método é altamente reprodutível e pode, potencialmente, ser ampliados por meios mecânicos lentes de teste a partir de animais maiores.
Introdução
The lens is a transparent and avascular organ in the anterior chamber of the eye that is responsible for fine focusing of light onto the retina. A clear basement membrane, called the lens capsule, surrounds a bulk of elongated fiber cells covered by an anterior monolayer of epithelial cells1,2. Life-long growth of the lens depends on the continuous proliferation and differentiation of epithelial cells at the lens equator into new fiber cells that are added onto previous generations of fiber cells in a concentric manner2. Over time, lens fiber cells undergo compaction, resulting in a rigid center in the middle of the lens called the nucleus1. Accommodation, defined as a dioptric change in the optical power of the eye, occurs in humans when the ciliary muscles contract to deform the lens and allow a true increase in optical power to focus on near objects3-5. In the unaccommodated eye, the lens is held in a relatively flattened state due to tension from zonular fibers. When the ciliary muscles contract, the tension on the lens is released, leading to decreased lens equatorial diameter and increased axial thickness. Age-related changes in the lens cause presbyopia, a progressive loss of lens accommodation, which leads to the need for reading glasses.
Several studies have linked presbyopia to age-related increase in the intrinsic stiffness of the lens6-11. Stiffness is defined as the resistance of an elastic object to deform under applied load. A variety of methods have been used to examine stiffness of human lenses, including spin compression12-14, actuator compression15, probe indentation16, dynamic mechanical analysis 6,10 and bubble-based acoustic radiation force17. While mouse lenses do not accommodate or develop presbyopia, mouse models for lens pathologies are valuable tools because mice are less expensive than larger animals, well characterized genetically and undergo accelerated age-related changes due to rapid aging. A handful of studies have examined mouse lens stiffness with compression methods and demonstrated changes in lens stiffness due to aging or targeted genetic disruptions18-21. Thus, mouse lenses are good models for studying age-related changes in lens stiffness.
This protocol describes a simple and inexpensive, yet precise and reproducible, compression method for determining mouse lens stiffness based on application of glass coverslips onto the lens in conjunction with photographing the lens through a dissection microscope and mirror. This method yields robust strain and morphometric data with an easily fabricated and assembled apparatus. The representative results confirm that mouse lenses increase in stiffness with age.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos os procedimentos com animais foram realizados de acordo com as recomendações do Guia para o Cuidado e Uso de Animais de Laboratório pelos Institutos Nacionais de Saúde e sob um protocolo aprovado pelo Comitê de Cuidado e Uso Institucional animal no Scripps Research Institute.
1. Lens Dissection
- Euthanize camundongos acordo com as recomendações dos Institutos Nacionais de Saúde "Guia para o Cuidado e Uso de Animais de Laboratório" e protocolos de uso instituição animais aprovados.
- Enuclear o olho de ratos usando uma pinça curva. Deprimir o tecido em volta do olho com a pinça para trazer o olho para fora da tomada, e depois arrancar o olho do soquete com a pinça. Transferir os olhos ao fosfato 1x salina fresca tamponada (PBS) no prato de dissecação.
- Cortar o nervo óptico tão perto do globo ocular possível. Suavemente e com cuidado insira uma pinça reta finos no globo ocular através do wher buracoe o nervo óptico sai do posterior.
- Cuidadosamente fazer uma incisão com tesoura no globo ocular a partir do posterior para o bordo da córnea. lentes de roedores ~ ocupar 30% do olho. Faça essas incisões cuidadosamente, e não introduza pinças ou tesouras muito profundo no olho para evitar danificar a lente.
- O corte ao longo da junção entre a córnea e a esclera, pelo menos, a meio caminho em torno do globo ocular.
- Com cuidado, empurre sobre a córnea para remover a lente do olho, através da abertura feita nas etapas 1.4 e 1.5.
- Use uma pinça ponta reta finos para remover cuidadosamente qualquer grande detritos que ainda está ligado à lente. inspecionar visualmente a lente por qualquer dano antes de prosseguir com as medidas de rigidez.
2. Medidas de rigidez
- Pesar pelo menos 10 lamelas a partir da mesma caixa usando uma balança analítica. Encontre o peso médio das lamelas. Para consistência, use a mesma caixa de lamelas para todos os experimentos. Pré-molhadoAs lamelas e em ângulo recto espelho em 1x PBS à temperatura ambiente durante pelo menos duas horas antes de começar as experiências.
- Encha a câmara de medição (ver Figura 1) com 65 - 75 ml de 1x PBS. A câmara de medição foi feita de Plexiglas por uma loja de máquina em casa, e divots na câmara foram feitas por uma imprensa de broca ajustado para a profundidade desejada com uma broca apropriada. Lentes permanecer transparente em 1x PBS, à temperatura ambiente, durante a duração do teste mecânico.

Figura 1:. Rigidez Medição Secção Uma foto que mostra as dimensões da câmara de medição de rigidez feito por medida com uma variedade de torrões de diferentes profundidades e formas. Os divots redondas que são 200 mm ou 300 mm de profundidade (setas amarelas) são utilizados para as medições em lentes de rato. Divots são 2 mm de diâmetro e 13 ~-. 14 mm a partir da borda da câmara Por favor clique aqui para ver uma versão maior desta figura.
- Coloque espelho de ângulo direito para dentro da câmara a uma distância constante do torrão que vai ser usada para segurar a lente. Certifique-se o espelho não se move durante o experimento.
- Transferência de lentes dissecados a câmara de medição com cuidado com apreensão fórceps ou pinças curvas.
- Dê uma vista de cima imagem da lente descarregado directamente de cima. Tome rato fotos lente em 30X de ampliação com iluminação de microscópio de dissecação (inferior) e uma fonte de luz de fibra óptica nas laterais esquerda e direita. Definir a fonte de alimentação da fibra óptica a 80% da intensidade de luz máxima. Ajustar a saída da fonte de alimentação com base na iluminação ambiente, a preferência do usuário e qualidade de imagem, conforme necessário.
- Dê uma vista lateral imagem da lente sem carga, o que pode ser visto através do riespelho GHT-ângulo. Se a câmera não está calibrado, tirar uma foto da borda do espelho no foco. A aresta do espelho é de 5 mm de comprimento, e essa medida pode depois ser usado para determinar a pixels / mm e servir como uma barra de escala nas imagens.
- lente lugar no torrão, e confirme que a lente está sentado de forma segura e em linha reta no torrão. Tire uma foto da lente antes do carregamento. A lente deve estar descansando na torrão sobre o seu anterior ou pólo posterior.
- Coloque uma lamela suavemente sobre a lente. Aguarde 2 min para permitir a fluência, e pegue outro lado-vista de imagem da lente carregado.
- Continue adicionando lamelas como no passo 2.8 e tendo side-ver fotos após a adição de cada lamela como no passo 2.8 até um total de 10 lamelas são aplicadas.
- Remova todas as lamelas. Aguarde 2 min, e dar uma visão lateral imagem da lente (dentro e fora do torrão) após a remoção de todas as lamelas.
Medição 3. Lens Nucleus
- para determine o tamanho núcleo da lente, mover a lente para uma placa de Petri limpa preenchido com 1x PBS.
- Gentilmente decapsulate a lente usando uma pinça reta finos.
- Slough fora das células das fibras corticais por rolando a lente entre os dedos enluvados. O núcleo do cristalino remanescente vai se sentir como um mármore duro. Usar este procedimento para isolar o núcleo em lentes de adultos a partir de 1 mês de idade. Uma vez que o núcleo isolado é um corpo rígido, mais ensaios mecânica do núcleo da lente não pode ser executada utilizando este método descrito.
- Lave o núcleo da lente em 1x PBS numa placa de Petri.
- Coloque o núcleo da lente de volta para a câmara de medição (não no torrão), e tomar uma imagem do núcleo da lente através do espelho de ângulo direito.
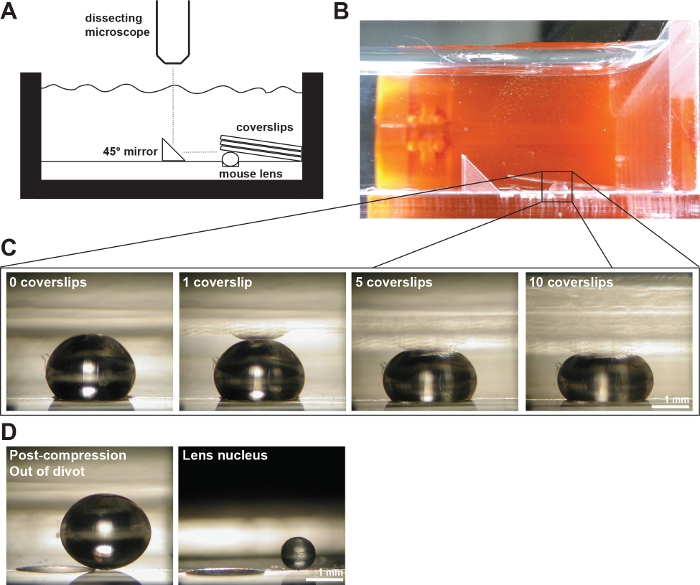
Figura 2:. A Lenses mouse comprimido por Lamelas (A) Esquema e (B) fotografia do exconfiguração perimental mostrando uma lente de 2 meses de idade mouse em um torrão de 200 mm de profundidade na câmara de medição preenchida com 1x PBS. Um espelho ângulo direito e uma câmera digital acoplada a um microscópio de dissecação foram usadas para recolher imagens da lente durante a compressão por lamelas. (C) Fotos de pontos de vista sagital de um 2 meses de idade lente de tipo selvagem comprimido sucessivamente um número crescente de lamelas, desde que os dados brutos para medir diâmetros axiais e equatoriais e calculando tensões axiais e equatoriais durante o teste de compressão à base de lamela. A reflexão da lente pode, por vezes, ser visto nas lamelas (mais claramente visível na imagem uma lamela). Ao fazer medições, ignorar a reflexão e medir até o ápice da lente. (D) Fotos de pontos de vista sagital dos 2 meses de idade, do tipo selvagem lente pós-compressão eo núcleo isolado lente. A lente pós-compressão e núcleo isolado está sentado fora do torrão. Barras de escala, de 1 mm. Este valor é modificado a partir Gokhin, et al. PLoS ONE, 19, 2012. Por favor clique aqui para ver uma versão maior desta figura.
Análise 4. Imagem
- Medir diâmetros equatoriais e axiais de lentes antes do carregamento e após cada etapa de carregamento usando ImageJ ou software similar. Medir o diâmetro de cada núcleo da lente. O núcleo da lente é esférica de modo quase uma medição em qualquer orientação será suficiente 19,21.
- Corrigir a lente axial diâmetros adicionando a profundidade do torrão utilizado. Na câmara de medição, o torrão obscurecido 200 uM (lentes de 2 meses de idade) ou de ratinho (300 um lentes de 4 meses de idade e 8 meses de idade) do rato da espessura axial da lente.
- Calcule o axial e estirpes equatoriais a partir das medições do diâmetro da lente usando a equação, ε = (d - d 0) / d 0, onde ε é a tensão, d é a axial ou ediâmetro quatorial a uma determinada carga, e d é o diâmetro 0 axial ou equatorial correspondente a uma carga nula.
- Traça-se a estirpes axial e equatorial como funções da carga aplicada (em mg).
- Traçar a axial, equatorial e diâmetros nucleares. Calcular e traçar a relação de aspecto lente dividindo o diâmetro axial pelo diâmetro equatorial.
- Calcular e definir o volume da lente usando a equação, Volume = 4/3 x π × 2 × R e R a, em que Re é o raio equatorial e R a é o raio medido a partir axial da fotografia tirada no passo 2.6. Esta equação assume a lente é um esferóide oblato (elipsóide) 1,22.
- Calcular e definir o volume nuclear utilizando a equação, Volume = 4/3 x π × R 3 N, em que R N é o raio do núcleo da lente, conforme medido a partir da fotografia tirada no passo 3.5. Esta equação assume que o núcleo da lente iesfera sa 19,21.
- Calcular e representar graficamente a fracção nuclear, tal como a razão do volume nuclear para o volume da lente.
Access restricted. Please log in or start a trial to view this content.
Resultados
A rigidez e dimensões de lentes 2-, 4- e 8 meses de idade rato foram medidos. Os ratinhos foram todos os animais de tipo selvagem sobre um fundo puro estirpe C57BL6 obtido a partir da criação de animais Facilidade TSRI animal, e cada lente foi carregado com 1 a 10 lamelas. As estirpes axiais e equatoriais foram calculadas como uma função da carga aplicada através da medição do diâmetro equatorial e axial da lente após a adição de cada lamela, e depois normalizando a cada muda...
Access restricted. Please log in or start a trial to view this content.
Discussão
Há várias considerações importantes quando se usa este método para medir a rigidez da lente. Em primeiro lugar, as lamelas são aplicados para a lente com um ângulo ligeiramente oblíquo (8-8,5 °) em relação ao fundo da câmara (θ). Isto aplica-se um componente muito pequeno da carga equatorial ao invés de axial. No entanto, essa carga equatorial é considerado insignificante, porque o pecado θ ≈ 0,1 19. Se este método é adaptado para lentes maiores, o ângulo das lamelas para o fundo da câma...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
This work was supported by National Eye Institute Grant R01 EY017724 (VMF) and National Institute of Arthritis and Musculoskeletal and Skin Diseases Grant K99 AR066534 (DSG).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Fine tip straight forceps | Fine Scientific Tools | 11252-40 | |
| Microdissection scissors, straight edge | Fine Scientific Tools | 15000-00 | |
| Curved forceps | Fine Scientific Tools | 11272-40 | |
| Seizing forceps | Hammacher | HSC 702-93 | Optional |
| Dissection dish | Fisher Scientific | 12565154 | |
| 60 mm Petri dish | Fisher Scientific | 0875713A | |
| 1x phosphate buffered saline (PBS) | Life Technologies | 14190 | |
| 18 x 18 mm glass coverslips | Fisher Scientific | 12-542A | |
| Measurement chamber with divots to hold lenses | Custom-made (see Figure 1) | ||
| Right-angle mirror | Edmund Optics | 45-591 | |
| Light source | Schott/Fostec | 8375 | |
| Illuminated dissecting microscope | Olympus | SZX-ILLD100 | With SZ-PT phototube |
| Digital camera | Nikon | Coolpix 990 |
Referências
- Lovicu, F. J., Robinson, M. L. Development of the ocular lens. , Cambridge University Press. (2004).
- Piatigorsky, J. Lens differentiation in vertebrates. A review of cellular and molecular features. Differentiation. 19 (3), 134-153 (1981).
- Glasser, A. Restoration of accommodation: surgical options for correction of presbyopia. Clin Exp Optom. 91 (3), 279-295 (2008).
- Keeney, A. H., Hagman, R. E., Fratello, C. J. Dictionary of ophthalmic optics. , Butterworth-Heinemann. (1995).
- Millodot, M. Dictionary of optometry and visual science. 7, Elsevier/Butterworth-Heinemann. (2009).
- Heys, K. R., Cram, S. L., Truscott, R. J. Massive increase in the stiffness of the human lens nucleus with age: the basis for presbyopia. Mol Vis. 10, 956-963 (2004).
- Heys, K. R., Friedrich, M. G., Truscott, R. J. Presbyopia and heat: changes associated with aging of the human lens suggest a functional role for the small heat shock protein, alpha-crystallin, in maintaining lens flexibility. Aging Cell. 6 (6), 807-815 (2007).
- Pierscionek, B. K. Age-related response of human lenses to stretching forces. Exp Eye Res. 60 (3), 325-332 (1995).
- Glasser, A., Biometric Campbell, M. C. optical and physical changes in the isolated human crystalline lens with age in relation to presbyopia. Vision Res. 39 (11), 1991-2015 (1999).
- Weeber, H. A., van der Heijde, R. G. On the relationship between lens stiffness and accommodative amplitude. Exp Eye Res. 85 (5), 602-607 (2007).
- Weeber, H. A., et al. Dynamic mechanical properties of human lenses. Exp Eye Res. 80 (3), 425-434 (2005).
- Fisher, R. F. Elastic properties of the human lens. Exp Eye Res. 11 (1), 143(1971).
- Krueger, R. R., Sun, X. K., Stroh, J., Myers, R. Experimental increase in accommodative potential after neodymium: yttrium-aluminum-garnet laser photodisruption of paired cadaver lenses. Ophthalmology. 108 (11), 2122-2129 (2001).
- Burd, H. J., Wilde, G. S., Judge, S. J. An improved spinning lens test to determine the stiffness of the human lens. Exp Eye Res. 92 (1), 28-39 (2011).
- Glasser, A., Campbell, M. C. Presbyopia and the optical changes in the human crystalline lens with age. Vision Res. 38 (2), 209-229 (1998).
- Pau, H., Kranz, J. The increasing sclerosis of the human lens with age and its relevance to accommodation and presbyopia. Graefes Arch Clin Exp Ophthalmol. 229 (3), 294-296 (1991).
- Hollman, K. W., O'Donnell, M., Erpelding, T. N. Mapping elasticity in human lenses using bubble-based acoustic radiation force. Exp Eye Res. 85 (6), 890-893 (2007).
- Baradia, H., Nikahd, N., Glasser, A. Mouse lens stiffness measurements. Exp Eye Res. 91 (2), 300-307 (2010).
- Gokhin, D. S., et al. Tmod1 and CP49 synergize to control the fiber cell geometry, transparency, and mechanical stiffness of the mouse lens. PLoS One. 7 (11), e48734(2012).
- Sindhu Kumari, S., et al. Role of Aquaporin 0 in lens biomechanics. Biochem Biophys Res Commun. , (2015).
- Fudge, D. S., et al. Intermediate filaments regulate tissue size and stiffness in the murine lens. Invest Ophthalmol Vis Sci. 52 (6), 3860-3867 (2011).
- Kuszak, J. R., Mazurkiewicz, M., Zoltoski, R. Computer modeling of secondary fiber development and growth: I. Nonprimate lenses. Mol Vis. 12, 251-270 (2006).
- Scarcelli, G., Kim, P., Yun, S. H. In vivo measurement of age-related stiffening in the crystalline lens by Brillouin optical microscopy. Biophys J. 101 (6), 1539-1545 (2011).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados