Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Последовательное применение покровные стекла для оценки сжимающей Жесткость объектива мыши: Штамм и Морфометрические анализы
В этой статье
Резюме
Age-related increases in eye lens stiffness are linked to presbyopia. This protocol describes a simple, cost-effective method for measuring mouse lens stiffness. Mouse lenses, like human lenses, become stiffer with age. This method is precise and can be adapted for lenses from larger animals.
Аннотация
Хрусталик глаза является прозрачным органом, который преломляет и фокусирует свет, чтобы сформировать четкое изображение на сетчатке. У людей, ресничные мышцы сокращаются, чтобы деформировать линзу, что приводит к увеличению оптической мощности на объективе, чтобы сосредоточиться на близлежащих объектах, процесс, известный как жилье. Возрастные изменения в жесткости линзы были связаны с пресбиопии, уменьшение способности объектива для размещения, и, соответственно, необходимость в очках для чтения. Даже если мышь линзы не учитывают или разрабатывать пресбиопии, мышиные модели может обеспечить неоценимый генетический инструмент для понимания патологии хрусталика, а также ускоренное старение наблюдается у мышей позволяет исследовать возрастных изменений в хрусталике. Этот протокол демонстрирует простой, точный и экономически эффективный метод определения жесткости объектива мыши, используя покровные стекла для применения последовательно увеличивая сжимающие нагрузки на объектив. Типичные данные подтверждают, что мыши линзы становятся более жесткими с возрастом, какчеловеческие линзы. Этот метод хорошо воспроизводим и потенциально могут быть расширены для механического тестирования линзы от более крупных животных.
Введение
The lens is a transparent and avascular organ in the anterior chamber of the eye that is responsible for fine focusing of light onto the retina. A clear basement membrane, called the lens capsule, surrounds a bulk of elongated fiber cells covered by an anterior monolayer of epithelial cells1,2. Life-long growth of the lens depends on the continuous proliferation and differentiation of epithelial cells at the lens equator into new fiber cells that are added onto previous generations of fiber cells in a concentric manner2. Over time, lens fiber cells undergo compaction, resulting in a rigid center in the middle of the lens called the nucleus1. Accommodation, defined as a dioptric change in the optical power of the eye, occurs in humans when the ciliary muscles contract to deform the lens and allow a true increase in optical power to focus on near objects3-5. In the unaccommodated eye, the lens is held in a relatively flattened state due to tension from zonular fibers. When the ciliary muscles contract, the tension on the lens is released, leading to decreased lens equatorial diameter and increased axial thickness. Age-related changes in the lens cause presbyopia, a progressive loss of lens accommodation, which leads to the need for reading glasses.
Several studies have linked presbyopia to age-related increase in the intrinsic stiffness of the lens6-11. Stiffness is defined as the resistance of an elastic object to deform under applied load. A variety of methods have been used to examine stiffness of human lenses, including spin compression12-14, actuator compression15, probe indentation16, dynamic mechanical analysis 6,10 and bubble-based acoustic radiation force17. While mouse lenses do not accommodate or develop presbyopia, mouse models for lens pathologies are valuable tools because mice are less expensive than larger animals, well characterized genetically and undergo accelerated age-related changes due to rapid aging. A handful of studies have examined mouse lens stiffness with compression methods and demonstrated changes in lens stiffness due to aging or targeted genetic disruptions18-21. Thus, mouse lenses are good models for studying age-related changes in lens stiffness.
This protocol describes a simple and inexpensive, yet precise and reproducible, compression method for determining mouse lens stiffness based on application of glass coverslips onto the lens in conjunction with photographing the lens through a dissection microscope and mirror. This method yields robust strain and morphometric data with an easily fabricated and assembled apparatus. The representative results confirm that mouse lenses increase in stiffness with age.
Access restricted. Please log in or start a trial to view this content.
протокол
Все процедуры на животных были проведены в соответствии с рекомендациями в Руководстве по уходу и использованию лабораторных животных Национальных институтов здравоохранения и в соответствии с утвержденным протоколом по уходу и использованию комитета Institutional животного происхождения в Скриппса научно-исследовательского института.
1. Объектив Вскрытие
- Эвтаназии мышей в соответствии с рекомендациями, содержащимися в Национальных Институтов Здоровья "Руководство по уходу и использованию лабораторных животных", а также утвержденных протоколов использования учреждением животных.
- Вылущивать глаз от мышей с использованием изогнутых щипцов. Выжмите ткань вокруг глаз с щипцами, чтобы принести глаз из розетки, а затем вырви глаз из гнезда с помощью пинцета. Перенести глаза на свежий 1x фосфатным буферным раствором (PBS) в рассечение блюдо.
- Отрезанные зрительного нерва как можно ближе к глазному яблоку, насколько это возможно. Аккуратно и осторожно вставьте тонкие прямые пинцетом в глазное яблоко через отверстие порогае зрительный нерв выходит из заднего.
- Аккуратно надрезать ножницами в глазное яблоко от заднего до края роговицы. Грызун линзы занимают ~ 30% глаз. Сделать тщательно эти надрезы, и не вставляйте пинцет или ножницы слишком глубоко в глаза, чтобы не повредить объектив.
- Разрежьте вдоль стыка между роговицы и склеры, по крайней мере на полпути вокруг глазного яблока.
- Слегка надавите на роговице, чтобы удалить линзу из глаза через отверстие, сделанные в шагах 1.4 и 1.5.
- Используйте тонкий пинцет кончик прямой тщательно удалить все крупные мусора, которые по-прежнему прикреплен к объективу. Визуально осмотрите линзу на наличие повреждений, прежде чем приступить к измерениям жесткости.
2. Жесткость Измерения
- Взвешивание по крайней мере 10 покровные из той же коробки с помощью аналитических весов. Найти средний вес покровные. Для согласованности, используйте ту же коробку покровные для всех экспериментов. Предварительно мокраяПокровные и правый угол зеркало в 1x PBS при комнатной температуре в течение по крайней мере 2 ч до начала экспериментов.
- Заполните измерительную камеру (см рисунок 1) с 65 - 75 мл 1x PBS. Измерительная камера была изготовлена из плексигласа с камеральной механического цеха, и дерн в камере были сделаны с помощью сверлильного станка на желаемую глубину с соответствующим сверлом. Линзы остаются прозрачными в 1X PBS при комнатной температуре в течение длительности механических испытаний.

Рисунок 1:. Жесткость измерительная камера фотография , где размеры измерительной камеры жесткости выполненного на заказ с различными дерн разной глубины и формы. Круглые дерн, которые являются 200 мкм или 300 мкм глубиной (желтые стрелки) используются для измерений на линзах мыши. Дерн 2 мм в диаметре и 13 ~-. 14 мм от края камеры Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Поместите правый угол зеркало в камеру на постоянном расстоянии от дерн, который будет использоваться для хранения линз. Убедитесь, что зеркало не двигается во время эксперимента.
- Передача расчлененный линзы в измерительную камеру осторожно с захватывая щипцов или изогнутыми щипцами.
- Возьмите вид сверху картину ненагруженном линзы из прямо над головой. Возьмите мышь фотографий объектив 30X при увеличении с подсветкой от рассечения микроскопа (внизу) и источник волоконно-оптический свет на левой и правой сторон. Установка волоконно-оптический источник питания до 80% от максимальной интенсивности света. Настройте выход источника питания, в зависимости от условий освещения, предпочтений пользователя и качества изображения по мере необходимости.
- Возьмите вид сбоку картину ненагруженном линзы, которые можно увидеть через Р.И.GHT угол зеркала. Если камера не откалиброван, сфотографировать зеркала края в фокусе. Кромка зеркало длиной 5 мм, и это измерение позже может быть использовано для определения пикселов / мм и служат в качестве масштабной линейки в изображениях.
- Поместите линзы в дерн, и убедитесь, что объектив надежно и прямо сидит в дерн. Сфотографируйте объектива перед загрузкой. Объектив должен отдыхать в дерн на его передней или заднем полюсе.
- Поместите 1 покровное мягко на объектив. Подождите 2 мин, чтобы позволить ползать, и взять другой вид сбоку изображение загруженного объектива.
- Продолжайте добавлять покровные, как на стадии 2.8, и принимая вида сбоку снимков после добавления каждого покровного как на шаге 2.8 до в общей сложности 10 покровные не применяются.
- Удалить все покровные. Подождите 2 минуты, и принять вид сбоку изображение объектива (внутри и снаружи дерн) после удаления всех покровные.
Измерение 3. Объектив Nucleus
- Для determине размер ядра хрусталика, переместите объектив в чистую чашку Петри с 1x PBS.
- Аккуратно decapsulate объектив с использованием тонких прямых щипцов.
- Шелушиться клетки коры головного мозга волокна путем прокатки линзы между пальцами в перчатках. Оставшийся ядро линзы будут чувствовать себя как жесткий мрамор. Используйте эту процедуру, чтобы изолировать ядро на взрослых линз, начиная с 1-месячного возраста. Так как изолированное ядро представляет собой твердое тело, дальнейшее механическое испытание ядра хрусталика не может быть выполнена с помощью этого метода, описанного.
- Осторожно промыть ядро линзы в 1x PBS в чашке Петри.
- Поместите ядро линзы обратно в измерительную камеру (не в дерн), и принять образ ядра хрусталика через правый угол зеркала.
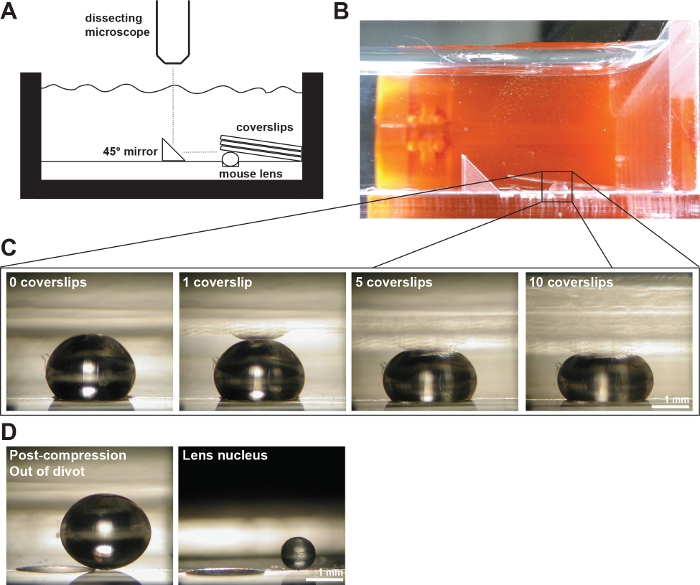
Рис . 2: A Линзы мыши сжат покровные (А) Схематическое и (Б) фотография эксментальная установка, показывающая 2-месячным объектив мыши в 200 мкм глубокой дерн в измерительной камере, заполненной 1x PBS. Правый угол зеркало и цифровая камера, установленная на рассечение микроскопа были использованы для сбора изображений объектива во время сжатия по покровные. (C) Фотографии сагиттальной видом 2-месячного дикого типа линзы сжатого путем последовательного увеличения числа покровных при условии, что исходные данные для измерения осевых и экваториальные диаметры и расчета осевых и экваториальные деформаций во время испытаний на сжатие покровного основе. Отражение объектива иногда можно увидеть в покровные (наиболее четко видна в 1 покровного изображения). При проведении измерений, игнорировать отражение и измерить расстояние до вершины линзы. (D) Фотографии сагиттальной видом на 2-месячного дикого типа линз после сжатия и изолированного ядра хрусталика. После сжатия линзы и изолированные ядра сидят за пределами дерн. Шкала баров, 1 мм. Эта цифра изменяется от Gokhв др. PLoS One, 2012 19. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Анализ 4. Изображение
- Мера экваториальные и осевые диаметры линз перед погрузкой и после каждой стадии загрузки с использованием ImageJ или подобное программное обеспечение. Измерьте диаметр каждого ядра хрусталика. Ядро линзы близка к сферической , так измерение при любой ориентации будет достаточно 19,21.
- Откорректируйте линзы осевого диаметра, добавляя глубину дерн, используемой. В камере измерения, дерн затемняется 200 мкм (2-месячным линзы мыши) или 300 мкм (4-месячным и 8-месячным линзы мыши) осевого толщины линзы.
- Вычислить осевые и экваториальные штаммы из измерений диаметра линзы с использованием уравнения, ε = (d - d 0) / d 0, где ε является деформация, d является осевая или еquatorial диаметр при заданной нагрузке, а d 0 представляет собой соответствующий аксиальном или экваториальном диаметра при нулевой нагрузке.
- Постройте осевую и экваториальных деформаций как функции приложенной нагрузки (в мг).
- Участок осевой, экваториальной и ядерных диаметров. Рассчитать и построить соотношение сторон объектива путем деления осевого диаметра от экваториального диаметра.
- Рассчитать и построить объем объектива , используя уравнение, объем = 4/3 × π × Г × E 2 R A, где г Е экваториальный радиус и г А осевой радиус измеряется от изображения , снятого на шаге 2.6. Это уравнение предполагает , что линза представляет собой сплюснутый сфероид (эллипсоид) 1,22.
- Рассчитать и построить ядерный объем с помощью уравнения, объем = 4/3 × × П г N 3, где г N является радиус ядра хрусталика, измеренная от фотографии , сделанной на шаге 3.5. Это уравнение предполагает I ядро линзыса сфера 19,21.
- Подсчитано и представлено графически ядерную фракцию как отношение объема ядра к объему линзы.
Access restricted. Please log in or start a trial to view this content.
Результаты
Измеряли жесткость и размеры 2-, 4- и 8-месячных линз мыши. Мыши были у всех животных дикого типа на чистом фоне C57BL6 штамма, полученного из Питомника TSRI животных, и каждая линза была загружена с 1 до 10 покровные. Осевые и экваториальные штаммы были рассчитаны в зависимости ?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Есть несколько ключевых соображений при использовании этого метода для измерения жесткости объектива. Во-первых, покровные применяются к линзе при слегка косо (8 - 8,5 °) по отношению к нижней части камеры (Q). Это будет применяться очень небольшой составляющей нагрузки экваториально, а не...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
This work was supported by National Eye Institute Grant R01 EY017724 (VMF) and National Institute of Arthritis and Musculoskeletal and Skin Diseases Grant K99 AR066534 (DSG).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Fine tip straight forceps | Fine Scientific Tools | 11252-40 | |
| Microdissection scissors, straight edge | Fine Scientific Tools | 15000-00 | |
| Curved forceps | Fine Scientific Tools | 11272-40 | |
| Seizing forceps | Hammacher | HSC 702-93 | Optional |
| Dissection dish | Fisher Scientific | 12565154 | |
| 60 mm Petri dish | Fisher Scientific | 0875713A | |
| 1x phosphate buffered saline (PBS) | Life Technologies | 14190 | |
| 18 x 18 mm glass coverslips | Fisher Scientific | 12-542A | |
| Measurement chamber with divots to hold lenses | Custom-made (see Figure 1) | ||
| Right-angle mirror | Edmund Optics | 45-591 | |
| Light source | Schott/Fostec | 8375 | |
| Illuminated dissecting microscope | Olympus | SZX-ILLD100 | With SZ-PT phototube |
| Digital camera | Nikon | Coolpix 990 |
Ссылки
- Lovicu, F. J., Robinson, M. L. Development of the ocular lens. , Cambridge University Press. (2004).
- Piatigorsky, J. Lens differentiation in vertebrates. A review of cellular and molecular features. Differentiation. 19 (3), 134-153 (1981).
- Glasser, A. Restoration of accommodation: surgical options for correction of presbyopia. Clin Exp Optom. 91 (3), 279-295 (2008).
- Keeney, A. H., Hagman, R. E., Fratello, C. J. Dictionary of ophthalmic optics. , Butterworth-Heinemann. (1995).
- Millodot, M. Dictionary of optometry and visual science. 7, Elsevier/Butterworth-Heinemann. (2009).
- Heys, K. R., Cram, S. L., Truscott, R. J. Massive increase in the stiffness of the human lens nucleus with age: the basis for presbyopia. Mol Vis. 10, 956-963 (2004).
- Heys, K. R., Friedrich, M. G., Truscott, R. J. Presbyopia and heat: changes associated with aging of the human lens suggest a functional role for the small heat shock protein, alpha-crystallin, in maintaining lens flexibility. Aging Cell. 6 (6), 807-815 (2007).
- Pierscionek, B. K. Age-related response of human lenses to stretching forces. Exp Eye Res. 60 (3), 325-332 (1995).
- Glasser, A., Biometric Campbell, M. C. optical and physical changes in the isolated human crystalline lens with age in relation to presbyopia. Vision Res. 39 (11), 1991-2015 (1999).
- Weeber, H. A., van der Heijde, R. G. On the relationship between lens stiffness and accommodative amplitude. Exp Eye Res. 85 (5), 602-607 (2007).
- Weeber, H. A., et al. Dynamic mechanical properties of human lenses. Exp Eye Res. 80 (3), 425-434 (2005).
- Fisher, R. F. Elastic properties of the human lens. Exp Eye Res. 11 (1), 143(1971).
- Krueger, R. R., Sun, X. K., Stroh, J., Myers, R. Experimental increase in accommodative potential after neodymium: yttrium-aluminum-garnet laser photodisruption of paired cadaver lenses. Ophthalmology. 108 (11), 2122-2129 (2001).
- Burd, H. J., Wilde, G. S., Judge, S. J. An improved spinning lens test to determine the stiffness of the human lens. Exp Eye Res. 92 (1), 28-39 (2011).
- Glasser, A., Campbell, M. C. Presbyopia and the optical changes in the human crystalline lens with age. Vision Res. 38 (2), 209-229 (1998).
- Pau, H., Kranz, J. The increasing sclerosis of the human lens with age and its relevance to accommodation and presbyopia. Graefes Arch Clin Exp Ophthalmol. 229 (3), 294-296 (1991).
- Hollman, K. W., O'Donnell, M., Erpelding, T. N. Mapping elasticity in human lenses using bubble-based acoustic radiation force. Exp Eye Res. 85 (6), 890-893 (2007).
- Baradia, H., Nikahd, N., Glasser, A. Mouse lens stiffness measurements. Exp Eye Res. 91 (2), 300-307 (2010).
- Gokhin, D. S., et al. Tmod1 and CP49 synergize to control the fiber cell geometry, transparency, and mechanical stiffness of the mouse lens. PLoS One. 7 (11), e48734(2012).
- Sindhu Kumari, S., et al. Role of Aquaporin 0 in lens biomechanics. Biochem Biophys Res Commun. , (2015).
- Fudge, D. S., et al. Intermediate filaments regulate tissue size and stiffness in the murine lens. Invest Ophthalmol Vis Sci. 52 (6), 3860-3867 (2011).
- Kuszak, J. R., Mazurkiewicz, M., Zoltoski, R. Computer modeling of secondary fiber development and growth: I. Nonprimate lenses. Mol Vis. 12, 251-270 (2006).
- Scarcelli, G., Kim, P., Yun, S. H. In vivo measurement of age-related stiffening in the crystalline lens by Brillouin optical microscopy. Biophys J. 101 (6), 1539-1545 (2011).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены