Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Application séquentielle de verre Lamelles pour évaluer la compression Rigidité de l'objectif de la souris: Strain et morphométriques Analyses
Dans cet article
Résumé
Age-related increases in eye lens stiffness are linked to presbyopia. This protocol describes a simple, cost-effective method for measuring mouse lens stiffness. Mouse lenses, like human lenses, become stiffer with age. This method is precise and can be adapted for lenses from larger animals.
Résumé
La lentille de l'œil est un organe transparent qui réfracte et se concentre la lumière pour former une image claire sur la rétine. Chez l'homme, les muscles ciliaires se contractent pour déformer la lentille, ce qui conduit à une augmentation de la puissance optique de la lentille de se concentrer sur des objets proches, un processus connu sous le nom d'hébergement. les changements liés à l'âge de la rigidité de la lentille ont été liés à la presbytie, une réduction de la lentille 'capacité à accueillir, et, par extension, le besoin de lunettes de lecture. Même si les lentilles de souris ne peuvent accueillir ou de développer la presbytie, des modèles de souris peuvent fournir un outil génétique inestimable pour la compréhension des pathologies de l'objectif, et le vieillissement accéléré observé chez la souris permet l'étude des changements liés à l'âge dans la lentille. Ce protocole présente un procédé simple, précise et économique pour la détermination de la rigidité de la lentille de la souris, en utilisant des lamelles de verre pour appliquer séquentiellement des charges de compression croissante sur la lentille. Les données représentatives confirment que les lentilles de souris deviennent plus rigide avec l'âge, commeLentilles humaines. Ce procédé est très reproductible et peut potentiellement être étendu par des moyens mécaniques des lentilles d'essai à partir des animaux plus gros.
Introduction
The lens is a transparent and avascular organ in the anterior chamber of the eye that is responsible for fine focusing of light onto the retina. A clear basement membrane, called the lens capsule, surrounds a bulk of elongated fiber cells covered by an anterior monolayer of epithelial cells1,2. Life-long growth of the lens depends on the continuous proliferation and differentiation of epithelial cells at the lens equator into new fiber cells that are added onto previous generations of fiber cells in a concentric manner2. Over time, lens fiber cells undergo compaction, resulting in a rigid center in the middle of the lens called the nucleus1. Accommodation, defined as a dioptric change in the optical power of the eye, occurs in humans when the ciliary muscles contract to deform the lens and allow a true increase in optical power to focus on near objects3-5. In the unaccommodated eye, the lens is held in a relatively flattened state due to tension from zonular fibers. When the ciliary muscles contract, the tension on the lens is released, leading to decreased lens equatorial diameter and increased axial thickness. Age-related changes in the lens cause presbyopia, a progressive loss of lens accommodation, which leads to the need for reading glasses.
Several studies have linked presbyopia to age-related increase in the intrinsic stiffness of the lens6-11. Stiffness is defined as the resistance of an elastic object to deform under applied load. A variety of methods have been used to examine stiffness of human lenses, including spin compression12-14, actuator compression15, probe indentation16, dynamic mechanical analysis 6,10 and bubble-based acoustic radiation force17. While mouse lenses do not accommodate or develop presbyopia, mouse models for lens pathologies are valuable tools because mice are less expensive than larger animals, well characterized genetically and undergo accelerated age-related changes due to rapid aging. A handful of studies have examined mouse lens stiffness with compression methods and demonstrated changes in lens stiffness due to aging or targeted genetic disruptions18-21. Thus, mouse lenses are good models for studying age-related changes in lens stiffness.
This protocol describes a simple and inexpensive, yet precise and reproducible, compression method for determining mouse lens stiffness based on application of glass coverslips onto the lens in conjunction with photographing the lens through a dissection microscope and mirror. This method yields robust strain and morphometric data with an easily fabricated and assembled apparatus. The representative results confirm that mouse lenses increase in stiffness with age.
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les procédures animales ont été réalisées conformément aux recommandations du Guide pour le soin et l'utilisation des animaux de laboratoire par les National Institutes of Health et en vertu d'un protocole approuvé par le Comité soin et l'utilisation institutionnelle des animaux à l'Institut de recherche Scripps.
1. Objectif Dissection
- Euthanasier souris selon les recommandations dans les National Institutes of Health "Guide pour le soin et l'utilisation des animaux de laboratoire» et les protocoles d'utilisation institution d'animaux approuvés.
- Énucléer l'œil de souris à l'aide des pinces incurvées. Enfoncer le tissu autour de l'œil avec la pince pour amener l'œil de la prise, puis arracher l'œil de la prise avec la pince. Transfert yeux frais phosphate 1x solution saline tamponnée (PBS) dans un plat de dissection.
- Coupez le nerf optique au plus près du globe oculaire que possible. Doucement et soigneusement insérer des pincettes droites fines dans le globe oculaire à travers le wher troue nerf optique quitte le postérieur.
- faire une incision soigneusement avec des ciseaux dans le globe oculaire à partir de la partie postérieure du bord de la cornée. Rongeur lentilles occupent environ 30% de l'oeil. Faire ces incisions soigneusement, et ne pas insérer des pinces ou des ciseaux trop profondément dans l'œil pour éviter d'endommager la lentille.
- Couper le long de la jonction entre la cornée et la sclérotique au moins à mi-chemin autour du globe oculaire.
- Poussez doucement sur la cornée pour enlever la lentille de l'oeil à travers l'ouverture pratiquée dans les étapes 1.4 et 1.5.
- Utilisez pince fine pointe de droites pour éliminer soigneusement les gros débris qui est encore attaché à la lentille. Inspecter visuellement l'objectif de tout dommage avant de procéder aux mesures de rigidité.
2. Mesures de rigidité
- Peser au moins 10 lamelles de la même boîte en utilisant une balance analytique. Trouver le poids moyen des lamelles. Par souci de cohérence, utilisez la même boîte de lamelles pour toutes les expériences. Pré-humideles lamelles et à angle droit miroir 1x PBS à la température ambiante pendant au moins 2 heures avant de commencer les expériences.
- Remplir la chambre de mesure (voir Figure 1) avec 65 - 75 ml de PBS 1x. La chambre de mesure a été faite de plexiglas par un atelier dans la maison-machine et divots dans la chambre ont été faites par une presse de forage fixé à la profondeur désirée avec une mèche appropriée. Objectifs restent transparents dans 1x PBS à la température ambiante pendant toute la durée des essais mécaniques.

Figure 1:. Rigidité Chambre de mesure Une photo montrant les dimensions de la chambre de mesure de rigidité sur mesure avec une variété de divots de différentes profondeurs et formes. Les divots rondes qui sont 200 um ou 300 um de profondeur (flèches jaunes) sont utilisés pour les mesures sur les lentilles de souris. Les mottes de gazon sont de 2 mm de diamètre et de 13 ~-. 14 mm du bord de la chambre S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Placez un miroir à angle droit dans la chambre à une distance constante du divot qui sera utilisé pour maintenir la lentille. Assurez-vous que le miroir ne se déplace pas pendant l'expérience.
- Transfert lentilles disséqués à la chambre de mesure soigneusement avec une pince ou une pince saisissant incurvées.
- Prenez une vue de dessus l'image de la lentille déchargé directement du dessus. Prenez des photos de lentilles de souris à 30X grossissement avec éclairage du microscope de dissection (en bas) et une source de lumière à fibres optiques sur les côtés gauche et droit. Régler l'alimentation en fibre optique à 80% de l'intensité lumineuse maximale. Régler la sortie de l'alimentation en fonction de l'éclairage ambiant, la préférence de l'utilisateur et la qualité de l'image en tant que de besoin.
- Prenez une vue latérale image de la lentille à vide, qui peut être vu à travers la rimiroir ght-angle. Si l'appareil photo est pas étalonné, prendre une photo du bord du miroir au point. Le bord du miroir est de 5 mm de long, et cette mesure peut ensuite être utilisée pour déterminer les pixels / mm et servir de barre d'échelle dans les images.
- Placez la lentille dans le divot, et confirmer que l'objectif est bien fixé et droite dans le divot. Prenez une photo de la lentille avant le chargement. La lentille doit reposer dans le divot sur sa face antérieure ou postérieure pôle.
- Placez 1 lamelle doucement sur la lentille. Attendre 2 min pour permettre le fluage, et de prendre une autre vue latérale image de la lentille chargée.
- Continuez à ajouter des lamelles comme dans l'étape 2.8 et la prise en vue latérale images après l'addition de chaque lamelle comme dans l'étape 2.8 jusqu'à un total de 10 lamelles sont appliquées.
- Retirez toutes les lamelles. Attendre 2 min, et de prendre une vue latérale image de la lentille (à l'intérieur et à l'extérieur de l'divot) après avoir enlevé tous les lamelles.
3. Objectif Nucleus Mesure
- Pour détermine la taille du noyau du cristallin, déplacer la lentille à un plat propre Petri remplie de PBS 1x.
- décapsuler doucement la lentille à l'aide des pinces droites fines.
- Slough au large des Les cellules fibreuses corticales par laminage de la lentille entre les doigts gantés. La lentille noyau restant se sentira comme un marbre dur. Utilisez cette procédure pour isoler le noyau sur les lentilles adultes à partir de 1 mois. Etant donné que le noyau isolé est un corps rigide, d'autres tests mécaniques du noyau de la lentille ne peut être effectuée en utilisant la méthode décrite.
- Rincer délicatement le noyau de lentille 1x PBS dans la boîte de Pétri.
- Placez le noyau de lentille arrière dans la chambre de mesure (pas dans le divot), et de prendre une image du noyau du cristallin à travers le miroir à angle droit.
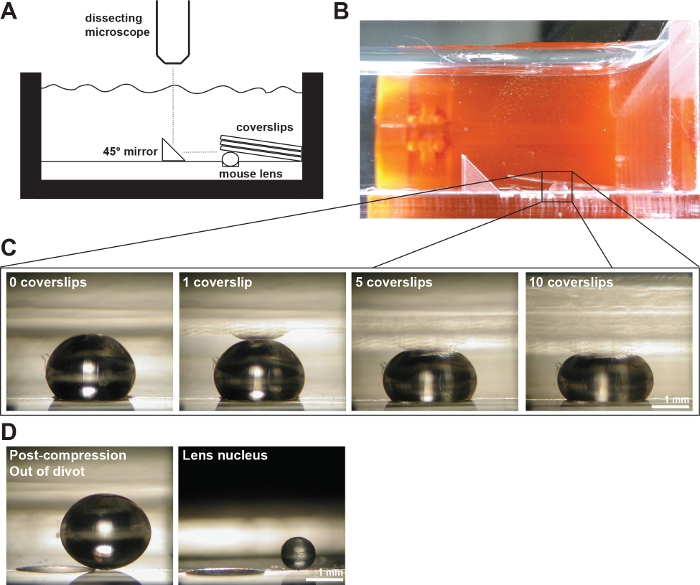
Figure 2:. A Objectifs Souris comprimé par Lamelles (A) Schéma et (B) photographie de l'exconfiguration expérimentale montrant une lentille de souris à 2 mois dans un divot de 200 um de profondeur dans la chambre de mesure remplie de PBS 1x. Un miroir à angle droit et une caméra numérique montée sur un microscope à dissection ont été utilisés pour recueillir des images de la lentille lors de la compression par des lamelles. (C) Photos de vues sagittale d'un 2-month-old lentille de type sauvage comprimé en augmentant successivement le nombre de lamelles à condition que les données brutes pour mesurer des diamètres axiaux et équatoriaux et calcul déformations axiales et équatoriales au cours des essais de compression à base de lamelle. Une réflexion de la lentille peut parfois être vu dans les lamelles (le plus clairement visible dans l'image 1 lamelle). Lors de mesures, ignorer la réflexion et de mesurer à l'apex de la lentille. (D) Photos de vues sagittales du 2-month-old type sauvage lentille de post-compression et la lentille noyau isolé. La lentille de post-compression et le noyau isolé sont assis à l'extérieur du divot. Les barres d'échelle, 1 mm. Ce chiffre est modifié à partir Gokhdans, et al. PLoS One, 2012 19. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
4. Analyse d'image
- Mesurer les diamètres équatoriales et axiales de lentilles avant le chargement et après chaque étape de chargement à l'aide ImageJ ou un logiciel similaire. Mesurer le diamètre de chaque noyau de la lentille. Le noyau de la lentille est presque sphérique de sorte une mesure à toute orientation suffira 19,21.
- Corrigez la lentille axiale diamètres en ajoutant la profondeur de la divot utilisée. Dans la chambre de mesure, la motte de terre obscurci à 200 um (verres 2-month-old souris) ou 300 um (lentilles 4-month-old et 8 mois souris âgées) de l'épaisseur axiale de la lentille.
- Calcul de la direction axiale et équatoriale des souches à partir des mesures du diamètre de la lentille en utilisant l'équation ε = (d - d 0) / d 0, où ε est la souche d est axiale ou ediamètre Quatorial à une charge donnée, et d 0 est le diamètre axial ou équatorial correspondant à une charge nulle.
- Tracer les déformations axiales et équatoriales en fonction de la charge imposée (en mg).
- Tracer la axiale, équatorial et diamètres nucléaires. Calculer et tracer le rapport d'aspect de la lentille en divisant le diamètre axial par le diamètre équatorial.
- Calculer et tracer le volume de la lentille à l' aide de l'équation, volume = 03.04 × π × r × E 2 R a, où R E est le rayon équatorial et R A est le rayon axial mesuré à partir de l'image prise à l' étape 2.6. Cette équation suppose la lentille est un sphéroïde (ellipsoïde) 1,22.
- Calculer et tracer le volume nucléaire en utilisant l'équation, volume = 03.04 × π × N r 3, où r N est le rayon du noyau de la lentille , telle que mesurée à partir de l'image prise à l' étape 3.5. Cette équation suppose la lentille noyau isa sphère 19,21.
- Calculer et tracer la fraction nucléaire comme étant le rapport du volume nucléaire au volume de la lentille.
Access restricted. Please log in or start a trial to view this content.
Résultats
La rigidité et les dimensions des lentilles de souris 2, 4 et 8-month-old ont été mesurés. Les souris étaient tous les animaux de type sauvage sur un pur souche C57BL6 fond obtenue à partir de l'élevage Facility IRST animaux, et chaque lentille a été chargé avec 1 à 10 lamelles. Les déformations axiales et équatoriales ont été calculées en fonction de la charge appliquée par mesure de la direction axiale et le diamètre equatorial de la lentille après l'addition...
Access restricted. Please log in or start a trial to view this content.
Discussion
Il y a plusieurs considérations clés lors de l'utilisation de cette méthode pour mesurer la rigidité de la lentille. En premier lieu, les lamelles sont appliquées à la lentille à un angle légèrement oblique (8 à 8,5 °) par rapport au fond de la chambre (θ). Il en sera une très petite partie de la charge équatorial plutôt que axialement. Cependant, cette charge équatoriale est considéré comme négligeable parce que le péché θ ≈ 0,1 19. Si cette méthode est adaptée pour des lentille...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
This work was supported by National Eye Institute Grant R01 EY017724 (VMF) and National Institute of Arthritis and Musculoskeletal and Skin Diseases Grant K99 AR066534 (DSG).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Fine tip straight forceps | Fine Scientific Tools | 11252-40 | |
| Microdissection scissors, straight edge | Fine Scientific Tools | 15000-00 | |
| Curved forceps | Fine Scientific Tools | 11272-40 | |
| Seizing forceps | Hammacher | HSC 702-93 | Optional |
| Dissection dish | Fisher Scientific | 12565154 | |
| 60 mm Petri dish | Fisher Scientific | 0875713A | |
| 1x phosphate buffered saline (PBS) | Life Technologies | 14190 | |
| 18 x 18 mm glass coverslips | Fisher Scientific | 12-542A | |
| Measurement chamber with divots to hold lenses | Custom-made (see Figure 1) | ||
| Right-angle mirror | Edmund Optics | 45-591 | |
| Light source | Schott/Fostec | 8375 | |
| Illuminated dissecting microscope | Olympus | SZX-ILLD100 | With SZ-PT phototube |
| Digital camera | Nikon | Coolpix 990 |
Références
- Lovicu, F. J., Robinson, M. L. Development of the ocular lens. , Cambridge University Press. (2004).
- Piatigorsky, J. Lens differentiation in vertebrates. A review of cellular and molecular features. Differentiation. 19 (3), 134-153 (1981).
- Glasser, A. Restoration of accommodation: surgical options for correction of presbyopia. Clin Exp Optom. 91 (3), 279-295 (2008).
- Keeney, A. H., Hagman, R. E., Fratello, C. J. Dictionary of ophthalmic optics. , Butterworth-Heinemann. (1995).
- Millodot, M. Dictionary of optometry and visual science. 7, Elsevier/Butterworth-Heinemann. (2009).
- Heys, K. R., Cram, S. L., Truscott, R. J. Massive increase in the stiffness of the human lens nucleus with age: the basis for presbyopia. Mol Vis. 10, 956-963 (2004).
- Heys, K. R., Friedrich, M. G., Truscott, R. J. Presbyopia and heat: changes associated with aging of the human lens suggest a functional role for the small heat shock protein, alpha-crystallin, in maintaining lens flexibility. Aging Cell. 6 (6), 807-815 (2007).
- Pierscionek, B. K. Age-related response of human lenses to stretching forces. Exp Eye Res. 60 (3), 325-332 (1995).
- Glasser, A., Biometric Campbell, M. C. optical and physical changes in the isolated human crystalline lens with age in relation to presbyopia. Vision Res. 39 (11), 1991-2015 (1999).
- Weeber, H. A., van der Heijde, R. G. On the relationship between lens stiffness and accommodative amplitude. Exp Eye Res. 85 (5), 602-607 (2007).
- Weeber, H. A., et al. Dynamic mechanical properties of human lenses. Exp Eye Res. 80 (3), 425-434 (2005).
- Fisher, R. F. Elastic properties of the human lens. Exp Eye Res. 11 (1), 143(1971).
- Krueger, R. R., Sun, X. K., Stroh, J., Myers, R. Experimental increase in accommodative potential after neodymium: yttrium-aluminum-garnet laser photodisruption of paired cadaver lenses. Ophthalmology. 108 (11), 2122-2129 (2001).
- Burd, H. J., Wilde, G. S., Judge, S. J. An improved spinning lens test to determine the stiffness of the human lens. Exp Eye Res. 92 (1), 28-39 (2011).
- Glasser, A., Campbell, M. C. Presbyopia and the optical changes in the human crystalline lens with age. Vision Res. 38 (2), 209-229 (1998).
- Pau, H., Kranz, J. The increasing sclerosis of the human lens with age and its relevance to accommodation and presbyopia. Graefes Arch Clin Exp Ophthalmol. 229 (3), 294-296 (1991).
- Hollman, K. W., O'Donnell, M., Erpelding, T. N. Mapping elasticity in human lenses using bubble-based acoustic radiation force. Exp Eye Res. 85 (6), 890-893 (2007).
- Baradia, H., Nikahd, N., Glasser, A. Mouse lens stiffness measurements. Exp Eye Res. 91 (2), 300-307 (2010).
- Gokhin, D. S., et al. Tmod1 and CP49 synergize to control the fiber cell geometry, transparency, and mechanical stiffness of the mouse lens. PLoS One. 7 (11), e48734(2012).
- Sindhu Kumari, S., et al. Role of Aquaporin 0 in lens biomechanics. Biochem Biophys Res Commun. , (2015).
- Fudge, D. S., et al. Intermediate filaments regulate tissue size and stiffness in the murine lens. Invest Ophthalmol Vis Sci. 52 (6), 3860-3867 (2011).
- Kuszak, J. R., Mazurkiewicz, M., Zoltoski, R. Computer modeling of secondary fiber development and growth: I. Nonprimate lenses. Mol Vis. 12, 251-270 (2006).
- Scarcelli, G., Kim, P., Yun, S. H. In vivo measurement of age-related stiffening in the crystalline lens by Brillouin optical microscopy. Biophys J. 101 (6), 1539-1545 (2011).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon