Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Sequential Anwendung von Glasplättchen die Drucksteifigkeit der Maus Objektiv zu beurteilen: Stamm und morphometrische Analysen
In diesem Artikel
Zusammenfassung
Age-related increases in eye lens stiffness are linked to presbyopia. This protocol describes a simple, cost-effective method for measuring mouse lens stiffness. Mouse lenses, like human lenses, become stiffer with age. This method is precise and can be adapted for lenses from larger animals.
Zusammenfassung
Die Augenlinse ist ein transparentes Organ, das Licht bricht und konzentriert sich auf die Netzhaut ein klares Bild zu bilden. Beim Menschen Vertrag Ziliarmuskeln die Linse zu verformen, zu einer Erhöhung führt in der Linse "optische Leistung auf nahe Objekte scharf, ein Verfahren, wie Unterkunft bekannt. Altersbedingte Veränderungen in der Linsensteifigkeit haben Presbyopie in Verbindung gebracht worden, eine Verminderung der Linse die Fähigkeit aufzunehmen, und durch Erweiterung, die Notwendigkeit für eine Lesebrille. Auch wenn die Maus Linsen aufnehmen oder nicht entwickeln Presbyopie, Mausmodelle können einen unschätzbaren genetisches Werkzeug für das Verständnis Objektiv Pathologien bieten, und die beschleunigte Alterung bei Mäusen beobachtet, ermöglicht die Untersuchung von altersbedingten Veränderungen in der Linse. Dieses Protokoll zeigt, eine einfache, präzise und kostengünstiges Verfahren für Maus Linsensteifigkeit Bestimmung unter Verwendung von Glasdeckgläser sequentiell Druckbelastungen auf die Linse Erhöhung anzuwenden. Repräsentative Daten bestätigen, dass die Maus Linsen steifer mit dem Alter, wiemenschliche Linsen. Dieses Verfahren ist sehr gut reproduzierbar und kann potenziell Testlinsen von größeren Tieren zu mechanisch skaliert werden.
Einleitung
The lens is a transparent and avascular organ in the anterior chamber of the eye that is responsible for fine focusing of light onto the retina. A clear basement membrane, called the lens capsule, surrounds a bulk of elongated fiber cells covered by an anterior monolayer of epithelial cells1,2. Life-long growth of the lens depends on the continuous proliferation and differentiation of epithelial cells at the lens equator into new fiber cells that are added onto previous generations of fiber cells in a concentric manner2. Over time, lens fiber cells undergo compaction, resulting in a rigid center in the middle of the lens called the nucleus1. Accommodation, defined as a dioptric change in the optical power of the eye, occurs in humans when the ciliary muscles contract to deform the lens and allow a true increase in optical power to focus on near objects3-5. In the unaccommodated eye, the lens is held in a relatively flattened state due to tension from zonular fibers. When the ciliary muscles contract, the tension on the lens is released, leading to decreased lens equatorial diameter and increased axial thickness. Age-related changes in the lens cause presbyopia, a progressive loss of lens accommodation, which leads to the need for reading glasses.
Several studies have linked presbyopia to age-related increase in the intrinsic stiffness of the lens6-11. Stiffness is defined as the resistance of an elastic object to deform under applied load. A variety of methods have been used to examine stiffness of human lenses, including spin compression12-14, actuator compression15, probe indentation16, dynamic mechanical analysis 6,10 and bubble-based acoustic radiation force17. While mouse lenses do not accommodate or develop presbyopia, mouse models for lens pathologies are valuable tools because mice are less expensive than larger animals, well characterized genetically and undergo accelerated age-related changes due to rapid aging. A handful of studies have examined mouse lens stiffness with compression methods and demonstrated changes in lens stiffness due to aging or targeted genetic disruptions18-21. Thus, mouse lenses are good models for studying age-related changes in lens stiffness.
This protocol describes a simple and inexpensive, yet precise and reproducible, compression method for determining mouse lens stiffness based on application of glass coverslips onto the lens in conjunction with photographing the lens through a dissection microscope and mirror. This method yields robust strain and morphometric data with an easily fabricated and assembled apparatus. The representative results confirm that mouse lenses increase in stiffness with age.
Protokoll
Alle Tier Verfahren wurden in Übereinstimmung mit Empfehlungen im Leitfaden für die Pflege und Verwendung von Labortieren durch die National Institutes of Health und im Rahmen einer genehmigten Protokoll, das von der Institutional Animal Care und Use Committee am Scripps Research Institute durchgeführt.
1. Objektiv Dissection
- Euthanize Mäuse gemäß den Empfehlungen in den National Institutes of Health "Leitfaden für die Pflege und Verwendung von Labortieren" und zugelassene Institution Tier Protokolle verwenden.
- Enucleate das Auge von Mäusen mit einer gebogenen Pinzette. Drücken Sie das Gewebe um das Auge mit der Zange aus der Steckdose, das Auge zu bringen, und dann reiß das Auge aus der Steckdose mit der Zange. Bringen Sie die Augen an die frische 1x phosphatgepufferter Salzlösung (PBS) in Dissektion Gericht.
- Schneiden Sie den Sehnerv so nah an der Augapfel wie möglich. Sanft und vorsichtig einsetzen feinen Pinzette gerade in den Augapfel durch das Loch where der Sehnerv tritt aus dem hinteren.
- machen sorgfältig einen Einschnitt mit einer Schere in den Augapfel vom hinteren zum Rand der Hornhaut. Nagetier Linsen besetzen ~ 30% des Auges. Nehmen Sie diese Einschnitte sorgfältig und nicht einlegen Pinzette oder Schere zu tief in das Auge eine Beschädigung der Linse zu vermeiden.
- Geschnitten entlang der Verbindung zwischen der Hornhaut und Sklera mindestens um die halbe Augapfel.
- Drücken Sie vorsichtig auf der Hornhaut, die Linse aus dem Auge durch die Öffnung in den Schritten 1.4 und 1.5 gemacht zu entfernen.
- Verwenden Sie feine Spitze gerade Pinzette vorsichtig jede große Trümmer zu entfernen, die noch am Objektiv angebracht ist. Eine Sichtprüfung des Objektivs für Schäden vor den Steifigkeitsmessungen fortfahren.
2. Steifigkeitsmessungen
- Wiegen Sie mindestens 10 Deckgläser aus dem gleichen Feld einer Analysenwaage verwenden. Finden Sie das durchschnittliche Gewicht der Deck. Daher sollten Sie das gleiche Feld von Deckgläsern für alle Experimente. VornässenDie Deckgläser und rechten Winkelspiegel bei Raumtemperatur für mindestens 2 h in 1x PBS vor Experimente beginnen.
- Füllen Sie die Messkammer (siehe Abbildung 1) mit 65 bis 75 ml 1x PBS. Die Messkammer wurde aus Plexiglas mit einer hauseigenen Maschinenhalle und Einschläge in der Kammer wurden durch eine Bohrmaschine auf die gewünschte Tiefe mit einem geeigneten Bohrer gemacht. Linsen verbleiben in 1x PBS bei Raumtemperatur für die Dauer der mechanischen Prüfung transparent.

Abb . 1: Steifigkeitsmesskammer ein Foto , um die Abmessungen der maßgeschneiderte Steifigkeitsmesskammer mit einer Vielzahl von Einschläge von verschiedenen Tiefen und Formen zeigt. Die runden Einschläge, die 200 & mgr; m oder 300 & mgr; m tief (gelbe Pfeile) werden für die Messungen an der Maus Linsen verwendet werden. Divots sind 2 mm im Durchmesser und ~ 13-. 14 mm vom Rand der Kammer Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
- Platzieren Sie rechts Winkelspiegel in die Kammer mit einem konstanten Abstand von der Divot, die verwendet werden, wird die Linse zu halten. Stellen Sie sicher, dass der Spiegel nicht während des Experiments nicht bewegt.
- Transfer seziert Linsen Messkammer sorgfältig mit Greifzange oder einer gebogenen Pinzette.
- Nehmen Sie eine Draufsicht Bild des unbelasteten Linse direkt von oben. Nehmen Maus Objektiv Fotos bei 30-facher Vergrößerung mit Beleuchtung von Binokular (unten) und eine Faseroptik-Lichtquelle auf der linken und rechten Seite. Stellen Sie die faseroptische Stromversorgung zu 80% der maximalen Lichtintensität. Stellen Sie die Stromversorgung Ausgabe basierend auf Umgebungsbeleuchtung, Benutzereinstellung und Bildqualität nach Bedarf.
- Nehmen Sie eine Seitenansicht Bild des unbelasteten Linse, die durch die ri zu sehen istght Winkelspiegel. Wenn die Kamera nicht kalibriert ist, nehmen Sie ein Bild von der Spiegelrand im Fokus. Der Spiegelrand ist 5 mm lang, und diese Messung später verwendet werden, können die Pixel / mm und dienen als Maßstab in den Bildern zu bestimmen.
- Platz Linse in das Divot, und bestätigen, dass die Linse fest sitzt und gerade in der Divot. Nehmen Sie ein Bild von der Linse vor dem Laden. Die Linse sollte in der Divot an der vorderen oder hinteren Pol ruhen.
- Platz 1 Deckglas vorsichtig auf die Linse. Warten Sie 2 min Kriechen zu ermöglichen, und nehmen Sie eine andere Seitenansicht Bild der geladenen Linse.
- Weiterhin Zugabe von Deckgläsern, wie in Schritt 2.8 und unter Seitenansicht Bilder nach der Zugabe von jedem Deckglas, wie in Schritt 2,8 bis insgesamt 10 Deckgläser aufgebracht.
- Entfernen Sie alle Deckgläser. Warten Sie 2 Minuten, und nehmen Sie eine Seitenansicht Bild der Linse (innerhalb und außerhalb des Divot), nachdem Sie alle Deckgläser zu entfernen.
3. Objektiv Nucleus Mess
- Um bestimine Linsenkerngröße, bewegen Sie die Linse auf eine saubere Petrischale mit 1x PBS gefüllt.
- Sanft decapsulate die Linse fein gerade Pinzette.
- Slough die kortikale Faserzellen aus, indem die Linse zwischen behandschuhten Fingern rollen. Der verbleibende Linsenkern wird wie eine harte Marmor fühlen. Verwenden Sie dieses Verfahren, um den Kern auf die Erwachsenen Linsen zu isolieren, um Alter von 1 Monat beginnen. Da der isolierte Kern ein starrer Körper ist, weitere mechanische Prüfung des Linsenkerns ist, kann nicht unter Verwendung dieses beschriebenen Verfahrens durchgeführt werden.
- Spülen Sie vorsichtig den Linsenkern in 1x PBS in der Petrischale.
- Setzen Sie den Linsenkern zurück in die Messkammer (nicht in der Divot), und nehmen Sie ein Bild des Linsenkerns durch den rechten Winkelspiegel.
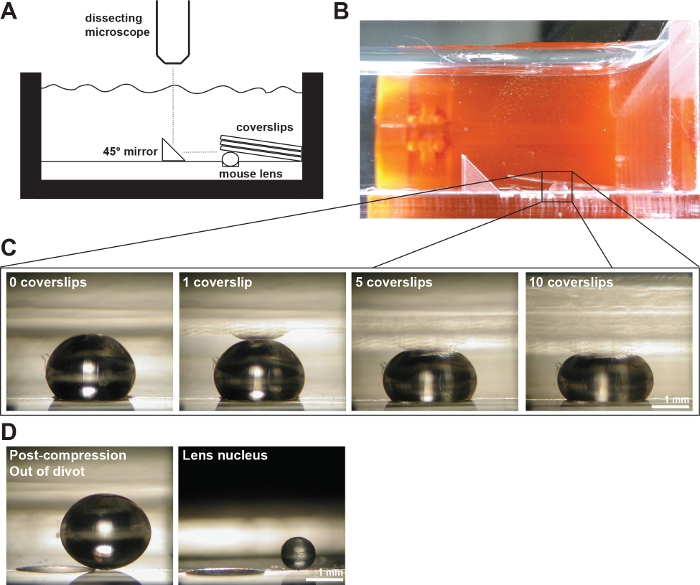
Abbildung 2: a . Durch Deckgläser Druck Maus Objektive (A) Schematische und (B) Fotografie des experimental Setup einen 2 Monate alten Maus-Objektiv in einem 200 & mgr; m tief Divot in der Messkammer gefüllt mit 1x PBS zeigt. Ein rechter Winkelspiegel und eine Digitalkamera auf einem Präpariermikroskop angebracht wurden verwendet, um Bilder der Linse während der Kompression durch Deckgläser zu sammeln. (C) Fotos von sagittalen Ansichten eines 2 Monate alten Wildtyp-Linse komprimiert, indem nacheinander Anzahl von Deck Erhöhung vorgesehen, um die Rohdaten zur Messung von axialen und äquatorialen Durchmesser und Berechnung axialen und äquatorialen Sorten während Deck-basierten Druckprüfung. Eine Reflexion der Linse kann manchmal in den Deckgläsern zu sehen (am deutlichsten sichtbar in der 1 Deckbild). Bei Messungen, ignorieren zu dem Scheitelpunkt der Linse, um die Reflexion und zu messen. (D) Fotos von sagittalen Blick auf die 2-Monate alten Wildtyp-Objektiv Nachverdichtung und der isolierten Linsenkern. Die Nachverdichtung Linse und isolierte Kern außerhalb des Divot sitzen. Maßstabsbalken, 1 mm. Diese Zahl wird geändert von Gokhin, et al. PLoS One, 2012 19. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
4. Bildanalyse
- Messen Sie äquatorialen und axialen Durchmesser der Linsen vor dem Laden und nach jedem Ladeschritt mit ImageJ oder ähnliche Software. Messen der Durchmesser jedes Linsenkern. Der Linsenkern ist nahezu kugelförmige so eine Messung bei jeder Ausrichtung 19,21 ausreichen.
- Korrigieren Sie die Linse axialen Durchmesser von verwendet, um die Tiefe des Divot Zugabe. In der Messkammer, verdeckt das Divot 200 um (2 Monate alten Maus-Linsen) oder 300 um (4 Monate alte und 8 Monate alten Maus-Linsen) der axialen Dicke der Linse.
- Berechnen der axialen und äquatorialen Stämme aus der Linsendurchmesser - Messungen unter Verwendung der Gleichung, ε = (d - d 0) / d 0 ist , wobei ε - Stamm ist, d der axiale oder eQuatorial Durchmesser bei einer gegebenen Last ist , und d 0 der entsprechenden axialen oder äquatorialen Durchmesser bei Nullast.
- Zeichnen Sie die axialen und äquatorialen Sorten als Funktionen der auferlegten Last (in mg).
- Zeichnen Sie die axial, äquatorialen und Kerndurchmesser. Berechnen und zeichnen Sie das Objektiv Seitenverhältnis durch die axiale Durchmesser durch den äquatorialen Durchmesser geteilt wird.
- Berechnen und zeichnen Sie das Objektiv Volumen unter Verwendung der Gleichung, Volumen = 4/3 × π × r E 2 × r A, wobei r E ist der äquatoriale Radius und r A die axiale Radius aus dem Bild in Schritt 2.6 genommen , gemessen. Diese Gleichung nimmt die Linse ist eine Oblate Sphäroid (Ellipsoid) 1,22.
- Berechnen und zeichnen Sie die Kernvolumen unter Verwendung der Gleichung, Volumen = 4/3 × π × r N 3, wobei r N der Radius des Linsenkerns ist , wie aus dem Bild in Schritt 3.5 genommen gemessen. Diese Gleichung nimmt den Linsenkern isa Kugel 19,21.
- Berechnen und Plotten der nukleären Fraktion als das Verhältnis des Kernvolumens zum Objektiv Volumen.
Ergebnisse
Die Steifigkeit und die Abmessungen der 2-, 4- und 8-Monate alten Maus Linsen wurden gemessen. Die Mäuse wurden alle Wildtyp-Tiere auf einem reinen Hintergrund C57BL6 Stamm aus der Zuchtanlage TSRI Tier erhalten, und jede Linse wurde mit 1 bis 10 Deckgläser geladen. Die axialen und äquatorialen Stämme wurden als Funktion der aufgebrachten Last berechnet, indem die axialen und äquatorialen Durchmesser der Linse nach der Zugabe von jedem Deckglas zu messen und dann jede Änderung des ...
Diskussion
Es gibt mehrere wichtige Überlegungen bei der Verwendung dieser Methode Linse Steifigkeit zu messen. Zuerst werden die Deckgläser auf die Linse bei einem leicht schrägen Winkel aufgetragen (8-8,5 °) in Bezug auf den Boden der Kammer (θ). Dies wird eine sehr kleine Komponente der Last anwenden aquatorial anstatt axial. Allerdings ist diese äquatorialen Last als vernachlässigbar , da sin θ ≈ 0,1 19. Wenn dieses Verfahren für größere Linsen angepasst ist, müsste der Winkel der Deckgläser auf den B...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
This work was supported by National Eye Institute Grant R01 EY017724 (VMF) and National Institute of Arthritis and Musculoskeletal and Skin Diseases Grant K99 AR066534 (DSG).
Materialien
| Name | Company | Catalog Number | Comments |
| Fine tip straight forceps | Fine Scientific Tools | 11252-40 | |
| Microdissection scissors, straight edge | Fine Scientific Tools | 15000-00 | |
| Curved forceps | Fine Scientific Tools | 11272-40 | |
| Seizing forceps | Hammacher | HSC 702-93 | Optional |
| Dissection dish | Fisher Scientific | 12565154 | |
| 60 mm Petri dish | Fisher Scientific | 0875713A | |
| 1x phosphate buffered saline (PBS) | Life Technologies | 14190 | |
| 18 x 18 mm glass coverslips | Fisher Scientific | 12-542A | |
| Measurement chamber with divots to hold lenses | Custom-made (see Figure 1) | ||
| Right-angle mirror | Edmund Optics | 45-591 | |
| Light source | Schott/Fostec | 8375 | |
| Illuminated dissecting microscope | Olympus | SZX-ILLD100 | With SZ-PT phototube |
| Digital camera | Nikon | Coolpix 990 |
Referenzen
- Lovicu, F. J., Robinson, M. L. . Development of the ocular lens. , (2004).
- Piatigorsky, J. Lens differentiation in vertebrates. A review of cellular and molecular features. Differentiation. 19 (3), 134-153 (1981).
- Glasser, A. Restoration of accommodation: surgical options for correction of presbyopia. Clin Exp Optom. 91 (3), 279-295 (2008).
- Keeney, A. H., Hagman, R. E., Fratello, C. J. . Dictionary of ophthalmic optics. , (1995).
- Millodot, M. . Dictionary of optometry and visual science. 7, (2009).
- Heys, K. R., Cram, S. L., Truscott, R. J. Massive increase in the stiffness of the human lens nucleus with age: the basis for presbyopia. Mol Vis. 10, 956-963 (2004).
- Heys, K. R., Friedrich, M. G., Truscott, R. J. Presbyopia and heat: changes associated with aging of the human lens suggest a functional role for the small heat shock protein, alpha-crystallin, in maintaining lens flexibility. Aging Cell. 6 (6), 807-815 (2007).
- Pierscionek, B. K. Age-related response of human lenses to stretching forces. Exp Eye Res. 60 (3), 325-332 (1995).
- Glasser, A., Biometric Campbell, M. C. optical and physical changes in the isolated human crystalline lens with age in relation to presbyopia. Vision Res. 39 (11), 1991-2015 (1999).
- Weeber, H. A., van der Heijde, R. G. On the relationship between lens stiffness and accommodative amplitude. Exp Eye Res. 85 (5), 602-607 (2007).
- Weeber, H. A., et al. Dynamic mechanical properties of human lenses. Exp Eye Res. 80 (3), 425-434 (2005).
- Fisher, R. F. Elastic properties of the human lens. Exp Eye Res. 11 (1), 143 (1971).
- Krueger, R. R., Sun, X. K., Stroh, J., Myers, R. Experimental increase in accommodative potential after neodymium: yttrium-aluminum-garnet laser photodisruption of paired cadaver lenses. Ophthalmology. 108 (11), 2122-2129 (2001).
- Burd, H. J., Wilde, G. S., Judge, S. J. An improved spinning lens test to determine the stiffness of the human lens. Exp Eye Res. 92 (1), 28-39 (2011).
- Glasser, A., Campbell, M. C. Presbyopia and the optical changes in the human crystalline lens with age. Vision Res. 38 (2), 209-229 (1998).
- Pau, H., Kranz, J. The increasing sclerosis of the human lens with age and its relevance to accommodation and presbyopia. Graefes Arch Clin Exp Ophthalmol. 229 (3), 294-296 (1991).
- Hollman, K. W., O'Donnell, M., Erpelding, T. N. Mapping elasticity in human lenses using bubble-based acoustic radiation force. Exp Eye Res. 85 (6), 890-893 (2007).
- Baradia, H., Nikahd, N., Glasser, A. Mouse lens stiffness measurements. Exp Eye Res. 91 (2), 300-307 (2010).
- Gokhin, D. S., et al. Tmod1 and CP49 synergize to control the fiber cell geometry, transparency, and mechanical stiffness of the mouse lens. PLoS One. 7 (11), e48734 (2012).
- Sindhu Kumari, S., et al. Role of Aquaporin 0 in lens biomechanics. Biochem Biophys Res Commun. , (2015).
- Fudge, D. S., et al. Intermediate filaments regulate tissue size and stiffness in the murine lens. Invest Ophthalmol Vis Sci. 52 (6), 3860-3867 (2011).
- Kuszak, J. R., Mazurkiewicz, M., Zoltoski, R. Computer modeling of secondary fiber development and growth: I. Nonprimate lenses. Mol Vis. 12, 251-270 (2006).
- Scarcelli, G., Kim, P., Yun, S. H. In vivo measurement of age-related stiffening in the crystalline lens by Brillouin optical microscopy. Biophys J. 101 (6), 1539-1545 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten