このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウスレンズの圧縮剛性を評価するために、ガラスカバースリップの逐次適用:ひずみと形態計測分析
要約
Age-related increases in eye lens stiffness are linked to presbyopia. This protocol describes a simple, cost-effective method for measuring mouse lens stiffness. Mouse lenses, like human lenses, become stiffer with age. This method is precise and can be adapted for lenses from larger animals.
要約
眼のレンズは屈折し、網膜上に鮮明な画像を形成するために光を集光する透明な器官です。ヒトでは、毛様体筋の契約は、近くの物体に焦点を合わせるレンズの光学的パワー、宿泊として知られているプロセスの増加につながる、レンズを変形させます。加齢に関連するレンズ剛性の変化老眼にリンクされている、対応するレンズの能力の減少、および、拡張によって、老眼鏡が必要とされています。マウスのレンズは老眼を受け入れるか、発症しないにもかかわらず、マウスモデルが理解レンズ病理のための貴重な遺伝的なツールを提供することができ、およびマウスで観察された促進老化は、レンズ内の加齢変化の研究を可能にします。このプロトコルは、レンズに圧縮荷重を増加させる、順次適用し、ガラスカバースリップを使用して、マウスレンズ剛性を決定するために、簡単、正確、かつ費用効果的な方法を示します。代表的なデータは、マウスのレンズのような、年齢とともにより硬くなっていることを確認します人間のレンズ。この方法は、非常に再現性があり、潜在的により大きな動物から試験レンズを機械的にスケールアップすることができます。
概要
The lens is a transparent and avascular organ in the anterior chamber of the eye that is responsible for fine focusing of light onto the retina. A clear basement membrane, called the lens capsule, surrounds a bulk of elongated fiber cells covered by an anterior monolayer of epithelial cells1,2. Life-long growth of the lens depends on the continuous proliferation and differentiation of epithelial cells at the lens equator into new fiber cells that are added onto previous generations of fiber cells in a concentric manner2. Over time, lens fiber cells undergo compaction, resulting in a rigid center in the middle of the lens called the nucleus1. Accommodation, defined as a dioptric change in the optical power of the eye, occurs in humans when the ciliary muscles contract to deform the lens and allow a true increase in optical power to focus on near objects3-5. In the unaccommodated eye, the lens is held in a relatively flattened state due to tension from zonular fibers. When the ciliary muscles contract, the tension on the lens is released, leading to decreased lens equatorial diameter and increased axial thickness. Age-related changes in the lens cause presbyopia, a progressive loss of lens accommodation, which leads to the need for reading glasses.
Several studies have linked presbyopia to age-related increase in the intrinsic stiffness of the lens6-11. Stiffness is defined as the resistance of an elastic object to deform under applied load. A variety of methods have been used to examine stiffness of human lenses, including spin compression12-14, actuator compression15, probe indentation16, dynamic mechanical analysis 6,10 and bubble-based acoustic radiation force17. While mouse lenses do not accommodate or develop presbyopia, mouse models for lens pathologies are valuable tools because mice are less expensive than larger animals, well characterized genetically and undergo accelerated age-related changes due to rapid aging. A handful of studies have examined mouse lens stiffness with compression methods and demonstrated changes in lens stiffness due to aging or targeted genetic disruptions18-21. Thus, mouse lenses are good models for studying age-related changes in lens stiffness.
This protocol describes a simple and inexpensive, yet precise and reproducible, compression method for determining mouse lens stiffness based on application of glass coverslips onto the lens in conjunction with photographing the lens through a dissection microscope and mirror. This method yields robust strain and morphometric data with an easily fabricated and assembled apparatus. The representative results confirm that mouse lenses increase in stiffness with age.
Access restricted. Please log in or start a trial to view this content.
プロトコル
全ての動物手順は、国立衛生研究所によってとスクリップス研究所の施設内動物管理使用委員会によって承認されたプロトコルの下で実験動物の管理と使用に関するガイドの推奨に従って行いました。
1.レンズ解剖
- 国立衛生研究所「実験動物の管理と使用に関する指針」および承認された機関の動物使用プロトコルの推奨事項に従ってマウスを安楽死させます。
- 湾曲した鉗子を用いて、マウスから眼を摘出。ソケットから目を持って来るためにピンセットで目の周りの組織を押し下げ、その後、ピンセットでソケットから目を摘み取ります。解剖皿に新鮮な1×リン酸緩衝生理食塩水(PBS)に目を移します。
- できるだけ眼球に近い視神経を切断。ゆっくりと慎重に穴wherを通して眼球内に微細なストレートピンセットを挿入電子視神経は後方を終了します。
- 慎重に、角膜の端に後方から眼球内にハサミで切開を行います。げっ歯類のレンズは、眼の〜30%を占めます。慎重にこれらの切開を行い、レンズの損傷を防ぐために、眼の中に深すぎるピンセットやハサミを入れないでください。
- 少なくとも半分眼球の周りに角膜と強膜との間の接合部に沿ってカットします。
- 静かにステップ1.4と1.5で作られた開口部を通って眼からレンズを除去するために、角膜を押します。
- 慎重に、まだレンズに装着されている任意の大きな破片を除去するために先端の細いストレートピンセットを使用してください。視覚的に剛性の測定に進む前に、いかなる損害についてレンズを検査します。
2.剛性の測定
- 化学天秤を使用して、同じボックスからの少なくとも10カバースリップを計量。カバースリップの平均重量を探します。一貫性を保つため、すべての実験のためのカバースリップの同じボックスを使用します。プリウェット実験を開始する前に、少なくとも2時間、室温で1×PBS中でカバースリップと直角ミラー。
- 1×PBSの75ミリリットル- 65で( 図1を参照)測定室を埋めます。測定室は、社内の機械工場によってプレキシグラスから作られた、チャンバ内のディボットは、適切なドリルビットで所望の深さに設定ドリルプレスによって作られました。レンズは、機械的試験の期間中、室温で1×PBS中に透明なままです。

図1:剛性測定チャンバー異なる深さや形状のディボットの様々なカスタムメイドの剛性測定室の寸法を示す写真。 200ミクロンまたは300ミクロンの深(黄色矢印)あるラウンドのディボットは、マウスのレンズ上の測定に使用されています。ディボットは、直径2ミリメートルと〜13です-チャンバの端から14ミリメートル。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- レンズを保持するために使用されるディボットから一定の距離でチャンバ内に直角ミラーを配置します。ミラーは、実験中に動かないことを確認してください。
- 転送は、鉗子または湾曲鉗子を押収して慎重に測定室にレンズを解剖しました。
- 真上からアンロードされたレンズのトップビュー画像を撮影します。顕微鏡(下)と左右の光ファイバ光源を解剖からの照明を用いて30倍の倍率でのマウスレンズの写真を撮ります。最大光強度の80%まで光ファイバ電源を設定します。必要に応じて、周囲の照明、ユーザの嗜好や画質に基づいて電源出力を調整します。
- RIを通して見ることができる無負荷レンズのサイドビュー画像を撮りますGHT-角度ミラー。カメラが校正されていない場合は、フォーカスのミラーエッジの写真を撮ります。ミラーのエッジを5mmの長さであり、この測定は、後述のピクセル/ mmで決定し、画像中のスケールバーとして機能するように使用することができます。
- 場所ディボットにレンズ、およびレンズがディボットにしっかりとまっすぐに装着されていることを確認します。ロードする前にレンズの写真を撮ります。レンズは、その前方または後方のポール上のディボットで休んでする必要があります。
- レンズの上にそっと1カバーガラスを置きます。クリープを可能にするために2分待ってから、ロードされたレンズの別のサイドビュー写真を撮ります。
- 10カバースリップの合計が適用されるまで、ステップ2.8のようにカバースリップを追加し、ステップ2.8のように各カバースリップを添加した後、サイドビューの写真撮影を続行。
- すべてのカバースリップを削除します。 2分待ってから、すべてのカバースリップを除去した後、レンズ(内側と外側ディボットの)のサイドビュー写真を撮ります。
3.レンズ核の測定
- determへレンズ核サイズINE、1×PBSで満たされたきれいなペトリ皿にレンズを移動させます。
- 優しく細かいストレートピンセットを用いてレンズをデカプセル化。
- 手袋をした指の間レンズを転がすことにより、皮質線維細胞脱落。残りのレンズ核は、ハード大理石のように感じるでしょう。生後1ヶ月から始まる大人のレンズに核を単離するために、この手順を使用します。単離された核が剛体であるため、レンズ核のさらなる機械的試験は、この記載された方法を用いて行うことができません。
- 優しくペトリ皿に1×PBS中の水晶体核をすすぎます。
- バック(ないディボット中)測定室に水晶体核を配置し、直角ミラーを介してレンズ核の画像を取ります。
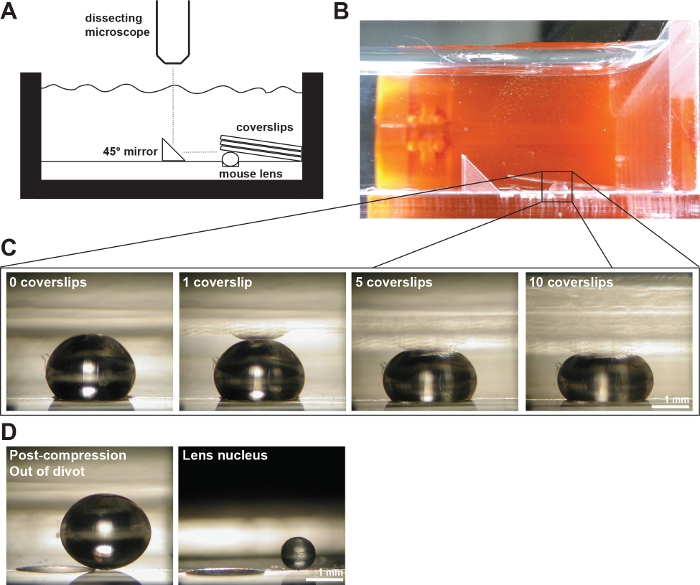
図2:元のカバーガラスにより圧縮されたマウスのレンズ (A)回路図および(B)の写真1×PBSで満たされた測定室で200μmの深いディボットに2ヶ月齢のマウスのレンズを示すperimentalセットアップ。直角ミラーと解剖顕微鏡に搭載のデジタルカメラは、カバーガラスにより圧縮時のレンズの画像を収集するために使用されました。 (C)連続したカバースリップの数を増加させることにより、圧縮2ヶ月齢の野生型レンズのサジタルビューの写真は、軸方向および赤道直径を測定し、カバーガラスベースの圧縮テスト中に軸方向および赤道株を計算するための生データを提供しました。レンズの反射は、時々(1カバースリップの画像の中で最も明瞭に見える)カバーガラスに見ることができます。測定を行うときは、反射を無視し、レンズの頂点に測定します。 (D)2ヶ月齢の野生型レンズ圧縮後と分離された水晶体核の矢状景色の写真。圧縮後のレンズおよび単離された核はディボットの外に座っています。スケールバー、1ミリメートル。この図は、Gokhから変更されていますら 、に。PLoSの1、2012 19。 この図の拡大版をご覧になるにはこちらをクリックしてください。
4.画像解析
- ロードの前およびImageJのまたは類似のソフトウェアを使用して、各負荷ステップの後にレンズの赤道と軸方向の直径を測定します。各レンズ核の直径を測定します。任意の方向での測定は19,21を十分ですので、レンズ核はほぼ球形です。
- 使用ディボットの深さを追加することで、レンズの軸方向の直径を修正してください。測定室では、ディボットは、レンズの軸方向の厚さの200ミクロン(2ヶ月齢マウスレンズ)または300ミクロン(4ヶ月齢と8ヶ月齢のマウスのレンズを)隠さ。
- 式を用いて、レンズ径の測定値から軸方向および赤道株を計算し、ε=(D - D 0)εが株である/ D 0、dは、軸方向またはEであり、quatorial与えられた負荷時の直径であり、d 0は、ゼロ負荷で対応する軸方向または赤道直径です。
- (mg単位)かかる負荷の関数として軸方向および赤道株をプロットします。
- 軸、赤道と核の直径をプロットします。赤道直径で軸方向の直径を除算することにより、レンズのアスペクト比を計算し、プロットします。
- 計算し、プロット式を用いてレンズのボリュームを、R eは赤道半径であり、r Aはステップ2.6で撮影した画像から測定軸方向の半径であるボリューム= 4/3×π×R E 2×R A、。この式は、レンズが扁球(楕円)1,22であると仮定します。
- ステップ3.5で撮影した画像から測定されるようにR Nはレンズ核の半径であるR N 3、×π×計算し、プロットする式を用いた核ボリュームを、ボリューム= 4/3。この式は、レンズ核私を前提としていSA球19,21。
- レンズボリュームへの核体積の比として核画分を計算し、プロットします。
Access restricted. Please log in or start a trial to view this content.
結果
剛性と2-、4-および8ヶ月齢のマウスのレンズの寸法を測定しました。マウスはTSRI動物飼育施設から得られた純粋なC57BL6株バックグラウンド上のすべての野生型動物であり、そして各レンズが1〜10のカバーガラスを装填しました。軸方向および赤道株を各カバースリップを添加した後にレンズの軸と赤道直径を測定し、次いで対応するアンロード直径の直径の各変?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
レンズの剛性を測定するために、このメソッドを使用する際には、いくつかの重要な考慮事項があります。室(θ)の底面に対して - (8.5°8)まず、カバーガラスを少し斜めの角度でレンズに適用されます。これは非常に小さな負荷のコンポーネント赤道ではなく、軸方向に適用されます。罪θ≈0.1 19しかし、この赤道負荷は無視できると考えられています。この方法は、より大きな?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは、開示することは何もありません。
謝辞
This work was supported by National Eye Institute Grant R01 EY017724 (VMF) and National Institute of Arthritis and Musculoskeletal and Skin Diseases Grant K99 AR066534 (DSG).
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Fine tip straight forceps | Fine Scientific Tools | 11252-40 | |
| Microdissection scissors, straight edge | Fine Scientific Tools | 15000-00 | |
| Curved forceps | Fine Scientific Tools | 11272-40 | |
| Seizing forceps | Hammacher | HSC 702-93 | Optional |
| Dissection dish | Fisher Scientific | 12565154 | |
| 60 mm Petri dish | Fisher Scientific | 0875713A | |
| 1x phosphate buffered saline (PBS) | Life Technologies | 14190 | |
| 18 x 18 mm glass coverslips | Fisher Scientific | 12-542A | |
| Measurement chamber with divots to hold lenses | Custom-made (see Figure 1) | ||
| Right-angle mirror | Edmund Optics | 45-591 | |
| Light source | Schott/Fostec | 8375 | |
| Illuminated dissecting microscope | Olympus | SZX-ILLD100 | With SZ-PT phototube |
| Digital camera | Nikon | Coolpix 990 |
参考文献
- Lovicu, F. J., Robinson, M. L. Development of the ocular lens. , Cambridge University Press. (2004).
- Piatigorsky, J. Lens differentiation in vertebrates. A review of cellular and molecular features. Differentiation. 19 (3), 134-153 (1981).
- Glasser, A. Restoration of accommodation: surgical options for correction of presbyopia. Clin Exp Optom. 91 (3), 279-295 (2008).
- Keeney, A. H., Hagman, R. E., Fratello, C. J. Dictionary of ophthalmic optics. , Butterworth-Heinemann. (1995).
- Millodot, M. Dictionary of optometry and visual science. 7, Elsevier/Butterworth-Heinemann. (2009).
- Heys, K. R., Cram, S. L., Truscott, R. J. Massive increase in the stiffness of the human lens nucleus with age: the basis for presbyopia. Mol Vis. 10, 956-963 (2004).
- Heys, K. R., Friedrich, M. G., Truscott, R. J. Presbyopia and heat: changes associated with aging of the human lens suggest a functional role for the small heat shock protein, alpha-crystallin, in maintaining lens flexibility. Aging Cell. 6 (6), 807-815 (2007).
- Pierscionek, B. K. Age-related response of human lenses to stretching forces. Exp Eye Res. 60 (3), 325-332 (1995).
- Glasser, A., Biometric Campbell, M. C. optical and physical changes in the isolated human crystalline lens with age in relation to presbyopia. Vision Res. 39 (11), 1991-2015 (1999).
- Weeber, H. A., van der Heijde, R. G. On the relationship between lens stiffness and accommodative amplitude. Exp Eye Res. 85 (5), 602-607 (2007).
- Weeber, H. A., et al. Dynamic mechanical properties of human lenses. Exp Eye Res. 80 (3), 425-434 (2005).
- Fisher, R. F. Elastic properties of the human lens. Exp Eye Res. 11 (1), 143(1971).
- Krueger, R. R., Sun, X. K., Stroh, J., Myers, R. Experimental increase in accommodative potential after neodymium: yttrium-aluminum-garnet laser photodisruption of paired cadaver lenses. Ophthalmology. 108 (11), 2122-2129 (2001).
- Burd, H. J., Wilde, G. S., Judge, S. J. An improved spinning lens test to determine the stiffness of the human lens. Exp Eye Res. 92 (1), 28-39 (2011).
- Glasser, A., Campbell, M. C. Presbyopia and the optical changes in the human crystalline lens with age. Vision Res. 38 (2), 209-229 (1998).
- Pau, H., Kranz, J. The increasing sclerosis of the human lens with age and its relevance to accommodation and presbyopia. Graefes Arch Clin Exp Ophthalmol. 229 (3), 294-296 (1991).
- Hollman, K. W., O'Donnell, M., Erpelding, T. N. Mapping elasticity in human lenses using bubble-based acoustic radiation force. Exp Eye Res. 85 (6), 890-893 (2007).
- Baradia, H., Nikahd, N., Glasser, A. Mouse lens stiffness measurements. Exp Eye Res. 91 (2), 300-307 (2010).
- Gokhin, D. S., et al. Tmod1 and CP49 synergize to control the fiber cell geometry, transparency, and mechanical stiffness of the mouse lens. PLoS One. 7 (11), e48734(2012).
- Sindhu Kumari, S., et al. Role of Aquaporin 0 in lens biomechanics. Biochem Biophys Res Commun. , (2015).
- Fudge, D. S., et al. Intermediate filaments regulate tissue size and stiffness in the murine lens. Invest Ophthalmol Vis Sci. 52 (6), 3860-3867 (2011).
- Kuszak, J. R., Mazurkiewicz, M., Zoltoski, R. Computer modeling of secondary fiber development and growth: I. Nonprimate lenses. Mol Vis. 12, 251-270 (2006).
- Scarcelli, G., Kim, P., Yun, S. H. In vivo measurement of age-related stiffening in the crystalline lens by Brillouin optical microscopy. Biophys J. 101 (6), 1539-1545 (2011).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved