È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Sequenziale Applicazione di vetrini di vetro per valutare la compressione Rigidità della lente Mouse: Strain e morfometriche analisi
In questo articolo
Riepilogo
Age-related increases in eye lens stiffness are linked to presbyopia. This protocol describes a simple, cost-effective method for measuring mouse lens stiffness. Mouse lenses, like human lenses, become stiffer with age. This method is precise and can be adapted for lenses from larger animals.
Abstract
La lente occhio è un organo trasparente che rifrange e si concentra la luce per formare una chiara immagine sulla retina. Negli esseri umani, contratto di muscoli ciliari deformare la lente, portando ad un aumento della potenza ottica della lente di concentrarsi su oggetti vicini, un processo noto come alloggio. Cambiamenti legati all'età in rigidità lente sono stati collegati a presbiopia, una riduzione nella lente 'possibilità di ospitare, e, per estensione, la necessità di occhiali da lettura. Anche se le lenti del mouse non ospitare o sviluppare presbiopia, modelli di mouse in grado di fornire uno strumento genetico prezioso per patologie lenti comprensione, e l'invecchiamento accelerato osservato nei topi permette lo studio dei cambiamenti legati all'età nella lente. Questo protocollo dimostra un metodo semplice, preciso e conveniente per determinare la rigidità della lente del mouse, utilizzando vetrini da applicare in sequenza crescente carichi di compressione sulla lente. Dati rappresentativi confermano che le lenti del mouse diventano più rigidi con l'età, comelenti umani. Questo metodo è altamente riproducibile e può potenzialmente essere scalata fino a meccanicamente le lenti di prova da animali più grandi.
Introduzione
The lens is a transparent and avascular organ in the anterior chamber of the eye that is responsible for fine focusing of light onto the retina. A clear basement membrane, called the lens capsule, surrounds a bulk of elongated fiber cells covered by an anterior monolayer of epithelial cells1,2. Life-long growth of the lens depends on the continuous proliferation and differentiation of epithelial cells at the lens equator into new fiber cells that are added onto previous generations of fiber cells in a concentric manner2. Over time, lens fiber cells undergo compaction, resulting in a rigid center in the middle of the lens called the nucleus1. Accommodation, defined as a dioptric change in the optical power of the eye, occurs in humans when the ciliary muscles contract to deform the lens and allow a true increase in optical power to focus on near objects3-5. In the unaccommodated eye, the lens is held in a relatively flattened state due to tension from zonular fibers. When the ciliary muscles contract, the tension on the lens is released, leading to decreased lens equatorial diameter and increased axial thickness. Age-related changes in the lens cause presbyopia, a progressive loss of lens accommodation, which leads to the need for reading glasses.
Several studies have linked presbyopia to age-related increase in the intrinsic stiffness of the lens6-11. Stiffness is defined as the resistance of an elastic object to deform under applied load. A variety of methods have been used to examine stiffness of human lenses, including spin compression12-14, actuator compression15, probe indentation16, dynamic mechanical analysis 6,10 and bubble-based acoustic radiation force17. While mouse lenses do not accommodate or develop presbyopia, mouse models for lens pathologies are valuable tools because mice are less expensive than larger animals, well characterized genetically and undergo accelerated age-related changes due to rapid aging. A handful of studies have examined mouse lens stiffness with compression methods and demonstrated changes in lens stiffness due to aging or targeted genetic disruptions18-21. Thus, mouse lenses are good models for studying age-related changes in lens stiffness.
This protocol describes a simple and inexpensive, yet precise and reproducible, compression method for determining mouse lens stiffness based on application of glass coverslips onto the lens in conjunction with photographing the lens through a dissection microscope and mirror. This method yields robust strain and morphometric data with an easily fabricated and assembled apparatus. The representative results confirm that mouse lenses increase in stiffness with age.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutte le procedure sugli animali sono stati eseguiti in conformità con le raccomandazioni della Guida per la cura e l'uso di animali da laboratorio dal National Institutes of Health e sotto un protocollo approvato dal Comitato Istituzionale cura e l'uso degli animali al The Scripps Research Institute.
1. Obiettivo dissezione
- Euthanize topi in base alle raccomandazioni del National Institutes of Health "Guida per la cura e l'uso di animali da laboratorio" e approvati utilizzano protocolli istituzione animali.
- Enucleate l'occhio da topo, utilizzando pinze curve. Premere il tessuto intorno l'occhio con le pinze per portare l'occhio dalla presa di corrente, e quindi cogliere l'occhio dalla presa con le pinze. Trasferire gli occhi di fresco 1x tampone fosfato salino (PBS) nel piatto dissezione.
- Tagliare il nervo ottico più vicino al bulbo oculare possibile. Delicatamente e con attenzione inserire sottili pinzette direttamente nel bulbo oculare attraverso il foro di where il nervo ottico esce dal posteriore.
- fare attenzione un'incisione con le forbici nel bulbo oculare dal posteriore al bordo della cornea. Lenti roditori occupano circa il 30% degli occhi. Fare queste incisioni attentamente, e non inserire le pinzette o forbici troppo in profondità nell'occhio per evitare di danneggiare l'obiettivo.
- Tagliare lungo la giunzione tra la cornea e nella sclera almeno mezzo giro del bulbo oculare.
- Premere delicatamente sulla cornea per rimuovere la lente dall'occhio attraverso l'apertura fatta in passi 1.4 e 1.5.
- Utilizzare pinza sottile punta diritta per rimuovere attentamente qualsiasi detriti di grandi dimensioni che è ancora attaccato alla lente. Visivamente la lente di eventuali danni prima di procedere con le misurazioni di rigidità.
2. Rigidità Misure
- Pesare almeno 10 vetrini dalla stessa scatola con una bilancia analitica. Trova il peso medio delle lamelle. Per coerenza, utilizzare la stessa confezione di lamelle per tutti gli esperimenti. Pre-bagnatoil coprioggetto e ad angolo retto specchio in 1x PBS a temperatura ambiente per almeno 2 ore prima di avviare esperimenti.
- Riempire la camera di misura (vedi figura 1) con 65 - 75 ml di PBS 1x. La camera di misurazione è stata fatta di plexiglas da un negozio di macchina in-house, e divots nella camera sono state fatte da un trapano a colonna impostato per la profondità desiderata con una punta da trapano appropriata. Lenti rimangono trasparenti in 1x PBS a temperatura ambiente per la durata della prova meccanica.

Figura 1:. Rigidità camera di misura Una fotografia che mostra le dimensioni della camera di misura rigidità misura con una varietà di zolle di diverse profondità e forme. Le zolle rotonde che si trovano a 200 micron o 300 micron di profondità (punte di freccia di colore giallo) sono utilizzati per le misurazioni su lenti del mouse. Divots sono 2 mm di diametro e 13 ~-. 14 mm dal bordo della camera Si prega di cliccare qui per vedere una versione più grande di questa figura.
- Posizionare specchio ad angolo nella camera ad una distanza costante dal incavo che verrà utilizzato per tenere la lente. Assicurarsi che lo specchio non si sposta durante l'esperimento.
- Trasferire lenti sezionati per camera di misura con attenzione con una pinza sequestro o pinze curve.
- Prendete una vista dall'alto immagine della lente scaricato da sopra la sua testa. Prendete il mouse foto di lenti a 30X di ingrandimento con illuminazione da dissezione microscopio (in basso) e una sorgente di luce in fibra ottica sui lati destro e sinistro. Impostare l'alimentazione fibra ottica al 80% della massima intensità luminosa. Regolare la potenza di alimentazione sulla base di illuminazione ambientale, preferenze dell'utente e la qualità dell'immagine in base alle esigenze.
- Dai vista laterale immagine della lente a vuoto, che può essere visto attraverso la rispecchio GHT angolo. Se la telecamera non è calibrato, scattare una foto del bordo specchio a fuoco. Il bordo dello specchio è lungo 5 mm, e questa misurazione può successivamente essere utilizzato per determinare il pixel / mm e servire come una barra di scala nelle immagini.
- Posizionare lente nel divot, e confermare che l'obiettivo sia inserito in modo sicuro e dritto in incavo. Scatta una foto della lente prima di caricarla. L'obiettivo deve essere appoggiato nella zolla sulla sua anteriore o polo posteriore.
- Mettere 1 coprioggetto delicatamente sulla lente. Attendere 2 minuti per consentire al creep, e prendere un altro vista laterale immagine della lente caricato.
- Continuare ad aggiungere vetrini come al punto 2.8 e prendendo lato-vista le immagini dopo l'aggiunta di ogni vetrino come al punto 2.8 fino a quando vengono applicati un totale di 10 lamelle.
- Rimuovere tutte le lamelle. Attendere 2 minuti, e prendere una vista laterale immagine della lente (all'interno e all'esterno del divot) dopo aver rimosso tutte le lamelle.
Misurazione 3. Obiettivo Nucleus
- per determine la dimensione nucleo della lente, spostare l'obiettivo di un piatto pulito Petri riempita con PBS 1x.
- decapsulate delicatamente la lente con pinza sottile diritte.
- Spogliarci di cellule corticali fibra facendo rotolare la lente tra le dita guantate. Il nucleo della lente rimanente si sentirà come un marmo duro. Utilizzare questa procedura per isolare il nucleo sulle lenti per adulti a partire da 1 mese di età. Poiché il nucleo isolato è un corpo rigido, ulteriori prove meccaniche del nucleo lente non può essere eseguita utilizzando il metodo descritto.
- Lavare delicatamente il nucleo della lente in 1x PBS nella scatola di Petri.
- Posizionare il nucleo obiettivo posteriore nella camera di misura (non nel divot), e prendere una immagine del nucleo lente attraverso lo specchio ad angolo retto.
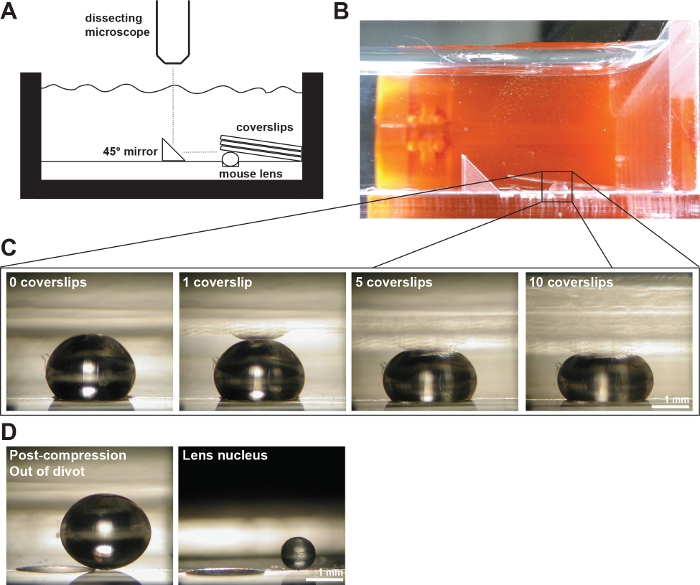
Figura 2:. A Lenti mouse compresso dal Coprioggetto (A) Schema e (B) fotografia della exl'installazione sperimentale che mostra un 2 mesi lente del mouse in una zolla di 200 micron di profondità nella camera di misura piena di PBS 1x. Uno specchio angolo retto e una fotocamera digitale montata su un microscopio dissezione stati usati per raccogliere le immagini della lente durante la compressione da coprioggetto. (C) Foto di viste sagittali di 2 mesi lente wild-type compressa in successione un numero crescente di vetrini fornito i dati grezzi per misurare i diametri assiali ed equatoriali e calcolando ceppi assiali ed equatoriali durante i test di compressione vetrino-based. Una riflessione della lente a volte può essere visto in i coprioggetti (più chiaramente visibile l'immagine del 1 vetrino in). Quando si effettuano misurazioni, ignorare il riflesso e misurare all'apice della lente. (D) Foto di vista sagittale del 2 mesi lente wild-type post-compressione e il nucleo della lente isolato. L'obiettivo post-compressione e nuclei isolati sono seduti al di fuori della incavo. Barre di scala, 1 mm. Questa cifra viene modificato da Gokhin, et al. PLoS ONE 2012 19. Cliccate qui per vedere una versione più grande di questa figura.
Analisi 4. Immagine
- Misurare i diametri equatoriale e assiali delle lenti prima del carico e dopo ogni fase di carico utilizzando ImageJ o software simili. Misurare il diametro di ogni nucleo lente. Il nucleo della lente è quasi sferica così una misura in qualsiasi orientamento sarà sufficiente 19,21.
- Correggere la lente assiale diametri aggiungendo la profondità incavo utilizzato. Nella camera di misura, incavo oscurata 200 micron (lenti 2 mesi di età topo) o 300 micron (lenti 4 mesi di età e 8 mesi di età mouse) dello spessore assiale della lente.
- Calcolare il assiale e ceppi equatoriali dalle misurazioni del diametro della lente utilizzando l'equazione, ε = (d - d 0) / d 0, dove ε è la deformazione, d è la assiale o ediametro Quatorial a un determinato carico, e d 0 è il diametro assiale o equatoriale corrispondente al carico nullo.
- Tracciare assiale e ceppi equatoriali come funzioni del carico imposto (in mg).
- Tracciare assiale, equatoriale e diametri nucleari. Calcolare e tracciare le proporzioni obiettivo dividendo il diametro assiale dal diametro equatoriale.
- Calcolare e tracciare il volume della lente utilizzando l'equazione, volume = 4/3 × π × R e 2 × R A, dove r è il raggio E e R equatoriale A è il raggio assiale misurata dalla foto scattata nella fase 2.6. Questa equazione presuppone la lente è uno sferoide oblato (ellissoide) 1,22.
- Calcolare e tracciare il volume nucleare utilizzando l'equazione, volume = 4/3 × π × r N 3, dove r N è il raggio del nucleo cristallino come misurata dalla foto scattata al passo 3.5. Questa equazione assume il I nucleo della lentesa sfera 19,21.
- Calcolare e tracciare la frazione nucleare come il rapporto tra il volume nucleare per il volume obiettivo.
Access restricted. Please log in or start a trial to view this content.
Risultati
La rigidità e dimensioni di 2, 4 e 8 mesi di età lenti di topo sono stati misurati. I topi sono stati tutti gli animali wild-type su un puro C57BL6 ceppo sfondo ottenuto dal Fondo Allevamento TSRI degli animali, e ogni obiettivo è stato caricato con da 1 a 10 lamelle. I ceppi assiali ed equatoriali sono stati calcolati in funzione del carico applicato misurando assiale e diametri equatoriale della lente dopo l'aggiunta di ciascun vetrino, quindi normalizzare ogni variazione di dia...
Access restricted. Please log in or start a trial to view this content.
Discussione
Ci sono diverse considerazioni importanti quando si utilizza questo metodo per misurare la rigidità della lente. Innanzitutto, i coprioggetti sono applicati alla lente con un angolo leggermente obliqua (8 - 8,5 °) rispetto al fondo della camera (θ). Questo si applica una piccola componente del carico equatoriale piuttosto che assialmente. Tuttavia, questo carico equatoriale è considerata trascurabile, perché il peccato θ ≈ 0.1 19. Se questo metodo è adattato per lenti più grandi, l'angolo delle ...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
This work was supported by National Eye Institute Grant R01 EY017724 (VMF) and National Institute of Arthritis and Musculoskeletal and Skin Diseases Grant K99 AR066534 (DSG).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Fine tip straight forceps | Fine Scientific Tools | 11252-40 | |
| Microdissection scissors, straight edge | Fine Scientific Tools | 15000-00 | |
| Curved forceps | Fine Scientific Tools | 11272-40 | |
| Seizing forceps | Hammacher | HSC 702-93 | Optional |
| Dissection dish | Fisher Scientific | 12565154 | |
| 60 mm Petri dish | Fisher Scientific | 0875713A | |
| 1x phosphate buffered saline (PBS) | Life Technologies | 14190 | |
| 18 x 18 mm glass coverslips | Fisher Scientific | 12-542A | |
| Measurement chamber with divots to hold lenses | Custom-made (see Figure 1) | ||
| Right-angle mirror | Edmund Optics | 45-591 | |
| Light source | Schott/Fostec | 8375 | |
| Illuminated dissecting microscope | Olympus | SZX-ILLD100 | With SZ-PT phototube |
| Digital camera | Nikon | Coolpix 990 |
Riferimenti
- Lovicu, F. J., Robinson, M. L. Development of the ocular lens. , Cambridge University Press. (2004).
- Piatigorsky, J. Lens differentiation in vertebrates. A review of cellular and molecular features. Differentiation. 19 (3), 134-153 (1981).
- Glasser, A. Restoration of accommodation: surgical options for correction of presbyopia. Clin Exp Optom. 91 (3), 279-295 (2008).
- Keeney, A. H., Hagman, R. E., Fratello, C. J. Dictionary of ophthalmic optics. , Butterworth-Heinemann. (1995).
- Millodot, M. Dictionary of optometry and visual science. 7, Elsevier/Butterworth-Heinemann. (2009).
- Heys, K. R., Cram, S. L., Truscott, R. J. Massive increase in the stiffness of the human lens nucleus with age: the basis for presbyopia. Mol Vis. 10, 956-963 (2004).
- Heys, K. R., Friedrich, M. G., Truscott, R. J. Presbyopia and heat: changes associated with aging of the human lens suggest a functional role for the small heat shock protein, alpha-crystallin, in maintaining lens flexibility. Aging Cell. 6 (6), 807-815 (2007).
- Pierscionek, B. K. Age-related response of human lenses to stretching forces. Exp Eye Res. 60 (3), 325-332 (1995).
- Glasser, A., Biometric Campbell, M. C. optical and physical changes in the isolated human crystalline lens with age in relation to presbyopia. Vision Res. 39 (11), 1991-2015 (1999).
- Weeber, H. A., van der Heijde, R. G. On the relationship between lens stiffness and accommodative amplitude. Exp Eye Res. 85 (5), 602-607 (2007).
- Weeber, H. A., et al. Dynamic mechanical properties of human lenses. Exp Eye Res. 80 (3), 425-434 (2005).
- Fisher, R. F. Elastic properties of the human lens. Exp Eye Res. 11 (1), 143(1971).
- Krueger, R. R., Sun, X. K., Stroh, J., Myers, R. Experimental increase in accommodative potential after neodymium: yttrium-aluminum-garnet laser photodisruption of paired cadaver lenses. Ophthalmology. 108 (11), 2122-2129 (2001).
- Burd, H. J., Wilde, G. S., Judge, S. J. An improved spinning lens test to determine the stiffness of the human lens. Exp Eye Res. 92 (1), 28-39 (2011).
- Glasser, A., Campbell, M. C. Presbyopia and the optical changes in the human crystalline lens with age. Vision Res. 38 (2), 209-229 (1998).
- Pau, H., Kranz, J. The increasing sclerosis of the human lens with age and its relevance to accommodation and presbyopia. Graefes Arch Clin Exp Ophthalmol. 229 (3), 294-296 (1991).
- Hollman, K. W., O'Donnell, M., Erpelding, T. N. Mapping elasticity in human lenses using bubble-based acoustic radiation force. Exp Eye Res. 85 (6), 890-893 (2007).
- Baradia, H., Nikahd, N., Glasser, A. Mouse lens stiffness measurements. Exp Eye Res. 91 (2), 300-307 (2010).
- Gokhin, D. S., et al. Tmod1 and CP49 synergize to control the fiber cell geometry, transparency, and mechanical stiffness of the mouse lens. PLoS One. 7 (11), e48734(2012).
- Sindhu Kumari, S., et al. Role of Aquaporin 0 in lens biomechanics. Biochem Biophys Res Commun. , (2015).
- Fudge, D. S., et al. Intermediate filaments regulate tissue size and stiffness in the murine lens. Invest Ophthalmol Vis Sci. 52 (6), 3860-3867 (2011).
- Kuszak, J. R., Mazurkiewicz, M., Zoltoski, R. Computer modeling of secondary fiber development and growth: I. Nonprimate lenses. Mol Vis. 12, 251-270 (2006).
- Scarcelli, G., Kim, P., Yun, S. H. In vivo measurement of age-related stiffening in the crystalline lens by Brillouin optical microscopy. Biophys J. 101 (6), 1539-1545 (2011).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon