A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إعداد وتحليل
In This Article
Summary
We demonstrate a method to generate 3D breast cancer surrogates, which can be cultured using a perfusion bioreactor system to deliver oxygen and nutrients. Following growth, surrogates are fixed and processed to paraffin for evaluation of parameters of interest. The evaluation of one such parameter, cell density, is explained.
Abstract
ثلاثية الأبعاد (3D) الثقافة هي أكثر أهمية من الناحية الفسيولوجية وسيلة لنمذجة سلوك الخلية في المختبر من اثنين ثقافة الأبعاد. سرطان، بما في ذلك سرطان الثدي، والأنسجة 3D معقدة تتألف من خلايا الظهارية السرطان ومكونات اللحمية، بما في ذلك الخلايا الليفية والمصفوفة خارج الخلية (ECM). بعد أكثر في المختبر نماذج من سرطان الثدي تتكون فقط من الخلايا الظهارية السرطان، وإهمال سدى، وبالتالي، فإن هيكل 3D من ورم في الجسم الحي. النمذجة 3D المناسب للسرطان مهم لفهم دقيق لعلم الأحياء الورم، والسلوك، واستجابة للعلاج. ومع ذلك، فإن مدة الثقافة وحجم 3D نماذج محدودة بسبب توافر الأكسجين والمواد المغذية داخل الثقافة. هنا، علينا أن نظهر الطريقة التي يتم دمج خلايا سرطان الثدي الظهارية والخلايا الليفية اللحمية في ECM لتوليد سرطان الثدي بديل 3D يتضمن سدى ويمكن تربيتها على أنهاهيكل 3D الصلبة أو باستخدام نظام مفاعل حيوي نضح لتقديم الأوكسجين والمواد المغذية. بعد الإعداد وفترة النمو الأولي، بدائل يمكن استخدامها لاختبار ما قبل السريرية المخدرات. بدلا من ذلك، المكونات الخلوية ومصفوفة من بديل يمكن تعديلها لمعالجة مجموعة متنوعة من الأسئلة البيولوجية. بعد ثقافة، يتم إصلاح بدائل ومعالجتها لالبارافين، بطريقة مماثلة لمعالجة العينات سرطان الثدي السريري، لتقييم المعلمات من الفائدة. تقييم واحدة من هذه المعلمة، وكثافة الخلايا الحالية، وأوضح، حيث يتم تطبيق أنظمة برمجيات تحليل الصور يماغيج وCellProfiler إلى photomicrographs من المقاطع النسيجية من بدائل لقياس عدد خلايا الأنوية في المنطقة. ويمكن استخدام هذا كمؤشر للتغيير في عدد الخلايا مع مرور الوقت أو تغيير في عدد الخلايا الناتجة عن اختلاف ظروف النمو والعلاجات.
Introduction
ثلاثية الأبعاد نماذج (3D) الثقافة التي تحاكي بدقة أكبر العمارة الورم والمكروية في الجسم الحي مهمة للدراسات تهدف إلى تشريح التفاعلات المعقدة بين الخلايا والمكروية ولاختبار فعالية من العلاجات مرشح. ورم تأثيرات الأبعاد الأكسجين والتدرجات المواد الغذائية، والتوحيد من التعرض للمخدرات، الخلالي تدفق ضغط الدم /، والهندسة المعمارية 3D 1-4. وجود المكروية انسجة المناسبة يساهم في أبعاد الورم والتأثيرات إشارات الخلية ECM ويشير نظير الصماوي بين خلايا انسجة والخلايا الظهارية الخبيثة. وتنشأ آثار الأبعاد الورم والمكروية على وظيفة الخلوية بشكل جيد، مع كل العوامل تغيير الاستجابة للدواء 1،3،5-8. بالإضافة إلى ذلك، حركية الخلوية النمو، ومعدلات التمثيل الغذائي، وإشارات الخلية تختلف بين الأبعاد (2D) الثقافة والثقافة في 3D، مع هذه العوامل affecting الاستجابة الخلوية 1،3،8-10.
في المختبر، المكروية البديلة الورم يمكن عن طريق التضمين بما في ذلك مكونات ECM التمثيلية والسكان خلية انسجة. تتأثر الخلايا الظهارية الخبيثة التي ECM وخلايا انسجة المرتبط بالسرطان إما بأسلوب تعاوني / وقائية لتعزيز تطور الورم أو بطريقة القمعية لمنع مزيد من 5،6،10 الورم نشر. في أي سياق، يمكن للسدى تؤثر على الاستجابة العلاجية وتسليم المخدرات عبر إشارات نظير الصماوي و / أو عن طريق زيادة الضغط الخلالي في الورم مما أدى إلى انخفاض تسليم المخدرات 1،6. ولذلك، فإن إضافة ECM والخلايا اللحمية في نماذج ما قبل السريرية تساعد تلخيص جوانب الورم التي لا يمكن أن تكون على غرار جيدا في الثقافة 2D.
هنا طريقة لوضع بدائل سرطان الثدي التي تتضمن المكروية تلخيصية، بما في ذلك مكونات ECM والصورةخلايا tromal، في حجم 3D يوصف. في سرطان الثدي، ويتكون السكان خلية اللحمية في الغالب من السرطان المرتبطة الليفية (الكاف) وECM انسجة تتكون في معظمها من نوع الكولاجين أنا مع نسبة أقل من مكونات المصفوفة التي تم العثور عليها في الغشاء القاعدي، بما في ذلك laminin ونوع الكولاجين الرابع 1،4،11-13. لذلك، هذه المكونات من المكروية سرطان الثدي (أي، CAF، أنا الكولاجين، والغشاء القاعدي) قد أدرجت في بدائل. ويمكن استخدام هذه الطريقة لتوليد الصلبة، من الامم المتحدة وperfused بدائل 3D (الشكل 1A) أو يمكن تكييفها لتشمل نضح المتوسطة من خلال بديل عن طريق نظام مفاعل حيوي (الشكل 1B). وصفت كلا النهجين هنا. ويمكن أيضا أن يتم تعديل هذا الأسلوب ليشمل عناصر انسجة أخرى، مثل الضامة المرتبطة ورم، أو لنموذج الأورام الصلبة الأخرى عن طريق ضبط المكونات الخلوية وECM، حسب الاقتضاء.
وبالنسبة للبديل سرطان الثدي هو موضح هنا، ونحن قد تستخدم وMDA-MB-231 (231) خط خلايا سرطان الثدي، CAF المعزولة سابقا من سرطان الثدي البشري 14، وECM تتألف من 90٪ الكولاجين الأول ( 6 ملغ / مل) و 10٪ عامل النمو انخفاض الطابق السفلي المواد غشاء (BM). إما نمت بديل في 8 جيدا الشرائح الغرفة (بديل الصلبة) أو تستخدم نظام مفاعل حيوي لتوفير نضح المغذيات المستمر (perfused بديل). أي نظام نضح مفاعل حيوي التي يمكن أن تستوعب حجم الخلايا ECM التي تحتوي يمكن استخدام 15. وكمثال على ذلك، ونحن تصف إعداد بدائل الأنسجة في نظام مفاعل حيوي لدينا. وقد تم تطوير هذا النظام في المنزل وغير متوفرة تجاريا. لأن تركيزنا هنا على إعداد وتحليل بدائل الأنسجة 3D، ونحن لم ندخل في التفاصيل واسعة النطاق بشأن تفاصيل تصنيع وتجميع نظام مفاعل حيوي لدينا. ومع ذلك، وصفا مفصلا لتم نشر هذا النظام وتطوره 16. في هذا النظام مفاعل حيوي، يتم استخدام قناة تدفق ثنائي ميثيل بولي سيلوكسان (PDMS) لإيواء بديل، الذي تدعمه رغوة PDMS (تشكلت باستخدام أساليب مماثلة لتلك التي وصفها Calcagnile وآخرون. 17). يتم اختراق هذا الحجم بنسبة 4 microchannels (كل ميكرون 400 في القطر) التي و perfused باستمرار المتوسطة عن طريق مضخة microphysiologic لتزويد الأكسجين والمواد المغذية إلى بديل.التحليل المناسب من الامهات البديلات أمر بالغ الأهمية للحصول على المعلومات ذات الصلة بشأن وظيفة الخلايا في الاستجابة للعلاج أو معالجات أخرى. ويمكن تحليل البدائل بطرق مختلفة بما في ذلك التصوير المباشر للبدائل سليمة باستخدام المجهر متحد البؤر أو غيرها من وسائل التصوير غير الغازية، والتحليل الخلوي غير المباشر عن طريق معايرة وسائل الإعلام مكيفة، أو الإرواء للمنتجات يفرز، أو التحليل على أقسام نسيجية بعد التثبيت والتجهيز إلىالبارافين. واحدة من هذه المعلمة التي يمكن تقييمها على أقسام نسيجية هي كثافة الخلية. نقدم نهج واحد لقياس كثافة الخلية (أي عدد الخلايا الأنوية في قسم المنطقة) باستخدام تقنيات معالجة الصور شبه الآلية المطبقة على photomicrographs من المقاطع النسيجية البديلة ملطخة الهيماتوكسيلين ويوزين (H & E). كثافة الخلية يمكن أن تستخدم كمؤشر على التغير النسبي في عدد الخلايا مع مرور الوقت أو الذي ينجم عن اختلاف ظروف النمو والعلاجات.
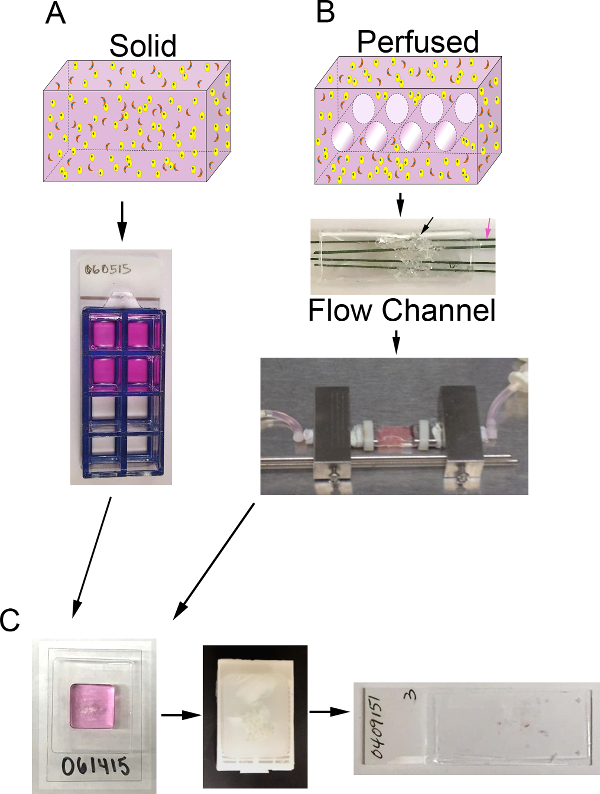
الشكل حجم 1. 3D ونظام مفاعل حيوي. أ) تخطيطي لعملية توليد بدائل 3D الصلبة. الأعلى: الكرتون حجم 3D الصلبة التي تحتوي على ECM (الوردي)، وخلايا سرطان الظهارية (الصفراء)، والكاف (برتقالي)؛ أسفل: عرض أعلى من 8 جيدا الشرائح غرفة تحتوي على بدائل B) تخطيطي لعملية توليد perfused بدائل 3D. أعلى: كاليفورنياrtoon من حجم 3D مع قنوات للسماح للنضح المتوسط والتي تحتوي على ECM (الوردي)، وخلايا سرطان الظهارية (الصفراء)، والكاف (برتقالي)؛ الأوسط: صورة من قناة تدفق PDMS تحتوي على PDMS رغوة (السهم الأسود) ليتم حقنه مع خلية + ECM واخترقت عن طريق أسلاك الفولاذ المقاوم للصدأ المطلي البوليمر (السهم الوردي) قياس 400 ميكرون في القطر. أسفل: صورة من قناة التدفق PDMS التي تحتوي على مركب ومتصلا نظام مفاعل حيوي للسماح لنضح المتوسط المستمر (مضخة تحوي وخزان سائل الإعلام لا يظهر) C) صور من خطوات المعالجة لكل من الوكلاء الصلبة وperfused بعد الثقافة. اليسار: صورة cryomold تحتوي على عينة تجهيز جل وبديل. الأوسط: صورة من كتلة البارافين تحتوي على مركب ثابت ومعالجتها. اليمين: صورة لشريحة زجاجية مع قسم نسيجية الملون E-H & من مركب الرجاء انقر هنا لعرضنسخة أكبر من هذا الرقم.
Protocol
1. خلية ثقافة
- ذوبان الجليد المكون BM بين عشية وضحاها في 4 درجات مئوية، على الجليد.
- المتوسط الدافئة إلى 37 درجة مئوية. لدعم نمو كل 231 الخلايا وCAF، استخدم Dulbecco لتعديل النسر متوسطة (DMEM) بالإضافة إلى 10٪ مصل بقري جنيني (FBS).
ملاحظة: إن وسائل الإعلام المستخدمة تعتمد على نوع من الخلايا والأهداف التجريبية. - إزالة المتوسطة من الطبق الثقافة (10 سم) من قرب خلايا متكدسة 231 وإضافة 1.5 مل التربسين / EDTA. احتضان لمدة 1-3 دقائق عند 37 درجة مئوية، ورصد لمفرزة الخلية. وبمجرد أن تبدأ الخلايا لجولة وتؤتي ثمارها لوحة، ووقف رد الفعل بإضافة 3 مل من مصل المتوسطة التي تحتوي على. ماصة المتوسطة وخلايا في أنبوب مخروطي 15 مل.
- أجهزة الطرد المركزي على المديين المتوسط والخلايا في 150 x ج لمدة 5 دقائق. إزالة طاف، وإعادة تعليق بيليه خلية في 2 مل المتوسطة.
- حساب عدد الخلايا في حجم باستخدام التريبان الأزرق وعدادة الكريات. وينبغي أن يكون بقاء الخلية أكبر من 90٪.
- تكرارعملية مع أنواع أخرى من الخلايا ليتم تضمينها في بديل. لبديل الموصوفة هنا، يتم تكرار العملية مع الكاف.
- تحديد حجم مناسب من كل تعليق الخلية للحصول على العدد المطلوب من الخلايا.
ملاحظة: للحصول على بديل الموصوفة هنا، وكثافة الخلايا 2.1 × 10 6 خلايا في 100 ميكرولتر من ECM، مع نسبة 2: 1 من الخلايا الطلائية إلى الخلايا الليفية (1.4 × 10 6 231 الخلايا و7 × 10 5 CAF في 100 ميكرولتر ECM)، ويستخدم. هذا كثافة الخلية هي نقطة انطلاق جيدة. ومع ذلك، فإن كثافة الخلية المثلى تعتمد على نوع من الخلايا، ومدة الثقافة، وأهداف التجربة. - وضع حجم مناسب من كل تعليق الخلية في أنبوب مخروطي 15 مل (أنبوب واحد لكل نوع من الخلايا). أجهزة الطرد المركزي على المديين المتوسط والخلايا في 150 x ج لمدة 5 دقائق.
- بعد الطرد المركزي، وإزالة طاف، وإعادة تعليق نوع خلية واحدة في الخليةالمياه ثقافة الصف (178.8 ميكرولتر، انظر الجدول 1) وغيرهم من نوع من الخلايا في 10X DMEM (100 ميكرولتر، انظر الجدول رقم 1، التي تحتوي على الفينول الأحمر لمراقبة درجة الحموضة). وضع أنابيب تحتوي على الخلايا على الجليد والمضي قدما بسرعة لإعداد ECM أدناه. أن يحدد الوقت الذي لا تزال الخلايا في الماء للحفاظ على قدرتها على البقاء.
ملاحظة: كل 10X مكونات مطلوبة DMEM والمياه خلية ثقافة درجة من ECM. لذا، اخترنا لاعادة تعليق الخلايا في كليهما. نحن هنا اختار تعسفا لاعادة تعليق الخلايا 231 في زراعة الخلايا المياه الصف والاتحاد الإفريقي في 10X DMEM، على الرغم من أن أي نوع من الخلايا يمكن إعادة تعليق في أي من هذين العنصرين.
2. إعداد الخلايا في ECM (6 ملغ / مل الأبقار الكولاجين النوع الأول + 10٪ BM)
ملاحظة: إن ECM تتألف من 90٪ الكولاجين I + تم اختيار 10٪ BM لنموذج سرطان الثدي لأنه يتكون سدى الورم في هذا الورم الخبيث في المقام الأول من الكولاجينأنا مع مكونات BM، مثل laminin، الكولاجين الرابع، وentactin، تتألف من جزء أصغر من ECM 12،13،18،19.
- على الجليد، إضافة المكونات المدرجة في الجدول 1، وذلك، في أنبوب microcentrifuge 2 مل.
ملاحظة: هذا المبلغ يكفي لمدة 8 بدائل الصلبة أو استخدام نظام مفاعل حيوي وصفها هنا، 4 بدائل perfused.
| إعداد الخلايا في ECM (6 ملغ / مل الأبقار الكولاجين النوع الأول + 10٪ BM) | |
| 178.8 μل | ثقافة خلية الصف المياه التي تحتوي على العدد المرغوب فيه من 231 الخلايا (تحديد أعلاه) |
| 606 ميكرولتر | أنا الكولاجين (10 ملغ / مل البقري)، إضافة قطرة قطرة |
| 100 ميكرولتر | الغشاء القاعدي، إذابة |
| 100 ميكرولتر | 10X DMEM (التي تحتوي على الفينول الأحمر) مع العدد المرغوب فيه من CAF (تحدد أعلاه) |
| 15.2 ميكرولتر | 7.5٪ (ت / ت) بيكربونات الصوديوم، إضافة قطرة قطرة |
الجدول 1. إعداد الخلايا في ECM.
- المزيج بلطف من قبل pipetting، وتجنب تشكيل فقاعات. مراقبة مستوى الرقم الهيدروجيني باستخدام الفينول الأحمر في 10X DMEM. تأكد من أن الخليط برتقالة / اللون الوردي يدل على درجة حموضة = 7. إذا كان الرقم الهيدروجيني منخفضة جدا (الأصفر أيضا)، إضافة ببطء إضافي 7.5٪ بيكربونات الصوديوم قطرة واحدة في وقت واحد (~ 5 ميكرولتر) حتى يتم الوصول إلى اللون المناسب.
- حافظ على الخليط على الجليد والعمل بسرعة لمنع سابق لأوانه البلمرة ECM.
3. إعداد بديل
- للثقافات 3D الصلبة (الشكل 1A):
- العمل في غطاء ثقافة الخلية باستخدام تقنية معقمة، تسمية غطاء العقيمة 8 جيدا الشرائح غرفة للإشارة إلى أي تغيير تجريبي في بدائل.
- حفظ الشريحة الغرفة على الجليد لمنع سابق لأوانه البلمرة ECM، ببطء ماصة 100 ميكرولتر من خلية + ECM الخليط في كل بئر من الشريحة الغرفة 8 جيدا.
ملاحظة: pipetting لخلية + ECM خليط حول حواف من أول بئر يساعد على تحسين توزيع خلية + ECM الخليط في البئر. - احتضان بدائل عند 37 درجة مئوية، و 5٪ CO 2 لمدة 45 دقيقة للسماح ECM البلمرة.
- بعد البلمرة ECM، إضافة 100 ميكرولتر سائل الإعلام والثقافة إلى كل بئر واحتضان عند 37 درجة مئوية، و 5٪ CO 2 لمدة التجربة،تغيير الثقافة المتوسطة كل يومين.
- للثقافات 3D perfused في نظام مفاعل حيوي (الشكل 1B):
- تعقيم جميع مكونات مفاعل حيوي لإعداد ثقافة 3D (أي مفاعل حيوي، وأنابيب، ملقط، والتجهيزات اللازمة لإعداد مفاعل حيوي) باستخدام عملية محددة لمفاعل حيوي لاستخدامها.
- لنظام المثال مفاعل حيوي يستخدم هنا، استخدام مزيج من التعقيم (على سبيل المثال، 12 دقيقة تعرض على 121.1 درجة مئوية مع 15 دقيقة التجفيف) ويحتضنها في 70٪ من الإيثانول لمدة 1 ساعة.
- إعداد وتجميع جزء من نظام مفاعل حيوي أن سيضم بديل.
- لنظام المثال مفاعل حيوي المستخدمة هنا، اضافة الى وجود العمود الفقري PDMS الرغوة في قناة تدفق PDMS الأنابيب باستخدام ملقط. دفع أربعة (400 ميكرون) المغلفة البوليمر أسلاك الفولاذ المقاوم للصدأ في رغوة PDMS لتوليد microchannels موازية.
- في غطاء ثقافة الخلية، وذلك باستخدام STERILتقنية الإلكترونية وإبرة قياس 26 مع حقنة، حقن الخلايا + ECM الخليط في مجال مفاعل حيوي نضح مصممة لتحتوي على خلايا. المضي قدما بسرعة إلى الخطوة التالية.
- لضمان أكثر حتى توزيع الخلايا داخل الامهات البديلات، ضع عنصر مفاعل حيوي السكن الامهات البديلات إلى 50 مل أنبوب مخروطي (تحت غطاء الثقافة الخلية) وتناوب مستمر في ~ 18 دورة في الدقيقة في حين يحتضنها عند 37 درجة مئوية لمدة 45 دقيقة للسماح ECM البلمرة.
ملاحظة: يمكن أن تكتمل دوران باستخدام المدورة في الحاضنة أو فرن مع بني في محور دوار، مثل التهجين وضع الفرن على 37 درجة مئوية. - ربط التجمع مفاعل حيوي يحتوي على مركب إلى مضخة نضح باستخدام تعليمات الشركة الصانعة.
ملاحظة: إن تفاصيل هذه العملية تختلف تبعا لمفاعل حيوي وضخ المستخدمة.- لنظام المثال مفاعل حيوي المستخدمة هنا، وإزالة الأسلاك الفولاذ المقاوم للصدأ قبل ربط bioreaالتجمع المنشئ للمضخة.
- بدء نضح المتوسط (معدل تدفق الجزء الأكبر من 167.1 ميكرولتر / دقيقة. متناهية إجهاد القص للجدران من 1 داين / سم 2) في حاضنة عند 37 درجة مئوية، و 5٪ CO 2.
ملاحظة: يمكن تعديل معدل نضح المتوسط، اعتمادا على الإعداد مفاعل حيوي والأهداف وتصميم التجربة. - تواصل نضح المتوسط لمدة التجربة، وتغيير الثقافة المتوسطة كل سبعة أيام.
- تعقيم جميع مكونات مفاعل حيوي لإعداد ثقافة 3D (أي مفاعل حيوي، وأنابيب، ملقط، والتجهيزات اللازمة لإعداد مفاعل حيوي) باستخدام عملية محددة لمفاعل حيوي لاستخدامها.
4. البديل التثبيت وتجهيز (الشكل 1C)
- cryomolds التسمية وأشرطة النسيج البلاستيكية لتثبيت البديل والمعالجة.
- بعد ذلك، بدائل يغلف في هلام تجهيز العينة، التي هي مادة المائية التي هي سائلة في درجات الحرارة الدافئة، ولكن يتصلب في درجة حرارة الغرفة. ويساعد معالجة عينة هلام في الحفاظ على بدائل سليمة أثناء معالجة ويسهل نسيجية باجتزاء 14،20-22.
- تذوب عينة تجهيز هلام في 60 ° C حمام الماء لتسيل، وحفظ في درجة الحرارة هذه حتى جاهزة للاستخدام. نقل مفاعل حيوي مع بديل لمجلس الوزراء للسلامة الأحيائية.
- ماصة ما يقرب من 300 ميكرولتر عينة هلام المعالجة في الجزء السفلي من cryomold المسمى (الشكل 1C، اللوحة اليسرى).
- باستخدام شفرة مشرط (رقم 10 المفضل) وملقط إزالة بعناية بديل من مفاعل حيوي أو من بئر شريحة الغرفة 8 جيدا ووضعه في cryomold تحتوي على عينة تجهيز هلام.
ملاحظة: الأنسجة بمناسبة الأصباغ (انظر المواد / قائمة معدات مثال محدد) من ألوان مختلفة يمكن أن يستخدم في تحديد بدائل، مما يسمح عينات متعددة ليتم تضمينها في كاسيت الأنسجة واحد بطريقة مميزة. - ماصة ما يقرب من 300 عينة ميكرولتر تجهيز هلام لتغطية بديل في cryomold واحتضان عند 4 درجة مئوية لمدة 30 دقيقة لsolidifذ.
- مرة واحدة وقد عززت جل معالجة عينة، وإزالة هلام معالجة العينة تحتوي على مركب من cryomold، ووضعه في شريط كاسيت الأنسجة.
- وضع كاسيت الأنسجة التي تحتوي على مركب إلى 10٪ من الفورمالين محايدة مخزنة ل10 إلى 12 ساعة في درجة حرارة الغرفة للسماح التثبيت الكامل.
- بعد التثبيت، ونقل كاسيت الأنسجة التي تحتوي على مركب إلى 70٪ من الإيثانول حتى معالجتها لالبارافين.
ملاحظة: نقل وبديل من الفورمالين لالإيثانول يمنع الإفراط في تثبيت مع الفورمالين التي يمكن أن تسبب فقدان مناعية بعض الحواتم 23. طول الوقت في الإيثانول ليست حرجة. هذا التغيير في تثبيتي مهم إذا كان سيتم استخدام بديل لالمناعية أو المناعي. والبديل الثابت هو الآن على استعداد لتجهيز لالبارافين (الشكل 1C، وسط لوحة). يتم تنفيذ هذه المعالجة عادة في معالج الأنسجة الموجودة في apprمجهزة opriately مختبر الأنسجة. ينصح برنامج أقصر نظرا لحجم وطبيعة حساسة من الامهات البديلات. 24
5. باجتزاء وH & E تلطيخ (الشكل 1C، لوحة يمين)
- وبعد تجهيز بدائل لكتلة البارافين، قسم منهم باستخدام مشراح القياسي لباجتزاء من والأنسجة جزءا لا يتجزأ من البارافين الثابتة الفورمالين 24،25.
ملاحظة: لا يمكن أن يؤديها هذا في مختبر الأنسجة مؤهل، أو في مختبر للأبحاث، إذا كانت مجهزة بشكل صحيح وذوي الخبرة. سمك من المقاطع النسيجية يمكن أن تختلف تبعا للاستخدام المقصود من المقاطع. ومع ذلك، ونحن عادة استخدام المقاطع التي هي 5 ميكرون في سمك. الرغوة PDMS المستخدمة هنا في بدائل perfused هو مقطوع بسهولة مع مشراح. - وضع المقاطع على الشرائح الزجاجية واضحة نسيجية.
- بعد باجتزاء، خبز المقاطع النسيجية في 58 درجة مئوية لمدة 10-12 ساعة للتحضير لتلطيخمع الهيماتوكسيلين ويوزين (H & E). الخبز يذوب البارافين ويسمح أيضا التزام أفضل من المقاطع إلى شريحة زجاجية.
- H & E تلطيخ:
- انشاء محطات وصفها في الجدول رقم 2 في الجرار coplin أو أطباق الزجاج تلطيخ، اعتمادا على عدد من الشرائح وصمة عار. مرة واحدة يتم تعيين الكواشف يصل، نقل أقسام من خلال كل محطة، في النظام، واحتضان للمرة المبين أدناه 24.
- جبل ساترة على كل شريحة باستخدام وسائل الإعلام في تصاعد مستمر.
- السماح لوسائل الإعلام متزايدة ليجف قبل التصوير.
| H & E تلطيخ | ||
| محطة | حل | مرة |
| 1 | زيلين | 5 دقيقة |
| 2 | زيلين | 5 دقيقة |
| 3 | زيلين | 5 دقيقة |
| 4 | الإيثانول بنسبة 100٪ | 5 دقيقة |
| 5 | الإيثانول بنسبة 100٪ | 5 دقيقة |
| 6 | 95٪ إيثانول | 5 دقيقة |
| 7 | 95٪ إيثانول | 5 دقيقة |
| 8 | ماء الصنبور | 5 دقيقة |
| 9 | غير المتأينة المياه | 5 دقيقة |
| 10 | الهيماتوكسيلين 7211 | 5 دقيقة |
| 11 | ماء الصنبور | 5 دقيقة |
| 12 | انارات * | 10 الانخفاضات |
| * ريتشارد ألان # 7401 أو 70٪ ايثانول + 0.5٪ حمض الهيدروكلوريك | ||
| 13 | ماء الصنبور | 5 دقيقة |
| 14 | الصبغة الزرقاء الكاشف | 30 ثانية |
| 15 | ماء الصنبور | 5 دقيقة |
| 16 | 95٪ إيثانول | 10 الانخفاضات |
| 17 | يوزين-Y | 1 دقيقة |
| 18 | 95٪ إيثانول | 10 الانخفاضات |
| 19 | 95٪ إيثانول | 10 الانخفاضات |
| 20 | الإيثانول بنسبة 100٪ | 10 الانخفاضات |
| 21 | الإيثانول بنسبة 100٪ | 10 الانخفاضات |
| 22 | الإيثانول بنسبة 100٪ | 5 دقيقة |
| 23 | زيلين | 10 الانخفاضات |
| 24 | 5 دقيقة | |
الجدول 2. H & E تلطيخ.
6. قياس كثافة الخلية
- صورة H & E قسم واحد على الأقل بأكمله الملون نسيجية من بديل باستخدام brightfield المجهري في 400X التكبير، وتوفير الصور وملفات .tif.
ملاحظة: فقط تم الانتهاء من معالجة الصور صفها باستخدام الصور الملونة. في حين لم تختبر، ونحن نعتقد أنه ينبغي للنفس المعالجة أن تنطبق أيضا على الصور الرمادية. - تحميل CellProfiler من معهد برود 26 (http://cellprofiler.org/download.shtml) ويماغيج من المعاهد الوطنية للصحة (http://rsb.info.nih.gov/ij/download.html)، وكلاهما من وهي متوفرة علنا دون أي تهمة.
- لقياس مساحة بديل في كل صورة، يماغيج فتح، حدد "تعيين القياسات" (ضمن علامة التبويب "تحليل")، حدد "مساحة"، ثم حدد "حسنا & #34 ؛.
- فتح صورة (ملف .tif) من بديل. باستخدام أداة المضلع في ImageJ (انظر الشكل 2)، الخطوط العريضة للمنطقة من بديل في الصورة عن طريق سحب الماوس والنقر على جعل نقاط الربط. استخدام حواف ECM كدليل. مرة واحدة المبين، حدد "قياس" تحت علامة التبويب "تحليل".
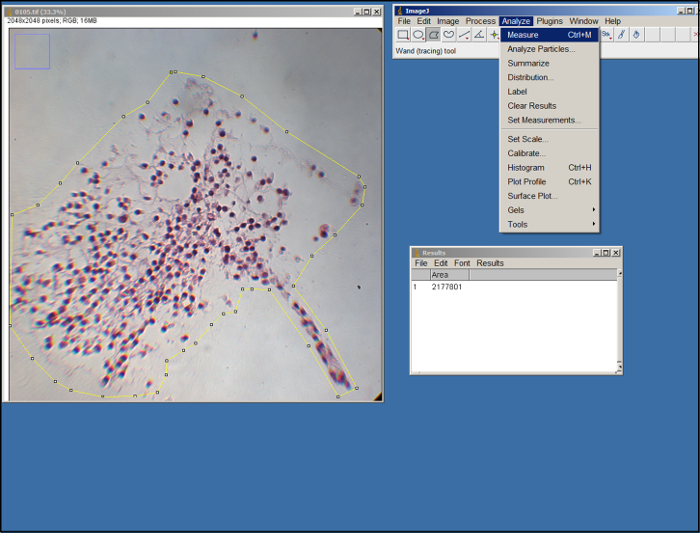
الشكل 2. تحليل يماغيج. لقطة من معالجة يماغيج. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- كرر لكل صورة بديل الأنسجة. حفظ القياسات ومعرفات الصورة المقابلة لبرنامج جدول بيانات.
- تحميل ملفات الصور المستخدمة لقياس منطقة في ImageJ إلى CellProfiler عن طريق سحب ملفات الصور إلى "ملف قائمة". تعيين اسم على الصور المستوردة فيو"NamesAndTypes" وحدة الإدخال وحدد نوع الصورة (أي، "لون صورة").
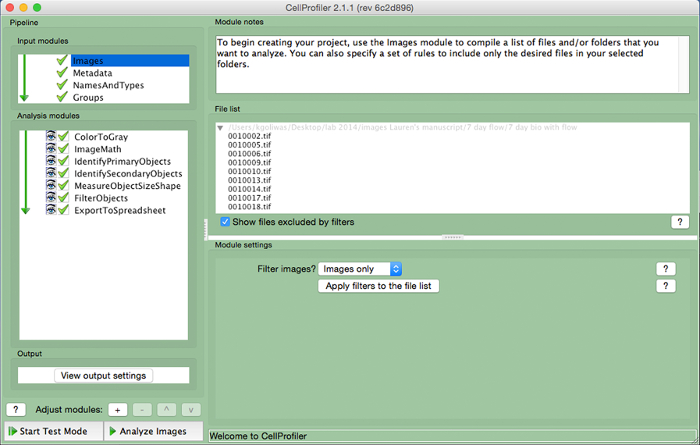
الشكل 3. CellProfiler سبيل المثال خط أنابيب. لقطة من خط الأنابيب مصممة لقياس عدد خلايا الأنوية في CellProfiler. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- إنشاء خط أنابيب التحليل أن يتضمن الوحدات التالية لحساب عدد الخلايا في صورة، من خلال النقر على علامة "+" بجانب "ضبط وحدة" (الشكل 3، في الجزء السفلي من اللوحة اليسرى). إضافة كل من وحدات أدناه.
- حدد "ColorToGray" (الشكل 4).
- حدد اسم الصورة المدخلة من القائمة المنسدلة، اسم الناتج صورة، وحدد نوع الصورة الأصلية (<م> أي RGB إذا كان لون المدخلات الصورة).
ملاحظة: لن تكون هناك حاجة إلى هذه الوحدة في حالة استخدام الصور الرمادية
- حدد اسم الصورة المدخلة من القائمة المنسدلة، اسم الناتج صورة، وحدد نوع الصورة الأصلية (<م> أي RGB إذا كان لون المدخلات الصورة).
- حدد "ImageMath" (الشكل 5).
- حدد "عكس" العملية، اسم إخراج الصورة، وتحديد صورة رمادية في علامة التبويب "تحديد الصورة الأولى".
- حدد "IdentifyPrimaryObjects" (الشكل 6).
- اختر صورة الإدخال (صورة بعد تصحيح الرياضيات)، اسم الهدف الرئيسي الكشف عن هويته (نوى)، وأدخل نطاق القطر للكائنات المراد قياسها في وحدات بكسل (حوالي 25-65). حدد "التكيف" استراتيجية عتبة مع "أوتسو" طريقة العتبة مع "ثلاث فئات". لا تغيير أي معايير أخرى من الإعدادات الافتراضية.
ملاحظة: يجب تحديد مجموعة الأمثل من أقطار عن طريق فتح صورة في وحدة إدخال الصور وقياس قطرها من النوى (أي،الهدف الأساسي) باستخدام أداة طول التدبير.
- اختر صورة الإدخال (صورة بعد تصحيح الرياضيات)، اسم الهدف الرئيسي الكشف عن هويته (نوى)، وأدخل نطاق القطر للكائنات المراد قياسها في وحدات بكسل (حوالي 25-65). حدد "التكيف" استراتيجية عتبة مع "أوتسو" طريقة العتبة مع "ثلاث فئات". لا تغيير أي معايير أخرى من الإعدادات الافتراضية.
- حدد "IdentifySecondaryObjects" (الشكل 7).
- حدد الصورة الإدخال (صورة بعد تصحيح الرياضيات)، حدد الكائنات الإدخال (نوى)، وتسمية الكشف عن هويته الكائنات (خلايا). اختيار "الدعاية" طريقة للتعرف على الأشياء الثانوية، واستخدام "التكيف" استراتيجية عتبة وطريقة "أوتسو" مع "فئتين" التقليل "التباين مرجح". حدد "لا تجانس" وعتبة معامل التصحيح 1، وانخفاض والحدود العليا من 0 و 1، وعاملا تسوية أوضاع 0.05. لا تغيير أي معايير أخرى من الإعدادات الافتراضية.
- حدد "MeasureObjectSizeShape" (الشكل 8).
- حدد الخلايا (كائن ثانوي) ونوى (الهدف الرئيسي)، والكائنات التي يتم قياسها.
- حدد "FilterObjects" (الشكل 9 ).
- تسمية الأشياء الانتاج وتحديد النوى (الهدف الرئيسي) ككائن لتصفية.
- إبقاء المتغيرات المقبلين حسب الإعدادات الافتراضية. حدد "AreaShape" كما القياس لتصفية حسب الفئة، و"FormFactor" كما القياس.
- حدد "نعم" لتصفية باستخدام قيمة قياس الحد الأدنى وإضافة قيمة الحد الأدنى من 0.52.
- اختيار "لا" لتصفية باستخدام الحد الأقصى لقياس.
- حدد "نعم" للاحتفاظ الخطوط العريضة للكائنات التي تمت تصفيتها وتسمية صورة المبينة.
- حدد "ExportToSpreadsheet" (الشكل 10)
- تحديد مكان حفظ الملف واسم "إخراج الملفات".
- بعد إنشاء خط أنابيب تحليل (خطوات 6.7.1 إلى 6.7.7.1)، بدء "اختبار الوضع" في CellProfiler وتقييم كل خطوة، بما في ذلك النواة في صورة اختبار يتم تصفيتها بشكل مناسب، لضمان سنويا الأمثلوقد تم اختيار rameters لتحديد الخلايا. ويبين الشكل 11 صورة الإخراج من CellProfiler التالية الترشيح، حيث نوى يتم بشكل صحيح المحددة (دائري باللون الأخضر)، ويتم تصفية الخلفية بعيدا.
- مرة واحدة يتم تقييم المعلمات ومصممة على أن تكون كافية، حفظ المشروع ومن ثم انقر فوق "تحليل الصور". هذا المشروع يمكن استخدامها مرارا وتكرارا لتحليل المستقبل.
ملاحظة: مرة واحدة وقد تم تأسيس المعلمات، ووضع برنامج لتحليل جميع الصور في "قائمة ملف"، بالتتابع. وسيؤدي هذا في العديد من النوافذ فتح لكل صورة تحليلها، مما يؤدي إلى وقت أطول معالجة.- لتجنب وقت المعالجة أطول، انقر فوق رمز العين على كل من وحدات باستثناء "ExportToSpreadsheet" ضمن قسم "وحدات التحليل".
- مرة واحدة وقد تم تجهيز جميع الصور البديلة التي كتبها CellProfiler، فتح جدول البيانات التي تحتوي على بيانات الصور التي تم إنشاؤها بواسطة خلية التعريف وجدول البيانات التي تحتوي على منطقة يقاس مع يماغيج. نسخ البيانات المصفاة النوى (العمود D في جدول CellProfiler) ومعرفات صورة (العمود R) ولصقها في جدول البيانات التي تحتوي على بيانات منطقة محسوبة.
- حساب مجموع كل من القياسات التي تم الحصول عليها لعدد من النوى في صورة بديل.
- حساب مجموع القياسات التي تم الحصول عليها عن منطقة بديلة من كل صورة من بديل. تقسيم المساحة الكلية تقاس 1X10 6.
- تقسيم العدد الإجمالي للنوى على مجموع قياس منطقة في الخطوة أعلاه للحصول على قيمة لعدد من الخلايا في 1X10 6 بكسل 2.
- حدد "ColorToGray" (الشكل 4).
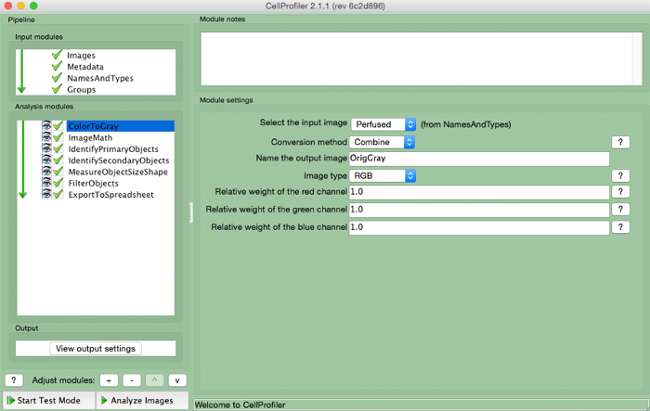
الرقم خط أنابيب 4. CellProfiler: تغيير صورة إلى الرمادي لقطة من وحدة "ColortoGray". الصورة: //www.jove.com/files/ftp_upload/54004/54004fig4highres.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
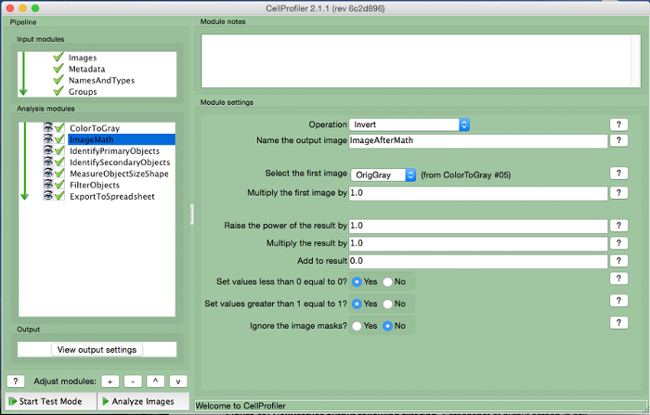
الرقم 5. CellProfiler خط أنابيب:.. عكس صورة لقطة من وحدة "ImageMath" الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6. CellProfiler خط أنابيب:. تحديد نواة لقطة من وحدة "IdentifyPrimaryObjects" الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
في الصفحة = "1"> 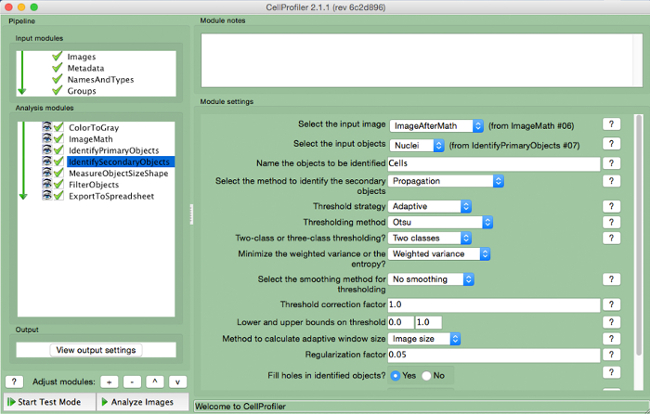
الرقم 7. CellProfiler خط أنابيب: الخلايا تحديد لقطة وحدة "IdentifySecondaryObjects" الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
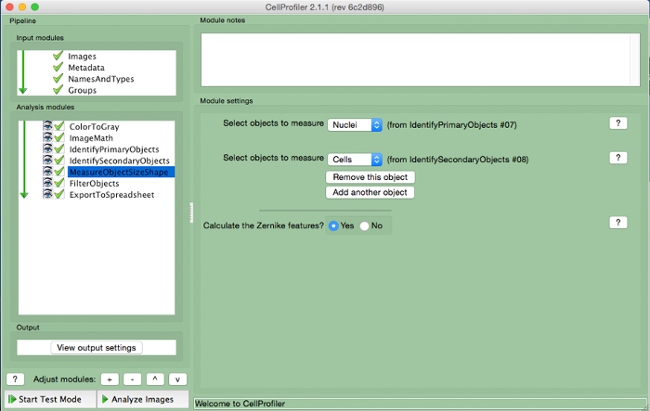
الرقم 8. خط أنابيب CellProfiler:.. الأشياء قياس لقطة من وحدة "MeasureObjectSizeShape" الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
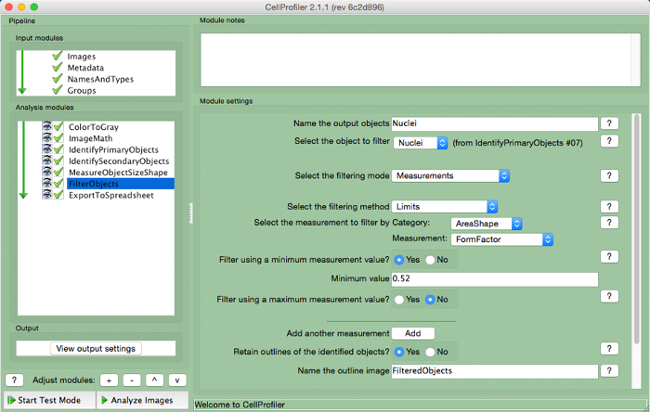
الرقم 9. خط أنابيب CellProfiler: تصفية الأجسام لقطة من "FilterObjects "وحدة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
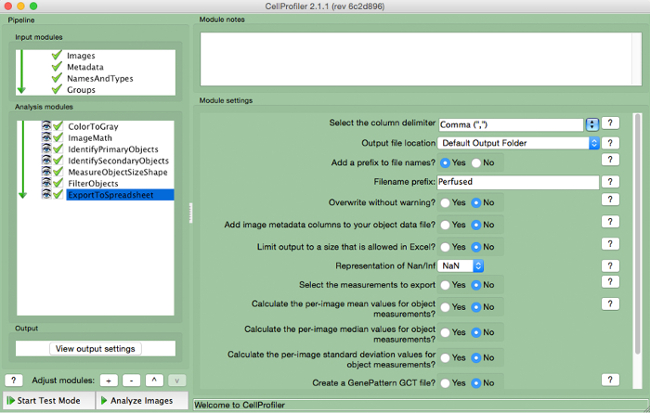
الرقم 10. خط أنابيب CellProfiler:.. تصدير البيانات لقطة من وحدة "ExportToSpreadsheet" الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
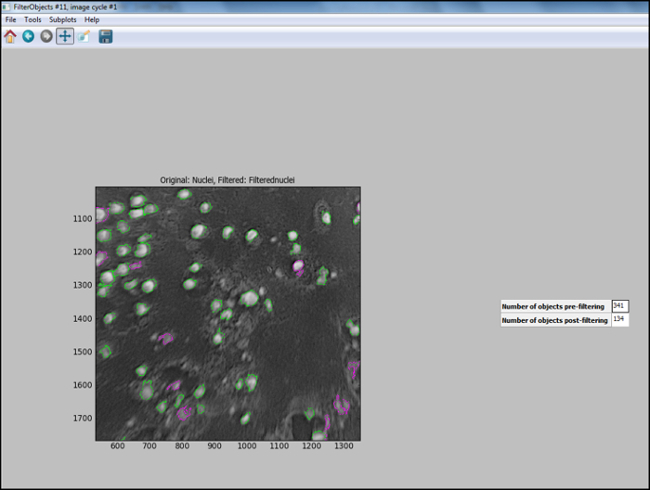
الرقم 11. الانتاج CellProfiler التالية التصفية. لقطة من الشاشة الانتاج في التعريف الخلية التالية تصفية الكائن. الرجاء انقر هنا لعرض أكبر فيرسيعلى هذا الرقم.
النتائج
وقد تم إعداد 3D بدائل سرطان الثدي الصلبة وperfused كما هو موضح أعلاه ونمت لمدة 7 أيام. وفي وقت لاحق، تم إصلاح بدائل، وتجهيزها لالبارافين، مقطوع، وملطخة الهيماتوكسيلين ويوزين، كما هو موضح أعلاه. وقد تم قياس عدد الخلايا الأنوية في منطقة (كل من خلايا 231 و CAF) ك...
Discussion
هنا، وقد وصفت طريقة للثقافة 3D الذي يشتمل على مكونات المكروية الأنسجة، بما في ذلك المصفوفة خارج الخلية (ECM) والخلايا الليفية اللحمية الإنسان، في وحدة تخزين نماذج عن كثب سرطان الثدي البشري للسماح لتطوير التشكل 3D تلخيصية . طريقة ثقافة 3D وصفها هو أكثر تمثيلا من الأمراض ال...
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
The University of Alabama at Birmingham Center for Metabolic Bone Disease performed the histologic processing and sectioning of surrogates. Southern Research (Birmingham, AL) provided support for the manufacture of the bioreactor system. Funding was provided by the United States Department of Defense Breast Cancer Research Program (BC121367).
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagel Medium 1x (DMEM) | Corning CellGro | 10-014-CV | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | |
| 0.25% Trypsin + 2.21 mM EDTA 1x | Corning | 25-053-CI | |
| Tissue Culture plates, 100 mm | CellTreat Scientific Products | 229620 | Sterile |
| Tissue Culture plates, 35 mm | CellTreat Scientific Products | 229638 | For PDMS foam formation |
| 9" Glass pipette | Fisher | 13-678-20D | Sterile |
| 10 ml pipette | CellTreat Scientific Products | 229210B | Sterile |
| 1,000 µl piptette tips | FisherBrand | 02-717-166 | Sterile Filtered |
| 200 µl pipette tips | FisherBrand | 02-717-141 | Sterile Filtered |
| 10 µl pipette tips | FisherBrand | 02-717-158 | Sterile Filtered |
| 15 ml conical tubes | CellTreat Scientific Products | 229410 | Sterile |
| 50 ml conical tubes | CellTreat Scientific Products | 229422 | Sterile |
| 1.5 ml microcentrifuge tubes | FisherBrand | 05-408-129 | Sterile |
| Trypan blue | Corning Cellgro | 25-900-CI | Sterile |
| Sylgard 184 | Electron Microscopy Sciences | 24236-10 | PDMS elastomer and curing agent. Used for our in-house bioreactor. |
| PDMS Foam | Made in-house for use in our in-house bioreactor. | ||
| High Concentration Bovine Collagen Type I | Advanced Biomatrix | 5133-A | FibriCol ~10 mg/ml |
| Growth Factor Reduced Matrigel (Basement Membrane) | Corning | 354230 | Basement membrane material |
| Sodium Bicarbonate | Sigma | S8761 | |
| Molecular Biology Grade Water | Fisher | BP2819-1 | |
| DMEM 10x | Sigma-Aldrich | D2429 | |
| Nunc Lab-Tek Chamber Slide System | Thermo Scientific | 177402 | 8-well |
| Bioreactor | Made in-house. | ||
| Spring-Back 304 Stainless Steel—Coated with PTFE polymer | McMaster-Carr | 1749T19 | Stainless steel wires to generate microchannels in our in-house bioreactor system. 0.016" Diameter |
| BioPharm Plus platinum-cured silicone pump tubing, L/S 14 | Masterflex | EW-96440-14 | For use in our in-house bioreactor system. Tubing ID: 1.6 mm, Hose barb size: 1/16 in. |
| 2-Stop Tubing Sets, non-flared PVC, 1.52 mm ID | Cole-Parmer | EW-74906-36 | For use in our in-house bioreactor system (with microperistalitic pump). |
| Six Channel precision micro peristaltic pump | Cole-Parmer | EW-74906-04 | For use with our in-house bioreactor system |
| Tuberculin Syringes | BD Medical | 309625 | 26 gauge 3/8 in. needle; Sterile |
| Dissecting Tissue Forceps | FisherBrand | 13-812-36 | 5.5 inch |
| Mini Tube Rotator | Boekel Scientific | 260750 | Equipment option for surrogate rotation. Used with carousel for 50 ml tubes (model number 260753) |
| 50 ml tube carousel | Boekel Scientific | 260753 | Used with mini tube rotator |
| Bambino Hybridization Oven | Boekel Scientific | 230301 | Equipment option for surrogate rotation |
| HistoGel Specimen Processing Gel | Thermo Scientific | HG-4000-012 | Specimen Processing Gel described in Step 5.2 |
| Cryomold | Andwin Scientific | 4566 | 15 mm x 15 mm x 5 mm |
| Tissue Marking Dye | Cancer Diagnostics, inc. | 03000P | Can be used to mark surrogates, allowing multiple samples to be included in one tissue cassette |
| Hinged tissue cassettes | FisherBrand | 22-272-416 | |
| Formalin | Fisher | 23-245-685 | |
| GoldSeal Plain Glass Slides | Thermo Scientific | 3048-002 | |
| Xylene | Fisher | X3P-1GAL | |
| Ethanol, 200 proof (100%), USP | Decon Laboratories, Inc. | 2805M | |
| Hematoxylin | Thermo Scientific Richard-Allan Scientific | 7211 | |
| Clarifier | Thermo Scientific Richard-Allan Scientific | 7401 | |
| Bluing Solution | Thermo Scientific Richard-Allan Scientific | 7301 | |
| Eosin Y | Thermo Scientific Richard-Allan Scientific | 7111 | |
| Cytoseal XYL mounting media | Thermo Scientific Richard-Allan Scientific | 83124 | |
| Coverslips | Fisher Scientific | 12-548-5G |
References
- Hakanson, M., Textor, M., Charnley, M. Engineered 3D environments to elucidate the effect of environmental parameters on drug response in cancer. Integr Biol (Camb). 3 (1), 31-38 (2011).
- Horning, J. L., et al. 3-D tumor model for in vitro evaluation of anticancer drugs. Mol Pharm. 5 (5), 849-862 (2008).
- Dhiman, H. K., Ray, A. R., Panda, A. K. Three-dimensional chitosan scaffold-based MCF-7 cell culture for the determination of the cytotoxicity of tamoxifen. Biomaterials. 26 (9), 979-986 (2005).
- Place, A. E., Jin Huh, S., Polyak, K. The microenvironment in breast cancer progression: biology and implications for treatment. Breast Cancer Res. 13 (6), 227 (2011).
- Mao, Y., Keller, E. T., Garfield, D. H., Shen, K., Wang, J. Stromal cells in tumor microenvironment and breast cancer. Cancer Metastasis Rev. 32 (1-2), 303-315 (2013).
- Paulsson, J., Micke, P. Prognostic relevance of cancer-associated fibroblasts in human cancer. Semin Cancer Biol. 25, 61-68 (2014).
- Roskelley, C. D., Desprez, P. Y., Bissell, M. J. Extracellular matrix-dependent tissue-specific gene expression in mammary epithelial cells requires both physical and biochemical signal transduction. Proc. Natl. Acad. Sci. 91, 12378-12382 (1994).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2008).
- Ivascu, A., Kubbies, M. Rapid generation of single-tumor spheroids for high-throughput cell function and toxicity analysis. J Biomol Screen. 11 (8), 922-932 (2006).
- Lovitt, C. J., Shelper, T. B., Avery, V. M. Advanced cell culture techniques for cancer drug discovery. Biology (Basel). 3 (2), 345-367 (2014).
- Bergamaschi, A., et al. Extracellular matrix signature identifies breast cancer subgroups with different clinical outcome. J Pathol. 214 (3), 357-367 (2008).
- Oskarsson, T. Extracellular matrix components in breast cancer progression and metastasis. The Breast. 22, S66-S72 (2013).
- Kelley, L. C., Lohmer, L. L., Hagedorn, E. J., Sherwood, D. R. Traversing the basement membrane in vivo: A diversity of strategies. JBC. 204 (3), 291-301 (2014).
- Sadlonova, A., et al. Breast fibroblasts modulate epithelial cell proliferation in three-dimensional in vitro co-culture. Breast Cancer Res. 4, (2004).
- Wendt, D., Marsano, A., Jakob, M., Heberer, M., Martin, I. Oscillating perfusion of cell suspensions through three-dimensional scaffolds enhances cell seeding efficiency and uniformity. Biotechnol Bioeng. 84 (2), 205-214 (2003).
- Marshall, L. E., et al. Flow-perfusion bioreactor system for engineered breast cancer surrogates to be used in preclinical testing. J Tissue Eng Regen Med. , (2015).
- Calcagnile, P., Fragouli, D., Mele, E., Ruffilli, R., Athanassiou, A. Polymeric foams with functional nanocomposite cells. RSC Adv. 4, 19177-19182 (2014).
- Naba, A., Clauser, K. R., Lamar, J. M., Carr, S. A., Hynes, R. O. Extracellular matrix signatures of human mammary carcinoma identify novel metastasis promoters. eLife. 3, (2014).
- Lochter, A., Bissell, M. J. Involvement of extracellular matrix constituents in breast cancer. Semin Cancer Biol. 6 (3), 165-173 (1995).
- Joiner, K. S., Spangler, E. A. Evaluation of HistoGel-embedded specimens for use in veterinary diagnostic pathology. J Vet Diagn Invest. 24 (4), 710-715 (2012).
- Varsegi, G. M., Shidham, V. Cell Block Preparation from Cytology Specimen with Predominance of Individually Scattered Cells. J Vis Exp. (29), e1316 (2009).
- Sadlonova, A., et al. Human Breast Fibroblasts Inhibit Growth of the MCF10AT Xenograft Model of Proliferative Breast Disease. Am J Pathol. 170 (3), (2007).
- Otali, D., He, Q., Stockard, C. R., Grizzle, W. E. Preservation of immunorecognition by transferring cells from 10% neutral buffered formalin to 70% ethanol. Biotech Histochem. 88, 170-180 (2013).
- Webster, S. S., Jenkins, L., Burg, K. J. L. Histological Techniques for Porous, Absorbable, Polymeric Scaffolds, Used in Tissue Engineering. J Histotechnol. 26 (1), 57-65 (2003).
- Troy, T. -. C., Arabzadeh, A., Enikanolaiye, A., Lariviere, N., Turksen, K. Immunohistochemistry on Paraffin Sections of Mouse Epidermis Using Fluorescent Antibodies. J Vis Exp. (11), (2008).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Kwon, Y. -. J., et al. Gli1 enhances migration and invasion via up-regulation of MMP-11 and promotes metastasis in ERa negative breast cancer cell lines. Clin Exp Metastasis. (28), (2011).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for Immunohistochemistry on Cryosectioned Rat Brain Tissue: Example Staining for Microglia and Neurons. J Vis Exp. (99), e52293 (2015).
- Pal, A., Kleer, C. G. Three dimensional cultures: a tool to study normal acinar architecture vs. malignant transformation of breast cells. J Vis Exp. (86), e51311 (2014).
- Hasselbach, L. A., et al. Optimization of High Grade Glioma Cell Culture from Surgical Specimens for Use in Clinically Relevant Animal Models and 3D Immunochemistry. J Vis Exp. (83), e51088 (2014).
- Foty, R. A Simple Hanging Drop Cell Culture Protocol for Generation of 3D Spheroids. J Vis Exp. (51), e2720 (2011).
- Materne, E. -. M., et al. The Multi-organ Chip - A Microfluidic Platform for Long-term Multi-tissue Coculture. J Vis Exp. (98), e52526 (2015).
- Sadlonova, A., et al. Identification of Molecular Distinctions Between Normal Breast-Associated Fibroblasts and Breast Cancer-Associated Fibroblasts. Cancer Microenviron. 2, 9-21 (2009).
- Wang, J. D., Douville, N. J., Takayama, S., ElSayed, M. Quantitative analysis of molecular absorption into PDMS microfluidic channels. Ann Biomed Eng. 40 (9), 1862-1873 (2012).
- Halldorsson, S., Lucumi, E., Gomez-Sjoberg, R., Fleming, R. M. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosens Bioelectron. 63, 218-231 (2015).
- Regehr, K. J., et al. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab Chip. 9 (15), 2132-2139 (2009).
- Burdett, E., Kasper, F. K., Mikos, A. G., Ludwig, J. A. Engineering tumors: a tissue engineering perspective in cancer biology. Tissue Eng Part B Rev. 16 (3), 351-359 (2010).
- Caruso, R. A., et al. Mechanisms of coagulative necrosis in malignant epithelial tumors (Review). Oncol Lett. 8 (4), 1397-1402 (2014).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicol Pathol. 35 (4), 495-516 (2007).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 146 (1), 3-15 (1995).
- Ogino, S., et al. Molecular pathological epidemiology of epigenetics: emerging integrative science to analyze environment, host, and disease. Mod Pathol. 26 (4), 465-484 (2013).
- Otali, D., et al. Combined effects of formalin fixation and tissue processing on immunorecognition. Biotech Histochem. 84 (5), 223-247 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved