JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
준비 및 분석
요약
We demonstrate a method to generate 3D breast cancer surrogates, which can be cultured using a perfusion bioreactor system to deliver oxygen and nutrients. Following growth, surrogates are fixed and processed to paraffin for evaluation of parameters of interest. The evaluation of one such parameter, cell density, is explained.
초록
삼차원 (3D) 배양 이차원 배양보다 시험 관내에서 세포 행동 모델에 더 중요한 생리 학적 방법이다. 유방 암종을 비롯한 암종, 섬유 아세포 및 세포 외 기질 (ECM)을 포함 경부암 상피 세포 및 간질 성분으로 이루어지는 복잡한 3 차원 조직이다. 그러나 유방암 대부분의 시험 관내 모델에 따라서, 기질을 생략 만 암 상피 세포로 구성하고, 생체 내에서 종양의 3 차원 구조. 암의 적절한 3D 모델링 종양 생물학, 행동 및 치료에 대한 반응의 정확한 이해를 위해 중요하다. 그러나, 문화, 3D 모델의 볼륨의 지속 시간은 문화 내에서 산소와 영양분의 가용성에 의해 제한된다. 여기서, 우리는 유방암 상피 세포 및 섬유 아세포가 간질 기질을 포함하고으로 배양 할 수있는 3D 유방암 대리를 생성 ECM에 포함시키는 방법을 보여고체 차원 구조 또는 산소와 영양분을 제공하기 위해 관류 생물 반응기 시스템을 사용함으로써. 설정 및 초기 성장 기간 후, 대리모는 임상 약물 테스트에 사용될 수있다. 대안 적으로, 대리모의 세포 매트릭스 성분은 생물학적 다양한 질문을 해결하기 위해 변형 될 수있다. 배양 후, 대체물은 고정 관심 파라미터의 평가를위한 임상 유방암 표본의 처리와 유사한 방식으로, 파라핀 처리된다. ImageJ에 CellProfiler 및 이미지 분석 소프트웨어 시스템을 대리의 조직 학적 섹션 현미경에 적용되고, 설명 하나의 파라미터, 본 셀의 밀도 평가 면적당의 유핵 세포 수를 정량화한다. 이것은 시간이 지남에 따라 세포 수의 변화 또는 다양한 성장 조건으로 치료로 인한 세포 수의 변화의 지표로 사용될 수있다.
서문
보다 정확하게 생체 내에서 종양의 구조와 미세 모방 삼차원 (3D) 모델은 배양 세포 및 미세 사이의 복잡한 상호 작용을 해부 후보 치료제의 효능을 시험 할 목적으로 연구에 중요하다. 종양 차원에 영향을 산소 및 영양소 구배 약물 노출 삽입 압력 / 혈류 및 3D 구조 1-4의 균일. 적절한 기질 미세 환경의 존재는 종양 차원 및 영향 셀 ECM 시그널링 및 간질 세포 및 악성 상피 세포 사이의 주변 분비 신호에 기여한다. 종양 차원 및 세포 기능의 미세 환경의 영향은 잘 약물 반응 1,3,5-8을 변경하는 두 요소로 설정됩니다. 또한, 세포 성장 속도론, 신진 대사 속도와 세포 신호는 원숭이 이러한 요소와 함께, 3D로 두 차원 (2D) 문화와 문화 사이에 차이가세포 반응 1,3,8-10을 cting.
시험관 내에서 종양 미세 환경 대리 대표적 ECM 성분 및 간질 세포 집단을 포함하여 변조 될 수있다. 악성 상피 세포는 더 종양 전파 5,6,10-을 억제하기 위해 ECM 및 암 관련 기질 세포에 의해 하나 종양의 진행을 촉진 상승 / 보호 방식으로 또는 억제 방식으로 영향을 받는다. 어느 상황에서, 간질 약물 전달 1,6- 감소 분비 시그널링을 통해 그리고 / 또는 결과적으로 종양 내 삽입 압력을 증가시킴으로써, 치료 반응 및 약물 전달에 영향을 미칠 수있다. 따라서, 전임상 모델에 ECM 및 간질 세포의 추가 차원 배양에서 잘 모델링 될 수 종양의 양태 요점을 되풀이 도울 것이다.
본원 방법은 ECM 성분 및 (S)를 포함하는 미세 recapitulative 통합 유방암 대용을 수립3 차원 볼륨 tromal 세포를 설명한다. 유방암에서 간질 세포 집단은 주로 암 관련 아세포 (CAF)과 간질 ECM 구성되어 주로 라미닌 콜라겐 타입 IV를 포함하는 기저막에서 발견되는 매트릭스 성분의 적은 비율로 콜라겐 타입 I로 구성되는 1,4,11-13. 그러므로, 유방 종양 미세 환경의 이러한 구성 요소 (즉, CAF는 콜라겐 I 및 기저막)는 대리로 통합되었다. 이 방법은 고체 비 - 관류 차원 대리 (도 1A)를 생성하거나 바이오 리액터 (도 1b)을 통해 서로 게이트를 통해 매체의 관류를 포함하도록 구성 될 수 사용될 수있다. 두 가지 접근법은 여기에 설명되어 있습니다. 이 방법은 또한 종양 연관된 대 식세포와 같은 다른 기질 요소를 포함하는, 또는 적절한 셀룰러 및 ECM 성분을 조정함으로써, 고형 종양을 모델링하기 위해 수정 될 수있다.
여기서 설명 우리는 MDA-MB-231 (231) 유방암 세포주, CAF는 이전 인간 유방암 (14)로부터 격리 이용했다 및 ECM은 (90 % 콜라겐 I 이루어지는 6 ㎎ / ㎖) 및 10 %의 성장 인자 감소 된 기저막 재료 (BM). 대리 역시 8 웰 챔버 슬라이드 (고체 대리)에서 성장하거나 바이오 리액터 시스템은 연속 관류 영양소 (관류 대리)를 제공하는데 이용된다. ECM 포함 된 셀의 체적을 수용 할 수있는 관류 생물 반응기 시스템 (15)을 사용할 수있다. 예를 들어, 우리는 바이오 리액터에서 조직 대용의 제조를 설명한다. 이 시스템은 자체 개발 및 상업적으로 사용할 수 없습니다되었다. 우리의 초점은 여기에 3 차원 조직 대용의 준비 및 분석에 있기 때문에, 우리는 우리의 생물 반응기 시스템의 제조 및 조립의 특성에 대한 광범위한 세부 사항으로 사라하지 않았습니다. 그러나, 상세한 설명이 시스템의 개발은 16 게시되었습니다. 본 생물 반응기 시스템에서, 폴리 디메틸 실록산 (PDMS) 유로는 PDMS 발포체 지원하는 대리를 수용하기 위해 사용된다 (Calcagnile 외. (17)에 의해 기재된 것과 유사한 방법을 이용하여 형성됨). 이 볼륨 연속적 대리 산소와 영양분을 공급하는 펌프를 통해 microphysiologic 매체에 의해 관류되는 4 마이크로 채널 (직경 400 μm의 각각)에 의해 관통된다.대용의 적절한 분석은 치료 또는 다른 조작에 응답하여 세포 기능에 대한 관련 정보를 얻기 위해 매우 중요합니다. 대체물은 고정 및 가공 후 분비 된 제품 또는 조직 학적 섹션을 분석을 위해, 공 초점 현미경 또는 비 침습성 영상화의 다른 수단의 조정 배지 또는 관류 액을 분석함으로써 간접적으로 세포 분석을 이용하여 그대로 대용 직접 영상을 포함하는 다양한 방법에 의해 분석 될 수있다 에파라핀. 조직학 부분에 평가 될 수있다 그러한 파라미터는 셀 밀도이다. 우리는 세포 밀도를 측정하는 한 가지 방법을 제시한다 (즉, 단면적 당 유핵 세포의 수) 헤 마톡 실린 및 에오신 (H & E) 염색을 대리 학적 섹션 현미경인가 반자동 화상 처리 기술을 사용. 세포 밀도는 시간에 따른 세포 수의 상대적인 변화의 지표로 사용할 수도 있고, 그 다양한 성장 조건으로 치료의 결과.
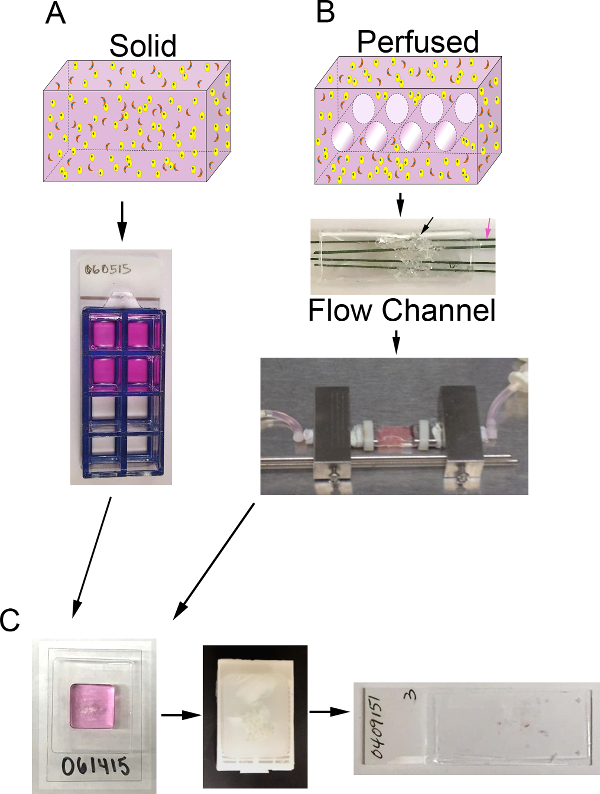
그림 1. 3D 볼륨 및 생물 반응기 시스템. 프로세스 A) 도식은 고체의 3D 대리를 생성합니다. 탑 : ECM (핑크), (노란색) 상피 암 세포 및 CAF (오렌지)를 포함하는 고체 3D 볼륨의 만화; 아래 :. 8 잘 챔버 슬라이드 포함 대리의 상위 뷰 B) 도식 프로세스는 3D 대리를 관류 생성합니다. 탑 : 캘리포니아채널 3D 볼륨의 rtoon 매체 관류 및 포함하는 ECM (핑크), 상피 암 세포 (노란색), 및 CAF (오렌지)을 허용하는 단계; 중간 : 발포 PDMS (흑색 화살표)를 포함 PDMS 유로의 이미지 셀 ECM + 주입 및 직경 400 μm의 측정 중합체 피복 스테인리스 와이어 (핑크 화살표)을 관통하는 단계; 바닥 :. 대리 함유 연속 매체 관류를 허용하는 바이오 리액터 시스템에 연결된 PDMS 유로의 화상 (연동 펌프 및 미디어 저장하지 않음) C) 배양 후의 고체 관류 대용 모두 처리 단계의 이미지. 왼쪽 : 젤 대리를 처리하는 표본을 포함하는 cryomold의 이미지; 중간 : 고정 가공 대리를 함유하는 파라핀 블록의 이미지; 오른쪽 :. 대리의 H & E 염색 조직 학적 섹션 유리 슬라이드의 이미지 을 보려면 여기를 클릭하십시오이 그림의 더 큰 버전.
프로토콜
1. 세포 배양
- 얼음에, 4 ° C에서 하룻밤 BM 구성 요소를 녹여.
- 37 ° C까지 따뜻한 매체. 모두 231 CAF 세포의 성장을 지원하기 위해, 둘 베코 변형 이글 중간 (DMEM)을 더한 10 % 소 태아 혈청 (FBS)을 사용한다.
주 : 사용 된 매체가 셀 유형과 실험 목적에 따라 달라질 것이다. - 근처에 합류 231 세포의 배양 접시 (10cm)에서 매체를 제거하고 1.5 ml의 트립신 / EDTA를 추가합니다. 세포 분리에 대한 모니터링, 37 ℃에서 1 분 3 알을 품다. 세포가 둥글게 플레이트를 나서야 시작하면 배지 함유 혈청을 3 ㎖를 첨가하여 반응을 정지. 15 ML 원뿔 튜브에 매체 및 세포를 피펫.
- 5 분 동안 150 XG에서 매체 세포를 원심 분리기. 상층 액을 제거하고, 2 ml의 배지에서 세포 펠렛을 다시 일시 중지합니다.
- 트리 판 블루와 혈구를 사용하여 볼륨 당 세포의 수를 계산합니다. 세포 생존율은 90 % 이상이어야한다.
- 반복다른 세포 유형의 처리는 대리 포함한다. 여기에 설명 된 대리를 들어, 프로세스는 CAF 반복한다.
- 세포의 수를 획득하기 위해 각각의 세포 현탁액의 적절한 양을 결정한다.
주 : 1 아세포에 상피 세포의 비율 (1.4 × 106 231 세포를 100 μL 당 7 × 105 CAF : 2 여기 기재된 대리, ECM 100 ㎕ 당 2.1 × 106 세포의 세포 밀도를 들어 ECM), 사용됩니다. 이러한 셀 밀도는 좋은 출발점이다; 그러나, 최적의 셀 밀도는 세포 유형, 배양 기간 및 실험의 목적에 따라 달라질 것이다. - 15 ML 원뿔 튜브 (각 세포 유형에 대해 하나의 튜브)로 각각의 세포 현탁액의 적절한 볼륨을 놓습니다. 5 분 동안 150 XG에서 매체 세포를 원심 분리기.
- 원심 분리에 이어, 상층 액을 제거, 셀에 하나의 셀 유형을 다시 중단배양 등급의 물 (pH는 모니터링하는 페놀 레드를 함유하는 표 1 참조, 100 μL) 및 10 배 DMEM에서 다른 세포 유형 (178.8 μL를 표 1 참조). 얼음에 세포를 포함하는 튜브를 놓고 아래 ECM의 준비에 신속하게 진행합니다. 세포가 생존을 유지하기 위해 물에 남아있는 시간을 제한한다.
참고 : ECM의 두 배 DMEM과 세포 배양 등급의 물이 필요한 구성 요소; 따라서, 우리는 모두 다시 중단 세포에 선택했습니다. 두 세포 유형이이 두 가지 구성 요소 중 하나에서 다시 정지 될 수 있지만 여기에 우리가 임의로 세포 배양 등급의 물과 10 배 DMEM에서 CAF에서 다시 정지 231 세포에 선택했다.
ECM에서 세포의 2. 준비 (6 ㎎ / ㎖ 소 콜라겐 타입 I + 10 % BM)
참고 : 90 % 콜라겐으로 구성된 ECM 내가이 악성 종양에서 종양 기질은 주로 콜라겐으로 구성되어 있기 때문에 10 % BM은 침윤성 유방암을 모델링하기 위해 선택되었다 +전자 재료 12,13,18,19의 작은 부분을 포함하는 등 라미닌, 콜라겐 IV, 그리고 entactin와 BM의 구성 요소와 I.
- 얼음에서 2 ML의 microcentrifuge 관으로 순서대로, 표 1의 성분을 추가한다.
4 관류 대용 여기서 설명하는 바이오 리액터 시스템을 사용하여,이 양이 8 고체 대용 충분하거나 참고.
| ECM 셀의 제조 (6 ㎎ / ㎖ 소 콜라겐 타입 I + 10 % BM) | |
| 178.8 μ엘 | 231 세포의 수를 포함하는 세포 배양 등급의 물 (상기 결정) |
| 606 μL | 콜라겐 I (10 ㎎ / ㎖ 소), 드롭에 의해 드롭을 추가 |
| 100 μL | 기저막, 해동 |
| 100 μL | CAF의 원하는 수의 10 배 DMEM (포함 페놀 레드) (위 결정) |
| 15.2 μL | 7.5 % (v / v)의 중탄산 나트륨은 드롭에 의해 드롭을 추가 |
표 ECM에서 세포의 1. 준비.
- 부드럽게 거품의 형성을 회피 피펫 팅하여 혼합한다. 10 배 DMEM에서 빨간색 페놀을 사용하여 ph 수준을 모니터링합니다. 혼합물의 pH ~을 나타내는 오렌지 / 핑크 색상 있는지 확인합니다 (7). pH가 (황색도)이 너무 낮 으면 해당 색상에 도달 할 때까지 천천히 시간 (~ 5 μL)에서 추가로 7.5 % 중탄산 나트륨을 추가 한 방울.
- 얼음 혼합물을 유지하고 조기 ECM 중합을 방지하기 위해 신속하게 작동합니다.
3. 대리 준비
- 고체 3D 문화 (그림 1A)의 경우 :
- 멸균 기법을 사용하여 세포 배양 후드에서 작업 대용 어떤 실험 편차를 나타내는 살균 8 웰 챔버 슬라이드 뚜껑 라벨.
- 얼음에 챔버 슬라이드를 유지하는 것은 천천히, 조기 ECM 중합을 방지 8 잘 챔버 슬라이드의 각 웰에 세포 + ECM 혼합물의 100 μl를 피펫합니다.
참고 : 물론 처음의 가장자리 주위에 세포 + ECM 혼합물을 피펫 팅하면 더 잘에서 셀 + ECM 혼합물을 배포하는 데 도움이됩니다. - ECM 중합 수 있도록 37 ° C, 5 % CO 2 45 분에 대리를 품어.
- ECM 중합 후, 각 웰에 100 ㎕의 배양 배지를 추가하고, 37 ℃에서 배양한다 실험 기간 동안 5 % CO 2,이틀마다 배지를 변경.
- 생물 반응기 시스템 (그림 1B)에서 관류 3D 문화의 경우 :
- 3D 배양 설치 모든 생물 반응기 부품 멸균 (즉, 바이오 리액터에 필요한 설정을위한 생물 반응기, 튜브, 집게, 피팅) 생물 반응기의 특정 프로세스를 사용하여 사용할 수있다.
- 여기 사용 된 예시적인 바이오 리액터 시스템의 경우 (예를 들어, 12 분, 15 분 건조로 121.1 ℃에서 노출)하고, 1 시간 동안 70 % 에탄올에서 항온 오토 클레이브의 조합을 사용한다.
- 준비하고 대리를 수용 할 생물 반응기 시스템의 부분을 조립한다.
- 여기 사용 된 예시적인 바이오 리액터 시스템의 사용 포셉 PDMS의 튜브의 유동 채널로 PDMS 발포 골격을 삽입한다. 병렬 마이크로 채널을 생성하기 위해 PDMS 거품에 사 (400 μm의) 폴리머 코팅 스테인레스 스틸 와이어를 밀어 넣습니다.
- 세포 배양 후드에서 steril를 사용전자 기술과 주사기와 26 게이지 바늘은, 세포를 포함하도록 설계 관류 생물 반응기의 면적에 세포 + ECM 혼합물을 주입. 다음 단계로 신속하게 진행합니다.
- ECM 수 있도록 45 분 동안 37 ℃에서 배양하면서 대용 내의 셀들의보다 균일 한 분포를 보장하기 위해, (세포 배양 후드)을 50 ㎖ 원뿔형 튜브에 대용 하우징 바이오 리액터 구성 요소를 배치 연속적 ~ 18 rpm으로 회전 중합.
주 : 회전은 37 ° C의 오븐에서 설정된 혼성화로 인큐베이터에서 회전하거나 회전 내장과 오븐을 이용하여 완성 될 수있다. - 제조업체의 지침을 사용하여 관류 펌프에 대리를 포함하는 생물 반응기 어셈블리를 연결합니다.
주 :이 프로세스의 세부 사항은 바이오 리액터에 따라 다를 사용되는 펌프 것이다.- 여기 사용 된 예시적인 바이오 리액터 시스템의 경우 biorea 연결하기 전의 스테인리스 와이어 삭제펌프에 ctor에 어셈블리.
- 매체 관류 (167.1 μL / 분의 부피 유동 속도 1 다인 / cm 2의 마이크로 채널 벽 전단 응력)을 시작 37 ℃ 배양기에서 5 % CO 2.
주 : 배지 관류 속도가 조절 될 수 있고, 바이오 리액터 설정 및 목표와 실험 디자인에 따라. - 일주일마다 배양 배지를 변화 실험 기간 동안 매체 관류를 계속한다.
- 3D 배양 설치 모든 생물 반응기 부품 멸균 (즉, 바이오 리액터에 필요한 설정을위한 생물 반응기, 튜브, 집게, 피팅) 생물 반응기의 특정 프로세스를 사용하여 사용할 수있다.
4. 대리 고정 및 처리 (그림 1C)
- 라벨 cryomolds 및 대리 고정 및 처리를위한 플라스틱 조직 카세트.
- 다음으로, 따뜻한 온도에서 액상 수용성 물질이지만, 실온에서 고화 시료 처리 겔에서 대용 넣다. 시편 처리 겔을 처리하는 동안 그대로 대용 유지에 도움과 용이는 조직 학적는 14,20-22을 절편.
- 60 ° C의 물 중탕에서 겔을 처리하는 시료를 사용할 준비가 될 때까지이 온도에서 유지하여 액화 녹아. 바이오 안전성 캐비닛에 대리로 생물 반응기를 이동합니다.
- 피펫은 약 300 μL가 표시 cryomold (그림 1C, 왼쪽 패널)의 하단에 처리 겔 표본.
- 메스 블레이드 (10 호 권장)와 집게를 사용하여 조심스럽게 생물 반응기 또는 8 잘 챔버 슬라이드의 우물에서 대리를 제거하고 젤을 처리 표본을 포함하는 cryomold에 배치합니다.
주 : 조직 마킹 염료 (원료 표시 / 장비 목록 구체적인 예) 다른 색상함으로써 여러 샘플을 식별 가능하게 한 조직 카세트에 포함될 수 있도록 대체물을 표시 할 수있다. - 피펫은 약 300 ㎕의 표본은 cryomold의 대리를 커버하고 solidif 30 분 동안 4 ° C에서 부화 젤 처리와이.
- 시험편 가공 겔 고화되면, cryomold에서 대리를 함유하는 시료 처리 겔을 제거하고, 티슈 카세트 넣.
- 완전 고정 할 수 있도록 실온에서 10 내지 12 시간에 10 % 중성 완충 포르말린에 대리를 함유하는 조직을 배치 카세트.
- 고정 후, 파라핀으로 처리 될 때까지 70 % 에탄올로 대용을 포함하는 조직 카세트를 이동한다.
참고 : 에탄올에 포르말린에서 대리 전송은 어떤 항원 결정기 (23)의 면역가 손실 될 수 있습니다 포르말린으로 오버 고정 방지 할 수 있습니다. 에탄올의 시간 길이는 중요하지 않다. 대리는 면역 조직 화학 염색 또는 면역에 사용되는 경우 정착액의 이러한 변화는 중요하다. 처리 (그림 1C, 중간 패널) 파라핀하는 고정 대리는 이제 준비가 된 것입니다. 이 처리는 일반적으로 appr에 위치한 조직의 프로세서에서 수행opriately 조직학 실험실을 갖추고 있습니다. 더 짧은 프로그램은 크기와 대리의 섬세한 성격으로 인해 권장합니다. (24)
5. 단면 및 H & E 염색 (그림 1C, 오른쪽 패널)
- 파라핀 블록에 대용의 처리는 다음의 섹션들을 포르말린 고정 파라핀 포매 조직 절편 (24, 25)들에 대한 표준 마이크로톰을 사용.
참고 : 제대로 갖추고 경험이 경우는, 자격을 갖춘 조직학 실험실에서 수행, 또는 연구 실험실에서 할 수있다. 조직 학적 부의 두께 부분의 의도 된 용도에 따라 변할 수있다; 그러나, 우리는 일반적으로 두께가 5 μm의 수 있습니다 섹션을 사용합니다. 관류 대용 여기에 사용 된 발포 PDMS 용이 마이크로톰으로 절단된다. - 일반 유리 조직 학적 슬라이드에 섹션을 배치합니다.
- 절편 한 후 염색을 준비하는 10 ~ 12 시간 동안 58 ° C에서 조직 학적 섹션을 구워헤 마톡 실린 및 에오신와 (H & E). 베이킹은 파라핀을 용해 또한 유리 슬라이드에 섹션을 더 잘 준수 할 수 있습니다.
- H & E 염색 :
- 얼룩하는 슬라이드의 수에 따라 코 플린 항아리 또는 유리 염색 요리를 표 2에 설명 된 방송국을 설정합니다. 시약이 설정되면, 24 아래에 표시된 시간 동안 배양 순서대로 각각의 스테이션을 통해 섹션을 이동합니다.
- 설치 미디어를 사용하여 각 슬라이드에 커버 슬립을 탑재합니다.
- 설치 미디어 이미징 전에 건조하도록 허용합니다.
| H & E 염색 | ||
| 역 | 해결책 | 시각 |
| 1 | 크실렌 | 5 분 |
| 이 | 크실렌 | 5 분 |
| 삼 | 크실렌 | 5 분 |
| 4 | 100 % 에탄올 | 5 분 |
| (5) | 100 % 에탄올 | 5 분 |
| 6 | 95 % 에탄올 | 5 분 |
| (7) | 95 % 에탄올 | 5 분 |
| 8 | 수돗물 | 5 분 |
| 9 | 탈 이온수 | 5 분 |
| (10) | 헤 마톡 실린 7211 | 5 분 |
| (11) | 수돗물 | 5 분 |
| (12) | 정화기 * | 10 딥 |
| * 리처드 앨런 번호 (74)01 또는 70 % 에탄올 + 0.5 % HCl | ||
| (13) | 수돗물 | 5 분 |
| (14) | 블루 우잉 시약 | 30 초 |
| (15) | 수돗물 | 5 분 |
| (16) | 95 % 에탄올 | 10 딥 |
| (17) | 에오신-Y | 1 분 |
| (18) | 95 % 에탄올 | 10 딥 |
| (19) | 95 % 에탄올 | 10 딥 |
| (20) | 100 % 에탄올 | 10 딥 |
| (21) | 100 % 에탄올 | 10 딥 |
| (22) | 100 % 에탄올 | 5 분 |
| (23) | 크실렌 | 10 딥 |
| (24) | 크실렌 | 5 분 |
표 2. H & E 염색.
6. 셀 밀도 측정
- .tif 파일로 영상을 저장, 400X 배율 시야 현미경을 이용하여 대용의 이미지 전체를 하나 이상의 H & E 염색 학적 부.
참고 기재된 화상 처리는 컬러 화상을 이용하여 완성되었다. 검증되지 않은 동안, 우리는 동일한 처리는 그레이 스케일 이미지에 적용 할 전망이다. - 모두 국립 보건원 (National Institutes of Health)에서 브로드 연구소 (26) (http://cellprofiler.org/download.shtml)와 ImageJ에 (http://rsb.info.nih.gov/ij/download.html)에서 CellProfiler 다운로드 이는 무료로 공개적으로 사용할 수 있습니다.
- 각 이미지의 대리의 면적을 측정하기 위해, 오픈 ImageJ에는, 선택 "영역"(이하 "분석"탭에서) "측정 설정"을 선택한 후 "좋아요 & #을 선택34 ;.
- 대리의 이미지 (.tif 파일)를 엽니 다. ImageJ에 다각형의 도구를 사용하여 마우스를 드래그 기준점하게 눌러 이미지에서 대용의 영역 개요 (도 2 참조). 가이드로 ECM의 가장자리를 사용합니다. 일단 "분석"탭에서, "측정"을 선택합니다 설명했다.
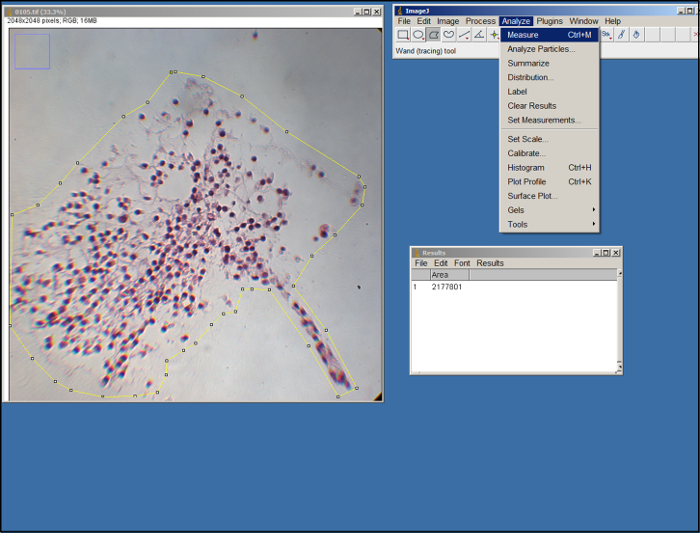
그림 2. ImageJ에 분석. ImageJ에 처리의 스크린 샷. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 조직 대리의 각 이미지에 대해 반복합니다. 스프레드 시트 프로그램으로 측정하고 해당 이미지 식별자를 저장합니다.
- "파일 목록"을 이미지 파일을 드래그하여 CellProfiler로 ImageJ에에서 영역을 측정하는 데 사용되는 이미지 파일을 업로드합니다. 가져온 이미지에 이름을 지정은 "NamesAndTypes"입력 모듈 및 이미지 유형 (즉, "컬러 이미지")를 선택합니다.
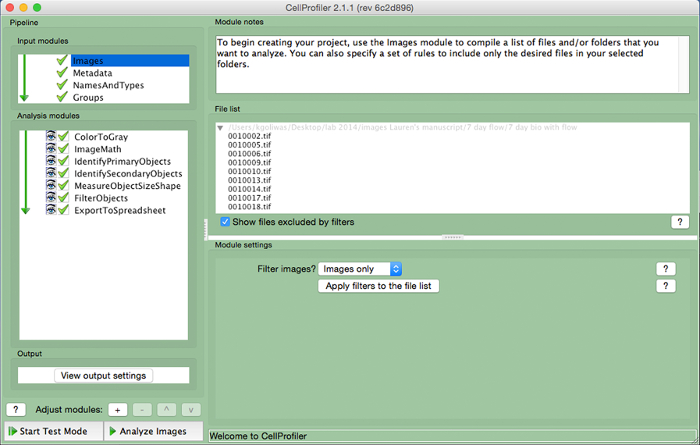
그림 3. CellProfiler 예 파이프 라인. CellProfiler에서 유핵 세포의 수를 측정하기위한 파이프 라인의 스크린 샷. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 다음 (왼쪽 패널의 맨 아래에있는 그림 3) "모듈을 조정"에 "+"기호를 클릭하여 이미지 당 세포의 수를 계산하기 위해 다음과 같은 모듈을 포함하는 분석 파이프 라인을 만듭니다. 아래의 각 모듈을 추가합니다.
- "ColorToGray"(그림 4)를 선택합니다.
- <(드롭 다운 메뉴에서 입력 화상 이름을 선택 출력 이미지의 이름을 상기 원 화상 타입을 선택EM> 즉 RGB) 컬러 화상을 입력하는 경우.
참고 :이 모듈은 필요하지 않을 것입니다 그레이 스케일 이미지를 사용하는 경우
- <(드롭 다운 메뉴에서 입력 화상 이름을 선택 출력 이미지의 이름을 상기 원 화상 타입을 선택EM> 즉 RGB) 컬러 화상을 입력하는 경우.
- "ImageMath"(그림 5)를 선택합니다.
- 의 "반전"작업을 선택 출력 이미지의 이름, 그리고 "첫 번째 이미지를 선택"탭에서 그레이 스케일 이미지를 선택합니다.
- "IdentifyPrimaryObjects"(그림 6)를 선택합니다.
- 선택 입력 화상 (수학 보정 후의 화상)를 식별 할 수있는 기본 객체 (핵) 이름 및 객체를 픽셀 단위로 측정 될 때까지 (약 25 65) 직경 범위를 입력한다. "세 개의 클래스"와 "오츠"임계 방법으로 "적응"임계 전략을 선택합니다. 기본 설정에서 다른 매개 변수를 변경하지 마십시오.
주 : 직경의 최적 범위는 예 (입력 화상 모듈에 이미지를 열고 핵의 직경을 측정하여 결정되어야측정 길이 도구를 사용하여 기본 객체).
- 선택 입력 화상 (수학 보정 후의 화상)를 식별 할 수있는 기본 객체 (핵) 이름 및 객체를 픽셀 단위로 측정 될 때까지 (약 25 65) 직경 범위를 입력한다. "세 개의 클래스"와 "오츠"임계 방법으로 "적응"임계 전략을 선택합니다. 기본 설정에서 다른 매개 변수를 변경하지 마십시오.
- "IdentifySecondaryObjects"(그림 7)을 선택합니다.
- 입력 화상 (수학 보정 후의 화상)을 선택 입력 오브젝트 (핵)를 선택하고, 개체 식별 방법 (셀)의 이름. 보조 객체를 식별 "가중 분산을"최소화 "두 클래스"와 "적응"임계 전략과 "오츠"방법을 사용하는 "전파"방법을 선택합니다. "평활화"1의 임계치 보정 계수를 선택하지 낮추고 0과 1의 상한 0.05의 정규화 인자. 기본 설정에서 다른 매개 변수를 변경하지 마십시오.
- "MeasureObjectSizeShape"(그림 8)을 선택합니다.
- 선택 세포 (보조 대상)와 개체로 핵 (기본 객체)을 측정한다.
- "FilterObjects"(그림 9를 선택 ).
- 출력 개체의 이름을 지정하고 필터링 대상이되는 핵 (기본 객체)을 선택합니다.
- 기본 설정에 따라 다음 두 개의 매개 변수를 유지합니다. 측정과 같은 범주로 필터링 할 수있는 측정과 "AreaShape"및 "폼팩터"를 선택합니다.
- "예"를 선택 최소 측정 값을 사용하여 필터링하고 0.52의 최소 값을 추가 할 수 있습니다.
- "아니오"를 선택 최대 측정을 사용하여 필터링합니다.
- "예"를 선택 필터링 된 객체의 윤곽선을 유지하고 설명 이미지 이름을 지정합니다.
- 선택 "ExportToSpreadsheet"(그림 10)
- 여기서 파일 이름 "출력 파일"을 저장하는 방법을 선택합니다.
- 분석 파이프 라인 (단계 6.7.7.1에 6.7.1)에서 생성 된 후, 최적의 PA를 위해, 테스트 이미지의 핵 적절히 필터링되는지를 포함하여 각 공정에서 CellProfiler "테스트 모드"를 시작하고 평가rameters 11은 핵 정확하게 식별 (녹색 동그라미)되어 필터링, 다음 CellProfiler로부터의 출력 화상을 나타낸 것이다. 세포를 식별하기 위해 선택하고, 배경을 여과한다.
- 매개 변수를 평가하고 충분한 것으로 결정되면, 프로젝트를 저장 한 다음 "이미지 분석"을 클릭합니다. 이 프로젝트는 향후 분석을 위해 반복적으로 사용할 수 있습니다.
참고 : 매개 변수가 설정되고 나면, 프로그램이 순차적으로 "파일 목록"에있는 모든 이미지를 분석하도록 설정되어 있습니다. 이것은 긴 처리 시간을 원인으로 분석 각각의 이미지에 대한 열기 여러 개의 창을 발생합니다.- 긴 처리 시간을 피하기 위해, "분석 모듈"섹션에서 "ExportToSpreadsheet"을 제외한 모든 모듈에 눈 아이콘을 클릭합니다.
- 모든 이미지가 대리 CellProfiler 처리 한 후, 세포에 의해 생성 된 화상 데이터를 포함하는 스프레드 시트를 열고 프로파일 및 ImageJ에 의해 측정 영역을 포함하는 스프레드 시트. 필터링 된 핵 데이터합니다 (CellProfiler 스프레드 시트의 열 D) 및 이미지 식별자 (열 R)를 복사하여 측정 영역 데이터가 포함 된 스프레드 시트에 붙여 넣습니다.
- 대리모의 이미지 당 핵의 수에 대해 획득 된 모든 측정의 합을 계산한다.
- 대리모의 각 이미지에서 서로 게이트 영역에 대해 얻어진 측정 값의 합을 계산한다. 1 × (6)에 의해 측정 된 전체 면적을 나눈다.
- 1 × 6 화소 당이 세포의 수에 대한 값을 얻기 위해 상기 공정에서 전체 면적 측정에 의해 핵의 수를 나눈다.
- "ColorToGray"(그림 4)를 선택합니다.
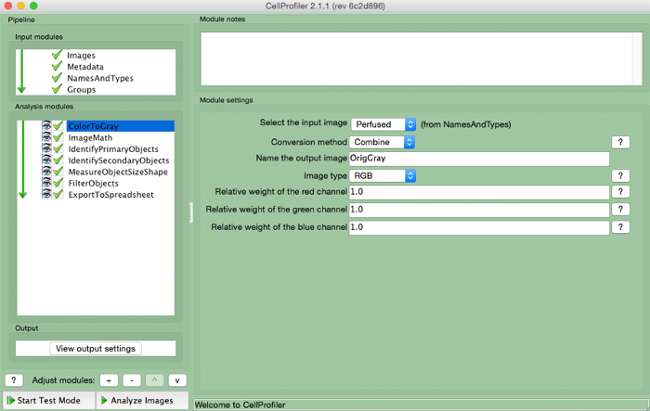
그림 4. CellProfiler 파이프 라인 :. "ColortoGray"모듈의 그레이 스케일 스크린에 이미지를 변경.S : //www.jove.com/files/ftp_upload/54004/54004fig4highres.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 5. CellProfiler 파이프 라인 :.. "ImageMath"모듈의 반전 이미지 스크린 샷 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6. CellProfiler 파이프 라인 :.. "IdentifyPrimaryObjects"모듈의 식별 핵 스크린 샷 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 7. CellProfiler 파이프 라인 :.. "IdentifySecondaryObjects"모듈의 식별 세포 스크린 샷 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 8. CellProfiler 파이프 라인 :.. "MeasureObjectSizeShape"모듈의 측정 개체 스크린 샷 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 9. CellProfiler 파이프 라인 :. F "의 개체를 필터링 스크린 샷ilterObjects "모듈. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 10. CellProfiler 파이프 라인 :.. "ExportToSpreadsheet"모듈의 데이터를 내보내는 스크린 샷 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
필터링 다음 그림 11. CellProfiler 출력. 객체 필터링 다음 셀 프로파일 러의 출력 화면의 스크린 샷. 더 큰 versi을 보려면 여기를 클릭하십시오이 그림의에.
결과
7 일간 상술 한 바와 같이 성장 두 고체 및 관류 3D 유방암 대체물을 제조 하였다. 이어서, 대체물은 고정 된 파라핀 처리, 절단, 전술 한 바와 같이, 헤 마톡 실린 및 에오신으로 염색 하였다. 핵 생성 영역 당 셀 (모두 231 세포 및 CAF) 각각의 대용의 수를 측정 하였다. 도 12에서 알 수있는 바와 같이, H & E 염색 섹션 나타내는 현미경 세포의 농도가 초기에 통합?...
토론
여기서, 3 차원 배양 방법은 더 가깝게 모델 인간 유방암은 recapitulative 차원 형태의 개발을 허용하는 양으로, 세포 외 기질 (ECM) 및 인간 간질 섬유 아세포를 포함하는 조직의 미세 환경의 구성 요소를 포함하고 그 설명되었지만 . 기재된 3D 배양 방법은 ECM의 3 차원 볼륨에 포함되는 여러 종류의 세포의 전통적인 2 차원 세포 배양에 비해 인간의 질병을 더 나타낸다. 이 조직 구조는, 미세 환경, 및 차...
공개
The authors declare that they have no competing financial interests.
감사의 말
The University of Alabama at Birmingham Center for Metabolic Bone Disease performed the histologic processing and sectioning of surrogates. Southern Research (Birmingham, AL) provided support for the manufacture of the bioreactor system. Funding was provided by the United States Department of Defense Breast Cancer Research Program (BC121367).
자료
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagel Medium 1x (DMEM) | Corning CellGro | 10-014-CV | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | |
| 0.25% Trypsin + 2.21 mM EDTA 1x | Corning | 25-053-CI | |
| Tissue Culture plates, 100 mm | CellTreat Scientific Products | 229620 | Sterile |
| Tissue Culture plates, 35 mm | CellTreat Scientific Products | 229638 | For PDMS foam formation |
| 9" Glass pipette | Fisher | 13-678-20D | Sterile |
| 10 ml pipette | CellTreat Scientific Products | 229210B | Sterile |
| 1,000 µl piptette tips | FisherBrand | 02-717-166 | Sterile Filtered |
| 200 µl pipette tips | FisherBrand | 02-717-141 | Sterile Filtered |
| 10 µl pipette tips | FisherBrand | 02-717-158 | Sterile Filtered |
| 15 ml conical tubes | CellTreat Scientific Products | 229410 | Sterile |
| 50 ml conical tubes | CellTreat Scientific Products | 229422 | Sterile |
| 1.5 ml microcentrifuge tubes | FisherBrand | 05-408-129 | Sterile |
| Trypan blue | Corning Cellgro | 25-900-CI | Sterile |
| Sylgard 184 | Electron Microscopy Sciences | 24236-10 | PDMS elastomer and curing agent. Used for our in-house bioreactor. |
| PDMS Foam | Made in-house for use in our in-house bioreactor. | ||
| High Concentration Bovine Collagen Type I | Advanced Biomatrix | 5133-A | FibriCol ~10 mg/ml |
| Growth Factor Reduced Matrigel (Basement Membrane) | Corning | 354230 | Basement membrane material |
| Sodium Bicarbonate | Sigma | S8761 | |
| Molecular Biology Grade Water | Fisher | BP2819-1 | |
| DMEM 10x | Sigma-Aldrich | D2429 | |
| Nunc Lab-Tek Chamber Slide System | Thermo Scientific | 177402 | 8-well |
| Bioreactor | Made in-house. | ||
| Spring-Back 304 Stainless Steel—Coated with PTFE polymer | McMaster-Carr | 1749T19 | Stainless steel wires to generate microchannels in our in-house bioreactor system. 0.016" Diameter |
| BioPharm Plus platinum-cured silicone pump tubing, L/S 14 | Masterflex | EW-96440-14 | For use in our in-house bioreactor system. Tubing ID: 1.6 mm, Hose barb size: 1/16 in. |
| 2-Stop Tubing Sets, non-flared PVC, 1.52 mm ID | Cole-Parmer | EW-74906-36 | For use in our in-house bioreactor system (with microperistalitic pump). |
| Six Channel precision micro peristaltic pump | Cole-Parmer | EW-74906-04 | For use with our in-house bioreactor system |
| Tuberculin Syringes | BD Medical | 309625 | 26 gauge 3/8 in. needle; Sterile |
| Dissecting Tissue Forceps | FisherBrand | 13-812-36 | 5.5 inch |
| Mini Tube Rotator | Boekel Scientific | 260750 | Equipment option for surrogate rotation. Used with carousel for 50 ml tubes (model number 260753) |
| 50 ml tube carousel | Boekel Scientific | 260753 | Used with mini tube rotator |
| Bambino Hybridization Oven | Boekel Scientific | 230301 | Equipment option for surrogate rotation |
| HistoGel Specimen Processing Gel | Thermo Scientific | HG-4000-012 | Specimen Processing Gel described in Step 5.2 |
| Cryomold | Andwin Scientific | 4566 | 15 mm x 15 mm x 5 mm |
| Tissue Marking Dye | Cancer Diagnostics, inc. | 03000P | Can be used to mark surrogates, allowing multiple samples to be included in one tissue cassette |
| Hinged tissue cassettes | FisherBrand | 22-272-416 | |
| Formalin | Fisher | 23-245-685 | |
| GoldSeal Plain Glass Slides | Thermo Scientific | 3048-002 | |
| Xylene | Fisher | X3P-1GAL | |
| Ethanol, 200 proof (100%), USP | Decon Laboratories, Inc. | 2805M | |
| Hematoxylin | Thermo Scientific Richard-Allan Scientific | 7211 | |
| Clarifier | Thermo Scientific Richard-Allan Scientific | 7401 | |
| Bluing Solution | Thermo Scientific Richard-Allan Scientific | 7301 | |
| Eosin Y | Thermo Scientific Richard-Allan Scientific | 7111 | |
| Cytoseal XYL mounting media | Thermo Scientific Richard-Allan Scientific | 83124 | |
| Coverslips | Fisher Scientific | 12-548-5G |
참고문헌
- Hakanson, M., Textor, M., Charnley, M. Engineered 3D environments to elucidate the effect of environmental parameters on drug response in cancer. Integr Biol (Camb). 3 (1), 31-38 (2011).
- Horning, J. L., et al. 3-D tumor model for in vitro evaluation of anticancer drugs. Mol Pharm. 5 (5), 849-862 (2008).
- Dhiman, H. K., Ray, A. R., Panda, A. K. Three-dimensional chitosan scaffold-based MCF-7 cell culture for the determination of the cytotoxicity of tamoxifen. Biomaterials. 26 (9), 979-986 (2005).
- Place, A. E., Jin Huh, S., Polyak, K. The microenvironment in breast cancer progression: biology and implications for treatment. Breast Cancer Res. 13 (6), 227 (2011).
- Mao, Y., Keller, E. T., Garfield, D. H., Shen, K., Wang, J. Stromal cells in tumor microenvironment and breast cancer. Cancer Metastasis Rev. 32 (1-2), 303-315 (2013).
- Paulsson, J., Micke, P. Prognostic relevance of cancer-associated fibroblasts in human cancer. Semin Cancer Biol. 25, 61-68 (2014).
- Roskelley, C. D., Desprez, P. Y., Bissell, M. J. Extracellular matrix-dependent tissue-specific gene expression in mammary epithelial cells requires both physical and biochemical signal transduction. Proc. Natl. Acad. Sci. 91, 12378-12382 (1994).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2008).
- Ivascu, A., Kubbies, M. Rapid generation of single-tumor spheroids for high-throughput cell function and toxicity analysis. J Biomol Screen. 11 (8), 922-932 (2006).
- Lovitt, C. J., Shelper, T. B., Avery, V. M. Advanced cell culture techniques for cancer drug discovery. Biology (Basel). 3 (2), 345-367 (2014).
- Bergamaschi, A., et al. Extracellular matrix signature identifies breast cancer subgroups with different clinical outcome. J Pathol. 214 (3), 357-367 (2008).
- Oskarsson, T. Extracellular matrix components in breast cancer progression and metastasis. The Breast. 22, S66-S72 (2013).
- Kelley, L. C., Lohmer, L. L., Hagedorn, E. J., Sherwood, D. R. Traversing the basement membrane in vivo: A diversity of strategies. JBC. 204 (3), 291-301 (2014).
- Sadlonova, A., et al. Breast fibroblasts modulate epithelial cell proliferation in three-dimensional in vitro co-culture. Breast Cancer Res. 4, (2004).
- Wendt, D., Marsano, A., Jakob, M., Heberer, M., Martin, I. Oscillating perfusion of cell suspensions through three-dimensional scaffolds enhances cell seeding efficiency and uniformity. Biotechnol Bioeng. 84 (2), 205-214 (2003).
- Marshall, L. E., et al. Flow-perfusion bioreactor system for engineered breast cancer surrogates to be used in preclinical testing. J Tissue Eng Regen Med. , (2015).
- Calcagnile, P., Fragouli, D., Mele, E., Ruffilli, R., Athanassiou, A. Polymeric foams with functional nanocomposite cells. RSC Adv. 4, 19177-19182 (2014).
- Naba, A., Clauser, K. R., Lamar, J. M., Carr, S. A., Hynes, R. O. Extracellular matrix signatures of human mammary carcinoma identify novel metastasis promoters. eLife. 3, (2014).
- Lochter, A., Bissell, M. J. Involvement of extracellular matrix constituents in breast cancer. Semin Cancer Biol. 6 (3), 165-173 (1995).
- Joiner, K. S., Spangler, E. A. Evaluation of HistoGel-embedded specimens for use in veterinary diagnostic pathology. J Vet Diagn Invest. 24 (4), 710-715 (2012).
- Varsegi, G. M., Shidham, V. Cell Block Preparation from Cytology Specimen with Predominance of Individually Scattered Cells. J Vis Exp. (29), e1316 (2009).
- Sadlonova, A., et al. Human Breast Fibroblasts Inhibit Growth of the MCF10AT Xenograft Model of Proliferative Breast Disease. Am J Pathol. 170 (3), (2007).
- Otali, D., He, Q., Stockard, C. R., Grizzle, W. E. Preservation of immunorecognition by transferring cells from 10% neutral buffered formalin to 70% ethanol. Biotech Histochem. 88, 170-180 (2013).
- Webster, S. S., Jenkins, L., Burg, K. J. L. Histological Techniques for Porous, Absorbable, Polymeric Scaffolds, Used in Tissue Engineering. J Histotechnol. 26 (1), 57-65 (2003).
- Troy, T. -. C., Arabzadeh, A., Enikanolaiye, A., Lariviere, N., Turksen, K. Immunohistochemistry on Paraffin Sections of Mouse Epidermis Using Fluorescent Antibodies. J Vis Exp. (11), (2008).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Kwon, Y. -. J., et al. Gli1 enhances migration and invasion via up-regulation of MMP-11 and promotes metastasis in ERa negative breast cancer cell lines. Clin Exp Metastasis. (28), (2011).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for Immunohistochemistry on Cryosectioned Rat Brain Tissue: Example Staining for Microglia and Neurons. J Vis Exp. (99), e52293 (2015).
- Pal, A., Kleer, C. G. Three dimensional cultures: a tool to study normal acinar architecture vs. malignant transformation of breast cells. J Vis Exp. (86), e51311 (2014).
- Hasselbach, L. A., et al. Optimization of High Grade Glioma Cell Culture from Surgical Specimens for Use in Clinically Relevant Animal Models and 3D Immunochemistry. J Vis Exp. (83), e51088 (2014).
- Foty, R. A Simple Hanging Drop Cell Culture Protocol for Generation of 3D Spheroids. J Vis Exp. (51), e2720 (2011).
- Materne, E. -. M., et al. The Multi-organ Chip - A Microfluidic Platform for Long-term Multi-tissue Coculture. J Vis Exp. (98), e52526 (2015).
- Sadlonova, A., et al. Identification of Molecular Distinctions Between Normal Breast-Associated Fibroblasts and Breast Cancer-Associated Fibroblasts. Cancer Microenviron. 2, 9-21 (2009).
- Wang, J. D., Douville, N. J., Takayama, S., ElSayed, M. Quantitative analysis of molecular absorption into PDMS microfluidic channels. Ann Biomed Eng. 40 (9), 1862-1873 (2012).
- Halldorsson, S., Lucumi, E., Gomez-Sjoberg, R., Fleming, R. M. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosens Bioelectron. 63, 218-231 (2015).
- Regehr, K. J., et al. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab Chip. 9 (15), 2132-2139 (2009).
- Burdett, E., Kasper, F. K., Mikos, A. G., Ludwig, J. A. Engineering tumors: a tissue engineering perspective in cancer biology. Tissue Eng Part B Rev. 16 (3), 351-359 (2010).
- Caruso, R. A., et al. Mechanisms of coagulative necrosis in malignant epithelial tumors (Review). Oncol Lett. 8 (4), 1397-1402 (2014).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicol Pathol. 35 (4), 495-516 (2007).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 146 (1), 3-15 (1995).
- Ogino, S., et al. Molecular pathological epidemiology of epigenetics: emerging integrative science to analyze environment, host, and disease. Mod Pathol. 26 (4), 465-484 (2013).
- Otali, D., et al. Combined effects of formalin fixation and tissue processing on immunorecognition. Biotech Histochem. 84 (5), 223-247 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유