È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Preparazione e analisi di
In questo articolo
Riepilogo
We demonstrate a method to generate 3D breast cancer surrogates, which can be cultured using a perfusion bioreactor system to deliver oxygen and nutrients. Following growth, surrogates are fixed and processed to paraffin for evaluation of parameters of interest. The evaluation of one such parameter, cell density, is explained.
Abstract
Tridimensionale (3D) cultura è un metodo più fisiologicamente rilevanti per modellare il comportamento delle cellule in vitro di due coltura dimensionale. I carcinomi, tra carcinomi mammari, sono tessuti 3D complessi composti da cellule epiteliali cancro e componenti stromali, tra cui fibroblasti e la matrice extracellulare (ECM). Tuttavia la maggior parte modelli in vitro di carcinoma mammario costituiti solo da cellule epiteliali cancerose, omettendo lo stroma e, di conseguenza, l'architettura 3D di un tumore in vivo. Appropriata modellazione 3D del carcinoma è importante per la comprensione accurata della biologia del tumore, il comportamento e la risposta alla terapia. Tuttavia, la durata della cultura e volume di modelli 3D è limitata dalla disponibilità di ossigeno e nutrienti all'interno della cultura. Qui, dimostriamo un metodo in cui le cellule di carcinoma mammario epiteliali e fibroblasti stromali sono incorporati in ECM per generare un surrogato cancro al seno 3D che include stroma e possono essere coltivate comestruttura 3D solido o utilizzando un sistema di bioreattore perfusione di fornire ossigeno e nutrienti. Dopo l'installazione e un periodo di crescita iniziale, surrogati possono essere utilizzati per il test della droga preclinica. In alternativa, i componenti cellulari e matrice della surrogata possono essere modificati per risolvere una varietà di questioni biologiche. Dopo coltura, surrogati sono fissi ed elaborati per paraffina, in modo simile al trattamento di campioni di carcinoma mammario clinica, per la valutazione dei parametri di interesse. La valutazione di un tale parametro, la densità di cellule presenti, è spiegato, dove sono applicati ai microfotografie di sezioni istologiche di surrogati sistemi software di analisi di immagine ImageJ e CellProfiler di quantificare il numero di cellule nucleate per area. Questo può essere usato come un indicatore della variazione del numero di cellule nel tempo o la variazione del numero di cellule risultanti da diverse condizioni di crescita e trattamenti.
Introduzione
Tridimensionale modelli (3D) cultura che imitano in modo più accurato l'architettura tumorale e microambiente in vivo sono importanti per gli studi volti a sezionare le complesse interazioni tra le cellule e il loro microambiente e per testare l'efficacia delle terapie candidati. Tumore impatti dimensionalità ossigeno e gradienti di nutrienti, l'uniformità di esposizione al farmaco, interstiziale flusso di pressione / del sangue, e l'architettura 3D 1-4. La presenza di un adeguato microambiente stromale contribuisce tumore dimensionalità e influenze segnalazione cellulare-ECM e segnalazione paracrina tra cellule stromali e cellule epiteliali maligne. Gli effetti della dimensionalità tumorale e il microambiente sulla funzione cellulare sono ben stabiliti, con entrambi i fattori che alterano la risposta ai farmaci 1,3,5-8. Inoltre, la cinetica cellulari crescita, tassi metabolici e segnalazione cellulare differiscono tra due dimensioni (2D) la cultura e la cultura in 3D, con questi fattori affecting risposta cellulare 1,3,8-10.
In vitro, il microambiente tumorale surrogata può essere modulata includendo componenti ECM rappresentative e popolazioni di cellule stromali. Cellule epiteliali maligne sono influenzati dalla ECM e cellule stromali cancro-associata sia in modo sinergico / protettivo per promuovere la progressione del tumore o in maniera soppressiva per inibire ulteriormente 5,6,10 tumorale propagazione. In entrambi i contesti, lo stroma può influenzare la risposta terapeutica e somministrazione di farmaci mediante segnali paracrini e / o aumentando la pressione interstiziale nel tumore conseguente diminuzione drug delivery 1,6. Pertanto, l'aggiunta di ECM e cellule stromali in modelli preclinici aiuterà Ricapitolando aspetti del tumore che non può essere modellato bene in coltura 2D.
Qui un metodo per stabilire surrogati del cancro al seno che incorporano un microambiente riepilogativo, tra cui componenti ECM e scellule tromal, in un volume 3D è descritto. Nel carcinoma mammario, la popolazione di cellule stromali è prevalentemente composto di cancro associato fibroblasti (CAF) e l'ECM stromale è in gran parte composto da collagene di tipo I, con una minore percentuale di componenti della matrice che si trovano nella membrana basale, tra cui laminina e collagene di tipo IV 1,4,11-13. Pertanto, questi componenti del microambiente carcinoma della mammella (cioè, CAF, collagene I, e membrana basale) sono stati incorporati nei surrogati. Questo metodo può essere utilizzato per generare solido, surrogati 3D non-perfusi (Figura 1A) o può essere adattato per includere perfusione del mezzo attraverso il surrogato tramite un sistema di bioreattore (Figura 1B). Entrambi gli approcci sono descritte qui. Questo metodo potrebbe anche essere modificato per includere altri elementi stromali, come macrofagi associati al tumore, o per modellare altri tumori solidi regolando i componenti cellulari e ECM, come appropriato.
Per il surrogato carcinoma mammario qui descritto, abbiamo utilizzato la MDA-MB-231 (231) la linea del seno delle cellule del cancro, CAF precedentemente isolato da carcinoma mammario umano 14, e un ECM composto da 90% di collagene I ( fattore di crescita materiale 6 mg / ml) e 10% ridotta membrana basale (BM). Il surrogata o è coltivato in 8 pozzetti slitta camera (surrogato solido) oppure un sistema bioreattore viene utilizzato per fornire perfusione continue dei nutrienti (surrogato perfuso). Qualsiasi sistema di perfusione bioreattore che può ospitare un volume di cellule ECM contenente può essere utilizzato 15. A titolo di esempio, si descrive la preparazione dei surrogati dei tessuti nel nostro sistema bioreattore. Questo sistema è stato sviluppato internamente e non è disponibile in commercio. Perché la nostra attenzione è rivolta alla preparazione e l'analisi dei surrogati del tessuto 3D, non siamo andati in ampio dettaglio per quanto riguarda le specifiche di fabbricazione e montaggio del nostro sistema bioreattore. Tuttavia, una descrizione dettagliata diquesto sistema e il suo sviluppo è stato pubblicato 16. In questo sistema bioreattore, un canale di flusso polidimetilsilossano (PDMS) viene utilizzato per ospitare il surrogato, che è supportato da una schiuma PDMS (formato usando metodi simili a quelli descritti da Calcagnile et al. 17). Questo volume è penetrato da 4 microcanali (ogni 400 micron di diametro) che vengono continuamente perfusi da media tramite una pompa microphysiologic per la fornitura di ossigeno e sostanze nutritive per la surrogata.analisi appropriata dei surrogati è fondamentale per ottenere informazioni pertinenti per quanto riguarda la funzione cellulare in risposta al trattamento o di altre manipolazioni. Surrogati possono essere analizzati con vari metodi tra cui l'imaging diretto di surrogati intatte usando la microscopia confocale o altri mezzi di imaging non invasiva, analisi cellulare indiretta analizzando i media condizionata, o perfusato, per i prodotti secreti, o analisi su sezioni istologiche dopo la fissazione e di trasformazione aparaffina. Una tale parametro che può essere valutata su sezioni istologiche è densità cellulare. Presentiamo un metodo per misurare la densità delle cellule (cioè, il numero di cellule nucleate per area sezione) utilizzando tecniche di elaborazione di immagini semi-automatizzato applicati alle microfotografie di sezioni istologiche surrogati colorate con ematossilina ed eosina (H & E). La densità cellulare può essere utilizzato come indicatore della variazione relativa del numero di cellule nel tempo o risultante da diverse condizioni di crescita e trattamenti.
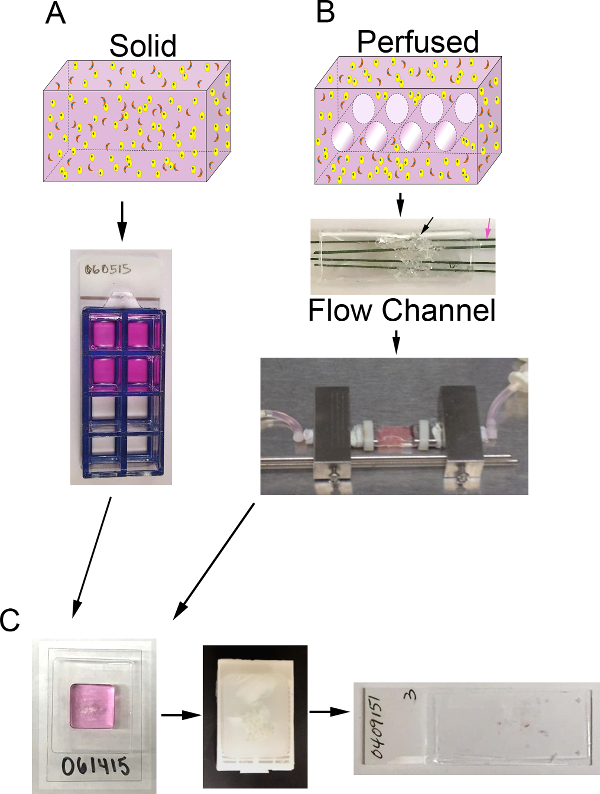
Figura volume 1. 3D e sistema di bioreattore. A) Schema del processo di generare surrogati 3D solidi. Top: cartone animato di volume di solido 3D contenente ECM (rosa), cellule di carcinoma epiteliali (di colore giallo), e CAF (arancione); In basso:. Vista dall'alto di 8 pozzetti scivolo camera contenente surrogati B) Schema del processo per generare perfuso surrogati 3D. Top: cartoon di volume 3D con canali per consentire mezzo di perfusione e contenente ECM (rosa), cellule di carcinoma epiteliali (giallo), e CAF (arancione); Al centro: immagine di canale di flusso PDMS contenente PDMS schiuma (freccia nera) da iniettare con cella + ECM e penetrato da fili di acciaio inossidabile con rivestimento polimerico (freccia rosa), di 400 micron di diametro; In basso:. Immagine del canale di flusso PDMS contenente un surrogato e collegato al sistema di bioreattore per consentire continuo perfusione media (pompa peristaltica e serbatoio media non mostrato) C) Immagini di fasi di lavorazione per entrambi surrogati solidi e perfusi dopo coltura. A sinistra: immagine del cryomold contenente campioni di elaborazione gel e surrogati; Al centro: immagine di un blocco di paraffina contenente un surrogato fisso ed elaborati; A destra:. Immagine di un vetrino con una sezione istologica H & E-macchiato di un surrogato Cliccate qui per visualizzare ungrande versione di questa figura.
Protocollo
Cultura 1. cellulare
- Scongelare componente BM notte a 4 ° C, sul ghiaccio.
- medio caldo a 37 ° C. Per sostenere la crescita di entrambe le 231 celle e CAF, utilizzare Dulbecco Modified Eagle Medium (DMEM) più siero fetale bovino al 10% (FBS).
Nota: I mezzi utilizzati dipenderanno dal tipo di cellula e gli obiettivi sperimentali. - Rimuovere media dalla capsula di Petri (10 cm) di cellule confluenti vicino a 231 e aggiungere 1,5 ml tripsina / EDTA. Incubare per 1 a 3 min a 37 ° C, il monitoraggio di distacco cellulare. Una volta che le cellule cominciano per arrotondare e prende il piatto, arrestare la reazione con l'aggiunta di 3 ml di medium contenente siero. Pipettare il mezzo e le cellule in una provetta conica da 15 ml.
- Centrifugare medio e cellule a 150 xg per 5 min. Rimuovere il surnatante e risospendere il pellet cellulare in 2 ml di mezzo.
- Contare il numero di cellule per volume utilizzando trypan blu e un emocitometro. La vitalità cellulare deve essere superiore al 90%.
- ripetere laprocesso, con altri tipi cellulari da includere nel surrogata. Per il surrogato qui descritto, il processo viene ripetuto con la CAF.
- Determinare il volume appropriato di ciascuna sospensione cellulare per ottenere il numero desiderato di cellule.
Nota: Per il surrogato qui descritto, una densità cellulare di 2,1 x 10 6 cellule per 100 ml di ECM, con un rapporto di 2: 1 di cellule epiteliali di fibroblasti (1,4 x 10 6 231 cellule e 7 x 10 5 CAF per 100 microlitri ECM), viene utilizzato. Questa densità cellulare è un buon punto di partenza; Tuttavia, la densità cellulare ottimale dipenderà dal tipo di cellula, la durata della cultura, e gli obiettivi dell'esperimento. - Posizionare il volume appropriato di ciascuna sospensione cellulare in un tubo da 15 ml (un tubo per ogni tipo di cellula). Centrifugare medio e cellule a 150 xg per 5 min.
- Dopo la centrifugazione, rimuovere il surnatante, risospendere un tipo di cellula in cellulaacqua cultura grade (178,8 ml, vedi Tabella 1) e l'altro tipo di cellula 10x DMEM (100 microlitri, vedi Tabella 1, contenente rosso fenolo per monitorare pH). Collocare le provette contenenti le cellule in ghiaccio e procedere rapidamente alla preparazione di ECM sotto. Limitare il tempo che le cellule rimangono in acqua per preservare la vitalità.
Nota: I due componenti 10x DMEM e l'acqua delle cellule cultura di grado sono richiesti della ECM; Pertanto, abbiamo scelto di ri-sospendere le cellule in entrambi. Qui abbiamo arbitrariamente scelto di ri-sospendere le 231 cellule in acqua di grado coltura cellulare e CAF a 10x DMEM, anche se entrambi i tipi di cellule potrebbero essere nuovamente sospeso in uno di questi due componenti.
2. Preparazione di cellule in ECM (6 mg / ml bovino collagene di tipo I + 10% BM)
Nota: Un ECM composto da 90% di collagene I + 10% BM è stato scelto per modellare il carcinoma mammario invasivo in quanto lo stroma del tumore in questa neoplasia è composto principalmente da collageneI componenti del BM, come laminina, collagene IV e entactina, comprendente una porzione più piccola della ECM 12,13,18,19.
- Il ghiaccio, aggiungere componenti elencati nella Tabella 1, in ordine, in una provetta 2 ml.
Nota: Questa quantità è sufficiente per 8 surrogati solidi o, utilizzando il sistema di bioreattore qui descritto, 4 surrogati perfusi.
| Preparazione delle cellule in ECM (6 mg / ml collagene bovino di tipo I + 10% BM) | |
| 178,8 μl | acqua di grado coltura cellulare contenente il numero desiderato di 231 cellule (sopra determinato) |
| 606 ml | Collagene I (10 mg / ml bovina), aggiungere goccia a goccia |
| 100 pl | Membrana basale, scongelati |
| 100 pl | 10x DMEM (contenente rosso fenolo) con il numero desiderato di CAF (sopra determinato) |
| 15.2 ml | 7,5% (v / v) di bicarbonato di sodio, aggiungere goccia a goccia |
Tabella 1. Preparazione delle cellule in ECM.
- Mescolare delicatamente pipettando, evitando la formazione di bolle. Monitorare il livello di pH utilizzando il rosso fenolo nella 10X DMEM. Verificare che la miscela è un colore arancione / rosa indica un pH di ~ 7. Se il pH è troppo bassa (troppo gialla), aggiungere lentamente ulteriore 7,5% bicarbonato di sodio una goccia alla volta (~ 5 microlitri) fino a raggiungere il colore appropriato.
- Mantenere la miscela su ghiaccio e lavorare velocemente per impedire la polimerizzazione prematura ECM.
3. Preparazione Surrogate
- Per culture solido 3D (Figura 1A):
- Lavorando in una cappa di coltura cellulare con tecnica sterile, etichettare il coperchio di una sterile slitta camera 8 pozzetti per indicare ogni variazione sperimentale surrogati.
- Mantenendo la diapositiva alloggiamento su ghiaccio per prevenire prematura polimerizzazione ECM, lentamente pipetta 100 microlitri della miscela di cellule + ECM in ciascun pozzetto della slitta camera 8 pozzetti.
Nota: pipettaggio la miscela di cellule + ECM intorno ai bordi del pozzo prima aiuta a meglio distribuire la miscela di cellule + ECM nel pozzo. - Incubare surrogati a 37 ° C, 5% CO 2 per 45 min per permettere ECM polimerizzazione.
- Dopo ECM polimerizzazione, aggiungere 100 microlitri terreni di coltura a ciascun pozzetto e incubare a 37 ° C, 5% CO 2 per tutta la durata dell'esperimento,cambiando terreno di coltura ogni due giorni.
- Per colture 3D perfusi in un sistema di bioreattore (Figura 1B):
- Sterilizzare tutti i componenti bioreattori per la configurazione cultura 3D (vale a dire, bioreattori, tubi, pinza e raccordi necessari per il setup bioreattore) utilizzando il processo specifico per il bioreattore da utilizzare.
- Ad esempio il sistema di bioreattore utilizzato qui, utilizzare una combinazione di autoclave (per esempio, 12 minuti di esposizione a 121,1 ° C con 15 min asciugatura) e incubando in etanolo al 70% per 1 ora.
- Preparare e assemblare la parte del sistema di bioreattore che ospiterà il surrogato.
- Per il sistema di esempio bioreattore utilizzato qui, inserire una spina dorsale in schiuma PDMS nel canale di flusso di PDMS tubo utilizzando una pinza. Spingere quattro (400 micron) fili di acciaio inossidabile con rivestimento polimerico nella schiuma PDMS per generare microcanali paralleli.
- In una cappa di coltura cellulare, utilizzando sterile tecnica e un ago calibro 26 con siringa, iniettare la miscela di cellule + ECM nella zona del bioreattore perfusione destinato a contenere cellule. Procedere rapidamente alla fase successiva.
- Per garantire una più uniforme distribuzione delle cellule all'interno surrogati, posizionare il componente bioreattore che ospita i surrogati in una provetta conica da 50 ml (sotto il cofano coltura cellulare) e continuamente ruotare a ~ 18 rpm mentre incubazione a 37 ° C per 45 minuti per consentire ECM polimerizzazione.
Nota: La rotazione può essere completato con un rotatore nell'incubatrice o un forno con un costruito in rotatore, quale un forno di ibridazione a 37 ° C. - Collegare il gruppo bioreattore contenente il surrogato alla pompa di perfusione utilizzando le istruzioni del produttore.
Nota: Le specifiche di questo processo varieranno a seconda del bioreattore e pompa in uso.- Per il sistema di esempio bioreattore utilizzato qui, rimuovere i cavi di acciaio inox prima di collegare il bioreaassemblaggio ctor alla pompa.
- Avviare perfusione media (portata di massa di 167,1 ml / min; microcanali parete shear stress di 1 dyne / cm 2) in un incubatore a 37 ° C, 5% CO 2.
Nota: Il tasso di mezzo di perfusione può essere regolata, a seconda della configurazione bioreattore e gli obiettivi e il disegno sperimentale. - Continuare mezzo di perfusione per la durata dell'esperimento, cambiando terreno di coltura ogni sette giorni.
- Sterilizzare tutti i componenti bioreattori per la configurazione cultura 3D (vale a dire, bioreattori, tubi, pinza e raccordi necessari per il setup bioreattore) utilizzando il processo specifico per il bioreattore da utilizzare.
4. Surrogate Fissazione e Processing (Figura 1C)
- cryomolds Label e cassette di tessuto in plastica per il fissaggio e l'elaborazione surrogata.
- Successivamente, surrogati Encase in gel trattamento dei campioni, che è un materiale acquoso che è liquido a temperature calde, ma solidifica a temperatura ambiente. Gli assist gel trattamento dei campioni nel mantenere i surrogati intatti durante la lavorazione e facilita istologico sezionamento 14,20-22.
- Melt esemplare elaborazione gel in un bagno d'acqua a 60 ° C per liquefare, mantenendo a questa temperatura fino al momento dell'uso. Spostare il bioreattore con il surrogato di un armadio biosicurezza.
- Pipettare circa 300 microlitri specimen gel trasformazione in fondo alla cryomold marcato (Figura 1C, pannello di sinistra).
- Utilizzando una lama di bisturi (n ° 10 preferito) e una pinza rimuovere con attenzione il surrogato dal bioreattore o dal pozzo di una sagoma camera 8-bene e posizionarlo nella cryomold contenente campioni di elaborazione gel.
Nota: marcatura tessuto coloranti (vedi Materiali / Equipment Elenco per un esempio specifico) di diversi colori può essere usato per marcare surrogati, consentendo campioni multipli da inserire in una cassetta tessuto in modo distinguibile. - Pipettare circa 300 campioni microlitri elaborazione gel per coprire il surrogato nel cryomold e incubare a 4 ° C per 30 min a solidify.
- Una volta che il gel trattamento dei campioni si è solidificato, rimuovere il gel di elaborazione campione contenente il surrogato dal cryomold, e metterlo in una cassetta di tessuto.
- Posizionare la cassetta tessuto contenente il surrogato in 10% formalina tamponata neutra per 10 a 12 ore a temperatura ambiente per consentire fissaggio completo.
- A seguito di fissaggio, spostare la cassetta tessuto contenente il surrogato al 70% di etanolo fino elaborati per paraffina.
Nota: Trasferimento del surrogata da formalina all'etanolo impedisce un eccesso di fissazione con formalina, che può causare la perdita di immunoreattività di alcuni epitopi 23. Il periodo di tempo in etanolo non è critica. Questo cambiamento di fissativo è importante se la surrogata sarà utilizzato per immunoistochimica o immunofluorescenza. Il surrogato fisso è ora pronto per l'elaborazione di paraffina (Figura 1C, pannello centrale). Questa elaborazione viene in genere eseguito in un processore tessuto situato in un appropriately attrezzato laboratorio di istologia. Un programma più breve è raccomandato a causa delle dimensioni e della delicatezza dei surrogati. 24
5. Sezioni e colorazione H & E (Figura 1C, pannello di destra)
- Dopo l'elaborazione dei surrogati ad un blocco di paraffina, sezione utilizzando un microtomo standard per il sezionamento di, inclusi in paraffina tessuti fissati in formalina 24,25.
Nota: Questo può essere eseguito in un laboratorio di istologia qualificato, o in un laboratorio di ricerca, se adeguatamente attrezzata ed esperto. Lo spessore delle sezioni istologiche può variare a seconda della destinazione delle sezioni; tuttavia, di solito utilizziamo sezioni che sono 5 micron di spessore. La schiuma PDMS qui utilizzato nei surrogati perfusione è facilmente sezionato con un microtomo. - Posizionare sezioni su semplici diapositive di vetro istologici.
- Dopo il sezionamento, cuocere le sezioni istologiche a 58 ° C per 10-12 ore per prepararsi per la colorazionecon ematossilina e eosina (H & E). Cottura scioglie la paraffina e consente inoltre una maggiore aderenza delle sezioni al vetrino.
- Colorazione H & E:
- Impostare le stazioni descritte nella Tabella 2 in Coplin o piatti di vetro di colorazione, a seconda del numero di vetrini per macchiare. Una volta che i reagenti sono costituite, spostare sezioni attraverso ogni stazione, in ordine, incubando per il tempo indicato di seguito 24.
- Montare un vetrino per ogni diapositiva utilizzando un supporto di montaggio.
- Consentire supporti di montaggio per asciugare prima di imaging.
| Colorazione H & E | ||
| Stazione | Soluzione | Tempo |
| 1 | xilene | 5 minuti |
| 2 | xilene | 5 min |
| 3 | xilene | 5 minuti |
| 4 | 100% di etanolo | 5 minuti |
| 5 | 100% di etanolo | 5 minuti |
| 6 | 95% etanolo | 5 minuti |
| 7 | 95% etanolo | 5 minuti |
| 8 | Acqua di rubinetto | 5 minuti |
| 9 | Acqua deionizzata | 5 minuti |
| 10 | Hematoxylin 7211 | 5 minuti |
| 11 | Acqua di rubinetto | 5 minuti |
| 12 | chiarificatore * | 10 tuffi |
| * Richard Allan # 7401 o 70% di etanolo + 0,5% HCl | ||
| 13 | Acqua di rubinetto | 5 minuti |
| 14 | brunitura reagente | 30 sec |
| 15 | Acqua di rubinetto | 5 minuti |
| 16 | 95% etanolo | 10 tuffi |
| 17 | Eosina-Y | 1 minuto |
| 18 | 95% etanolo | 10 tuffi |
| 19 | 95% etanolo | 10 tuffi |
| 20 | 100% di etanolo | 10 tuffi |
| 21 | 100% di etanolo | 10 tuffi |
| 22 | 100% di etanolo | 5 minuti |
| 23 | xilene | 10 tuffi |
| 24 | xilene | 5 minuti |
Tabella 2. colorazione H & E.
6. Cella di misura della densità
- Immagine almeno una intera sezione istologica macchiato H & E della surrogata usando la microscopia in campo chiaro a 400X ingrandimento, salvare le immagini come file .tif.
Nota: L'elaborazione delle immagini descritto è stato completato solo utilizzando immagini a colori. Mentre non testati, riteniamo che lo stesso trattamento dovrebbe essere applicabile anche alle immagini in scala di grigi. - Scarica CellProfiler dal Broad Institute 26 (http://cellprofiler.org/download.shtml) e ImageJ dal National Institutes of Health (http://rsb.info.nih.gov/ij/download.html), entrambi che sono pubblicamente disponibili senza alcun costo.
- Per misurare l'area della surrogata in ogni immagine, aperto ImageJ, selezionare "Imposta Misure" (nella scheda "Analizza"), selezionare "Area", quindi selezionare "OK & #34 ;.
- Aprire un'immagine (file .tif) della surrogata. Utilizzando lo strumento poligono nel ImageJ (vedi figura 2), delineano l'area del surrogato nell'immagine trascinando il mouse e fare clic per fare punti di ancoraggio. Utilizzare i bordi della ECM come guida. Una volta delineato, selezionare "Measure" nella scheda "Analizza".
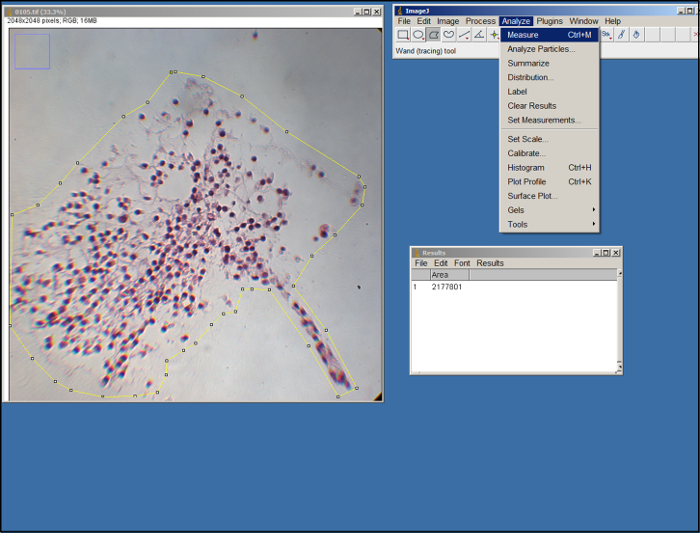
Figura 2. Analisi ImageJ. Schermata di elaborazione ImageJ. Cliccate qui per vedere una versione più grande di questa figura.
- Ripetere per ogni immagine della surrogata tessuti. Salvare le misure e gli identificatori di immagine corrispondente ad un foglio di calcolo.
- Carica file di immagine utilizzati per misurare la zona in ImageJ in CellProfiler trascinando i file di immagine per la "Lista File". Assegnare un nome alle immagini importate inil modulo di ingresso "NamesAndTypes" e selezionare il tipo di immagine (ad esempio, "Immagine a colori").
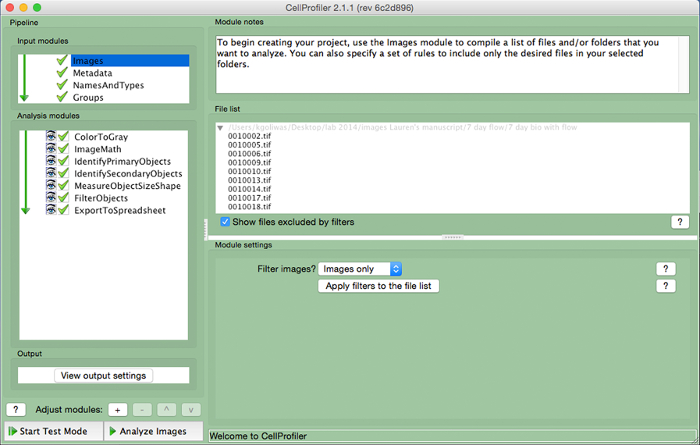
Figura 3. CellProfiler esempio gasdotto. Schermata del gasdotto progettato per misurare il numero di cellule nucleate in CellProfiler. Cliccate qui per vedere una versione più grande di questa figura.
- Creare una pipeline di analisi che include i seguenti moduli per calcolare il numero di cellule per immagine, facendo clic sul segno "+" accanto a "Regolare Module" (Figura 3, nella parte inferiore del pannello di sinistra). Aggiungere ciascuno dei moduli sottostanti.
- Selezionare "ColorToGray" (Figura 4).
- Selezionare il nome dell'immagine in ingresso dal menu a discesa, nome l'immagine di output, e selezionare il tipo di immagine originale ( vale a dire, se l'ingresso RGB immagine a colori).
Nota: non sarebbe necessario Questo modulo se si utilizza le immagini in scala di grigi
- Selezionare il nome dell'immagine in ingresso dal menu a discesa, nome l'immagine di output, e selezionare il tipo di immagine originale ( vale a dire, se l'ingresso RGB immagine a colori).
- Selezionare "ImageMath" (Figura 5).
- Selezionare l'operazione "Inverti", nome l'immagine di output, e selezionare l'immagine in scala di grigi nella scheda "select prima immagine".
- Seleziona "IdentifyPrimaryObjects" (Figura 6).
- immagine in ingresso Select (immagine dopo la correzione per la matematica), il nome l'oggetto primario da identificare (nuclei), e inserire la gamma di diametri per gli oggetti da misurare in unità pixel (circa 25 a 65). Selezionare strategia di soglia "adattiva" con il metodo della soglia "Otsu" con "tre classi". Non modificare altri parametri delle impostazioni di default.
Nota: Il campo ottimale di diametri dovrebbe essere determinato aprendo un'immagine nel modulo di immagine di ingresso e misurando il diametro di nuclei (cioè,l'oggetto primario) utilizzando lo strumento di misura di lunghezza.
- immagine in ingresso Select (immagine dopo la correzione per la matematica), il nome l'oggetto primario da identificare (nuclei), e inserire la gamma di diametri per gli oggetti da misurare in unità pixel (circa 25 a 65). Selezionare strategia di soglia "adattiva" con il metodo della soglia "Otsu" con "tre classi". Non modificare altri parametri delle impostazioni di default.
- Seleziona "IdentifySecondaryObjects" (Figura 7).
- Selezionare l'immagine in ingresso (immagine dopo la correzione per la matematica), selezionare gli oggetti in ingresso (nuclei), e il nome gli oggetti da identificare (cellule). Scegliere il metodo di "propagazione" per identificare gli oggetti secondari, utilizzare la strategia di "adaptive" soglia e il metodo "Otsu" con "due classi" minimizzazione "varianza ponderata". Selezionare "No lisciatura" e un fattore di correzione soglia di 1, limiti inferiore e superiore di 0 e 1, e un fattore di regolarizzazione di 0,05. Non modificare altri parametri delle impostazioni di default.
- Selezionare "MeasureObjectSizeShape" (Figura 8).
- Selezionare le celle (oggetto secondario) e nuclei (oggetto primario) come gli oggetti da misurare.
- Seleziona "FilterObjects" (Figura 9 ).
- Nome gli oggetti di output e selezionare i nuclei (oggetto primario) come l'oggetto da filtrare.
- Mantenere i due parametri successivi come per le impostazioni di default. Selezionare "areashape", come la misurazione per filtrare per categoria, e "form factor", come la misurazione.
- Selezionare "Sì" per filtrare con un valore minimo di misura e aggiungere un valore minimo di 0,52.
- Selezionare "No" per filtrare con un massimo di misurazione.
- Selezionare "Sì" per mantenere i contorni di oggetti filtrati e il nome l'immagine delineata.
- Selezionare "ExportToSpreadsheet" (Figura 10)
- Selezionare dove salvare il file e il nome "file di output".
- Dopo la pipeline di analisi viene generato (passaggi 6.7.1 a 6.7.7.1), avviare "Test Mode" in CellProfiler e valutare ogni passo, compreso che i nuclei l'immagine di prova in sono opportunamente filtrati, per garantire la pa ottimalerametri sono stati scelti per identificare le cellule. La figura 11 mostra un immagine in uscita da CellProfiler dopo il filtraggio, in cui nuclei sono correttamente identificati (cerchiato in verde), e lo sfondo viene filtrato.
- Quando i parametri sono valutati e decisi a essere sufficiente, salvare il progetto e quindi fare clic su "analizzare le immagini". Questo progetto può essere utilizzato più volte per le analisi future.
Nota: Una volta che i parametri sono stati stabiliti, il programma è impostato per analizzare tutte le immagini nella "File List", in modo sequenziale. Questo si tradurrà in più finestre di apertura per ogni immagine analizzato, che causa un tempo di lavorazione maggiore.- Per evitare un tempo di elaborazione più lungo, fare clic sull'icona occhio su tutti i moduli tranne "ExportToSpreadsheet" nella sezione "moduli di analisi".
- Una volta che tutte le immagini surrogate sono stati elaborati da CellProfiler, aprire il foglio che contiene i dati di immagine generati dal cellulare Profiler e il foglio di calcolo che contiene l'area misurata con ImageJ. Copiare i dati filtrati nuclei (colonna D nel foglio di calcolo CellProfiler) e gli identificatori di immagine (colonna R) e incollarli nel foglio di calcolo contenente i dati area misurata.
- Calcolare la somma di tutte le misure ottenute per il numero di nuclei per immagine della surrogata.
- Calcolare la somma delle misure ottenute per zona surrogata da ciascuna immagine della surrogata. Dividere la superficie totale misurato da 1x10 6.
- Dividere il numero totale di nuclei per la misura dell'area totale nel passaggio sopra per ottenere un valore per il numero di cellule per 1x10 6 pixel 2.
- Selezionare "ColorToGray" (Figura 4).
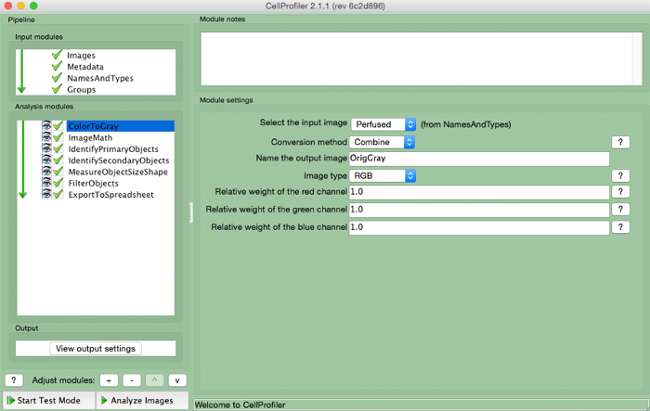
Figura 4. CellProfiler gasdotto: cambiare l'immagine in scala di grigi Schermata di modulo "ColortoGray"..s: //www.jove.com/files/ftp_upload/54004/54004fig4highres.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
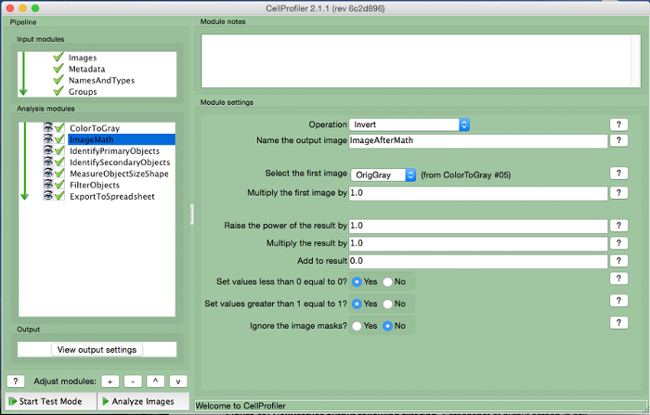
Figura 5. CellProfiler gasdotto:.. Immagine invertendo Schermata di modulo "ImageMath" Si prega di cliccare qui per vedere una versione più grande di questa figura.

Figura 6. CellProfiler gasdotto:.. Nuclei identificativi Schermata di modulo "IdentifyPrimaryObjects" Si prega di cliccare qui per vedere una versione più grande di questa figura.
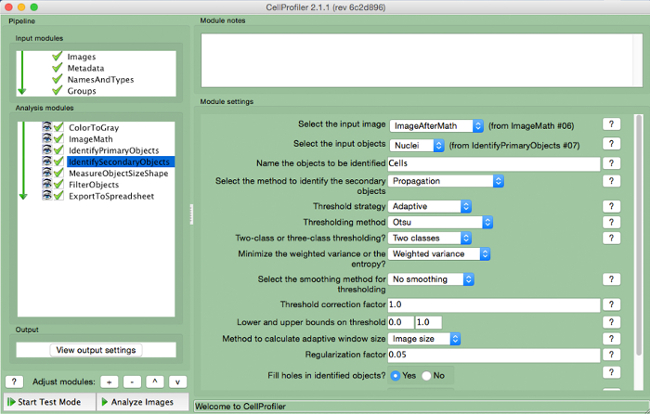
Figura 7. CellProfiler gasdotto:.. Le cellule che identificano Schermata di modulo "IdentifySecondaryObjects" Si prega di cliccare qui per vedere una versione più grande di questa figura.
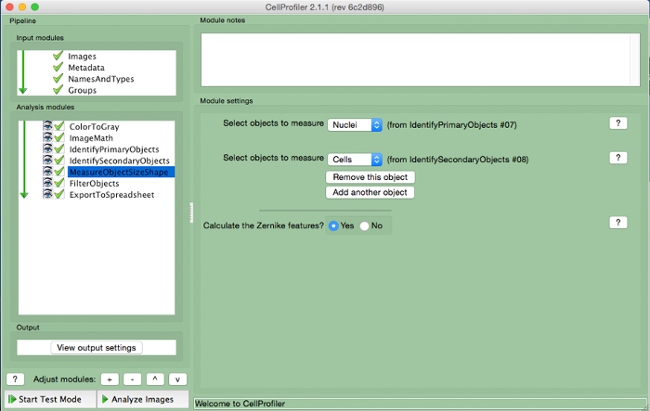
Figura 8. CellProfiler gasdotto:.. Oggetti di misurazione Schermata di modulo "MeasureObjectSizeShape" Si prega di cliccare qui per vedere una versione più grande di questa figura.
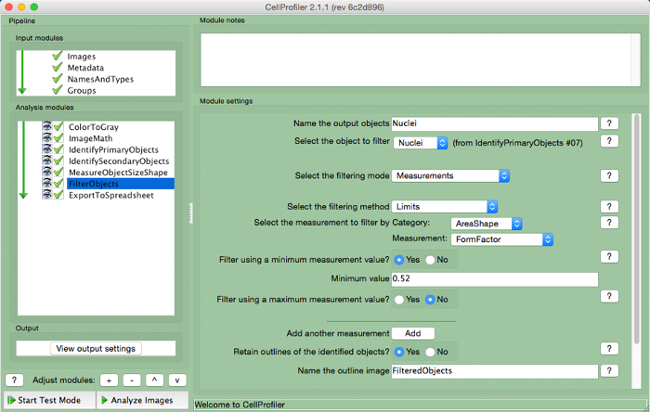
Figura 9. CellProfiler gasdotto:. Filtraggio oggetti Schermata di "FilterObjects "modulo. Fai clic qui per vedere una versione più grande di questa figura.
Figura 10. CellProfiler gasdotto:.. Esportazione dei dati Schermata di modulo "ExportToSpreadsheet" Si prega di cliccare qui per vedere una versione più grande di questa figura.
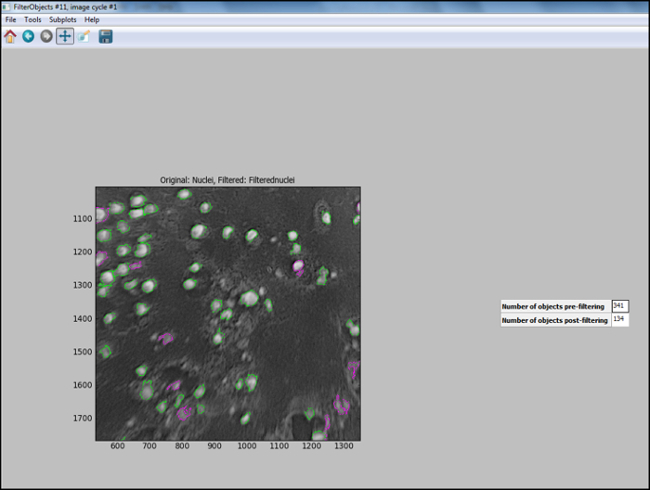
Figura 11. Uscita CellProfiler dopo il filtraggio. Schermata di schermo output in profiler cella dopo il filtro oggetto. Cliccate qui per visualizzare un Versi più grandisu questa figura.
Risultati
Entrambi surrogati di cancro al seno in 3D solidi e irrorati sono stati preparati come descritto sopra e alla produzione di 7 giorni. Successivamente, surrogati sono stati fissati, elaborati per paraffina, sezionati e colorati con ematossilina ed eosina, come descritto sopra. Il numero di cellule nucleate per area (sia 231 cellule e CAF) di ciascun surrogata è stata misurata. Come si vede nella figura 12, microfotografie rappresentativi delle sezioni H colorati con EE d...
Discussione
Qui, un metodo di coltura 3D è stato descritto che incorpora i componenti del microambiente tissutale, tra la matrice extracellulare (ECM) e fibroblasti stromali umane, in un volume che modelli più strettamente carcinoma mammario umano per consentire lo sviluppo di una morfologia 3D riepilogativo . Il metodo di coltura 3D descritto è più rappresentativo delle malattie umane di coltura cellulare in 2D tradizionale in quanto più tipi di cellule sono incorporati in un volume 3D di ECM. E 'stato osservato che quest...
Divulgazioni
The authors declare that they have no competing financial interests.
Riconoscimenti
The University of Alabama at Birmingham Center for Metabolic Bone Disease performed the histologic processing and sectioning of surrogates. Southern Research (Birmingham, AL) provided support for the manufacture of the bioreactor system. Funding was provided by the United States Department of Defense Breast Cancer Research Program (BC121367).
Materiali
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagel Medium 1x (DMEM) | Corning CellGro | 10-014-CV | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | |
| 0.25% Trypsin + 2.21 mM EDTA 1x | Corning | 25-053-CI | |
| Tissue Culture plates, 100 mm | CellTreat Scientific Products | 229620 | Sterile |
| Tissue Culture plates, 35 mm | CellTreat Scientific Products | 229638 | For PDMS foam formation |
| 9" Glass pipette | Fisher | 13-678-20D | Sterile |
| 10 ml pipette | CellTreat Scientific Products | 229210B | Sterile |
| 1,000 µl piptette tips | FisherBrand | 02-717-166 | Sterile Filtered |
| 200 µl pipette tips | FisherBrand | 02-717-141 | Sterile Filtered |
| 10 µl pipette tips | FisherBrand | 02-717-158 | Sterile Filtered |
| 15 ml conical tubes | CellTreat Scientific Products | 229410 | Sterile |
| 50 ml conical tubes | CellTreat Scientific Products | 229422 | Sterile |
| 1.5 ml microcentrifuge tubes | FisherBrand | 05-408-129 | Sterile |
| Trypan blue | Corning Cellgro | 25-900-CI | Sterile |
| Sylgard 184 | Electron Microscopy Sciences | 24236-10 | PDMS elastomer and curing agent. Used for our in-house bioreactor. |
| PDMS Foam | Made in-house for use in our in-house bioreactor. | ||
| High Concentration Bovine Collagen Type I | Advanced Biomatrix | 5133-A | FibriCol ~10 mg/ml |
| Growth Factor Reduced Matrigel (Basement Membrane) | Corning | 354230 | Basement membrane material |
| Sodium Bicarbonate | Sigma | S8761 | |
| Molecular Biology Grade Water | Fisher | BP2819-1 | |
| DMEM 10x | Sigma-Aldrich | D2429 | |
| Nunc Lab-Tek Chamber Slide System | Thermo Scientific | 177402 | 8-well |
| Bioreactor | Made in-house. | ||
| Spring-Back 304 Stainless Steel—Coated with PTFE polymer | McMaster-Carr | 1749T19 | Stainless steel wires to generate microchannels in our in-house bioreactor system. 0.016" Diameter |
| BioPharm Plus platinum-cured silicone pump tubing, L/S 14 | Masterflex | EW-96440-14 | For use in our in-house bioreactor system. Tubing ID: 1.6 mm, Hose barb size: 1/16 in. |
| 2-Stop Tubing Sets, non-flared PVC, 1.52 mm ID | Cole-Parmer | EW-74906-36 | For use in our in-house bioreactor system (with microperistalitic pump). |
| Six Channel precision micro peristaltic pump | Cole-Parmer | EW-74906-04 | For use with our in-house bioreactor system |
| Tuberculin Syringes | BD Medical | 309625 | 26 gauge 3/8 in. needle; Sterile |
| Dissecting Tissue Forceps | FisherBrand | 13-812-36 | 5.5 inch |
| Mini Tube Rotator | Boekel Scientific | 260750 | Equipment option for surrogate rotation. Used with carousel for 50 ml tubes (model number 260753) |
| 50 ml tube carousel | Boekel Scientific | 260753 | Used with mini tube rotator |
| Bambino Hybridization Oven | Boekel Scientific | 230301 | Equipment option for surrogate rotation |
| HistoGel Specimen Processing Gel | Thermo Scientific | HG-4000-012 | Specimen Processing Gel described in Step 5.2 |
| Cryomold | Andwin Scientific | 4566 | 15 mm x 15 mm x 5 mm |
| Tissue Marking Dye | Cancer Diagnostics, inc. | 03000P | Can be used to mark surrogates, allowing multiple samples to be included in one tissue cassette |
| Hinged tissue cassettes | FisherBrand | 22-272-416 | |
| Formalin | Fisher | 23-245-685 | |
| GoldSeal Plain Glass Slides | Thermo Scientific | 3048-002 | |
| Xylene | Fisher | X3P-1GAL | |
| Ethanol, 200 proof (100%), USP | Decon Laboratories, Inc. | 2805M | |
| Hematoxylin | Thermo Scientific Richard-Allan Scientific | 7211 | |
| Clarifier | Thermo Scientific Richard-Allan Scientific | 7401 | |
| Bluing Solution | Thermo Scientific Richard-Allan Scientific | 7301 | |
| Eosin Y | Thermo Scientific Richard-Allan Scientific | 7111 | |
| Cytoseal XYL mounting media | Thermo Scientific Richard-Allan Scientific | 83124 | |
| Coverslips | Fisher Scientific | 12-548-5G |
Riferimenti
- Hakanson, M., Textor, M., Charnley, M. Engineered 3D environments to elucidate the effect of environmental parameters on drug response in cancer. Integr Biol (Camb). 3 (1), 31-38 (2011).
- Horning, J. L., et al. 3-D tumor model for in vitro evaluation of anticancer drugs. Mol Pharm. 5 (5), 849-862 (2008).
- Dhiman, H. K., Ray, A. R., Panda, A. K. Three-dimensional chitosan scaffold-based MCF-7 cell culture for the determination of the cytotoxicity of tamoxifen. Biomaterials. 26 (9), 979-986 (2005).
- Place, A. E., Jin Huh, S., Polyak, K. The microenvironment in breast cancer progression: biology and implications for treatment. Breast Cancer Res. 13 (6), 227 (2011).
- Mao, Y., Keller, E. T., Garfield, D. H., Shen, K., Wang, J. Stromal cells in tumor microenvironment and breast cancer. Cancer Metastasis Rev. 32 (1-2), 303-315 (2013).
- Paulsson, J., Micke, P. Prognostic relevance of cancer-associated fibroblasts in human cancer. Semin Cancer Biol. 25, 61-68 (2014).
- Roskelley, C. D., Desprez, P. Y., Bissell, M. J. Extracellular matrix-dependent tissue-specific gene expression in mammary epithelial cells requires both physical and biochemical signal transduction. Proc. Natl. Acad. Sci. 91, 12378-12382 (1994).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2008).
- Ivascu, A., Kubbies, M. Rapid generation of single-tumor spheroids for high-throughput cell function and toxicity analysis. J Biomol Screen. 11 (8), 922-932 (2006).
- Lovitt, C. J., Shelper, T. B., Avery, V. M. Advanced cell culture techniques for cancer drug discovery. Biology (Basel). 3 (2), 345-367 (2014).
- Bergamaschi, A., et al. Extracellular matrix signature identifies breast cancer subgroups with different clinical outcome. J Pathol. 214 (3), 357-367 (2008).
- Oskarsson, T. Extracellular matrix components in breast cancer progression and metastasis. The Breast. 22, S66-S72 (2013).
- Kelley, L. C., Lohmer, L. L., Hagedorn, E. J., Sherwood, D. R. Traversing the basement membrane in vivo: A diversity of strategies. JBC. 204 (3), 291-301 (2014).
- Sadlonova, A., et al. Breast fibroblasts modulate epithelial cell proliferation in three-dimensional in vitro co-culture. Breast Cancer Res. 4, (2004).
- Wendt, D., Marsano, A., Jakob, M., Heberer, M., Martin, I. Oscillating perfusion of cell suspensions through three-dimensional scaffolds enhances cell seeding efficiency and uniformity. Biotechnol Bioeng. 84 (2), 205-214 (2003).
- Marshall, L. E., et al. Flow-perfusion bioreactor system for engineered breast cancer surrogates to be used in preclinical testing. J Tissue Eng Regen Med. , (2015).
- Calcagnile, P., Fragouli, D., Mele, E., Ruffilli, R., Athanassiou, A. Polymeric foams with functional nanocomposite cells. RSC Adv. 4, 19177-19182 (2014).
- Naba, A., Clauser, K. R., Lamar, J. M., Carr, S. A., Hynes, R. O. Extracellular matrix signatures of human mammary carcinoma identify novel metastasis promoters. eLife. 3, (2014).
- Lochter, A., Bissell, M. J. Involvement of extracellular matrix constituents in breast cancer. Semin Cancer Biol. 6 (3), 165-173 (1995).
- Joiner, K. S., Spangler, E. A. Evaluation of HistoGel-embedded specimens for use in veterinary diagnostic pathology. J Vet Diagn Invest. 24 (4), 710-715 (2012).
- Varsegi, G. M., Shidham, V. Cell Block Preparation from Cytology Specimen with Predominance of Individually Scattered Cells. J Vis Exp. (29), e1316 (2009).
- Sadlonova, A., et al. Human Breast Fibroblasts Inhibit Growth of the MCF10AT Xenograft Model of Proliferative Breast Disease. Am J Pathol. 170 (3), (2007).
- Otali, D., He, Q., Stockard, C. R., Grizzle, W. E. Preservation of immunorecognition by transferring cells from 10% neutral buffered formalin to 70% ethanol. Biotech Histochem. 88, 170-180 (2013).
- Webster, S. S., Jenkins, L., Burg, K. J. L. Histological Techniques for Porous, Absorbable, Polymeric Scaffolds, Used in Tissue Engineering. J Histotechnol. 26 (1), 57-65 (2003).
- Troy, T. -. C., Arabzadeh, A., Enikanolaiye, A., Lariviere, N., Turksen, K. Immunohistochemistry on Paraffin Sections of Mouse Epidermis Using Fluorescent Antibodies. J Vis Exp. (11), (2008).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Kwon, Y. -. J., et al. Gli1 enhances migration and invasion via up-regulation of MMP-11 and promotes metastasis in ERa negative breast cancer cell lines. Clin Exp Metastasis. (28), (2011).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for Immunohistochemistry on Cryosectioned Rat Brain Tissue: Example Staining for Microglia and Neurons. J Vis Exp. (99), e52293 (2015).
- Pal, A., Kleer, C. G. Three dimensional cultures: a tool to study normal acinar architecture vs. malignant transformation of breast cells. J Vis Exp. (86), e51311 (2014).
- Hasselbach, L. A., et al. Optimization of High Grade Glioma Cell Culture from Surgical Specimens for Use in Clinically Relevant Animal Models and 3D Immunochemistry. J Vis Exp. (83), e51088 (2014).
- Foty, R. A Simple Hanging Drop Cell Culture Protocol for Generation of 3D Spheroids. J Vis Exp. (51), e2720 (2011).
- Materne, E. -. M., et al. The Multi-organ Chip - A Microfluidic Platform for Long-term Multi-tissue Coculture. J Vis Exp. (98), e52526 (2015).
- Sadlonova, A., et al. Identification of Molecular Distinctions Between Normal Breast-Associated Fibroblasts and Breast Cancer-Associated Fibroblasts. Cancer Microenviron. 2, 9-21 (2009).
- Wang, J. D., Douville, N. J., Takayama, S., ElSayed, M. Quantitative analysis of molecular absorption into PDMS microfluidic channels. Ann Biomed Eng. 40 (9), 1862-1873 (2012).
- Halldorsson, S., Lucumi, E., Gomez-Sjoberg, R., Fleming, R. M. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosens Bioelectron. 63, 218-231 (2015).
- Regehr, K. J., et al. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab Chip. 9 (15), 2132-2139 (2009).
- Burdett, E., Kasper, F. K., Mikos, A. G., Ludwig, J. A. Engineering tumors: a tissue engineering perspective in cancer biology. Tissue Eng Part B Rev. 16 (3), 351-359 (2010).
- Caruso, R. A., et al. Mechanisms of coagulative necrosis in malignant epithelial tumors (Review). Oncol Lett. 8 (4), 1397-1402 (2014).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicol Pathol. 35 (4), 495-516 (2007).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 146 (1), 3-15 (1995).
- Ogino, S., et al. Molecular pathological epidemiology of epigenetics: emerging integrative science to analyze environment, host, and disease. Mod Pathol. 26 (4), 465-484 (2013).
- Otali, D., et al. Combined effects of formalin fixation and tissue processing on immunorecognition. Biotech Histochem. 84 (5), 223-247 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon