É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Elaboração e análise de
Neste Artigo
Resumo
We demonstrate a method to generate 3D breast cancer surrogates, which can be cultured using a perfusion bioreactor system to deliver oxygen and nutrients. Following growth, surrogates are fixed and processed to paraffin for evaluation of parameters of interest. The evaluation of one such parameter, cell density, is explained.
Resumo
Três cultura tridimensional (3D) é um método mais fisiologicamente relevante para modelar o comportamento de células in vitro do que dois cultura tridimensional. Carcinomas, incluindo carcinomas da mama, são tecidos complexos 3D compostas por células epiteliais de cancro e componentes do estroma, incluindo fibroblastos e matriz extracelular (ECM). No entanto, a maioria dos modelos in vitro de carcinoma da mama consistir apenas de células epiteliais de cancro, omitindo o estroma e, por conseguinte, a arquitectura 3D de um tumor in vivo. modelagem 3D apropriado de carcinoma é importante para a exata compreensão da biologia do tumor, comportamento e resposta à terapia. No entanto, a duração da cultura e o volume de modelos 3D é limitado pela disponibilidade de nutrientes e de oxigénio dentro da cultura. Aqui, demonstramos um método em que as células de carcinoma da mama epiteliais e de fibroblastos do estroma são incorporados ECM para gerar um substituto do cancro da mama em 3D que inclui estroma e podem ser cultivadas como umestrutura 3D sólido ou utilizando um sistema de bioreactor de perfusão para fornecer oxigénio e nutrientes. Seguinte configuração e um período de crescimento inicial, substitutos podem ser usados para testes de drogas pré-clínicos. Alternativamente, os componentes celulares e da matriz de o substituto pode ser modificado para abordar uma variedade de questões biológicas. Após cultura, substitutos são fixadas e processadas de parafina, de uma maneira semelhante ao tratamento dos espécimes de carcinoma da mama clínica, para a avaliação dos parâmetros de interesse. A avaliação de um tal parâmetro, a densidade de células presentes, é explicada, em que os sistemas de software de análise de imagem e ImageJ CellProfiler são aplicados a fotomicrografias de secções histológicas de substitutos para quantificar o número de células nucleadas por área. Isto pode ser utilizado como um indicador da mudança no número de células ao longo do tempo ou a mudança no número de células, resultante de condições de crescimento diferentes e tratamentos.
Introdução
Três modelos tridimensionais de cultura (3D) que simulam de forma mais precisa a arquitectura do tumor e microambiente in vivo são importantes para estudos destinados a dissecar as interacções complexas entre as células e o seu microambiente e para testar a eficácia de terapias candidatos. Tumor impactos dimensionalidade oxigênio e gradientes de nutrientes, a uniformidade da exposição à droga, fluxo de pressão / sangue intersticial, e arquitetura 3D 1-4. A presença de um micro-ambiente apropriado estromal contribui para dimensionalidade do tumor e influências de sinalização célula-ECM e sinalização parácrina entre as células do estroma e as células epiteliais malignas. Os efeitos da dimensionalidade do tumor e do microambiente em função celular estão bem estabelecidos, com ambos os fatores que alteram a resposta à droga 1,3,5-8. Além disso, cinética celular de crescimento, as taxas metabólicas e sinalização celular diferem entre duas culturas e da cultura dimensões (2D) em 3D, com esses fatores affecting resposta celular 1,3,8-10.
In vitro, o microambiente tumoral substituto pode ser modulada através da inclusão de componentes ECM representativos e populações de células do estroma. Células epiteliais malignas são influenciados pela ECM e as células do estroma associadas a cancro, quer de uma forma sinergética / protector para promover a progressão do tumor ou de uma forma supressiva para inibir ainda mais 5,6,10 propagação do tumor. Em qualquer contexto, o estroma podem afectar a resposta terapêutica e a entrega de drogas através da sinalização parácrina e / ou pelo aumento da pressão intersticial no tumor, resultando em diminuição de administração de fármaco de 1,6. Portanto, a adição de ECM e células estromais em modelos pré-clínicos irão ajudar recapitular aspectos do tumor que não pode ser modelado bem em cultura 2D.
Aqui um método para estabelecer substitutos de cancro da mama que incorporam um microambiente recapitulativo, incluindo os constituintes da MEC e stromal células, num volume 3D é descrito. No carcinoma da mama, a população de células de estroma é predominantemente composta de cancro associado fibroblastos (CAF) e a ECM de estroma é em grande medida constituído por colagénio do tipo I com uma proporção menor de componentes de matriz que são encontrados na membrana basal, incluindo laminina e colagénio de tipo IV 1,4,11-13. Portanto, estes componentes do microambiente do carcinoma da mama (isto é, CAF, colagénio I, e membrana basal) foram incorporados nos substitutos. Este método pode ser usado para gerar sólido, un substitutos 3D-perfundido (Figura 1A) ou pode ser adaptado para incluir a perfusão do meio através do substituto através de um sistema de bioreactor (Figura 1B). Ambas as abordagens são descritos aqui. Este método também pode ser modificada para incluir outros elementos estromais, tais como macrófagos associados a tumores, ou para modelar outros tumores sólidos, ajustando os componentes celulares e de ECM, como apropriado.
Para o substituto carcinoma da mama descrito aqui, nós utilizamos o MDA-MB-231 (231) linha de células de cancro da mama, CAF previamente isoladas de carcinoma da mama humano 14, e um ECM composto por 90% de colágeno I ( material de 6 mg / ml) e 10% de factor de crescimento reduzida membrana basal (BM). O substituto é ou cultivados numa corrediça de 8 poços câmara (substituto sólido) ou um sistema de bioreactor é utilizado para fornecer nutrientes a perfusão contínua (substituto perfundido). Qualquer sistema de bioreactor de perfusão que podem acomodar um volume de células contendo ECM pode ser utilizado 15. Como exemplo, descreve-se a preparação dos substitutos de tecido no nosso sistema de biorreactor. Este sistema foi desenvolvido in-house e não está comercialmente disponível. Porque o nosso foco aqui é sobre a preparação e análise dos substitutos de tecido 3D, não ter ido para muitos detalhes sobre as especificidades de fabrico e montagem do nosso sistema biorreator. No entanto, uma descrição detalhada deeste sistema e seu desenvolvimento foi publicada em 16. Neste sistema biorreactor, um canal de fluxo de polidimetilsiloxano (PDMS) é utilizada para alojar o substituto, que é suportado por uma espuma de PDMS (formado usando métodos semelhantes aos descritos por Calcagnile et ai. 17). Este volume é penetrada por 4 microcanais (cada 400 um de diâmetro), que são continuamente perfundidas por meio de uma bomba através de microphysiologic para fornecer oxigénio e nutrientes para o substituto.análise adequada dos substitutos é crucial para obter informações pertinentes sobre a função celular em resposta ao tratamento ou outras manipulações. Substitutos pode ser analisado por diversos métodos, incluindo a imagiologia directa de substitutos intactas através de microscopia confocal ou outros meios de imagem não invasiva, a análise celular indirecta por análise do meio condicionado, ou perfusato, para produtos segregados, ou a análise de secções histológicas após a sua fixação e de processamento paraparafina. Um tal parâmetro que pode ser avaliada em secções histológicas é a densidade celular. Apresenta-se uma abordagem para medir a densidade celular (isto é, o número de células nucleadas por área de secção), utilizando técnicas de processamento de imagem semi-automatizados aplicados a fotomicrografias de secções histológicas coradas substitutos com hematoxilina e eosina (H & E). A densidade celular pode ser usada como um indicador da mudança relativa no número de células ao longo do tempo ou que resulta de condições de crescimento diferentes e tratamentos.
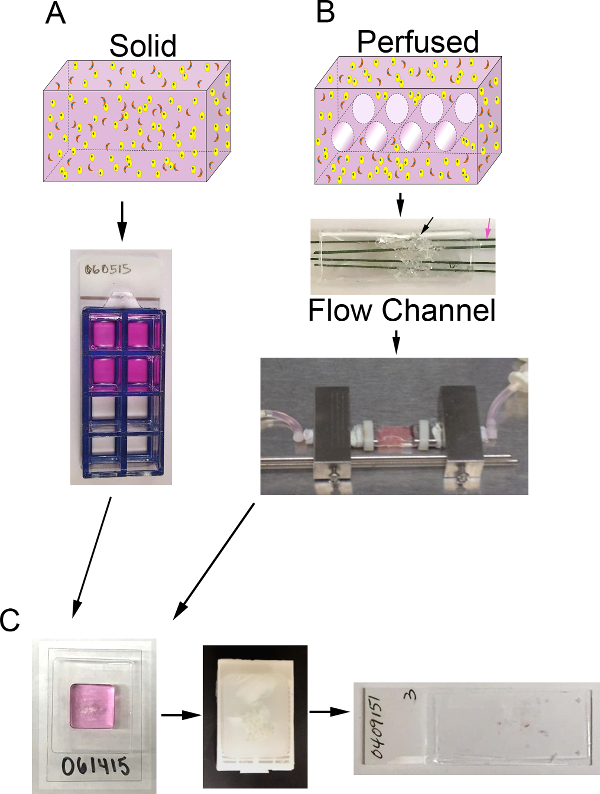
Figura 1. de volume 3D e sistema de biorreactor. A) Representação esquemática do processo para gerar substitutos 3D sólidos. Top: desenhos animados de volume 3D sólida contendo ECM (rosa), células de carcinoma epitelial (amarelo) e CAF (laranja); Resumindo:. Vista superior de 8 poços de slides câmara contendo substitutos B) Esquema do processo para gerar perfusão substitutos 3D. Top: cartoon de volume 3D com canais para permitir a perfusão médio e contendo ECM (rosa), células de carcinoma epitelial (amarelo) e CAF (laranja); Meio: imagem do canal de fluxo de PDMS contendo PDMS espuma (seta preta) a ser injectado com células + ECM e penetrada por fios de aço inoxidável revestidos com polímero (seta rosa) de medição de 400 um de diâmetro; Parte inferior:. Imagem do canal de fluxo de PDMS contendo um substituto e ligados ao sistema de bioreactor de perfusão para permitir o meio contínuo (bomba peristáltica e reservatório de meios não mostrados) C) Imagens de passos de processamento para ambos os substitutos sólidos e perfusados após cultura. À esquerda: imagem do cryomold contendo amostra de processamento de gel e surrogate; Médio: imagem de um bloco de parafina contendo um substituto fixo e processados; Direita:. Imagem de uma lâmina de vidro com uma secção histológica H & E-manchado de um substituto Por favor clique aqui para ver umaversão maior desta figura.
Protocolo
Cultura 1. celular
- Descongelar componente BM durante a noite a 4 ° C, em gelo.
- Quente meio a 37 ° C. Para suportar o crescimento de ambas as células 231 e CAF, utilizar de Dulbecco Modified Eagle Médium (DMEM) mais soro fetal bovino a 10% (FBS).
Nota: Os meios utilizados irá depender do tipo de célula e os objectivos experimentais. - Remova o meio da placa de cultura (10 cm) de células confluentes próximos 231 e adicionar 1,5 ml de tripsina / EDTA. Incubar durante 1 a 3 minutos a 37 ° C, a monitorização de separação celular. Uma vez que as células começam a arredondar e saem da placa, parar a reacção por adição de 3 ml de soro meio contendo. Pipetar o meio e as células para um tubo cónico de 15 ml.
- Centrifuga-se o meio e as células a 150 xg durante 5 min. Remover o sobrenadante, e re-suspender o sedimento celular em 2 ml de meio.
- Contar o número de células por volume usando azul de tripano e um hemocitómetro. A viabilidade das células deve ser superior a 90%.
- Repita oprocesso com outros tipos de células a ser incluído no sucedâneo. Para o substituto descrito aqui, o processo é repetido com o CAF.
- Determinar o volume apropriado de cada suspensão de células para obter o número desejado de células.
Nota: Para o substituto descrito aqui, uma densidade celular de 2,1 x 10 6 células por 100 ul de ECM, com uma proporção de 2: 1 de células epiteliais de fibroblastos (1,4 x 10 6 231 e 7 x 10 5 CAF por 100 ul ECM), é utilizada. Esta densidade celular é um bom ponto de partida; No entanto, a densidade celular óptima vai depender do tipo de célula, a duração da cultura, e os objectivos da experiência. - Colocar o volume apropriado de cada suspensão de células para um tubo de 15 ml (um tubo para cada tipo de célula). Centrifuga-se o meio e as células a 150 xg durante 5 min.
- Após a centrifugação, remover o sobrenadante, re-suspender um tipo de célula em célulaA água de grau de cultura (178,8 ul, ver Tabela 1) e o outro tipo de células em DMEM 10x (100 jil, ver Tabela 1, contendo vermelho de fenol para monitorar o pH). Colocar os tubos contendo as células em gelo e proceder rapidamente a preparação de ECM abaixo. Limitar o tempo que as células permanecem na água para preservar a viabilidade.
Nota: Ambos os componentes 10x DMEM e água cultura grau de célula são necessárias do ECM; por isso, optámos por voltar a suspender as células em ambos. Aqui nós escolhemos arbitrariamente para re-suspender as células 231 em água de grau de cultura de células e a CAF em 10x DMEM, embora qualquer tipo de célula pode ser re-suspenso em qualquer um destes dois componentes.
2. Preparação de células em ECM (6 mg / mL de colagénio de bovino do tipo I + 10% BM)
Nota: Um composto de ECM de colagénio de 90% I + 10% BM foi escolhido como modelo de carcinoma da mama invasivo pois o estroma tumoral neste malignidade é composto principalmente de colagénioI com componentes da BM, tais como laminina, colagénio IV, entactina e, compreendendo uma porção menor da ECM 12,13,18,19.
- Em gelo, adicionar os componentes listados na Tabela 1, a fim de, para um tubo de microcentrifugação de 2 ml.
Nota: Esta quantidade é suficiente para 8 ou substitutos sólidas, utilizando o sistema de biorreactor descrito aqui, 4 substitutos perfundidos.
| Preparação de células em ECM (6 mg / mL de colagénio de bovino do tipo I + 10% BM) | |
| 178,8 μeu | A água de grau de cultura de células contendo o número desejado de células 231 (determinado acima) |
| 606 ul | O colagénio I (10 mg / ml de bovino), adicionar gota a gota |
| 100 ul | membrana basal, descongelados |
| 100 ul | 10x DMEM (contendo vermelho de fenol) com o número desejado de CAF (determinado acima) |
| 15,2 ul | 7,5% (v / v) de bicarbonato de sódio, adicionar gota a gota |
Tabela 1. Preparação de células em ECM.
- Misture delicadamente por pipetagem, evitando a formação de bolhas. Monitorar o nível de pH utilizando o vermelho de fenol na 10x DMEM. Verificar que a mistura é uma laranja / cor-de-rosa indicando um pH de ~ 7. Se o pH é demasiado baixo (muito amarela), adiciona-se lentamente adicional de 7,5% de bicarbonato de sódio a uma gota de cada vez (~ 5 mL) até que a cor adequada seja atingida.
- Mantenha mistura sobre gelo e trabalhar rapidamente para evitar a polimerização prematura ECM.
3. Preparação Surrogate
- Para culturas em 3D sólidos (Figura 1A):
- Trabalhando em um capuz de cultura de células utilizando uma técnica estéril, rotular a tampa de uma lâmina de câmara de 8 poços estéril para indicar qualquer variação experimental em substitutos.
- Mantendo a corrediça câmara em gelo para evitar a polimerização prematura ECM, lentamente pipeta 100 uL da mistura de células + ECM em cada cavidade da lâmina câmara de 8 poços.
Nota: pipetagem a mistura de células + ECM em torno das bordas do primeiro poço ajuda a distribuir melhor a mistura de células + ECM no poço. - Incubar substitutos a 37 ° C, 5% de CO 2 durante 45 min para permitir que a polimerização do ECM.
- Após polimerização ECM, adicionar 100 ul de meio de cultura a cada poço e incubar a 37 ° C, 5% de CO2 durante a duração da experiência,mudando o meio de cultura de dois em dois dias.
- Para culturas em 3D perfundidos em um sistema de bioreactor (Figura 1B):
- Esterilizar todos os componentes do bioreactor para a configuração cultura 3D (isto é, de biorreactor, tubos, uma pinça, e os acessórios necessários para a configuração do bioreactor) utilizando o processo específico para o bio-reactor para ser utilizado.
- Por exemplo o sistema de bioreactor utilizado aqui, utilizar uma combinação de tratamento em autoclave (por exemplo, 12 min de exposição a 121,1 ° C com 15 minutos de secagem) e incubação em etanol a 70% durante 1 h.
- Preparar e montar a parte do sistema de bioreactor que vai abrigar o substituto.
- Para o sistema de exemplo biorreator usada aqui, inserir um backbone de espuma PDMS para o canal de fluxo PDMS tubulação usando uma pinça. Empurrar quatro fios de aço inoxidável revestidos com polímero (400 uM) na espuma PDMS para gerar microcanais paralelos.
- Num capuz de cultura de células, utilizando Sterile técnica e uma agulha de calibre 26 com uma seringa, injectar a mistura de células + ECM para a área do bioreactor de perfusão destinado a conter células. Avançar rapidamente para a próxima etapa.
- A fim de assegurar uma distribuição mais uniforme de células dentro dos substitutos, colocar o componente biorreactor abrigando os substitutos para um tubo de 50 ml (sob o capuz de cultura de células) e rodar continuamente em ~ 18 rpm enquanto a incubação a 37 ° C durante 45 min para permitir ECM polimerização.
Nota: A rotação pode ser efectuada usando um rotor na incubadora ou num forno com um construído no rotador, tais como hibridação forno regulado para 37 ° C. - Conecte o conjunto do biorreator contendo o substituto para a bomba de perfusão utilizando as instruções do fabricante.
Nota: Os detalhes deste processo pode variar dependendo do bioreactor e da bomba está sendo usado.- Por exemplo o sistema de bioreactor utilizado aqui, remover os fios de aço inoxidável antes de conectar o bioreactor de montagem para a bomba.
- Iniciar perfusão médio (taxa de fluxo de massa de 167,1 ul / min; microcanal parede de tensão de cisalhamento de 1 dine / cm2) em uma incubadora a 37 ° C, 5% de CO 2.
Nota: A taxa de perfusão de meio pode ser ajustado, dependendo da configuração do bioreactor e os objectivos e a concepção da experiência. - Continue perfusão meio para a duração da experiência, mudando o meio de cultura a cada sete dias.
- Esterilizar todos os componentes do bioreactor para a configuração cultura 3D (isto é, de biorreactor, tubos, uma pinça, e os acessórios necessários para a configuração do bioreactor) utilizando o processo específico para o bio-reactor para ser utilizado.
4. Surrogate Fixação e Processamento (Figura 1C)
- cryomolds de etiquetas e fitas de tecido de plástico para fixação e processamento de substitutos.
- Em seguida, substitutos encerram em gel de processamento do espécime, o qual é um material aquoso que é líquido a temperaturas quentes, mas solidifica à temperatura ambiente. As assistências processamento das amostras de gel em manter os substitutos intacta durante o processamento e facilita histológico seccionamento 14,20-22.
- Derreter processamento do espécime de gel num banho de água a 60 ° C para liquefazer o que, mantendo-se a esta temperatura até estar pronto para usar. Mova o biorreator com o substituto para uma cabine de segurança biológica.
- Pipeta de aproximadamente 300 ul de amostra de gel de processamento na parte inferior da cryomold marcado (Figura 1C, painel esquerdo).
- Usando uma lâmina de bisturi (No. 10 de preferência) e uma pinça retire cuidadosamente o substituto do biorreator ou do poço de um slide de câmara de 8 poços e colocá-lo no cryomold contendo amostra de processamento de gel.
Nota: marcação de tecidos corantes (ver Materiais / lista de equipamentos para um exemplo específico) de cores diferentes podem ser usados para marcar substitutos, permitindo assim que vários exemplos para ser incluído em uma cassete de tecido de uma maneira distinguíveis. - Pipeta de aproximadamente 300 ul de amostra de gel de processamento para cobrir o substituto na cryomold e incubar a 4 ° C durante 30 min para solidify.
- Uma vez que o gel de processamento de espécimes tem solidificado, remova o gel processamento das amostras contendo o substituto do cryomold, e colocá-lo em uma cassete de tecido.
- Coloque a cassete de tecido contendo o substituto em 10% de formalina tamponada neutra para 10 a 12 horas à temperatura ambiente para permitir a fixação completa.
- Após a fixação, mover a cassete de tecido contendo o substituto de etanol a 70% até ser processada a parafina.
Nota: Transferir o substituto de formalina em etanol evita a fixação com formalina, que pode causar a perda de imunorreactividade de cerca de 23 epitopos. O período de tempo em etanol não é crítica. Esta mudança de fixador é importante se o substituto será utilizado para imuno-histoquímica ou imunofluorescência. O substituto fixo está agora pronto para o processamento de parafina (Figura 1C, painel do meio). Esta transformação é tipicamente realizada num processador de tecido localizado numa aproxopriately laboratório equipado histologia. Um programa mais curto é recomendado devido ao tamanho e delicada natureza dos substitutos 24.
5. Seccionamento e H & E coloração (Figura 1C, painel da direita)
- Na sequência de processamento dos substitutos para um bloco de parafina, secção-los usando um micrótomo padrão para o corte de, tecidos embebidos em parafina fixadas em formalina 24,25.
Nota: Isto pode ser realizado em um laboratório de histologia qualificada, ou em um laboratório de pesquisa, se devidamente equipado e experiente. A espessura das secções histológicas pode variar dependendo do uso pretendido das secções; no entanto, que normalmente usam seções que são 5 mm de espessura. A espuma PDMS usados aqui nos substitutos perfundidos é facilmente seccionado em micrótomo. - Coloque secções em lâminas histológicas de vidro simples.
- Após a secção, assar os cortes histológicos a 58 ° C durante 10-12 horas para se preparar para a coloraçãocom hematoxilina e eosina (H & E). Baking derrete a parafina e também permite uma melhor aderência de seções para a lâmina de vidro.
- H & E coloração:
- Configurar as estações descritos na Tabela 2 em frascos Coplin ou pratos de vidro para coloração, dependendo do número de lâminas para corar. Uma vez que os reagentes são criados, mover as seções através de cada estação, a fim, incubando durante o tempo indicado abaixo de 24.
- Montar uma lamela a cada slide usando a mídia de montagem.
- Permitir meios de montagem para secar antes de imagem.
| H & E coloração | ||
| Estação | Solução | Tempo |
| 1 | xileno | 5 min |
| 2 | xileno | 5 min |
| 3 | xileno | 5 min |
| 4 | Etanol a 100% | 5 min |
| 5 | Etanol a 100% | 5 min |
| 6 | 95% Etanol | 5 min |
| 7 | 95% Etanol | 5 min |
| 8 | Agua de torneira | 5 min |
| 9 | Água desionizada | 5 min |
| 10 | hematoxilina 7211 | 5 min |
| 11 | Agua de torneira | 5 min |
| 12 | clarificador * | 10 mergulhos |
| * Richard Allan # 7401 ou 70% de etanol + 0,5% de HCl | ||
| 13 | Agua de torneira | 5 min |
| 14 | bluing Reagente | 30 seg |
| 15 | Agua de torneira | 5 min |
| 16 | 95% Etanol | 10 mergulhos |
| 17 | Eosina Y- | 1 minuto |
| 18 | 95% Etanol | 10 mergulhos |
| 19 | 95% Etanol | 10 mergulhos |
| 20 | Etanol a 100% | 10 mergulhos |
| 21 | Etanol a 100% | 10 mergulhos |
| 22 | Etanol a 100% | 5 min |
| 23 | xileno | 10 mergulhos |
| 24 | xileno | 5 min |
Tabela 2. Coloração com H & E.
6. Medindo a densidade celular
- pelo menos um inteiro corte histológico imagem H & E manchada do substituto usando microscopia de campo claro no aumento de 400X, salvar as imagens como arquivos .tif.
Nota: O processamento de imagem descrita apenas foi concluída usando imagens coloridas. Embora não testado, acreditamos que o mesmo processamento também deve ser aplicável a imagens em tons de cinza. - Baixar CellProfiler do Instituto Broad 26 (http://cellprofiler.org/download.shtml) e ImageJ dos Institutos Nacionais de Saúde (http://rsb.info.nih.gov/ij/download.html), ambos que são publicamente disponíveis sem nenhum custo.
- Para medir a área do substituto em cada imagem, ImageJ aberta, selecione "Definir Medidas" (na guia "Analisar"), selecione "Área" e selecione "Ok & #34 ;.
- Abra uma imagem (arquivo .tif) do substituto. Usando a ferramenta de polígono em ImageJ (ver Figura 2), delinear a área do substituto na imagem arrastando o mouse e clicar para fazer pontos de ancoragem. Use as bordas da ECM como um guia. Uma vez delineado, selecione "Measure" sob a guia "Analisar".
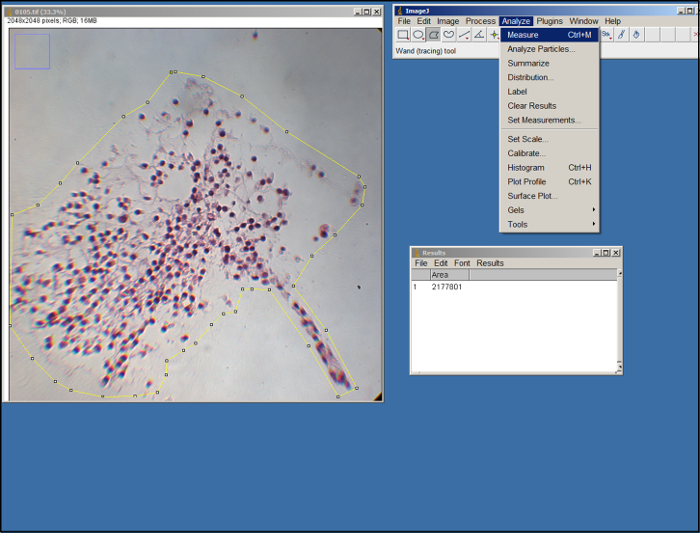
Figura 2. Análise ImageJ. Captura de tela de processamento de ImageJ. Por favor clique aqui para ver uma versão maior desta figura.
- Repita o procedimento para cada imagem do substituto do tecido. Salve medições e identificadores de imagem correspondentes a um programa de planilha.
- Fazer upload de arquivos de imagem usados para medir a área em ImageJ em CellProfiler arrastando arquivos de imagem para a "Lista de arquivos". Atribuir um nome para as imagens importadas emo "NamesAndTypes" módulo de entrada e selecione o tipo de imagem (ie, "color image").
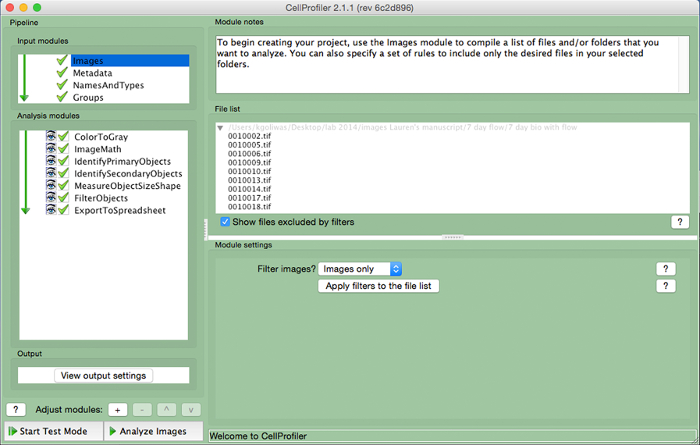
Figura 3. CellProfiler exemplo pipeline. Screenshot do gasoduto projetado para medir o número de células nucleadas em CellProfiler. Por favor clique aqui para ver uma versão maior desta figura.
- Criar um gasoduto análise que inclui os seguintes módulos para calcular o número de células por imagem, clicando no sinal "+" ao lado de "Ajuste Module" (Figura 3, na parte inferior do painel da esquerda). Adicionar a cada um dos módulos abaixo.
- Seleccionar "ColorToGray" (Figura 4).
- Selecione o nome da imagem de entrada a partir do menu drop-down, o nome da imagem de saída, e selecione o tipo de imagem original ( ou seja, RGB se a entrada de imagem a cores).
Nota: Este módulo não seria necessária se o uso de imagens em tons de cinza
- Selecione o nome da imagem de entrada a partir do menu drop-down, o nome da imagem de saída, e selecione o tipo de imagem original ( ou seja, RGB se a entrada de imagem a cores).
- Seleccionar "ImageMath" (Figura 5).
- Selecione a operação "Invert", o nome da imagem de saída, e selecione a imagem em escala de cinza na guia "select primeira imagem".
- Seleccionar "IdentifyPrimaryObjects" (Figura 6).
- Selecionar imagem de entrada (imagem após a correção de matemática), o nome do objecto principal a ser identificado (núcleos) e digite a faixa de diâmetro para os objetos a serem medidos em unidades de pixel (cerca de 25 a 65). Selecione estratégia de limiar "adaptativa" com o método de limiar "Otsu", com "três classes". Não altere quaisquer outros parâmetros das configurações padrão.
Nota: O alcance máximo de diâmetros deverá ser determinada através da abertura de uma imagem na imagem de entrada do módulo e da medição do diâmetro de núcleo (isto é,o objecto principal) utilizando a ferramenta de medida de comprimento.
- Selecionar imagem de entrada (imagem após a correção de matemática), o nome do objecto principal a ser identificado (núcleos) e digite a faixa de diâmetro para os objetos a serem medidos em unidades de pixel (cerca de 25 a 65). Selecione estratégia de limiar "adaptativa" com o método de limiar "Otsu", com "três classes". Não altere quaisquer outros parâmetros das configurações padrão.
- Selecione "IdentifySecondaryObjects" (Figura 7).
- Selecione a imagem de entrada (imagem após a correção de matemática), selecione os objetos de entrada (núcleos), e nomear os objetos a serem identificados (células). Escolha o método de "propagação" para identificar objetos secundários, usar a estratégia limiar "adaptativa" e o método "Otsu" com "duas classes" minimização "variância ponderada". Selecione "sem suavização" e um fator de correção limiar de 1, o limite inferior e superior de 0 e 1, e um fator de regularização de 0,05. Não altere quaisquer outros parâmetros das configurações padrão.
- Seleccionar "MeasureObjectSizeShape" (Figura 8).
- células Seleccione (objeto secundário) e núcleos (objeto primário) como os objetos a serem medidos.
- Selecione "FilterObjects" (Figura 9 ).
- Nomear os objetos de saída e selecionar os núcleos (objeto primário) como o objeto para filtrar.
- Mantenha os próximos dois parâmetros conforme as configurações padrão. Seleccionar "AreaShape", como o de medição para filtrar por categoria, e "FormFactor" como a medição.
- Selecione "Sim" para filtrar usando um valor mínimo de medição e adicionar um valor mínimo de 0,52.
- Selecione "Não" para filtrar utilizando uma medição máxima.
- Selecione "Sim" para reter os contornos de objetos filtrados e nomear a imagem delineada.
- Seleccionar "ExportToSpreadsheet" (Figura 10)
- Selecione onde deseja salvar o arquivo eo nome "Arquivos de saída".
- Depois de a conduta análise é gerado (Passos 6.7.1 a 6.7.7.1), inicie o "Modo de teste" no CellProfiler e avaliar cada etapa, incluindo que os núcleos na imagem de teste são devidamente filtrada, para garantir aa idealtros foram escolhidos para identificar as células. A Figura 11 mostra uma imagem de saída a partir CellProfiler seguinte filtragem, em que os núcleos estão correctamente identificados (circulado em verde), eo fundo é filtrado.
- Uma vez que os parâmetros são avaliados e determinado a ser suficiente, salve o projeto e clique em "Analisar Imagens". Este projeto pode ser usado repetidamente para análise futura.
Nota: Uma vez que os parâmetros foram estabelecidos, o programa está configurado para analisar todas as imagens na "Lista de arquivos", sequencialmente. Isto irá resultar em várias janelas que abrem para cada imagem analisada, o que faz com que um maior tempo de processamento.- Para evitar um tempo de processamento mais longo, clique no ícone de olho em todos os módulos, exceto "ExportToSpreadsheet" sob a seção "módulos de análise".
- Uma vez que todas as imagens substitutos foram processados por CellProfiler, abra a planilha que contém os dados de imagem gerada por celular Profiler e a planilha que contém a área medida com ImageJ. Copiar os dados filtrados núcleos (coluna D na planilha CellProfiler) e os identificadores de imagem (coluna P) e colá-los na planilha que contém os dados da área medidos.
- Calcular a soma de todas as medições obtidas para o número de núcleos por imagem do substituto.
- Calcular a soma das medidas obtidas para a área de substituição a partir de cada imagem do substituto. Dividir a área total medido pelo 1x10 6.
- Dividir o número total de núcleos pela medição da área total do passo acima para se obter um valor para o número de células por 1x10 6 2 pixels.
- Seleccionar "ColorToGray" (Figura 4).
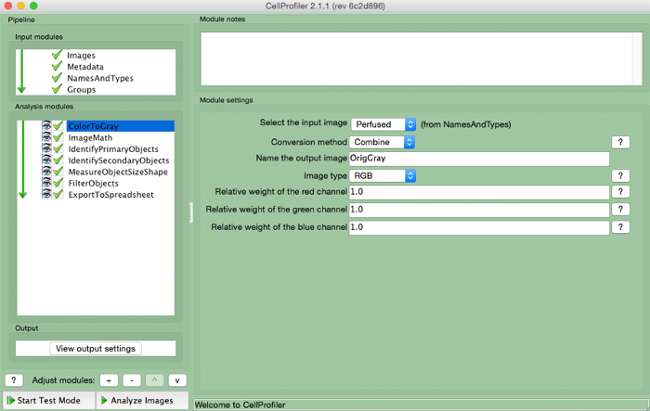
Figura 4. gasoduto CellProfiler: mudar a imagem em escala de cinza Captura de tela do módulo "ColortoGray"..s: //www.jove.com/files/ftp_upload/54004/54004fig4highres.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
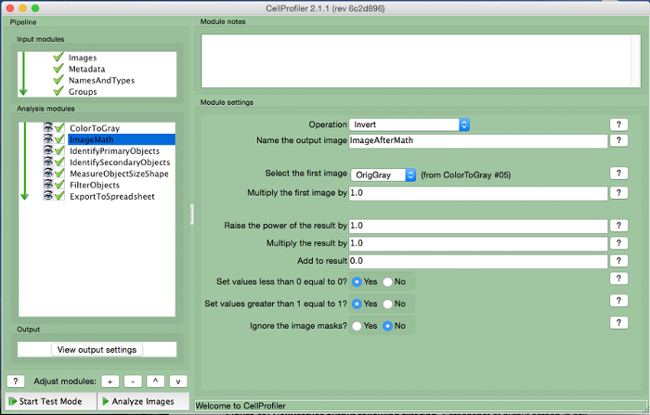
Figura 5. gasoduto CellProfiler:.. Image invertendo Captura de tela do módulo "ImageMath" Por favor clique aqui para ver uma versão maior desta figura.

Figura 6. gasoduto CellProfiler:.. Identificando núcleos Captura de tela do módulo "IdentifyPrimaryObjects" Por favor clique aqui para ver uma versão maior desta figura.
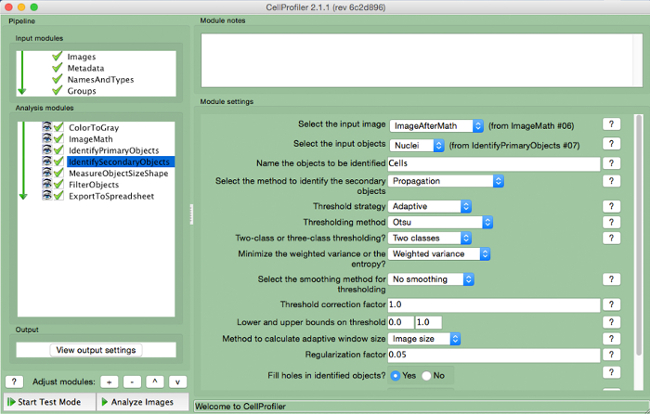
Figura 7. gasoduto CellProfiler:.. Células de identificação Captura de tela do módulo "IdentifySecondaryObjects" Por favor clique aqui para ver uma versão maior desta figura.
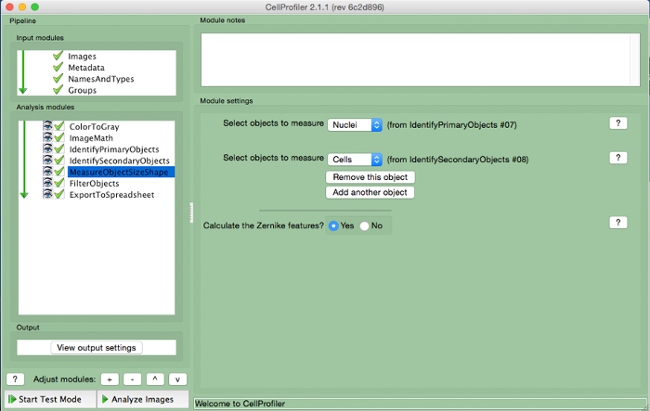
Figura 8. gasoduto CellProfiler:.. Objetos de medição Captura de tela do módulo "MeasureObjectSizeShape" Por favor clique aqui para ver uma versão maior desta figura.
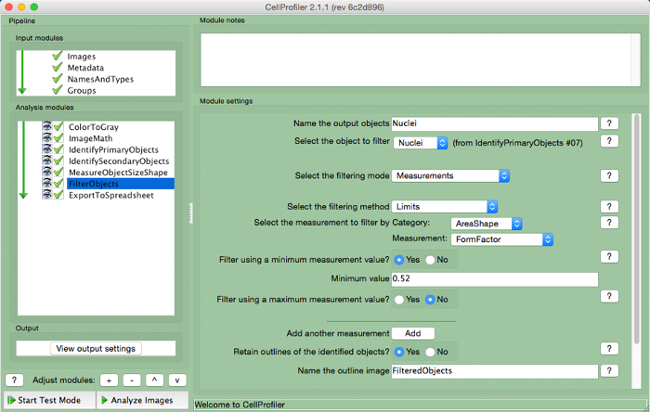
Figura 9. gasoduto CellProfiler:. Filtrando objetos Screenshot de "FilterObjects "módulo. Por favor clique aqui para ver uma versão maior desta figura.
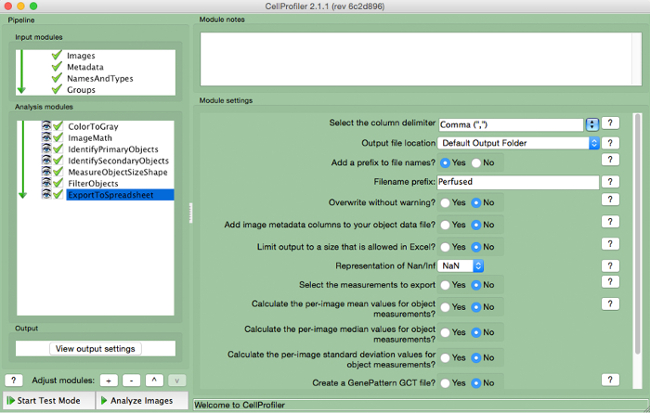
Figura 10. gasoduto CellProfiler:.. Exportação de dados Captura de tela do módulo "ExportToSpreadsheet" Por favor clique aqui para ver uma versão maior desta figura.
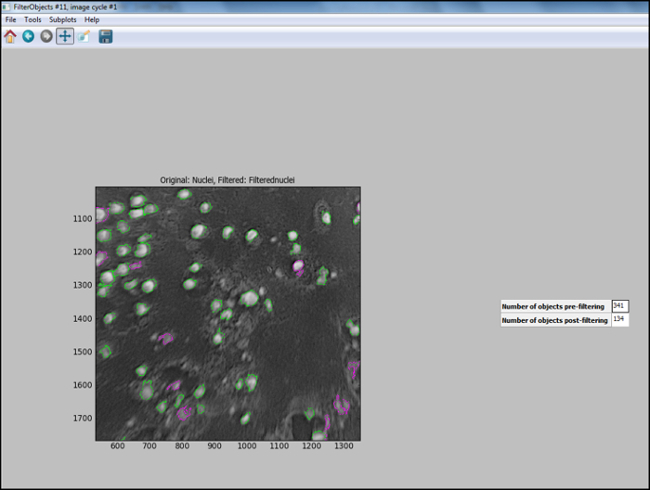
Figura 11. saída CellProfiler seguinte filtragem. Captura de tela da tela de saída no profiler celular após filtragem objeto. Por favor clique aqui para ver uma versi maioresem dessa figura.
Resultados
Ambos substitutos do cancro da mama 3D sólidos e perfundidos foram preparados como descrito acima e cultivados durante 7 dias. Subsequentemente, substitutos foram fixadas, processadas a parafina, seccionados e corados com hematoxilina e eosina, como descrito acima. O número de células nucleadas por área (231 células e a CAF) de cada substituto foi medida. Como pode ser visto na Figura 12, as fotomicrografias representativas das secções de H @ E-coradas demonstrar ...
Discussão
Nisto, um processo de cultura 3D tem sido descrito que incorpora componentes do microambiente do tecido, incluindo a matriz extracelular (ECM) e fibroblastos de estroma humano, em um volume que mais de perto modelos de cancro da mama humano para permitir o desenvolvimento de uma morfologia 3D recapitulativo . O método de cultura 3D descrito é mais representativo das doenças humanas de cultura celular tradicional 2D em que vários tipos de células são incorporados em um volume 3D de ECM. Tem-se observado que esses p...
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
The University of Alabama at Birmingham Center for Metabolic Bone Disease performed the histologic processing and sectioning of surrogates. Southern Research (Birmingham, AL) provided support for the manufacture of the bioreactor system. Funding was provided by the United States Department of Defense Breast Cancer Research Program (BC121367).
Materiais
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagel Medium 1x (DMEM) | Corning CellGro | 10-014-CV | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | |
| 0.25% Trypsin + 2.21 mM EDTA 1x | Corning | 25-053-CI | |
| Tissue Culture plates, 100 mm | CellTreat Scientific Products | 229620 | Sterile |
| Tissue Culture plates, 35 mm | CellTreat Scientific Products | 229638 | For PDMS foam formation |
| 9" Glass pipette | Fisher | 13-678-20D | Sterile |
| 10 ml pipette | CellTreat Scientific Products | 229210B | Sterile |
| 1,000 µl piptette tips | FisherBrand | 02-717-166 | Sterile Filtered |
| 200 µl pipette tips | FisherBrand | 02-717-141 | Sterile Filtered |
| 10 µl pipette tips | FisherBrand | 02-717-158 | Sterile Filtered |
| 15 ml conical tubes | CellTreat Scientific Products | 229410 | Sterile |
| 50 ml conical tubes | CellTreat Scientific Products | 229422 | Sterile |
| 1.5 ml microcentrifuge tubes | FisherBrand | 05-408-129 | Sterile |
| Trypan blue | Corning Cellgro | 25-900-CI | Sterile |
| Sylgard 184 | Electron Microscopy Sciences | 24236-10 | PDMS elastomer and curing agent. Used for our in-house bioreactor. |
| PDMS Foam | Made in-house for use in our in-house bioreactor. | ||
| High Concentration Bovine Collagen Type I | Advanced Biomatrix | 5133-A | FibriCol ~10 mg/ml |
| Growth Factor Reduced Matrigel (Basement Membrane) | Corning | 354230 | Basement membrane material |
| Sodium Bicarbonate | Sigma | S8761 | |
| Molecular Biology Grade Water | Fisher | BP2819-1 | |
| DMEM 10x | Sigma-Aldrich | D2429 | |
| Nunc Lab-Tek Chamber Slide System | Thermo Scientific | 177402 | 8-well |
| Bioreactor | Made in-house. | ||
| Spring-Back 304 Stainless Steel—Coated with PTFE polymer | McMaster-Carr | 1749T19 | Stainless steel wires to generate microchannels in our in-house bioreactor system. 0.016" Diameter |
| BioPharm Plus platinum-cured silicone pump tubing, L/S 14 | Masterflex | EW-96440-14 | For use in our in-house bioreactor system. Tubing ID: 1.6 mm, Hose barb size: 1/16 in. |
| 2-Stop Tubing Sets, non-flared PVC, 1.52 mm ID | Cole-Parmer | EW-74906-36 | For use in our in-house bioreactor system (with microperistalitic pump). |
| Six Channel precision micro peristaltic pump | Cole-Parmer | EW-74906-04 | For use with our in-house bioreactor system |
| Tuberculin Syringes | BD Medical | 309625 | 26 gauge 3/8 in. needle; Sterile |
| Dissecting Tissue Forceps | FisherBrand | 13-812-36 | 5.5 inch |
| Mini Tube Rotator | Boekel Scientific | 260750 | Equipment option for surrogate rotation. Used with carousel for 50 ml tubes (model number 260753) |
| 50 ml tube carousel | Boekel Scientific | 260753 | Used with mini tube rotator |
| Bambino Hybridization Oven | Boekel Scientific | 230301 | Equipment option for surrogate rotation |
| HistoGel Specimen Processing Gel | Thermo Scientific | HG-4000-012 | Specimen Processing Gel described in Step 5.2 |
| Cryomold | Andwin Scientific | 4566 | 15 mm x 15 mm x 5 mm |
| Tissue Marking Dye | Cancer Diagnostics, inc. | 03000P | Can be used to mark surrogates, allowing multiple samples to be included in one tissue cassette |
| Hinged tissue cassettes | FisherBrand | 22-272-416 | |
| Formalin | Fisher | 23-245-685 | |
| GoldSeal Plain Glass Slides | Thermo Scientific | 3048-002 | |
| Xylene | Fisher | X3P-1GAL | |
| Ethanol, 200 proof (100%), USP | Decon Laboratories, Inc. | 2805M | |
| Hematoxylin | Thermo Scientific Richard-Allan Scientific | 7211 | |
| Clarifier | Thermo Scientific Richard-Allan Scientific | 7401 | |
| Bluing Solution | Thermo Scientific Richard-Allan Scientific | 7301 | |
| Eosin Y | Thermo Scientific Richard-Allan Scientific | 7111 | |
| Cytoseal XYL mounting media | Thermo Scientific Richard-Allan Scientific | 83124 | |
| Coverslips | Fisher Scientific | 12-548-5G |
Referências
- Hakanson, M., Textor, M., Charnley, M. Engineered 3D environments to elucidate the effect of environmental parameters on drug response in cancer. Integr Biol (Camb). 3 (1), 31-38 (2011).
- Horning, J. L., et al. 3-D tumor model for in vitro evaluation of anticancer drugs. Mol Pharm. 5 (5), 849-862 (2008).
- Dhiman, H. K., Ray, A. R., Panda, A. K. Three-dimensional chitosan scaffold-based MCF-7 cell culture for the determination of the cytotoxicity of tamoxifen. Biomaterials. 26 (9), 979-986 (2005).
- Place, A. E., Jin Huh, S., Polyak, K. The microenvironment in breast cancer progression: biology and implications for treatment. Breast Cancer Res. 13 (6), 227 (2011).
- Mao, Y., Keller, E. T., Garfield, D. H., Shen, K., Wang, J. Stromal cells in tumor microenvironment and breast cancer. Cancer Metastasis Rev. 32 (1-2), 303-315 (2013).
- Paulsson, J., Micke, P. Prognostic relevance of cancer-associated fibroblasts in human cancer. Semin Cancer Biol. 25, 61-68 (2014).
- Roskelley, C. D., Desprez, P. Y., Bissell, M. J. Extracellular matrix-dependent tissue-specific gene expression in mammary epithelial cells requires both physical and biochemical signal transduction. Proc. Natl. Acad. Sci. 91, 12378-12382 (1994).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2008).
- Ivascu, A., Kubbies, M. Rapid generation of single-tumor spheroids for high-throughput cell function and toxicity analysis. J Biomol Screen. 11 (8), 922-932 (2006).
- Lovitt, C. J., Shelper, T. B., Avery, V. M. Advanced cell culture techniques for cancer drug discovery. Biology (Basel). 3 (2), 345-367 (2014).
- Bergamaschi, A., et al. Extracellular matrix signature identifies breast cancer subgroups with different clinical outcome. J Pathol. 214 (3), 357-367 (2008).
- Oskarsson, T. Extracellular matrix components in breast cancer progression and metastasis. The Breast. 22, S66-S72 (2013).
- Kelley, L. C., Lohmer, L. L., Hagedorn, E. J., Sherwood, D. R. Traversing the basement membrane in vivo: A diversity of strategies. JBC. 204 (3), 291-301 (2014).
- Sadlonova, A., et al. Breast fibroblasts modulate epithelial cell proliferation in three-dimensional in vitro co-culture. Breast Cancer Res. 4, (2004).
- Wendt, D., Marsano, A., Jakob, M., Heberer, M., Martin, I. Oscillating perfusion of cell suspensions through three-dimensional scaffolds enhances cell seeding efficiency and uniformity. Biotechnol Bioeng. 84 (2), 205-214 (2003).
- Marshall, L. E., et al. Flow-perfusion bioreactor system for engineered breast cancer surrogates to be used in preclinical testing. J Tissue Eng Regen Med. , (2015).
- Calcagnile, P., Fragouli, D., Mele, E., Ruffilli, R., Athanassiou, A. Polymeric foams with functional nanocomposite cells. RSC Adv. 4, 19177-19182 (2014).
- Naba, A., Clauser, K. R., Lamar, J. M., Carr, S. A., Hynes, R. O. Extracellular matrix signatures of human mammary carcinoma identify novel metastasis promoters. eLife. 3, (2014).
- Lochter, A., Bissell, M. J. Involvement of extracellular matrix constituents in breast cancer. Semin Cancer Biol. 6 (3), 165-173 (1995).
- Joiner, K. S., Spangler, E. A. Evaluation of HistoGel-embedded specimens for use in veterinary diagnostic pathology. J Vet Diagn Invest. 24 (4), 710-715 (2012).
- Varsegi, G. M., Shidham, V. Cell Block Preparation from Cytology Specimen with Predominance of Individually Scattered Cells. J Vis Exp. (29), e1316 (2009).
- Sadlonova, A., et al. Human Breast Fibroblasts Inhibit Growth of the MCF10AT Xenograft Model of Proliferative Breast Disease. Am J Pathol. 170 (3), (2007).
- Otali, D., He, Q., Stockard, C. R., Grizzle, W. E. Preservation of immunorecognition by transferring cells from 10% neutral buffered formalin to 70% ethanol. Biotech Histochem. 88, 170-180 (2013).
- Webster, S. S., Jenkins, L., Burg, K. J. L. Histological Techniques for Porous, Absorbable, Polymeric Scaffolds, Used in Tissue Engineering. J Histotechnol. 26 (1), 57-65 (2003).
- Troy, T. -. C., Arabzadeh, A., Enikanolaiye, A., Lariviere, N., Turksen, K. Immunohistochemistry on Paraffin Sections of Mouse Epidermis Using Fluorescent Antibodies. J Vis Exp. (11), (2008).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Kwon, Y. -. J., et al. Gli1 enhances migration and invasion via up-regulation of MMP-11 and promotes metastasis in ERa negative breast cancer cell lines. Clin Exp Metastasis. (28), (2011).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for Immunohistochemistry on Cryosectioned Rat Brain Tissue: Example Staining for Microglia and Neurons. J Vis Exp. (99), e52293 (2015).
- Pal, A., Kleer, C. G. Three dimensional cultures: a tool to study normal acinar architecture vs. malignant transformation of breast cells. J Vis Exp. (86), e51311 (2014).
- Hasselbach, L. A., et al. Optimization of High Grade Glioma Cell Culture from Surgical Specimens for Use in Clinically Relevant Animal Models and 3D Immunochemistry. J Vis Exp. (83), e51088 (2014).
- Foty, R. A Simple Hanging Drop Cell Culture Protocol for Generation of 3D Spheroids. J Vis Exp. (51), e2720 (2011).
- Materne, E. -. M., et al. The Multi-organ Chip - A Microfluidic Platform for Long-term Multi-tissue Coculture. J Vis Exp. (98), e52526 (2015).
- Sadlonova, A., et al. Identification of Molecular Distinctions Between Normal Breast-Associated Fibroblasts and Breast Cancer-Associated Fibroblasts. Cancer Microenviron. 2, 9-21 (2009).
- Wang, J. D., Douville, N. J., Takayama, S., ElSayed, M. Quantitative analysis of molecular absorption into PDMS microfluidic channels. Ann Biomed Eng. 40 (9), 1862-1873 (2012).
- Halldorsson, S., Lucumi, E., Gomez-Sjoberg, R., Fleming, R. M. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosens Bioelectron. 63, 218-231 (2015).
- Regehr, K. J., et al. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab Chip. 9 (15), 2132-2139 (2009).
- Burdett, E., Kasper, F. K., Mikos, A. G., Ludwig, J. A. Engineering tumors: a tissue engineering perspective in cancer biology. Tissue Eng Part B Rev. 16 (3), 351-359 (2010).
- Caruso, R. A., et al. Mechanisms of coagulative necrosis in malignant epithelial tumors (Review). Oncol Lett. 8 (4), 1397-1402 (2014).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicol Pathol. 35 (4), 495-516 (2007).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 146 (1), 3-15 (1995).
- Ogino, S., et al. Molecular pathological epidemiology of epigenetics: emerging integrative science to analyze environment, host, and disease. Mod Pathol. 26 (4), 465-484 (2013).
- Otali, D., et al. Combined effects of formalin fixation and tissue processing on immunorecognition. Biotech Histochem. 84 (5), 223-247 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados