A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הכנה וניתוח של
In This Article
Summary
We demonstrate a method to generate 3D breast cancer surrogates, which can be cultured using a perfusion bioreactor system to deliver oxygen and nutrients. Following growth, surrogates are fixed and processed to paraffin for evaluation of parameters of interest. The evaluation of one such parameter, cell density, is explained.
Abstract
תלת ממד תרבות (3D) היא שיטה רלוונטית יותר מבחינה פיזיולוגיה מודל התנהגות תאי במבחנה משני תרבות ממדים. קרצינומות, כולל קרצינומות השד, הן רקמות 3D מורכבים מורכב מתאי אפיתל סרטן ורכיבים סטרומה, כולל fibroblasts ו תאי מטריקס (ECM). עם זאת, רוב במבחנת מודלים של סרטן שד פולשני מורכבים רק תאי אפיתל סרטן, השמטת stroma, ולכן ארכיטקטורת 3D של גידול in vivo. המודלים של קרצינומה 3D מתאימים חשובים הבנה מדויקת של ביולוגית גידול, התנהגות, ואת תגובה לטיפול. עם זאת, משך תרבות ונפח של מודלי 3D הוא מוגבל על ידי הזמינות של חמצן וחומרים מזינים בתוך התרבות. בזאת, אנחנו מדגימים שיטה שבה שד קרצינומה תאי אפיתל פיברובלסטים סטרומה ישולבו ECM כדי ליצור פונדקאי סרטן שד 3D הכולל stroma ויכול להיות מתורבתת כמומבנה 3D מוצק או באמצעות מערכת bioreactor זלוף לספק חמצן וחומרים מזינים. בעקבות התקנת תקופת צמיחה ראשונית, פונדקאיים יכול לשמש לבדיקות סמים פרה-קליניות. לחלופין, המרכיבים הסלולר מטריצה של פונדקאי יכולים להיות שונים כדי לענות על מגוון של שאלות ביולוגיות. לאחר בתרבות, פונדקאיות הם קבועים ומעובדים כדי פרפין, באופן דומה את הטיפול דגימות קרצינומה שד קלינית, להערכת הפרמטרים של עניין. ההערכה של פרמטר אחד כזה, את הצפיפות של תאים הנמצאים, מוסבר, שבו מערכות תוכנה ניתוח התמונה ImageJ ו CellProfiler מוחלים photomicrographs סעיפים היסטולוגית של פונדקאיות לכמת את מספר התאים בעלי הגרעין ליחידת שטח. זה יכול לשמש כאינדיקטור של שינוי מספר תאים לאורך זמן או שינוי מספר התא וכתוצאה מתנאים וטיפולים צמיחה שונים.
Introduction
תלת ממד (3D) מודלי תרבות שיותר במדויק לחקות את אדריכלות גידול microenvironment in vivo חשובים מחקרים שמטרתם לנתח את יחסי הגומלין המורכבים בין תאי microenvironment שלהם כדי לבחון את היעילות של טיפולים מועמדים. חמצן גידול משפיע ממדי והדרגות מזינות, אחידות חשיפה לסמים, זרימת לחץ / דם ביניים, ו 3D אדריכלות 1-4. הנוכחות של המיקרו-סביבת סטרומה המתאימה תורמת השפעות ממדיות גידול איתות תא ECM ואיתות paracrine בין תאי סטרומה ותאי אפיתל ממאירים. ההשפעות של ממדיות גידול ואת microenvironment על תפקוד הסלולר מבוססות היטב, עם שני גורמי שינוי תרופה בתגובה 1,3,5-8. בנוסף, קינטיקה צמיחה הסלולר, קצב חילוף חומרים, ואיתות תא שונה בין שני ממדיים (2D) תרבות ותרבות 3D, עם גורמים אלה affecting תגובה תאית 1,3,8-10.
במבחנה, במיקרו-סביבה של פונדקאית הגידול יכול להיות מווסתת על ידי כולל מרכיבים ECM יציגים ונוגעים אוכלוסיות תאים סטרומה. תאי אפיתל ממאירים מושפעים ECM ותאי סטרומה הסרטן קשור או באופן סינרגיסטי / מגן לקדם התקדמות גידול או באופן מדכא לעכב 5,6,10 התפשטות גידול נוספת. בשני ההקשר, stroma יכול להשפיע על תגובה טיפולית משלוח סמים באמצעות איתות paracrine ו / או על ידי הגדלת לחץ ביניים בגידול הדבר שגרם לפגיעת משלוח סמים 1,6. לכן, התוספת של ECM ותאי סטרומה לתוך במודלים פרה תעזור לשחזר היבטים של הגידול כי לא יכול להיות מודל היטב בתרבות 2D.
בזאת שיטת להקים פונדקאיות סרטן השד משלב microenvironment מסכם, כולל מרכיבי ECM ו- sתאי tromal, בנפח 3D מתואר. בשנת סרטן השד, אוכלוסיית תאי סטרומה מורכבת ברובה של פיברובלסטים הסרטן קשור (CAF) ואת ECM סטרומה מורכב ברובה מסוג קולגן אני עם שיעור נמוך יותר של רכיבים מטריקס המצויים קרום המרתף, כולל laminin וסוג קולגן IV 1,4,11-13. לכן, רכיבים אלה של microenvironment סרטן שד (כלומר, CAF, אני קולגן, ואת קרום במרתף) שולבו את התחליפים. שיטה זו יכולה לשמש כדי ליצור פונדקאיות 3D מוצק, בלתי-perfused (איור 1 א) או יכול להיות מותאם לכלול זלוף של המדיום דרך פונדקאית באמצעות מערכת bioreactor (איור 1B). שתי הגישות המתוארות כאן. שיטה זו יכולה גם להיות שונה כדי לכלול אלמנטים סטרומה אחרים, כגון מקרופאגים גידולים הקשורים, או לבנות מודל גידולים מוצקים אחרים על ידי התאמת מרכיבים תאיים ו ECM, לפי העניין.
עבור הפונדקאית סרטן שד המתואר כאן, יש לנו מנוצל הקו הסלולרי מד"א- MB-231 (231) סרטן השד, CAF מבודדת בעבר מפני סרטן שד אנושי 14, ו ECM מורכב 90% קולגן אני ( 6 מ"ג / מ"ל) ו -10% חומר קרום במרתף מופחת גורם הגדילה (BM). הפונדקאי גם הוא גדל שקופית קאמרית 8 היטב (פונדקאית מוצקה) או מערכת bioreactor היא מנוצלת כדי לספק זלוף מזין רציף (פונדקאי perfused). כל מערכת bioreactor זלוף שיכול להכיל נפח של תאים המכילים ECM יכול לשמש 15. כדוגמא, אנו מתארים את הכנו את תחליפי רקמות במערכת bioreactor שלנו. מערכת זו פותחה ללא צורך במיקור חוץ אינו זמין מסחרי. בגלל ההתמקדות שלנו כאן היא על ההכנה והניתוח של פונדקאיות רקמת 3D, אנחנו לא נכנסנו בפירוט רב לגבי הפרטים של ייצור והרכבה של מערכת bioreactor שלנו. עם זאת, תיאור מפורט שלמערכת זו והתפתחותה פורסמו 16. במערכת bioreactor זה, ערוץ זרימה polydimethylsiloxane (PDMS) משמש כדי לשכן את פונדקאית, אשר נתמך על ידי קצף PDMS (נוצר באמצעות שיטות דומות לאלה שתוארו על ידי Calcagnile et al. 17). כרך זה הוא חדר 4 microchannels (כל 400 מיקרומטר קוטר) אשר perfused ברציפות על ידי מדיום באמצעות משאבת microphysiologic לספק חמצן וחומרים מזינים הפונדקאי.הניתוח מתאים של פונדקאיות הוא חיוני כדי לקבל מידע רלוונטי לגבי תפקוד הסלולר בתגובה לייחס או מניפולציות אחרות. מחליפים ניתן לנתח בשיטות שונות, כולל הדמיה ישירה של פונדקאיות שלמות באמצעות מיקרוסקופ confocal או אמצעים אחרים של הדמיה לא פולשנית, ניתוח הסלולר עקיף על ידי מנסה לאמוד תקשורת המותנה, או perfusate עבור מוצרים מופרשים, או ניתוח על סעיפים היסטולוגית לאחר קיבוע ועיבוד לפָּרָפִין. פרמטר אחד כזה שיכול להיות מוערך על סעיפים היסטולוגית הוא צפיפות תאים. אנו מציגים גישה אחת למדוד צפיפות התאים (כלומר, את מספר התאים בעלי הגרעין לכל אזור סעיף) באמצעות טכניקות עיבוד תמונה חצי אוטומטי להחיל photomicrographs סעיפים היסטולוגית פונדקאית מוכתם hematoxylin ו eosin (H & E). צפיפות התאים יכולים לשמש כאינדיקטור את השינוי היחסי מספר הסלולרי לאורך זמן או הנובע תנאים וטיפולים צמיחה שונים.
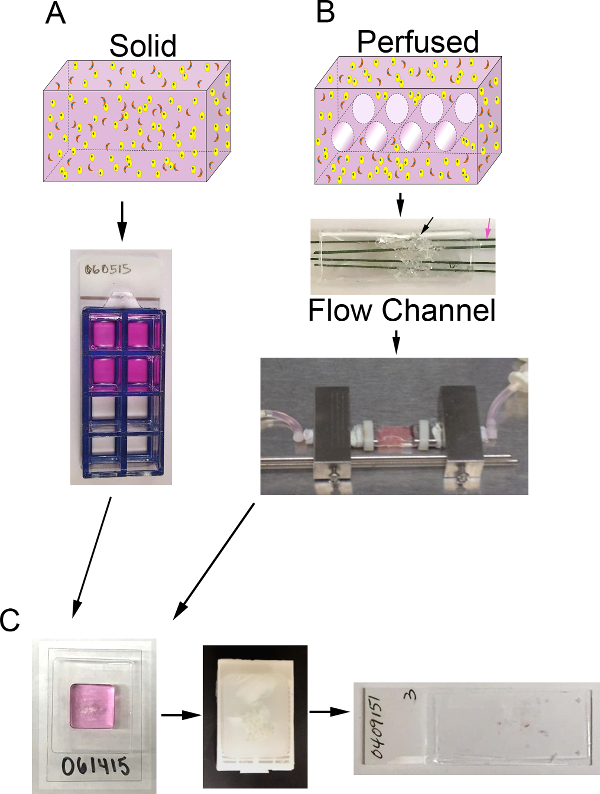
איור 1. נפח 3D ומערכת bioreactor. א) סכמטי של התהליך על מנת ליצור פונדקאיות 3D מוצקות. למעלה: קריקטורה של נפח 3D מוצק המכיל ECM (ורוד), קרצינומה של תאי אפיתל (צהובים), CAF (כתום); תחתון:. מבט מלמעלה של פונדקאיות המכילות שקופיות קאמריות 8-גם B) סכמטי של התהליך על מנת ליצור perfused פונדקאית 3D. למעלה: cartoon של נפח 3D עם ערוצים כדי לאפשר זלוף בינוני המכיל ECM (ורוד), קרצינומה של תאי אפיתל (צהוב), CAF (כתום); התיכון: תמונה של ערוץ זרימה PDMS המכיל קצף PDMS (חץ שחור) להיות מוזרק עם תא + ECM וחדרה ידי חוטי נירוסטה מצופה פולימר (חץ ורוד) מדידת 400 מיקרומטר קוטר; תחתונה:. תמונה של ערוץ הזרימה PDMS המכיל פונדקאית המחוברים למערכת bioreactor כדי לאפשר זלוף תווך רציף (משאבת peristaltic ואת המאגר התקשורת לא מוצג) C) תמונות של מדרגות עיבוד הן פונדקאיות מוצק perfused לאחר התרבות. משמאל: תמונה של cryomold המכיל דגימת עיבוד ג'ל פונדקאית; תיכון: תמונה של בלוק פרפין המכיל פונדקאי קבועה ומעובדים; מימין:. תמונה של זכוכית שקופית עם קטע היסטולוגית מוכתם E H & של פונדקאית אנא לחץ כאן כדי להציגגרסה גדולה יותר של דמות זו.
Protocol
1. תרבית תאים
- להפשיר רכיב BM לילה ב 4 מעלות צלזיוס, על הקרח.
- מדיום חמים 37 ° C. כדי לתמוך בצמיחה של שני 231 תאים CAF, השתמש בינוני הנשר שונה של Dulbecco (DMEM) בתוספת 10% בסרום שור העובר (FBS).
הערה: התקשורת המשמש יהיה תלוי בסוג התא ואת מטרות הניסוי. - הסר בינוני מצלחת תרבות (10 ס"מ) של תאים ליד ומחוברות 231 ולהוסיף 1.5 מ"ל טריפסין / EDTA. דגירה של 1 עד 3 דקות ב 37 מעלות צלזיוס, ניטור עבור ניתוק התא. לאחר התאים מתחילים לעגל ולבוא מצלחת, לעצור את התגובה על ידי הוספת 3 מ"ל של סרום המכיל בינוני. פיפטה המדיום ותאי לתוך צינור חרוטי 15 מ"ל.
- צנטריפוגה בינוני התאים ב XG 150 במשך 5 דקות. הסר את supernatant, מחדש להשעות את התא גלולה ב 2 מ"ל בינוני.
- ספירת תאים לכל נפח באמצעות trypan כחול ו hemocytometer. כדאיויות תא צריכות להיות גדולות מ -90%.
- חזור עלתהליך עם סוגי תאים אחרים להיכלל הפונדקאי. עבור הפונדקאית המתוארת כאן, התהליך חוזר על עצמו עם CAF.
- לקבוע את הנפח המתאים של כל השעית תא להשיג את המספר הרצוי של תאים.
הערה: הפונדקאית המתוארות כאן, צפיפות תאים של 2.1 x 10 6 תאים לכל 100 μl של ECM, עם יחס של 2: 1 של תאי אפיתל פיברובלסטים (1.4 x 10 6 231 תאים ו -7 x 10 5 CAF ל -100 μl ECM), משמש. צפיפות התאים זוהי נקודת התחלה טובה; עם זאת, את צפיפות התא האופטימלית תהיה תלויה בסוג התא, משך התרבות, ואת מטרות הניסוי. - מניח את הנפח המתאים של כל השעית תא לתוך צינור חרוטים 15 מיליליטר (שפופרת אחת לכל סוג תא). צנטריפוגה בינוני התאים ב XG 150 במשך 5 דקות.
- בעקבות צנטריפוגה, להסיר את supernatant, מחדש להשעות סוג תא אחד בתאמים תרבות כיתה (178.8 μl, ראה טבלה 1) ואת סוג תא אחר 10x DMEM (100 μl, ראו טבלה 1, המכיל פנול אדום כדי לפקח pH). מניחים את הצינורות המכיל את התאים על הקרח ולהמשיך במהירות כדי הכנת ECM להלן. הגבל את הזמן כי התאים נשארים במים כדי לשמר יכולת קיום.
הערה: שניהם 10x DMEM ומי כיתת תרבית תאים הם רכיבים דרושים של ECM; ולכן, בחרנו מחדש להשעות תאים בשני. כאן בחרנו באופן שרירותי מחדש להשעות את 231 התאים במי תרבות כיתת תא CAF ב 10x DMEM, למרות או סוג התא יכול להיות מושעה מחדש באחת משני רכיבים אלה.
2. הכנת תאים ב ECM (6 מ"ג / מ"ל שור קולגן Type I + 10% BM)
הערה: ECM מורכב 90% קולגן I + 10% בע"מ נבחרה לדגמן קרצינומה שד פולשני משום stroma הגידול ממאיר זה מורכב בעיקר של קולגןאני עם רכיבים של BM, כגון laminin, קולגן IV, ו entactin, המהווים חלק קטן יותר של 12,13,18,19 ECM.
- על קרח, להוסיף רכיבים המפורטים בטבלה 1, לפי הסדר, לתוך צינור microcentrifuge 2 מ"ל.
הערה: הכמות הזו מספיקה עבור 8 פונדקאיות מוצקות או, באמצעות מערכת bioreactor המתוארת כאן, 4 פונדקאיות perfused.
| הכנת התאים ECM (6 מ"ג / מ"ל שור קולגן Type I + 10% BM) | |
| 178.8 μl | מים ניידים תרבות כיתה המכילים את המספר הרצוי של 231 תאים (נקבע לעיל) |
| 606 μl | קולגן אני (10 מ"ג / מ"ל שור), להוסיף טיפה אחר טיפה |
| 100 μl | קרום מרתף, מופשר |
| 100 μl | 10x DMEM (פנול אדום המכיל) עם המספר הרצוי של CAF (נקבע לעיל) |
| 15.2 μl | 7.5% (V / V) סודיום ביקרבונט, להוסיף טיפה אחר טיפה |
טבלה 1. הכנת התאים ECM.
- לערבב בעדינות על ידי pipetting, הימנעות היווצרות של בועות. לפקח על רמת החומציות באמצעות פנול אדום 10x DMEM. בדוק את התערובת היא צבע כתום / ורוד מה שמעיד על pH של ~ 7. אם ה- pH נמוך מדי (צהוב מדי), לאט להוסיף סודיום ביקרבונט 7.5% נוספים טיפה אחת בכל פעם (~ 5 μl) עד הצבע המתאים הוא הגיע.
- שמור תערובת על קרח לעבוד במהירות כדי למנוע פילמור ECM המוקדם.
3. הכנת סרוגייט
- עבור תרבויות 3D מוצקות (איור 1 א):
- עבודה במנדף תרבית תאים באמצעות טכניקה סטרילית, לתייג את המכסה של שקופית קאמרית 8-גם סטרילי כדי לציין כל וריאציה ניסיונית בתחליפים.
- שמירה על השקופית הקאמרית על קרח כדי למנוע פילמור ECM המוקדם, לאט פיפטה 100 μl של תערובת התאים + ECM לבאר כל השקופית הקאמרית 8-היטב.
הערה: pipetting את תערובת התא + ECM מסביב לקצוות של הבאר הראשונה עוזר להפיץ את תערובת התאים + ECM טוב יותר גם כן. - דגירה פונדקאית על 37 מעלות צלזיוס, 5% CO 2 עבור 45 דקות, כדי לאפשר פילמור ECM.
- בעקבות פילמור ECM, להוסיף 100 תקשורת ותרבות μl היטב כל לדגור על 37 מעלות צלזיוס, 5% CO 2 עבור תקופת הניסוי,שינוי התרבות בינוני כל יומיים.
- עבור תרבויות 3D perfused במערכת bioreactor (איור 1B):
- לעקר את כל רכיבי bioreactor עבור התקנת תרבות 3D (כלומר, bioreactor, צינורות, מלקחיים, ואבזרים הדרושים להתקנת bioreactor) באמצעות תהליך מסוים עבור bioreactor לשמש.
- עבור מערכת bioreactor למשל מנוצלת כאן, להשתמש בשילוב של מעוקר (למשל, 12 חשיפה דקה ב 121.1 מעלות צלזיוס עם 15 דקות ייבוש) דוגרת באתנול 70% במשך שעה 1.
- הכן ולהרכיב את החלק של מערכת bioreactor שירכז הפונדקאי.
- עבור מערכת bioreactor למשל משמש כאן, להכניס עמוד שדרה קצף PDMS לתוך התעלה תזרים PDMS צינורות באמצעות מלקחיים. לדחוף ארבעה (400 מיקרומטר) חוטי נירוסטה מצופה פולימר לתוך הקצף PDMS ליצור microchannels במקביל.
- במנדף תרבית תאים, באמצעות sterilטכניקה דואר ומחט 26 מד עם מזרק, להזריק את תערובת תאים + ECM לאזור של bioreactor זלוף מתוכנן להכיל תאים. המשך במהירות לשלב הבא.
- כדי להבטיח יותר אפילו חלוקת התאים בתוך פונדקאיות, למקם את רכיב bioreactor דיור את התחליפים לתוך צינור חרוטי 50 מ"ל (מתחת למכסה המנוע תרבית תאים) וסובב ברציפות ב ~ 18 סל"ד בעוד דוגרים על 37 מעלות צלזיוס במשך 45 דקות כדי לאפשר ECM פילמור.
הערה: סיבוב ניתן להשלים באמצעות הכתף בחממה או בתנור עם מובנה הכתף, כגון הכלאה להגדיר בתנור על 37 מעלות צלזיוס. - חבר את הרכבת bioreactor המכיל הפונדקאי למשאבת זלוף באמצעות הוראות היצרן.
הערה: הפרטים של תהליך זה ישתנה בהתאם על bioreactor ומשאבה בשימוש.- עבור מערכת bioreactor למשל משמש כאן, להסיר את חוטי נירוסטה לפני חיבור bioreaהרכבת ctor למשאבה.
- התחל זלוף בינוני (קצב הזרימה עיקר 167.1 μl / min; מאמץ הגזירה קיר microchannel של 1 דיין / 2 ס"מ) באינקובטור ב 37 מעלות צלזיוס, 5% CO 2.
הערה: שיעור זלוף בינוני יכול להיות מותאם, ובהתאם להגדרות bioreactor ואת המטרות ואת העיצוב של הניסוי. - המשך זלוף בינוני עבור תקופת הניסוי, שינוי המדיום תרבות כל שבעה ימים.
- לעקר את כל רכיבי bioreactor עבור התקנת תרבות 3D (כלומר, bioreactor, צינורות, מלקחיים, ואבזרים הדרושים להתקנת bioreactor) באמצעות תהליך מסוים עבור bioreactor לשמש.
קיבוע סרוגייט 4. עיבוד (איור 1 ג)
- cryomolds לייבל וקלטות רקמות פלסטיק עבור קיבעון ועיבוד פונדקאיים.
- לאחר מכן, פונדקאי לשים בארגז בג'ל עיבוד דגימה, אשר מהווה חומר מימי כי הוא נוזלי בטמפרטורות חמות, אבל מבצר בטמפרטורת חדר. הדגימה עיבוד ג'ל מסייע בשמירה על פונדקאיות ללא פגע במהלך עיבוד ומקל היסטולוגית חתך 14,20-22.
- ממיסים הדגימה עיבוד ג'ל באמבט מים C ° 60 להנזלת זה, שמירה בטמפרטורה זו עד מוכן לשימוש. הזז את bioreactor עם הפונדקאית לארון בטיחות ביולוגית.
- פיפטה כ 300 μl הדגימה ג'ל עיבוד לתוך החלק התחתון של cryomold שכותרתו (תרשים 1C, פאנל משמאל).
- באמצעות סכין אזמל (מס '10 מועדפת) ו מלקחיים ובזהירות להסיר את הפונדקאית מן bioreactor או מהבאר של שקופית קאמרית 8 היטב ומניחים אותו לתוך cryomold המכיל הדגימה עיבוד ג'ל.
הערה: צבעי סימון רקמות (ראה חומרים / ציוד רשימה עבור דוגמה ספציפית) בצבעים שונים שניתן להשתמש בהם כדי לסמן ממלאי מקום, ובכך לאפשר דגימות מרובות להיכלל קלטת ברקמה אחת באופן להבחין. - פיפטה כ 300 הדגימה μl עיבוד ג'ל לכסות הפונדקאית ב cryomold דגירה על 4 מעלות צלזיוס במשך 30 דקות כדי solidify.
- לאחר ג'ל עיבוד הדגימה יש הקרושה, להסיר את הג'ל עיבוד הדגימה המכיל הפונדקאית מן cryomold, ולמקם אותו לתוך קלטת רקמות.
- מניחים את קלטת רקמה המכילה הפונדקאית לתוך 10% נייטרלי שנאגרו פורמלין למשך 10 עד 12 שעות בטמפרטורת החדר כדי לאפשר קיבעון מוחלט.
- בעקבות קיבעון, להזיז את קלטת רקמה המכילה הפונדקאית אתנול 70% עד מעובד כדי פרפין.
הערה: העברה הפונדקאית מן פורמלין כדי אתנול מונעת על-קיבעון עם פורמלין אשר יכול לגרום לאובדן immunoreactivity של כמה אפיטופים 23. משך הזמן באתנול אינו קריטי. שינוי של מקבע זה חשוב אם פונדקאית ישמש אימונוהיסטוכימיה או immunofluorescence. הפונדקאית הקבועה מוכנה כעת לצורך עיבודו פרפין (איור 1 ג, פנל באמצע). עיבוד זה מבוצע בדרך כלל במעבד רקמות הממוקם appropriately מצויד מעבדת היסטולוגיה. תוכנית קצרה מומלץ בשל גודלו ואופי עדין של פונדקאיות. 24
5. חתך ו- H & E מכתים (תרשים 1C, פאנל מימין)
- בעקבות עיבוד של ממלאי המקום בלוק פרפין, סעיף אותם באמצעות microtome סטנדרטי עבור חתך של קבוע בפורמלין, רקמות-מוטבע פרפין 24,25.
הערה: זה יכול להתבצע במעבדה היסטולוגיה מוסמכת, או מעבדת מחקר, אם מצויד ומנוסה כמו שצריך. העובי של סעיפים היסטולוגית יכול להשתנות בהתאם לשימוש המיועד של חלקים; עם זאת, אנו משתמשים בדרך כלל חלקים כי הם 5 מיקרומטר עובי. קצף PDMS משמש כאן את תחליפי perfused מחולק בקלות עם microtome. - מניח בסעיפים בשקופיות היסטולוגית זכוכית רגילות.
- לאחר חתך, לאפות בסעיפים היסטולוגית ב -58 מעלות צלזיוס במשך 10-12 שעות להתכונן מכתיםעם hematoxylin ו eosin (H & E). האפייה ממסה את פרפין וגם מאפשרת היצמדות טובה יותר של חלקים לשקופית הזכוכית.
- צביעת H & E:
- הגדרת התחנות המתואר בטבלה 2 בצנצנות coplin או מנות מכתימות זכוכית, תלוי במספר השקופיות להכתים. לאחר ריאגנטים מוגדרים, להזיז את החלקים דרך כל תחנה, לפי סדר, דוגר בפעם המצוינת בהמשך 24.
- הר coverslip כל שקופית באמצעות תקשורת הרכבה.
- אפשר תקשורת הרכבה להתייבש לפני ההדמיה.
| H & E מכתימה | ||
| תַחֲנָה | פִּתָרוֹן | זְמַן |
| 1 | קסילן | 5 דקות |
| 2 | קסילן | |
| 3 | קסילן | 5 דקות |
| 4 | 100% אתנול | 5 דקות |
| 5 | 100% אתנול | 5 דקות |
| 6 | 95% אתנול | 5 דקות |
| 7 | 95% אתנול | 5 דקות |
| 8 | מי ברז | 5 דקות |
| 9 | מי דה מיונן | 5 דקות |
| 10 | hematoxylin 7211 | 5 דקות |
| 11 | מי ברז | 5 דקות |
| 12 | להבהיר * | 10 מטבלים |
| * ריצ'רד אלן # 7401 או 70% אתנול + 0.5% HCl | ||
| 13 | מי ברז | 5 דקות |
| 14 | Bluing מגיב | 30 שניות |
| 15 | מי ברז | 5 דקות |
| 16 | 95% אתנול | 10 מטבלים |
| 17 | Eosin-Y | דקה 1 |
| 18 | 95% אתנול | 10 מטבלים |
| 19 | 95% אתנול | 10 מטבלים |
| 20 | 100% אתנול | 10 מטבלים |
| 21 | 100% אתנול | 10 מטבלים |
| 22 | 100% אתנול | 5 דקות |
| 23 | קסילן | 10 מטבלים |
| 24 | 5 דקות | |
טבלה 2. H & E מכתים.
6. מדידת צפיפות התאים
- תמונה לפחות בסעיף היסטולוגית כולו אחד H & E מוכתם של פונדקאית באמצעות מיקרוסקופ brightfield בהגדלה 400X, שמירת תמונות כמו .tif קבצים.
הערה: עיבוד התמונה תיאר הושלם רק באמצעות תמונות צבע. בעוד שלא נבדק, אנו מאמינים כי באותה העיבוד צריך גם לחול על תמונות בגוונים אפורות. - הורד CellProfiler מן Broad Institute 26 (http://cellprofiler.org/download.shtml) ו ImageJ מן המכונים הלאומיים לבריאות (http://rsb.info.nih.gov/ij/download.html), הן של אשר זמינים בפומבי ללא תשלום.
- כדי למדוד את השטח של פונדקאית כל תמונה, ImageJ פתוח, בחר "קבע ומדידה" (תחת הלשונית "לנתח"), בחר "שטח", ולאחר מכן בחר "אוקיי & #34 ;.
- פתח (קובץ .tif) תמונה של הפונדקאית. באמצעות כלי פוליגון ImageJ (ראה איור 2), מתאר את השטח של הפונדקאי בתמונה על ידי גרירת העכבר והלחיצה לעשות נקודות עיגון. השתמש הקצוות של ECM כמדריך. לאחר שתואר, בחר "מדוד" תחת הלשונית "לנתח".
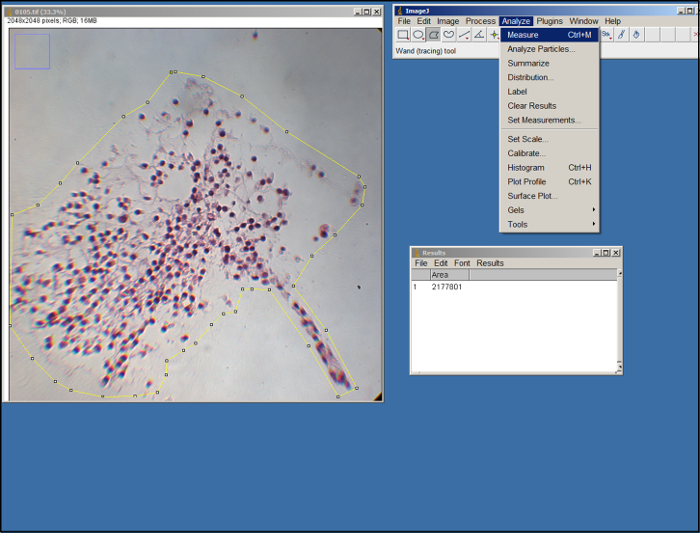
ניתוח ImageJ איור 2.. תמונת מסך של עיבוד ImageJ. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- חזור על הפעולה עבור כל תמונה של הפונדקאית רקמות. שמור מדידות ומזהה תמונה מתאימה לתכנית גיליון אלקטרונית.
- העלה קבצי תמונה המשמשים למדידת שטח ImageJ לתוך CellProfiler ידי גרירת קבצי תמונה אל "רשימת הקבצים". קצה שם לתמונות המיובאות"NamesAndTypes" מודול קלט ובחר את סוג התמונה (כלומר, "צבעי תמונה").
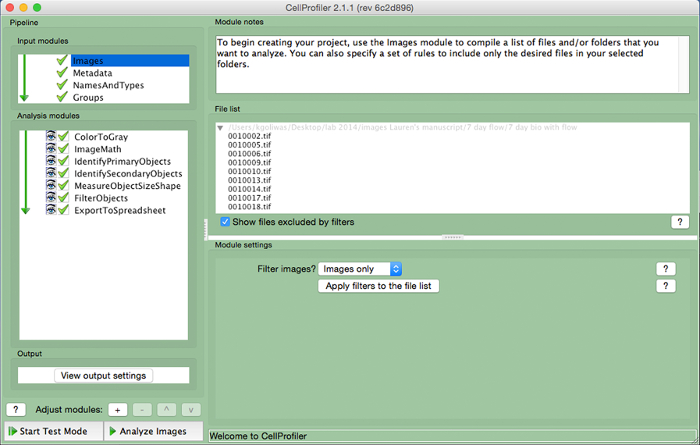
איור 3. צינור למשל CellProfiler. תמונת מסך של צינור שנועד למדוד את מספר התאים בעלי הגרעין ב CellProfiler. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- צור צינור ניתוח הכולל את המודולים הבאים כדי לחשב את מספר תאים לכל תמונה, על ידי לחיצה על הסימן "+" ליד "התאם מודול" (איור 3, בתחתית הלוח השמאלי). להוסיף בכל אחד מהמודולים להלן.
- בחר "ColorToGray" (איור 4).
- בחר את שם תמונת הקלט מן התפריט הנפתח, שם תמונת הפלט, ובחר את סוג התמונה המקורי ( כלומר, RGB אם קלט תמונה צבעונית).
הערה: מודול זה לא יהיה צורך אם באמצעות תמונות בגוונים אפורות
- בחר את שם תמונת הקלט מן התפריט הנפתח, שם תמונת הפלט, ובחר את סוג התמונה המקורי ( כלומר, RGB אם קלט תמונה צבעונית).
- בחר "ImageMath" (איור 5).
- בחר את הפעולה "הפוך", שם את תמונת הפלט, ובחר את התמונה בגווני אפור ב "תמונה לבחור ראשונה" הכרטיסייה.
- בחר "IdentifyPrimaryObjects" (איור 6).
- תמונת קלט בחר (תמונה לאחר תיקון מתמטיקה), שם האובייקט הראשוני להיות מזוהה (גרעינים), והזן את הטווח בקוטר עבור החפצים כדי להימדד ביחידות פיקסל (כ -25 עד 65). "הסתגלות" בחר באסטרטגיה הסף "Otsu" שיטת thresholding עם "שלוש כיתות". אל תשנה שום פרמטרים אחרים מהגדרות ברירת המחדל.
הערה: טווח אופטימלי של קטרים צריך להיקבע על ידי פתיחת תמונה במודול תמונת קלט ומדידת הקוטר של גרעינים (כלומר,האובייקט הראשוני) באמצעות כלי אורך מידה.
- תמונת קלט בחר (תמונה לאחר תיקון מתמטיקה), שם האובייקט הראשוני להיות מזוהה (גרעינים), והזן את הטווח בקוטר עבור החפצים כדי להימדד ביחידות פיקסל (כ -25 עד 65). "הסתגלות" בחר באסטרטגיה הסף "Otsu" שיטת thresholding עם "שלוש כיתות". אל תשנה שום פרמטרים אחרים מהגדרות ברירת המחדל.
- בחר "IdentifySecondaryObjects" (איור 7).
- בחר תמונת הקלט (תמונה לאחר תיקון מתמטיקה), בחר את אובייקטי קלט (גרעינים), ואת שם חפץ להיות מזוהים (תאים). בחר את השיטה "התפשטות" לזהות אובייקטים משניים, להשתמש באסטרטגית סף "אדפטיבית" ו "Otsu" שיטה עם "שתי כיתות" מזעור "שונה משוקלל". בחר "אין חלקה" ו בגורם תיקון סף של 1, להפחית ו לתחום העליון של 0 ו -1, וגרם הסדרה 0.05. אל תשנה שום פרמטרים אחרים מהגדרות ברירת המחדל.
- בחר "MeasureObjectSizeShape" (איור 8).
- בחרו את תאים (אובייקט משני) גרעינים (אובייקט ראשוני) כמו החפצים כדי להימדד.
- בחר "FilterObjects" (איור 9 ).
- שם אובייקטים פלטו ובחר את הגרעינים (אובייקט ראשוני) כאובייקט לסנן.
- שמור על שני הפרמטרים הבאים על פי הגדרות ברירת המחדל. בחר "AreaShape" כמו המדידה לסנן לפי קטגוריה, ו "FormFactor" כמו המדידה.
- בחר "כן" כדי לסנן באמצעות ערך מדידה למינימום, ומוסיף ערך מינימאלי של 0.52.
- "לא" בחר כדי לסנן באמצעות מדידה מקסימלית.
- בחר "כן" כדי לשמר את קווי המתאר של עצמים מסוננים שם התמונה התוותה.
- בחר "ExportToSpreadsheet" (איור 10)
- בחר היכן לשמור את הקובץ בשם "קבצי פלט".
- לאחר בצנרת הניתוח נוצרת (צעדים 6.7.1 ל 6.7.7.1), להתחיל "בדיקת מצב" ב CellProfiler ולהעריך כל שלב, כולל גרעיני תמונת הניסיון מסוננים כראוי, כדי להבטיח pa האופטימליrameters נבחר כדי לזהות תאים. איור 11 מציג תמונת פלט CellProfiler הבא סינון, שבו גרעינים מזוהים כראוי (בעיגול ירוק), והרקע מסונן החוצה.
- לאחר פרמטרים מוערכים וקבעו להיות מספיק, לשמור את הפרויקט ולאחר מכן לחץ על "נתח תמונות". פרויקט זה יכול לשמש שוב ושוב לצורך ניתוח עתידי.
הערה: לאחר פרמטרים הוקמו, התכנית מוגדרת לנתח את כל התמונות "רשימת הקבצים", ברצף. זה יגרום חלונות מרובים לפתוח עבור כל תמונה המנותחת, מה שגורם זמן עיבוד ארוך יותר.- כדי למנוע זמן עיבוד ארוך יותר, לחץ על סמל העין על כל המודולים למעט "ExportToSpreadsheet" תחת הסעיף "מודולים ניתוח".
- לאחר שכל התמונות הפונדקאיות שעובדו על ידי CellProfiler, לפתוח את הגיליון האלקטרוני המכיל את נתוני תמונה שנוצר על ידי Cell Profiler ואת גיליון אלקטרוני המכיל את האזור הנמדד עם ImageJ. העתק את נתוני גרעינים מסוננים (עמודה D בגיליון האלקטרוני CellProfiler) ואת מזהים תמונה (R טור) ולהדביק אותם לתוך הגיליון האלקטרוני המכיל את נתוני השטח הנמדד.
- חשב את הסכום של כל המדידות המתקבלות עבור במספר הגרעינים לכל תמונה של הפונדקאית.
- לחשב הסכום של המדידות שהתקבלו עבור אזור פונדקאי מכל תמונה של הפונדקאי. מחלקים את השטח הכולל נמדדת 1x10 6.
- מחלקים את המספר הכולל של גרעינים על ידי מדידת השטח הכולל בשלב לעיל כדי לקבל ערך עבור מספר התאים לכל 1x10 6 פיקסלים 2.
- בחר "ColorToGray" (איור 4).
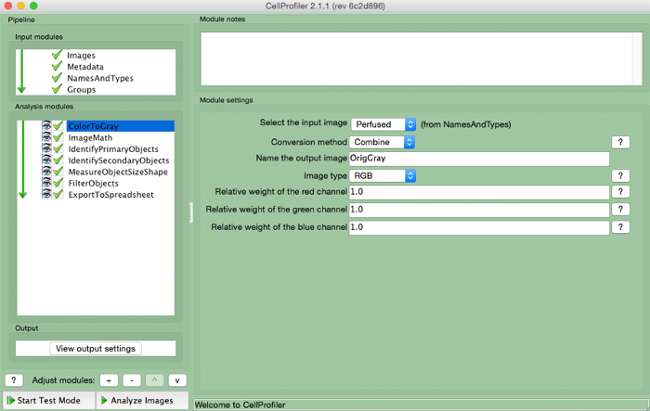
איור 4. צינור CellProfiler: שינוי תמונה בגווני אפור המסך של מודול "ColortoGray".. s: //www.jove.com/files/ftp_upload/54004/54004fig4highres.jpg "target =" _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
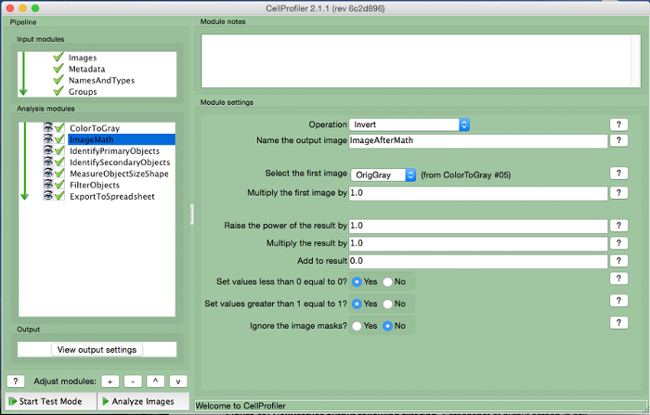
איור 5. צינור CellProfiler:.. תמונת היפוך המסך של מודול "ImageMath" אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 6. צינור CellProfiler:.. גרעיני זיהוי המסך של מודול "IdentifyPrimaryObjects" אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
ב-page = "1"> 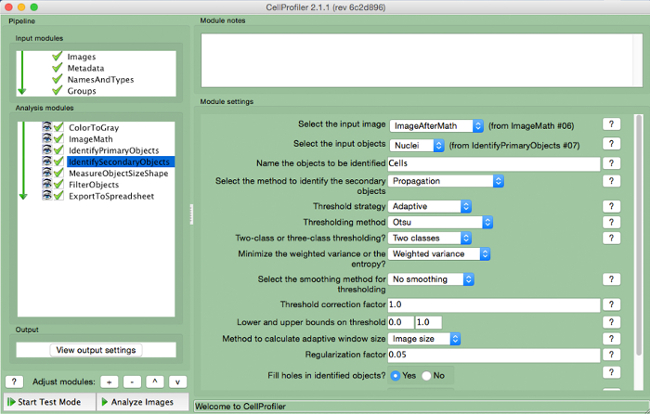
איור 7. צינור CellProfiler:.. תאים לזיהוי תמונת מסך של מודול "IdentifySecondaryObjects" אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
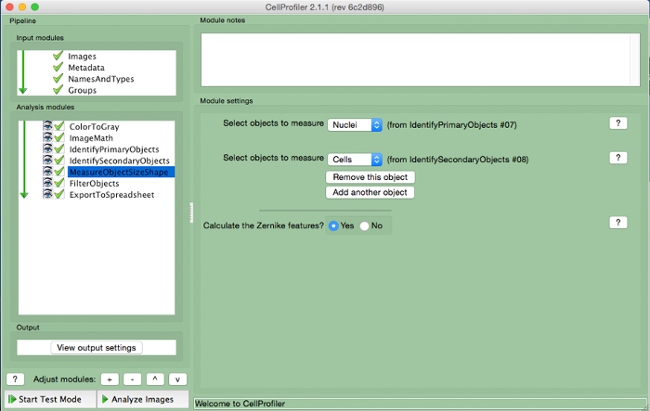
איור 8. צינור CellProfiler:.. אובייקטי מדידת המסך של מודול "MeasureObjectSizeShape" אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
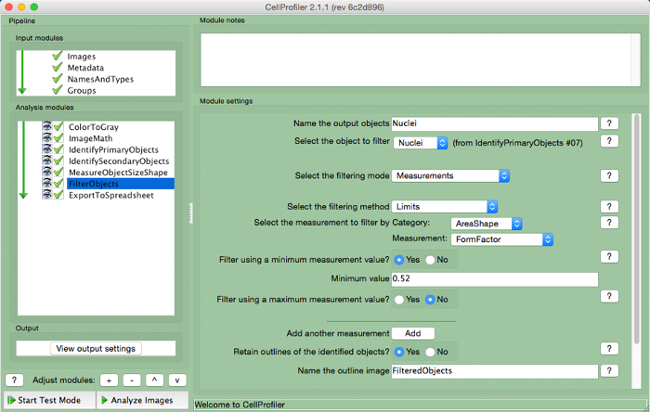
צינור CellProfiler איור 9.:. סינון חפצים צילום מסך של "F"מודול ilterObjects. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
צינור CellProfiler איור 10.:.. ייצוא נתונים מסך של "ExportToSpreadsheet" מודול אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
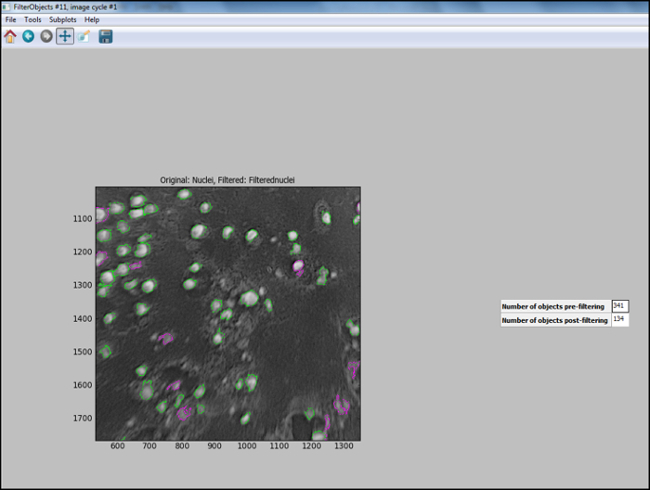
פלט איור 11. CellProfiler הבאים סינון. צילום מסך של מסך התפוקה ב מאבחן תא הבאים סינון אובייקט. אנא לחץ כאן כדי להציג versi גדולעל של נתון זה.
תוצאות
שני מחליפי 3D מוצקים perfused סרטן השד הוכנו כמתואר לעיל גדל במשך 7 ימים. בהמשך לכך, פונדקאיות שתוקנו, מעובד כדי פרפין, מחולק, ומוכתמים hematoxylin ו eosin, כפי שתואר לעיל. מספר תאי בעלי גרעין ליחידת שטח (שניהם 231 התאים CAF) של כל פונדקאי נמדד. כפי שניתן לראות בתרש?...
Discussion
בזאת, שיטה של תרבות 3D תואר המשלבת רכיבים של microenvironment הרקמות, כוללים תאי מטריקס (ECM) ו פיברובלסטים סטרומה אדם, בנפח שיותר מקרוב מודלי סרטן השד אנושי כדי לאפשר התפתחות של מורפולוגיה 3D מסכמת . השיטה תרבות 3D תיאר מייצג בצורה טובה יותר של מחלות אנושיות מאשר תרבית תאים 2D ה?...
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
The University of Alabama at Birmingham Center for Metabolic Bone Disease performed the histologic processing and sectioning of surrogates. Southern Research (Birmingham, AL) provided support for the manufacture of the bioreactor system. Funding was provided by the United States Department of Defense Breast Cancer Research Program (BC121367).
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagel Medium 1x (DMEM) | Corning CellGro | 10-014-CV | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | |
| 0.25% Trypsin + 2.21 mM EDTA 1x | Corning | 25-053-CI | |
| Tissue Culture plates, 100 mm | CellTreat Scientific Products | 229620 | Sterile |
| Tissue Culture plates, 35 mm | CellTreat Scientific Products | 229638 | For PDMS foam formation |
| 9" Glass pipette | Fisher | 13-678-20D | Sterile |
| 10 ml pipette | CellTreat Scientific Products | 229210B | Sterile |
| 1,000 µl piptette tips | FisherBrand | 02-717-166 | Sterile Filtered |
| 200 µl pipette tips | FisherBrand | 02-717-141 | Sterile Filtered |
| 10 µl pipette tips | FisherBrand | 02-717-158 | Sterile Filtered |
| 15 ml conical tubes | CellTreat Scientific Products | 229410 | Sterile |
| 50 ml conical tubes | CellTreat Scientific Products | 229422 | Sterile |
| 1.5 ml microcentrifuge tubes | FisherBrand | 05-408-129 | Sterile |
| Trypan blue | Corning Cellgro | 25-900-CI | Sterile |
| Sylgard 184 | Electron Microscopy Sciences | 24236-10 | PDMS elastomer and curing agent. Used for our in-house bioreactor. |
| PDMS Foam | Made in-house for use in our in-house bioreactor. | ||
| High Concentration Bovine Collagen Type I | Advanced Biomatrix | 5133-A | FibriCol ~10 mg/ml |
| Growth Factor Reduced Matrigel (Basement Membrane) | Corning | 354230 | Basement membrane material |
| Sodium Bicarbonate | Sigma | S8761 | |
| Molecular Biology Grade Water | Fisher | BP2819-1 | |
| DMEM 10x | Sigma-Aldrich | D2429 | |
| Nunc Lab-Tek Chamber Slide System | Thermo Scientific | 177402 | 8-well |
| Bioreactor | Made in-house. | ||
| Spring-Back 304 Stainless Steel—Coated with PTFE polymer | McMaster-Carr | 1749T19 | Stainless steel wires to generate microchannels in our in-house bioreactor system. 0.016" Diameter |
| BioPharm Plus platinum-cured silicone pump tubing, L/S 14 | Masterflex | EW-96440-14 | For use in our in-house bioreactor system. Tubing ID: 1.6 mm, Hose barb size: 1/16 in. |
| 2-Stop Tubing Sets, non-flared PVC, 1.52 mm ID | Cole-Parmer | EW-74906-36 | For use in our in-house bioreactor system (with microperistalitic pump). |
| Six Channel precision micro peristaltic pump | Cole-Parmer | EW-74906-04 | For use with our in-house bioreactor system |
| Tuberculin Syringes | BD Medical | 309625 | 26 gauge 3/8 in. needle; Sterile |
| Dissecting Tissue Forceps | FisherBrand | 13-812-36 | 5.5 inch |
| Mini Tube Rotator | Boekel Scientific | 260750 | Equipment option for surrogate rotation. Used with carousel for 50 ml tubes (model number 260753) |
| 50 ml tube carousel | Boekel Scientific | 260753 | Used with mini tube rotator |
| Bambino Hybridization Oven | Boekel Scientific | 230301 | Equipment option for surrogate rotation |
| HistoGel Specimen Processing Gel | Thermo Scientific | HG-4000-012 | Specimen Processing Gel described in Step 5.2 |
| Cryomold | Andwin Scientific | 4566 | 15 mm x 15 mm x 5 mm |
| Tissue Marking Dye | Cancer Diagnostics, inc. | 03000P | Can be used to mark surrogates, allowing multiple samples to be included in one tissue cassette |
| Hinged tissue cassettes | FisherBrand | 22-272-416 | |
| Formalin | Fisher | 23-245-685 | |
| GoldSeal Plain Glass Slides | Thermo Scientific | 3048-002 | |
| Xylene | Fisher | X3P-1GAL | |
| Ethanol, 200 proof (100%), USP | Decon Laboratories, Inc. | 2805M | |
| Hematoxylin | Thermo Scientific Richard-Allan Scientific | 7211 | |
| Clarifier | Thermo Scientific Richard-Allan Scientific | 7401 | |
| Bluing Solution | Thermo Scientific Richard-Allan Scientific | 7301 | |
| Eosin Y | Thermo Scientific Richard-Allan Scientific | 7111 | |
| Cytoseal XYL mounting media | Thermo Scientific Richard-Allan Scientific | 83124 | |
| Coverslips | Fisher Scientific | 12-548-5G |
References
- Hakanson, M., Textor, M., Charnley, M. Engineered 3D environments to elucidate the effect of environmental parameters on drug response in cancer. Integr Biol (Camb). 3 (1), 31-38 (2011).
- Horning, J. L., et al. 3-D tumor model for in vitro evaluation of anticancer drugs. Mol Pharm. 5 (5), 849-862 (2008).
- Dhiman, H. K., Ray, A. R., Panda, A. K. Three-dimensional chitosan scaffold-based MCF-7 cell culture for the determination of the cytotoxicity of tamoxifen. Biomaterials. 26 (9), 979-986 (2005).
- Place, A. E., Jin Huh, S., Polyak, K. The microenvironment in breast cancer progression: biology and implications for treatment. Breast Cancer Res. 13 (6), 227 (2011).
- Mao, Y., Keller, E. T., Garfield, D. H., Shen, K., Wang, J. Stromal cells in tumor microenvironment and breast cancer. Cancer Metastasis Rev. 32 (1-2), 303-315 (2013).
- Paulsson, J., Micke, P. Prognostic relevance of cancer-associated fibroblasts in human cancer. Semin Cancer Biol. 25, 61-68 (2014).
- Roskelley, C. D., Desprez, P. Y., Bissell, M. J. Extracellular matrix-dependent tissue-specific gene expression in mammary epithelial cells requires both physical and biochemical signal transduction. Proc. Natl. Acad. Sci. 91, 12378-12382 (1994).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2008).
- Ivascu, A., Kubbies, M. Rapid generation of single-tumor spheroids for high-throughput cell function and toxicity analysis. J Biomol Screen. 11 (8), 922-932 (2006).
- Lovitt, C. J., Shelper, T. B., Avery, V. M. Advanced cell culture techniques for cancer drug discovery. Biology (Basel). 3 (2), 345-367 (2014).
- Bergamaschi, A., et al. Extracellular matrix signature identifies breast cancer subgroups with different clinical outcome. J Pathol. 214 (3), 357-367 (2008).
- Oskarsson, T. Extracellular matrix components in breast cancer progression and metastasis. The Breast. 22, S66-S72 (2013).
- Kelley, L. C., Lohmer, L. L., Hagedorn, E. J., Sherwood, D. R. Traversing the basement membrane in vivo: A diversity of strategies. JBC. 204 (3), 291-301 (2014).
- Sadlonova, A., et al. Breast fibroblasts modulate epithelial cell proliferation in three-dimensional in vitro co-culture. Breast Cancer Res. 4, (2004).
- Wendt, D., Marsano, A., Jakob, M., Heberer, M., Martin, I. Oscillating perfusion of cell suspensions through three-dimensional scaffolds enhances cell seeding efficiency and uniformity. Biotechnol Bioeng. 84 (2), 205-214 (2003).
- Marshall, L. E., et al. Flow-perfusion bioreactor system for engineered breast cancer surrogates to be used in preclinical testing. J Tissue Eng Regen Med. , (2015).
- Calcagnile, P., Fragouli, D., Mele, E., Ruffilli, R., Athanassiou, A. Polymeric foams with functional nanocomposite cells. RSC Adv. 4, 19177-19182 (2014).
- Naba, A., Clauser, K. R., Lamar, J. M., Carr, S. A., Hynes, R. O. Extracellular matrix signatures of human mammary carcinoma identify novel metastasis promoters. eLife. 3, (2014).
- Lochter, A., Bissell, M. J. Involvement of extracellular matrix constituents in breast cancer. Semin Cancer Biol. 6 (3), 165-173 (1995).
- Joiner, K. S., Spangler, E. A. Evaluation of HistoGel-embedded specimens for use in veterinary diagnostic pathology. J Vet Diagn Invest. 24 (4), 710-715 (2012).
- Varsegi, G. M., Shidham, V. Cell Block Preparation from Cytology Specimen with Predominance of Individually Scattered Cells. J Vis Exp. (29), e1316 (2009).
- Sadlonova, A., et al. Human Breast Fibroblasts Inhibit Growth of the MCF10AT Xenograft Model of Proliferative Breast Disease. Am J Pathol. 170 (3), (2007).
- Otali, D., He, Q., Stockard, C. R., Grizzle, W. E. Preservation of immunorecognition by transferring cells from 10% neutral buffered formalin to 70% ethanol. Biotech Histochem. 88, 170-180 (2013).
- Webster, S. S., Jenkins, L., Burg, K. J. L. Histological Techniques for Porous, Absorbable, Polymeric Scaffolds, Used in Tissue Engineering. J Histotechnol. 26 (1), 57-65 (2003).
- Troy, T. -. C., Arabzadeh, A., Enikanolaiye, A., Lariviere, N., Turksen, K. Immunohistochemistry on Paraffin Sections of Mouse Epidermis Using Fluorescent Antibodies. J Vis Exp. (11), (2008).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Kwon, Y. -. J., et al. Gli1 enhances migration and invasion via up-regulation of MMP-11 and promotes metastasis in ERa negative breast cancer cell lines. Clin Exp Metastasis. (28), (2011).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for Immunohistochemistry on Cryosectioned Rat Brain Tissue: Example Staining for Microglia and Neurons. J Vis Exp. (99), e52293 (2015).
- Pal, A., Kleer, C. G. Three dimensional cultures: a tool to study normal acinar architecture vs. malignant transformation of breast cells. J Vis Exp. (86), e51311 (2014).
- Hasselbach, L. A., et al. Optimization of High Grade Glioma Cell Culture from Surgical Specimens for Use in Clinically Relevant Animal Models and 3D Immunochemistry. J Vis Exp. (83), e51088 (2014).
- Foty, R. A Simple Hanging Drop Cell Culture Protocol for Generation of 3D Spheroids. J Vis Exp. (51), e2720 (2011).
- Materne, E. -. M., et al. The Multi-organ Chip - A Microfluidic Platform for Long-term Multi-tissue Coculture. J Vis Exp. (98), e52526 (2015).
- Sadlonova, A., et al. Identification of Molecular Distinctions Between Normal Breast-Associated Fibroblasts and Breast Cancer-Associated Fibroblasts. Cancer Microenviron. 2, 9-21 (2009).
- Wang, J. D., Douville, N. J., Takayama, S., ElSayed, M. Quantitative analysis of molecular absorption into PDMS microfluidic channels. Ann Biomed Eng. 40 (9), 1862-1873 (2012).
- Halldorsson, S., Lucumi, E., Gomez-Sjoberg, R., Fleming, R. M. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosens Bioelectron. 63, 218-231 (2015).
- Regehr, K. J., et al. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab Chip. 9 (15), 2132-2139 (2009).
- Burdett, E., Kasper, F. K., Mikos, A. G., Ludwig, J. A. Engineering tumors: a tissue engineering perspective in cancer biology. Tissue Eng Part B Rev. 16 (3), 351-359 (2010).
- Caruso, R. A., et al. Mechanisms of coagulative necrosis in malignant epithelial tumors (Review). Oncol Lett. 8 (4), 1397-1402 (2014).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicol Pathol. 35 (4), 495-516 (2007).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 146 (1), 3-15 (1995).
- Ogino, S., et al. Molecular pathological epidemiology of epigenetics: emerging integrative science to analyze environment, host, and disease. Mod Pathol. 26 (4), 465-484 (2013).
- Otali, D., et al. Combined effects of formalin fixation and tissue processing on immunorecognition. Biotech Histochem. 84 (5), 223-247 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved