Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Получение и анализ
В этой статье
Резюме
We demonstrate a method to generate 3D breast cancer surrogates, which can be cultured using a perfusion bioreactor system to deliver oxygen and nutrients. Following growth, surrogates are fixed and processed to paraffin for evaluation of parameters of interest. The evaluation of one such parameter, cell density, is explained.
Аннотация
Трехмерные (3D) культура является физиологически более соответствующий метод для моделирования поведения клеток в пробирке , чем двухмерной культуры. Карцином, включая карциномы молочной железы, представляют собой сложные 3D-ткани, состоящие из раковых эпителиальных клеток и компонентов стромы, включая фибробласты и внеклеточного матрикса (ЕСМ). Тем не менее , большинство моделей в пробирке клеток карциномы молочной железы состоят только из раковых эпителиальных клеток, опуская стромы и, следовательно, 3D архитектура опухоли в живом организме . Соответствующее 3D моделирование рака имеет важное значение для правильного понимания биологии опухоли, поведение и реакции на терапию. Тем не менее, продолжительность культуры и объема 3D-моделей ограничена наличием кислорода и питательных веществ в культуре. В данном случае мы демонстрируют способ, в котором рак молочной железы эпителиальные клетки и фибробластами стромы встроены в ECM для создания суррогат рака молочной железы 3D, которая включает в строму и могут быть выращены в качестветвердый 3D структуры или с помощью системы биореактора перфузионного для доставки кислорода и питательных веществ. После установки и начального периода роста, суррогаты могут быть использованы для доклинических испытаний лекарственных средств. В качестве альтернативы, клеточные и матричные компоненты суррогата могут быть модифицированы с целью решения различных биологических вопросов. После того, как культуры, суррогаты фиксируются и обрабатываются в парафин, в манере, подобной обработке образцов рака молочной железы клинические, для оценки параметров, представляющих интерес. Оценка одного такого параметра, плотность клеток, присутствующих, объясняется, где ImageJ и CellProfiler системы программного обеспечения для анализа изображений применяются к микрофотографии гистологических разделов суррогатов для количественного определения количества ядросодержащих клеток на единицу площади. Это может быть использовано в качестве индикатора изменения числа клеток с течением времени или изменение количества клеток в результате изменяющихся условий роста и обработок.
Введение
Трехмерные модели (3D) культуры , которая более точно имитируют архитектуру опухоли и микросреду в естественных условиях имеют важное значение для исследований , направленных рассекать сложных взаимодействий между клетками и их микросреды и проверить эффективность терапии кандидата. Опухоль мерность воздействия кислорода и питательных градиенты, равномерность воздействия лекарственного средства, интерстициальный потока давления / крови, и 3D архитектуры 1-4. Наличие соответствующего стромы микросреды способствует размерностью опухоли и оказывает влияние на клеточной сигнализации-ECM и паракринной сигнализации между клетками стромы и злокачественные эпителиальные клетки. Эффекты размерностью опухоли и микросреды на клеточной функции хорошо установлены, с обоими факторами , изменяющих реакцию снадобья 1,3,5-8. Кроме того, кинетика клеточного роста, скорости метаболизма и клеточной сигнализации различаются между двухмерной (2D) культуры и культуры в 3D, с учетом этих факторов AFFEcting клеточный ответ 1,3,8-10.
В пробирке, опухоль суррогатной микросреда может модулироваться включая репрезентативные ЕСМ компоненты и популяции стромальных клеток. Злокачественные эпителиальные клетки находятся под влиянием ECM и рак связаны стромальных клеток либо в синергетической / защитной манере способствовать прогрессии опухоли или в подавляющей способом для ингибирования дальнейшего распространения опухоли 5,6,10. В любом контексте, строма может повлиять на терапевтический ответ и доставки лекарственного средства посредством сигнализации паракринной и / или путем увеличения интерстициального давления в опухоли приводит к снижению доставки лекарств 1,6. Таким образом, добавление внеклеточного матрикса и клеток стромы в доклинических моделей поможет резюмировать аспекты опухоли, которые не могут быть смоделированы хорошо в 2D культуре.
При этом способ установить рака молочной железы суррогаты, которые включают обзорном микросреду, в том числе ECM компонентов и сtromal клетки, в 3D-объеме описывается. При раке молочной железы, популяция стромальных клеток преимущественно состоит из раковых ассоциированных фибробластов (CAF) и стромы ECM в основном состоит из I типа коллагена с меньшим долей матричных компонентов, которые находятся в базальной мембране, в том числе ламинин и коллагена типа IV 1,4,11-13. Таким образом, эти компоненты карциномы молочной железы микросреды (т.е., CAF, коллаген I, и базальную мембрану), были включены в суррогатов. Этот метод может быть использован для получения твердых, не-перфузию 3D индикатору (Фигура 1А) , или могут быть адаптированы для включения перфузию среды через суррогат через систему биореактора (Фиг.1В). Оба подхода описаны здесь. Этот метод также может быть модифицирован, чтобы включать в себя другие элементы стромы, такие как опухоль-ассоциированных макрофагов, или моделировать другие твердые опухоли, регулируя клеточные и ECM компонентов, в зависимости от обстоятельств.
Для карциномы молочной железы суррогата описано здесь, мы использовали МДА-МВ-231 (231) молочной линии раковых клеток, АКР ранее выделенный из человеческой карциномы 14 молочной железы, и ЕСМ состоит из 90% коллагена I ( фактор роста мембранного материала снижается подвальный 6 мг / мл) и 10% (БМ). Суррогатная либо выращивают в 8-а камера скольжения (твердый суррогата) или система биореактора используется для обеспечения непрерывного питательный перфузию (перфузировались суррогатной). Любая система проточном биореакторе , который может вместить объем ЕСМ , содержащий клетки , могут быть использованы 15. В качестве примера, мы описываем получение суррогатов ткани в нашей системе биореактора. Эта система была разработана в доме и не является коммерчески доступным. Потому что наше внимание здесь уделяется подготовке и анализу суррогатами 3D тканей, мы не пошли в обширную подробно о специфике производства и сборки нашей системы биореактора. Тем не менее, подробное описаниеэта система и ее развитие было опубликовано 16. В этом биореакторе системе, проточный канал полидиметилсилоксан (PDMS) используется для размещения суррогат, который поддерживается с помощью PDMS пены (формируется с использованием методов , аналогичных тем , которые описаны Calcagnile и др. 17). Этот объем пронизана 4 микроканалов (каждый из которых 400 мкм в диаметре), которые непрерывно увлажненную среды через microphysiologic насос для подачи кислорода и питательных веществ к суррогат.Соответствующий анализ суррогатами имеет решающее значение, чтобы получить необходимую информацию относительно клеточной функции в ответ на лечение или других манипуляций. Суррогаты могут быть проанализированы различными способами, в том числе прямой визуализации интактных суррогатов с помощью конфокальной микроскопии или другие средства неинвазивной визуализации, непрямой клеточный анализ путем анализа кондиционированной среды или перфузат, секретируемые продукты или анализа на гистологических участков после фиксации и обработки кпарафин. Одним из таких параметров, которые могут быть оценены на гистологических препаратов является плотность клеток. Приведем один подход к измерению плотности клеток (то есть, число ядросодержащих клеток на площадь поперечного сечения) с использованием полуавтоматических методов обработки изображений , применяемые к микрофотографий суррогатных гистологических срезах , окрашенных гематоксилином и эозином (H & E). Плотность клеток может быть использована в качестве индикатора относительного изменения количества клеток в течение долгого времени, или, что является результатом различных условиях роста и обработок.
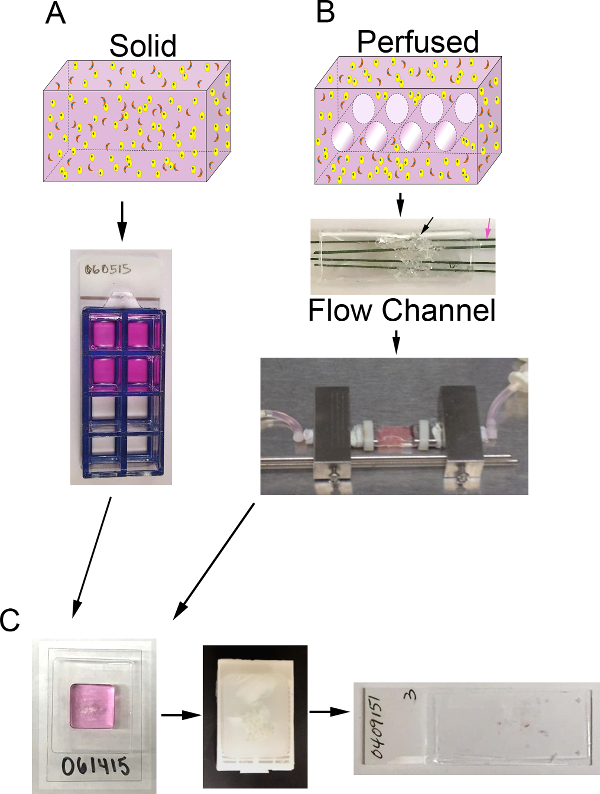
Рисунок 1. Объем 3D и система биореактора. А) Схема процесса для создания 3D твердых суррогаты. Топ: мультфильм 3D твердого объема, содержащего ECM (розовый), эпителиальные клетки карциномы (желтые) и CAF (оранжевый); Внизу:. Вид сверху 8-а камера слайд - содержащих суррогатами B) Схема процесса для генерации перфузировались 3D суррогаты. Топ: чаrtoon 3D-объема с каналами для обеспечения средней перфузии и содержащий ECM (розовый), эпителиальные клетки карциномы (желтый) и CAF (оранжевый); Средний: изображение канала потока, содержащего PDMS PDMS пены (черная стрелка), который будет введен с ячейкой + ECM и пронизана с полимерным покрытием из нержавеющей стальной проволоки (розовая стрелка) измерения 400 мкм в диаметре; Внизу:. Изображение проточного канала PDMS , содержащего суррогат и подсоединенного к системе биореактора , чтобы обеспечить сплошной среды перфузией (перистальтический насос и медиа - резервуар не показан) С) Изображения этапов обработки для обоих твердых и увлажненную суррогатами после культивирования. Слева: изображение cryomold, содержащего образец обработку геля и суррогатной; Средний: образ парафинового блока, содержащего фиксированный и обработанный суррогат; Справа:. Изображение стекло с H & E-окрашенных гистологических раздел суррогата Пожалуйста , нажмите здесь для просмотраБольшая версия этой фигуры.
протокол
1. Культура клеток
- Оттепель BM компонента в течение ночи при 4 ° С, на льду.
- Теплый среда до 37 ° С. Для поддержания роста обоих 231 клеток и CAF, использовать Дульбекко в модификации Дульбекко (DMEM) с добавлением 10% фетальной бычьей сыворотки (FBS).
Примечание: Средства массовой информации , используемые будет зависеть от типа клеток и экспериментальных целей. - Удалить среду из культуральной чашки (10 см) вблизи клеток сливающийся 231 и добавляют 1,5 мл трипсин / ЭДТА. Выдержите в течение от 1 до 3 мин при 37 ° С, контроль за открепления клеток. После того, как клетки начинают округлять и отрываются пластину, остановить реакцию добавлением 3 мл среды, содержащей сыворотку. Пипетировать среду и клетки в коническую пробирку на 15 мл.
- Центрифуга средой, и клетки при 150 мкг в течение 5 мин. Удалить супернатант и повторно приостанавливать осадок клеток в 2 мл среды.
- Подсчитайте количество клеток в объеме с использованием трипанового синего и гемоцитометра. Жизнеспособность клеток должна быть больше, чем на 90%.
- Повторитьпроцесс с другими типами клеток, которые будут включены в суррогат. Для получения суррогата, описанного здесь, процесс повторяется с CAF.
- Определить соответствующий объем каждой клеточной суспензии, чтобы получить желаемое количество ячеек.
Примечание: Для получения суррогата , описанной здесь, плотности клеток 2,1 × 10 6 клеток на 100 мкл ECM, с соотношении 2: 1 эпителиальных клеток фибробластов (1,4 × 10 6 231 клеток и 7 × 10 5 CAF на 100 мкл ECM), используется. Эта плотность клеток является хорошей отправной точкой; Тем не менее, оптимальная плотность клеток будет зависеть от типа клеток, продолжительность культуры, а также целей эксперимента. - Поместите соответствующий объем каждой клеточной суспензии в 15 мл коническую пробирку (одна трубка для каждого типа клеток). Центрифуга средой, и клетки при 150 мкг в течение 5 мин.
- После центрифугирования, удалить супернатант, повторно приостанавливать один тип клеток в клеткисорт культуры воды (178,8 мкл, таблица 1) , а другой тип клеток в 10 - кратном DMEM (100 мкл, см таблицу 1, содержащую фенол красный для контроля рН). Поместите пробирки, содержащие клетки на льду и быстро приступить к подготовке ECM ниже. Ограничить время, что клетки остаются в воде, чтобы сохранить жизнеспособность.
Примечание: Оба 10x DMEM и культуры клеток воды класса требуются компоненты ECM; Поэтому, мы решили вновь приостановить клетки в обоих. Здесь мы произвольно выбрали ресуспендируйте 231 клеток в культуре клеток воды класса и CAF в 10х DMEM, хотя любой тип клеток может быть повторно приостановлено в любом из этих двух компонентов.
2. Подготовка клеток в ECM (6 мг / мл бычьим коллагеном I типа + 10% БМ)
Примечание: ЕСМ состоит из 90% коллагена I + 10% БМ был выбран для моделирования инвазивной карциномы молочной железы , так как строма опухоли в этой злокачественной опухоли состоит в основном из коллагенаЯ с компонентами БМ, такие как ламинин, коллаген IV, и энтактин, составляющим меньшую часть ECM 12,13,18,19.
- На льду, добавляют компоненты , перечисленные в таблице 1, в порядке, в микроцентрифужных пробирку 2 мл.
Примечание: Эта сумма достаточно для 8 твердых суррогатами или, используя систему биореактора , описанную здесь, 4 перфузируемые суррогаты.
| Подготовка клеток в ECM (6 мг / мл бычьим коллагеном I типа + 10% БМ) | |
| 178,8 μL | воды класса клеточной культуры, содержащей необходимое количество 231 клеток (определено выше) |
| 606 мкл | Коллаген I (10 мг / мл бычьего), добавляют по каплям |
| 100 мкл | Базальная мембрана, оттаивали |
| 100 мкл | 10x DMEM (содержащий фенол красный) с требуемым количеством CAF (определено выше) |
| 15.2 мкл | 7,5% (об / об) Бикарбонат натрия, добавить по каплям |
Таблица 1. Приготовление клеток в ЕСМ.
- Осторожно перемешать с помощью пипетки, избегая образования пузырьков. Монитор уровень рН с использованием фенола красного в 10х DMEM. Убедитесь, что смесь оранжевый / розовый цвет, указывающий рН ~ 7. Если рН слишком низкий (слишком желтый), медленно добавляют дополнительные 7,5% -ным раствором бикарбоната натрия, по одной капле за раз (~ 5 мкл) до тех пор, пока не будет достигнут соответствующий цвет,
- Держите смесь на лед и работать быстро, чтобы предотвратить преждевременную полимеризацию ECM.
3. Суррогатное Подготовка
- Для твердых 3D культур (рис 1А):
- Работа в капот культуре клеток с использованием стерильной техники, маркировать крышку стерильной 8-луночного камеры горкой для обозначения любого экспериментального изменения в суррогаты.
- Поддержание камеры слайд на льду, чтобы предотвратить преждевременную полимеризацию ЕСМ, медленно пипеткой по 100 мкл клеток + ЕСМ смеси в каждую лунку 8-луночные камеры слайд.
Примечание: при использовании пипеток сотовый + ЕСМ смесь по краям колодца первым помогает лучше распределить клеток + ЕСМ смеси в скважине. - Выдержите суррогаты при 37 ° C, 5% CO 2 в течение 45 мин , чтобы позволить полимеризации ЕСМ.
- После полимеризации ЕСМ, добавляют 100 мкл питательных сред в каждую лунку и инкубировали при 37 ° С, 5% СО 2 в течение всего эксперимента,изменение культуральной среды через каждые два дня.
- Для увлажненную 3D культур в системе биореактора (рис 1B):
- Стерилизовать все компоненты биореактора для установки 3D культуры (то есть, биореактор, трубы, щипцов и фитинги , необходимые для установки биореакторов) с использованием процесса , специфичного для биореактора для использования.
- Для системы примера биореактора , используемого здесь, используют комбинацию автоклавированием (например, 12 мин экспозиции при 121,1 ° С с 15 мин сушки) и инкубирование в 70% этаноле в течение 1 часа.
- Подготовить и собрать часть системы биореактора, которая разместится суррогат.
- Для примерной системы биореактора используется здесь, вставить PDMS пены основу в проточном канале PDMS трубопроводов при использовании щипцов. Нажмите четыре (400 мкм) с полимерным покрытием проволоки из нержавеющей стали в PDMS пены для создания параллельных микроканалов.
- В капот культуре клеток, используя STERILд техника и 26 калибра с иглой шприца, впрыснуть клеток + ЕСМ смесь в зоне проточном биореакторе, предназначенного для хранения клеток. быстро переходите к следующему шагу.
- Для того, чтобы обеспечить более равномерное распределение клеток в суррогаты, поместите компонент биореактора жилищного строительства суррогаты в 50 мл коническую трубку (под капот культуре клеток) и непрерывно вращаться со скоростью ~ 18 оборотов в минуту во время инкубирования при 37 ° С в течение 45 мин, чтобы позволить ECM полимеризация.
Примечание: Вращение может быть выполнено с использованием ротатора в инкубаторе или печь со встроенным в ротатор, такие как гибридизация печь при 37 ° С. - Подключите узел биореактор, содержащий заменяющего перфузионного насоса, используя инструкции производителя.
Примечание: Специфика этого процесса будет варьироваться в зависимости от биореактора и насос используется.- Для системы примера биореактора, используемого здесь, удалите провода из нержавеющей стали перед подключением bioreaт е р в сборе к насосу.
- Начало среднего перфузию (объемной скорости потока 167.1 мкл / мин; микроканальной стенки касательное напряжение 1 дин / см 2) в термостате при температуре 37 ° С, 5% СО 2.
Примечание: Скорость среды перфузии можно регулировать, в зависимости от настройки биореактора и целей и разработке эксперимента. - Продолжить среднюю перфузию в течение всего срока эксперимента, изменение культуральной среды через каждые семь дней.
- Стерилизовать все компоненты биореактора для установки 3D культуры (то есть, биореактор, трубы, щипцов и фитинги , необходимые для установки биореакторов) с использованием процесса , специфичного для биореактора для использования.
4. Суррогатная фиксации и обработки (рис 1C)
- Этикетка cryomolds и кассеты пластиковые ткани для суррогатной фиксации и обработки.
- Затем EnCase суррогаты в образце обработки геля, который представляет собой водный материал, который находится в жидком состоянии при высокой температуре, но затвердевает при комнатной температуре. Гель обработка образца способствует поддержанию суррогаты нетронутыми во время обработки и облегчает гистологическое секционирования 14,20-22.
- Растопить образец обработки геля в C водяной бане при 60 ° сжижать его, сохраняя при этой температуре до готовности к использованию. Перемещение биореактор с суррогатной к шкафу биологической безопасности.
- Пипетка приблизительно 300 мкл образца геля обработки в нижнюю часть меченого cryomold (Рисунок 1C, левая панель).
- Используя лезвие скальпеля (№ 10) и предпочтительным пинцета осторожно удалите суррогат из биореактора или из колодца камере слайде 8-а и поместите его в cryomold, содержащую образец обработки геля.
Примечание: Ткань маркировки красители (см Материалы / Перечень оборудования для конкретного примера) различных цветов могут быть использованы для обозначения суррогаты, тем самым позволяя несколько образцов , которые будут включены в одну кассету ткани в различимым образом. - Пипетка приблизительно 300 мкл образца обработки геля для покрытия суррогат в cryomold и инкубировать при температуре 4 ° С в течение 30 мин до solidifу.
- После того, как гель обработки образца затвердеет, удалить гель обработки образца, содержащего суррогат из cryomold, и поместите ее в кассету ткани.
- Поместите кассету ткань, содержащую суррогат в 10% нейтральный забуференный формалин в течение от 10 до 12 ч при комнатной температуре, чтобы обеспечить полную фиксацию.
- После фиксации перемещения кассеты ткань, содержащую заменяющего 70% этанола до обработки в парафине.
Примечание: Передача суррогат из формалина в этаноле препятствует чрезмерной фиксации формалином , который может привести к потере иммунореактивности некоторых эпитопов 23. Продолжительность времени , в этаноле не имеет решающего значения. Это изменение фиксаторе важно , если суррогатной будет использоваться для иммуногистохимии или иммунофлюоресценции. Фиксированный суррогатной теперь готов к обработке парафином (рис 1C, средняя панель). Эта обработка обычно выполняется в процессоре ткани , расположенной в проверopriately оборудованная гистологии лаборатория. Более короткая программа рекомендуется из - за размера и деликатного характера суррогатами. 24
5. Секционирование и H & E Окрашивание (Рисунок 1C, правая панель)
- После обработки суррогатов в парафиновый блок, раздел их , используя стандартную микротом для секционирования фиксированные формалином, парафиновых срезах тканей 24,25.
Примечание: Это может быть выполнено в квалифицированной лаборатории гистологии, или в научно - исследовательской лаборатории, если должным образом оборудованы и опытный. Толщина гистологических препаратов может изменяться в зависимости от предполагаемого использования секций; Тем не менее, мы обычно используем разделы, которые 5 мкм в толщину. Пена PDMS используется здесь в увлажненную суррогатами легко разрезали с помощью микротома. - Поместите участки на равнине стекла гистологических слайдов.
- После секционирования, испечь гистологические при 58 ° С в течение 10-12 часов, чтобы подготовиться к окрашиваниюгематоксилином и эозином (H & E). Выпечке плавится парафин, а также позволяет лучше сцепление секций к стеклу.
- H & E окрашивание:
- Настройка станций , описанных в таблице 2 в Коплин банки или стекла окрашивания блюд, в зависимости от количества слайдов , чтобы пятно. После того, как реагенты устанавливаются, перемещение секций по каждой станции, для того, инкубирование в течение времени , указанного ниже 24.
- Установите покровное на каждом слайде с помощью крепежных средств массовой информации.
- Разрешить монтажные носители высохнуть перед визуализации.
| H & E Окрашивание | ||
| станция | Решение | Время |
| 1 | Ксилол | 5 мин |
| 2 | Ксилол | 5 мин |
| 3 | Ксилол | 5 мин |
| 4 | 100% Этанол | 5 мин |
| 5 | 100% Этанол | 5 мин |
| 6 | 95% -ного этилового спирта | 5 мин |
| 7 | 95% -ного этилового спирта | 5 мин |
| 8 | Водопроводная вода | 5 мин |
| 9 | Деионизированная вода | 5 мин |
| 10 | гематоксилин 7211 | 5 мин |
| 11 | Водопроводная вода | 5 мин |
| 12 | отстойник * | 10 провалов |
| * Ричард Аллан # 7401 или 70% -ного этилового спирта + 0,5% НСl | ||
| 13 | Водопроводная вода | 5 мин |
| 14 | Воронение Реагент | 30 сек |
| 15 | Водопроводная вода | 5 мин |
| 16 | 95% -ного этилового спирта | 10 провалов |
| 17 | Эозин-Y | 1 мин |
| 18 | 95% -ного этилового спирта | 10 провалов |
| 19 | 95% -ного этилового спирта | 10 провалов |
| 20 | 100% Этанол | 10 провалов |
| 21 | 100% Этанол | 10 провалов |
| 22 | 100% Этанол | 5 мин |
| 23 | Ксилол | 10 провалов |
| 24 | Ксилол | 5 мин |
Таблица 2. H & E Окрашивание.
6. Измерение ячейки плотности
- Изображение по меньшей мере один весь H & E окрашенных гистологических раздел суррогата с помощью микроскопии при светлого 400X увеличении, сохраняя изображения в виде файлов .tif.
Примечание: обработка изображений описано только было завершено с использованием цветных изображений. В то время как непроверенный, мы считаем , что такая же обработка должна быть также применимы к черно - белого изображения. - Скачать CellProfiler из Broad Institute 26 (http://cellprofiler.org/download.shtml) и ImageJ от Национальных институтов здравоохранения (http://rsb.info.nih.gov/ij/download.html~~HEAD=pobj), оба из которые в открытом доступе бесплатно.
- Для того, чтобы измерить площадь суррогат в каждом изображении, откройте ImageJ, выберите "Установить измерений" (на вкладке "Анализ"), выберите "Area", а затем выберите "Хорошо & #34 ;.
- Открыть изображение (.tif файл) суррогата. С помощью инструмента полигона в ImageJ (см рисунок 2), очертить площадь суррогат в изображении с помощью мыши и нажав , чтобы опорные точки. Используйте края ECM в качестве руководства. После того, как указано, выберите "Measure" на вкладке "Analyze".
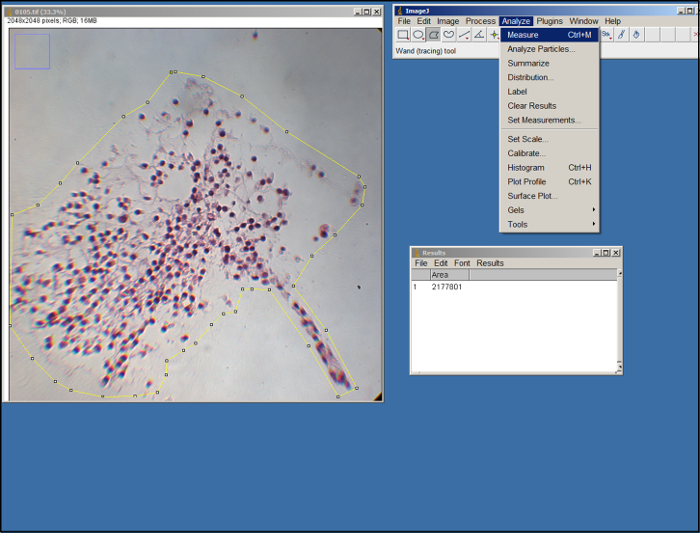
Рисунок 2. Анализ ImageJ. Снимок экрана обработки ImageJ. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Повторите эти действия для каждого образа суррогата ткани. Сохранить результаты измерений и соответствующие идентификаторы изображений в программе электронных таблиц.
- Загрузить файлы изображений, используемые для измерения площади в ImageJ в CellProfiler путем перетаскивания файлов изображений в "Список файлов". Назначьте имя для изображения, импортированные вК "NamesAndTypes" модуль ввода и выберите тип изображения (то есть, "цветное изображение").
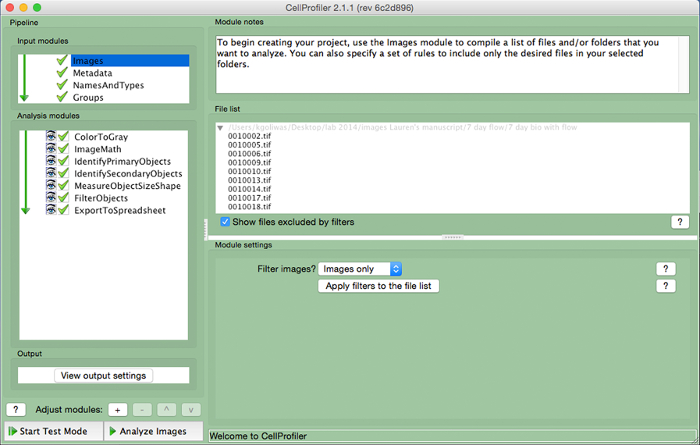
Рисунок 3. Пример CellProfiler трубопровода. Снимок экрана трубопровода , предназначенного для измерения количества ядросодержащих клеток в CellProfiler. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Создание трубопровода анализа , который включает в себя следующие модули для расчета количества клеток на изображении, нажав на знак "+" рядом с "Adjust модуля" (рисунок 3, в нижней части левой панели). Добавьте каждый из перечисленных ниже модулей.
- Выберите "ColorToGray" (рисунок 4).
- Выберите имя входного изображения из выпадающего меню, имя выходного изображения, а также выбрать тип оригинала изображения ( то есть, RGB , если цвет входного изображения).
Примечание: Этот модуль не будет необходимости при использовании черно - белых изображений
- Выберите имя входного изображения из выпадающего меню, имя выходного изображения, а также выбрать тип оригинала изображения ( то есть, RGB , если цвет входного изображения).
- Выберите "ImageMath" (рисунок 5).
- Выберите операцию "Инверсия", имя выходного изображения, а затем выберите изображение в оттенках серого на вкладке "выбрать первое изображение".
- Выберите "IdentifyPrimaryObjects" (рисунок 6).
- Выберите входное изображение (изображение после коррекции по математике), имя основной идентифицировать объект (ядра) и введите диапазон диаметров для объектов должны измеряться в единицах пикселов (приблизительно от 25 до 65 лет). Выберите "адаптивный" пороговой стратегии с методом "Оцу пороговой" с "тремя классами". Не изменяйте никакие другие параметры из настроек по умолчанию.
Примечание: оптимальный диапазон диаметров должно быть определено путем открытия изображения в модуле входного изображения и измерения диаметра ядер (то есть,первичный объект) с помощью инструмента измерения длины.
- Выберите входное изображение (изображение после коррекции по математике), имя основной идентифицировать объект (ядра) и введите диапазон диаметров для объектов должны измеряться в единицах пикселов (приблизительно от 25 до 65 лет). Выберите "адаптивный" пороговой стратегии с методом "Оцу пороговой" с "тремя классами". Не изменяйте никакие другие параметры из настроек по умолчанию.
- Выберите "IdentifySecondaryObjects" (рисунок 7).
- Выберите входное изображение (изображение после коррекции по математике), выбрать входные объекты (ядра), а также назвать объекты, которые будут определены (клетки). Выберите метод "распространения" для идентификации вторичных объектов, используйте "адаптивный" пороговой стратегии и метод "Оцу" с "двумя классами" сведение к минимуму "взвешенной дисперсии". Выберите "без сглаживания" и коэффициент коррекции порога 1, нижняя и верхняя границы 0 и 1, а коэффициент регуляризация 0,05. Не изменяйте никакие другие параметры из настроек по умолчанию.
- Выберите "MeasureObjectSizeShape" (рисунок 8).
- Выделение ячеек (вторичный объект) и ядра (первичный объект) в качестве объектов, подлежащих измерению.
- Выберите "FilterObjects" (рисунок 9 ).
- Назовите выходные объекты и выберите ядра (первичный объект) в качестве объекта для фильтрации.
- Держите следующие два параметра в соответствии с настройками по умолчанию. Выберите "AreaShape" в качестве измерения для фильтрации по категориям, и "формфактора" в качестве измерения.
- Выберите "Да" для фильтрации с использованием минимального значения измерения и добавьте минимальное значение 0,52.
- Выберите "Нет" для фильтрации с использованием максимального измерения.
- Выберите "Да", чтобы сохранить контуры объектов, отфильтрованных и имя очерченное изображение.
- Выберите "ExportToSpreadsheet" (рисунок 10)
- Выберите место для сохранения файла и имя "Output Files".
- После того, как трубопровод анализа генерируется (шаги 6.7.1 на 6.7.7.1), начать "Тестовый режим" в CellProfiler и оценивать каждый шаг, в том числе, что ядра в тестовом изображении надлежащим образом фильтруется, чтобы обеспечить оптимальную рараметры были выбраны для идентификации клеток. На рисунке 11 показан выходной сигнал изображения из CellProfiler следующей фильтрации, где ядра правильно идентифицированы (обведено зеленым), а фон отфильтровывают.
- После того, как параметры оцениваются и определяются достаточными, сохранить проект, а затем нажмите кнопку "Анализ изображений". Этот проект может быть использован повторно для последующего анализа.
Примечание: После того, как параметры были установлены, программа настроена , чтобы проанализировать все изображения в "Список файлов", последовательно. Это приведет к несколько окон открытия для каждого изображения анализируемого, что вызывает большее время обработки.- Чтобы избежать более длительного времени обработки, нажмите на иконку глаза на все модули, за исключением "ExportToSpreadsheet" в разделе "Анализ модулей".
- После того, как все суррогатные изображения были обработаны CellProfiler, откройте таблицу, содержащую данные изображения, генерируемые Cell Профили и электронную таблицу, содержащую область, измеренная с помощью ImageJ. Скопируйте отфильтрованные данные ядра (столбец D в CellProfiler таблицу) и идентификаторы изображений (столбец R) и вставить их в таблицу, содержащую данные измеренной площади.
- Вычислить сумму всех измерений, полученных для числа ядер в образе суррогата.
- Вычислить сумму измерений, полученные для суррогатной области от каждого образа суррогата. Разделите общую площадь , измеренное 1x10 6.
- Следует разделить общее количество ядер общего измерения площади в описанной выше стадии , чтобы получить значение числа клеток на 1x10 6 пикселей 2.
- Выберите "ColorToGray" (рисунок 4).
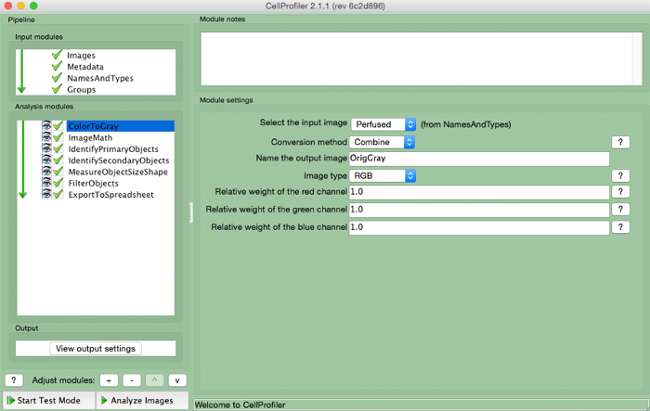
Рисунок 4. CellProfiler трубопровода: изменение изображения в оттенках серого Скриншот модуля "ColortoGray"..s: //www.jove.com/files/ftp_upload/54004/54004fig4highres.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Рисунок 5. CellProfiler трубопровода:.. Переворачивая изображение Снимок экрана модуля "ImageMath" Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 6. CellProfiler трубопровода:.. Идентифицирующие ядра Снимок экрана модуля "IdentifyPrimaryObjects" Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Рисунок 7. CellProfiler трубопровода:.. Идентифицирующие клетки Снимок экрана модуля "IdentifySecondaryObjects" Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Рисунок 8. CellProfiler трубопровода:.. Измерительные объекты Снимок экрана модуля "MeasureObjectSizeShape" Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Рисунок 9. CellProfiler трубопровода:. Фильтрация объектов Снимок экрана "FilterObjects "модуль. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Рисунок 10. CellProfiler трубопровода:.. Экспорт данных Снимок экрана модуля "ExportToSpreadsheet" Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
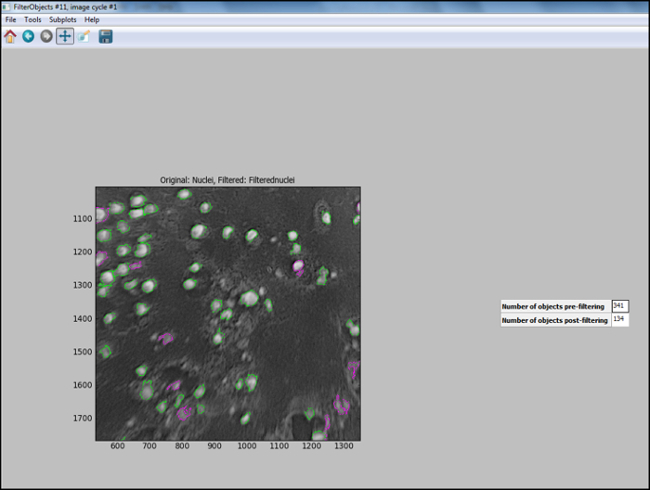
Рисунок 11. Выход CellProfiler следующие фильтрации. Снимок экрана вывода экрана в ячейке профайлере следующей фильтрации объекта. Пожалуйста , нажмите здесь , чтобы увидеть увеличенное Versiна этой фигуре.
Результаты
Цельных и перфузируемые 3D суррогаты рака молочной железы были получены, как описано выше, и выращивали в течение 7 дней. Впоследствии суррогаты фиксировались, обработаны парафином, делали срезы и окрашивали гематоксилином и эозином, как описано выше. Было измерено кол...
Обсуждение
При этом метод 3D культуры было описано, что включает в себя компоненты микроокружения ткани, в том числе внеклеточного матрикса (ЕСМ) и фибробластами стромы человека, в объеме, который более точно модели рака молочной железы человека, чтобы позволить для разработки суммирующий 3D морфол...
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
The University of Alabama at Birmingham Center for Metabolic Bone Disease performed the histologic processing and sectioning of surrogates. Southern Research (Birmingham, AL) provided support for the manufacture of the bioreactor system. Funding was provided by the United States Department of Defense Breast Cancer Research Program (BC121367).
Материалы
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagel Medium 1x (DMEM) | Corning CellGro | 10-014-CV | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | |
| 0.25% Trypsin + 2.21 mM EDTA 1x | Corning | 25-053-CI | |
| Tissue Culture plates, 100 mm | CellTreat Scientific Products | 229620 | Sterile |
| Tissue Culture plates, 35 mm | CellTreat Scientific Products | 229638 | For PDMS foam formation |
| 9" Glass pipette | Fisher | 13-678-20D | Sterile |
| 10 ml pipette | CellTreat Scientific Products | 229210B | Sterile |
| 1,000 µl piptette tips | FisherBrand | 02-717-166 | Sterile Filtered |
| 200 µl pipette tips | FisherBrand | 02-717-141 | Sterile Filtered |
| 10 µl pipette tips | FisherBrand | 02-717-158 | Sterile Filtered |
| 15 ml conical tubes | CellTreat Scientific Products | 229410 | Sterile |
| 50 ml conical tubes | CellTreat Scientific Products | 229422 | Sterile |
| 1.5 ml microcentrifuge tubes | FisherBrand | 05-408-129 | Sterile |
| Trypan blue | Corning Cellgro | 25-900-CI | Sterile |
| Sylgard 184 | Electron Microscopy Sciences | 24236-10 | PDMS elastomer and curing agent. Used for our in-house bioreactor. |
| PDMS Foam | Made in-house for use in our in-house bioreactor. | ||
| High Concentration Bovine Collagen Type I | Advanced Biomatrix | 5133-A | FibriCol ~10 mg/ml |
| Growth Factor Reduced Matrigel (Basement Membrane) | Corning | 354230 | Basement membrane material |
| Sodium Bicarbonate | Sigma | S8761 | |
| Molecular Biology Grade Water | Fisher | BP2819-1 | |
| DMEM 10x | Sigma-Aldrich | D2429 | |
| Nunc Lab-Tek Chamber Slide System | Thermo Scientific | 177402 | 8-well |
| Bioreactor | Made in-house. | ||
| Spring-Back 304 Stainless Steel—Coated with PTFE polymer | McMaster-Carr | 1749T19 | Stainless steel wires to generate microchannels in our in-house bioreactor system. 0.016" Diameter |
| BioPharm Plus platinum-cured silicone pump tubing, L/S 14 | Masterflex | EW-96440-14 | For use in our in-house bioreactor system. Tubing ID: 1.6 mm, Hose barb size: 1/16 in. |
| 2-Stop Tubing Sets, non-flared PVC, 1.52 mm ID | Cole-Parmer | EW-74906-36 | For use in our in-house bioreactor system (with microperistalitic pump). |
| Six Channel precision micro peristaltic pump | Cole-Parmer | EW-74906-04 | For use with our in-house bioreactor system |
| Tuberculin Syringes | BD Medical | 309625 | 26 gauge 3/8 in. needle; Sterile |
| Dissecting Tissue Forceps | FisherBrand | 13-812-36 | 5.5 inch |
| Mini Tube Rotator | Boekel Scientific | 260750 | Equipment option for surrogate rotation. Used with carousel for 50 ml tubes (model number 260753) |
| 50 ml tube carousel | Boekel Scientific | 260753 | Used with mini tube rotator |
| Bambino Hybridization Oven | Boekel Scientific | 230301 | Equipment option for surrogate rotation |
| HistoGel Specimen Processing Gel | Thermo Scientific | HG-4000-012 | Specimen Processing Gel described in Step 5.2 |
| Cryomold | Andwin Scientific | 4566 | 15 mm x 15 mm x 5 mm |
| Tissue Marking Dye | Cancer Diagnostics, inc. | 03000P | Can be used to mark surrogates, allowing multiple samples to be included in one tissue cassette |
| Hinged tissue cassettes | FisherBrand | 22-272-416 | |
| Formalin | Fisher | 23-245-685 | |
| GoldSeal Plain Glass Slides | Thermo Scientific | 3048-002 | |
| Xylene | Fisher | X3P-1GAL | |
| Ethanol, 200 proof (100%), USP | Decon Laboratories, Inc. | 2805M | |
| Hematoxylin | Thermo Scientific Richard-Allan Scientific | 7211 | |
| Clarifier | Thermo Scientific Richard-Allan Scientific | 7401 | |
| Bluing Solution | Thermo Scientific Richard-Allan Scientific | 7301 | |
| Eosin Y | Thermo Scientific Richard-Allan Scientific | 7111 | |
| Cytoseal XYL mounting media | Thermo Scientific Richard-Allan Scientific | 83124 | |
| Coverslips | Fisher Scientific | 12-548-5G |
Ссылки
- Hakanson, M., Textor, M., Charnley, M. Engineered 3D environments to elucidate the effect of environmental parameters on drug response in cancer. Integr Biol (Camb). 3 (1), 31-38 (2011).
- Horning, J. L., et al. 3-D tumor model for in vitro evaluation of anticancer drugs. Mol Pharm. 5 (5), 849-862 (2008).
- Dhiman, H. K., Ray, A. R., Panda, A. K. Three-dimensional chitosan scaffold-based MCF-7 cell culture for the determination of the cytotoxicity of tamoxifen. Biomaterials. 26 (9), 979-986 (2005).
- Place, A. E., Jin Huh, S., Polyak, K. The microenvironment in breast cancer progression: biology and implications for treatment. Breast Cancer Res. 13 (6), 227 (2011).
- Mao, Y., Keller, E. T., Garfield, D. H., Shen, K., Wang, J. Stromal cells in tumor microenvironment and breast cancer. Cancer Metastasis Rev. 32 (1-2), 303-315 (2013).
- Paulsson, J., Micke, P. Prognostic relevance of cancer-associated fibroblasts in human cancer. Semin Cancer Biol. 25, 61-68 (2014).
- Roskelley, C. D., Desprez, P. Y., Bissell, M. J. Extracellular matrix-dependent tissue-specific gene expression in mammary epithelial cells requires both physical and biochemical signal transduction. Proc. Natl. Acad. Sci. 91, 12378-12382 (1994).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2008).
- Ivascu, A., Kubbies, M. Rapid generation of single-tumor spheroids for high-throughput cell function and toxicity analysis. J Biomol Screen. 11 (8), 922-932 (2006).
- Lovitt, C. J., Shelper, T. B., Avery, V. M. Advanced cell culture techniques for cancer drug discovery. Biology (Basel). 3 (2), 345-367 (2014).
- Bergamaschi, A., et al. Extracellular matrix signature identifies breast cancer subgroups with different clinical outcome. J Pathol. 214 (3), 357-367 (2008).
- Oskarsson, T. Extracellular matrix components in breast cancer progression and metastasis. The Breast. 22, S66-S72 (2013).
- Kelley, L. C., Lohmer, L. L., Hagedorn, E. J., Sherwood, D. R. Traversing the basement membrane in vivo: A diversity of strategies. JBC. 204 (3), 291-301 (2014).
- Sadlonova, A., et al. Breast fibroblasts modulate epithelial cell proliferation in three-dimensional in vitro co-culture. Breast Cancer Res. 4, (2004).
- Wendt, D., Marsano, A., Jakob, M., Heberer, M., Martin, I. Oscillating perfusion of cell suspensions through three-dimensional scaffolds enhances cell seeding efficiency and uniformity. Biotechnol Bioeng. 84 (2), 205-214 (2003).
- Marshall, L. E., et al. Flow-perfusion bioreactor system for engineered breast cancer surrogates to be used in preclinical testing. J Tissue Eng Regen Med. , (2015).
- Calcagnile, P., Fragouli, D., Mele, E., Ruffilli, R., Athanassiou, A. Polymeric foams with functional nanocomposite cells. RSC Adv. 4, 19177-19182 (2014).
- Naba, A., Clauser, K. R., Lamar, J. M., Carr, S. A., Hynes, R. O. Extracellular matrix signatures of human mammary carcinoma identify novel metastasis promoters. eLife. 3, (2014).
- Lochter, A., Bissell, M. J. Involvement of extracellular matrix constituents in breast cancer. Semin Cancer Biol. 6 (3), 165-173 (1995).
- Joiner, K. S., Spangler, E. A. Evaluation of HistoGel-embedded specimens for use in veterinary diagnostic pathology. J Vet Diagn Invest. 24 (4), 710-715 (2012).
- Varsegi, G. M., Shidham, V. Cell Block Preparation from Cytology Specimen with Predominance of Individually Scattered Cells. J Vis Exp. (29), e1316 (2009).
- Sadlonova, A., et al. Human Breast Fibroblasts Inhibit Growth of the MCF10AT Xenograft Model of Proliferative Breast Disease. Am J Pathol. 170 (3), (2007).
- Otali, D., He, Q., Stockard, C. R., Grizzle, W. E. Preservation of immunorecognition by transferring cells from 10% neutral buffered formalin to 70% ethanol. Biotech Histochem. 88, 170-180 (2013).
- Webster, S. S., Jenkins, L., Burg, K. J. L. Histological Techniques for Porous, Absorbable, Polymeric Scaffolds, Used in Tissue Engineering. J Histotechnol. 26 (1), 57-65 (2003).
- Troy, T. -. C., Arabzadeh, A., Enikanolaiye, A., Lariviere, N., Turksen, K. Immunohistochemistry on Paraffin Sections of Mouse Epidermis Using Fluorescent Antibodies. J Vis Exp. (11), (2008).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Kwon, Y. -. J., et al. Gli1 enhances migration and invasion via up-regulation of MMP-11 and promotes metastasis in ERa negative breast cancer cell lines. Clin Exp Metastasis. (28), (2011).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for Immunohistochemistry on Cryosectioned Rat Brain Tissue: Example Staining for Microglia and Neurons. J Vis Exp. (99), e52293 (2015).
- Pal, A., Kleer, C. G. Three dimensional cultures: a tool to study normal acinar architecture vs. malignant transformation of breast cells. J Vis Exp. (86), e51311 (2014).
- Hasselbach, L. A., et al. Optimization of High Grade Glioma Cell Culture from Surgical Specimens for Use in Clinically Relevant Animal Models and 3D Immunochemistry. J Vis Exp. (83), e51088 (2014).
- Foty, R. A Simple Hanging Drop Cell Culture Protocol for Generation of 3D Spheroids. J Vis Exp. (51), e2720 (2011).
- Materne, E. -. M., et al. The Multi-organ Chip - A Microfluidic Platform for Long-term Multi-tissue Coculture. J Vis Exp. (98), e52526 (2015).
- Sadlonova, A., et al. Identification of Molecular Distinctions Between Normal Breast-Associated Fibroblasts and Breast Cancer-Associated Fibroblasts. Cancer Microenviron. 2, 9-21 (2009).
- Wang, J. D., Douville, N. J., Takayama, S., ElSayed, M. Quantitative analysis of molecular absorption into PDMS microfluidic channels. Ann Biomed Eng. 40 (9), 1862-1873 (2012).
- Halldorsson, S., Lucumi, E., Gomez-Sjoberg, R., Fleming, R. M. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosens Bioelectron. 63, 218-231 (2015).
- Regehr, K. J., et al. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab Chip. 9 (15), 2132-2139 (2009).
- Burdett, E., Kasper, F. K., Mikos, A. G., Ludwig, J. A. Engineering tumors: a tissue engineering perspective in cancer biology. Tissue Eng Part B Rev. 16 (3), 351-359 (2010).
- Caruso, R. A., et al. Mechanisms of coagulative necrosis in malignant epithelial tumors (Review). Oncol Lett. 8 (4), 1397-1402 (2014).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicol Pathol. 35 (4), 495-516 (2007).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 146 (1), 3-15 (1995).
- Ogino, S., et al. Molecular pathological epidemiology of epigenetics: emerging integrative science to analyze environment, host, and disease. Mod Pathol. 26 (4), 465-484 (2013).
- Otali, D., et al. Combined effects of formalin fixation and tissue processing on immunorecognition. Biotech Histochem. 84 (5), 223-247 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены