Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung und Analyse von
In diesem Artikel
Zusammenfassung
We demonstrate a method to generate 3D breast cancer surrogates, which can be cultured using a perfusion bioreactor system to deliver oxygen and nutrients. Following growth, surrogates are fixed and processed to paraffin for evaluation of parameters of interest. The evaluation of one such parameter, cell density, is explained.
Zusammenfassung
Dreidimensionale (3D) Kultur ist eine physiologisch relevante Methode Zellverhalten in vitro als zweidimensionale Kultur zu modellieren. Karzinome, Brustkarzinome, einschließlich, sind komplexe 3D-Gewebe von Krebs besteht Epithelzellen und Stromazellen Komponenten, einschließlich Fibroblasten und extrazelluläre Matrix (ECM). Doch die meisten in vitro - Modelle von Mammakarzinom nur von Krebs epithelialen Zellen bestehen, Weglassen des Stromas und damit die 3D - Architektur eines Tumors in vivo. Entsprechende 3D-Modellierung von Karzinomen ist wichtig für eine genaue Verständnis der Tumorbiologie, Verhalten und Ansprechen auf die Therapie. Jedoch wird die Dauer der Kultur und das Volumen von 3D-Modellen durch die Verfügbarkeit von Sauerstoff und Nährstoffe in der Kultur beschränkt. Hierin zeigen wir ein Verfahren, bei dem Mammakarzinom Epithelzellen und Stromazellen Fibroblasten in ECM integriert sind ein 3D Brustkrebs Surrogat zu erzeugen, das Stroma enthält und als kultiviert werden,solide 3D-Struktur oder durch eine Perfusionsbioreaktorsystem System unter Verwendung von Sauerstoff und Nährstoffe zu liefern. Nach Einrichtung und einer anfänglichen Wachstumsperiode Surrogate können für die präklinische Drogentests verwendet werden. Alternativ können die zelluläre und Matrixkomponenten des Surrogat modifiziert werden, um eine Vielzahl von biologischen Fragen anzugehen. Nach der Kultur werden fixiert und Surrogate, in einer Weise zur Auswertung von Parametern von Interesse für die Behandlung der klinischen Brustkarzinom Proben, ähnlich zu Paraffin verarbeitet. Die Auswertung eines solchen Parameters, der Dichte der Zellen vorhanden ist, erklärt, wobei ImageJ und CellProfiler Bildanalysesoftwaresysteme Photomikrographien von histologischen Schnitten von Surrogaten angewendet werden, um die Anzahl von nukleierten Zellen pro Fläche zu quantifizieren. Dies kann als ein Indikator für die Veränderung der Zellzahl über die Zeit oder der Veränderung der Zellzahl verwendet werden, die aus unterschiedlichen Wachstumsbedingungen und Behandlungen.
Einleitung
Dreidimensionale (3D) Kulturmodelle , die genauer den Tumor Architektur und Mikroumgebung in vivo nachahmen sind wichtig für die Studien mit dem Ziel , die komplexen Wechselwirkungen zwischen Zellen und ihrer Mikroumgebung zu sezieren und die Wirksamkeit von Therapien Kandidaten zu testen. Tumor Dimensionalität Auswirkungen von Nährstoffen und Sauerstoff - Gradienten, die Gleichförmigkeit der Wirkstoffexposition, interstitielle Druck / Durchblutung und 3D - Architektur 1-4. Die Anwesenheit eines geeigneten stromalen Mikroumgebung trägt zur Tumor Dimensionalität und Einflüsse zell ECM Signalisierungs- und parakrine Signalisierung zwischen Stromazellen und maligne Epithelzellen. Die Auswirkungen von Tumor Dimensionalität und der Mikroumgebung auf die Zellfunktion sind gut etabliert, mit beiden Faktoren verändern Arzneimittelreaktion 1,3,5-8. Zusätzlich Zellwachstum Kinetik, Stoffwechselraten und Zellsignalisierung unterscheiden sich zwischen den zweidimensionalen (2D) Kultur und Kultur in 3D, mit diesen Faktoren affefesselndes zelluläre Antwort 1,3,8-10.
In vitro kann der Tumor - Mikroumgebung Surrogat indem repräsentative ECM Bestandteile und Stroma - Zellpopulationen moduliert werden. Maligne Epithelzellen werden durch das ECM und Krebs-assoziiertes Stroma - Zellen , die entweder in einer synergistischen / protektiv Weise beeinflusst Tumorprogression oder in einer unterdrückenden Art und Weise weiter zu fördern Tumorausbreitung 5,6,10 hemmen. In jedem Zusammenhang kann das Stroma beeinflussen therapeutische Reaktion und Arzneimittelabgabe über parakrine Signalisierungs- und / oder durch interstitiellen Druck in dem Tumor Erhöhung was zu einer verringerten Medikamentenabgabe 1,6. Daher hilft die Zugabe von ECM und Stromazellen in präklinischen Modellen Aspekte des Tumors rekapitulieren, die nicht gut in 2D Kultur modelliert werden können.
Hierin wird ein Verfahren Brustkrebs Surrogate zu etablieren, die eine zusammenfassender Mikro integrieren, einschließlich ECM Bestandteile und stromal Zellen in einem 3D-Volumen beschrieben. In Brustkarzinom ist die stromale Zellpopulation überwiegend wird Krebs-Fibroblasten (CAF) und dem Stroma ECM besteht aus weitgehend von Kollagen Typ zusammengesetzt I mit einem kleineren Anteil der Matrixkomponenten, die in der Basalmembran gefunden werden, einschließlich Laminin und Kollagen Typ IV 1,4,11-13. Daher werden diese Komponenten des Mammakarzinoms Mikroumgebung (dh, CAF, Kollagen I und Basalmembran) wurden in die Surrogate eingebaut. Dieses Verfahren kann verwendet werden , um feste, nicht-perfundierten 3D Surrogate (1A) zu erzeugen , oder können angepasst werden Perfusion des Mediums durch das Surrogat über ein Bioreaktorsystem (1B) aufzunehmen. Beide Ansätze werden hier beschrieben. Dieses Verfahren könnte auch auf andere stromalen Elemente modifiziert werden, wie beispielsweise Tumor-assoziierten Makrophagen, oder andere feste Tumore zu modellieren, indem die zellulären und ECM-Komponenten, gegebenenfalls anzupassen.
Für das Surrogat Mammakarzinoms hier beschrieben, haben wir die MDA-MB-231 (231) Brustkrebs-Zelllinie, CAF zuvor von menschlichen Brustkarzinom 14 und eine ECM , bestehend aus 90% Kollagen I isoliert verwendet ( 6 mg / ml) und 10% Wachstumsfaktor reduziert Basalmembran Material (BM). Der Ersatz wird in einem 8-Well-Kammerobjektträger (fest Surrogat) oder ein Bioreaktorsystem verwendet wird, um entweder angebaut kontinuierliche Nährstoff Perfusion zu liefern (durchbluteten Surrogat). Jede Perfusions - Bioreaktor - System , das ein Volumen von ECM enthaltenden Zellen aufnehmen kann , kann 15 verwendet werden. Als Beispiel beschreiben wir die Herstellung der Gewebe Surrogate im Bioreaktorsystem. Dieses System wurde im eigenen Haus entwickelt und ist nicht im Handel erhältlich. Weil unsere hier konzentrieren sich auf die Vorbereitung und Analyse der 3D-Gewebe Surrogate ist, haben wir nicht in umfangreichen Detail in Bezug auf die Besonderheiten der Herstellung und Montage unserer Bioreaktorsystem gegangen. Jedoch wird eine detaillierte Beschreibung vonDieses System und seine Entwicklung wurde 16 veröffentlicht. In diesem Bioreaktorsystem, ein Polydimethylsiloxan (PDMS) Strömungskanal des Surrogat zu Haus verwendet wird, die von einem PDMS - Schaum unterstützt wird (gebildet Methoden ähnlich denen von Calcagnile beschriebenen et al. 17). Dieses Volumen wird von 4 Mikrokanäle (jeweils 400 & mgr; m im Durchmesser) durchsetzt, die durch Medium über eine microphysiologic Pumpe kontinuierlich durchblutet werden Sauerstoff und Nährstoffe zum Ersatz zu liefern.Entsprechende Analyse der Surrogate ist entscheidend wichtige Informationen in Bezug auf die Zellfunktion in Reaktion auf die Behandlung oder andere Manipulationen zu gewinnen. Surrogates kann durch verschiedene Verfahren einschließlich der direkten Bildgebung von intaktem Surrogate mittels konfokaler Mikroskopie oder andere Mittel der nichtinvasiven Bildgebung, indirekte Zellanalyse durch Bestimmung des konditionierten Medien oder Perfusat, für sezernierte Produkte oder Analyse auf histologischen Schnitten nach der Fixierung und Verarbeitung analysiert werden, nachParaffin. Ein solcher Parameter, der auf histologischen Schnitten ausgewertet werden kann, ist die Zelldichte. Wir stellen einen Ansatz Zelldichte zu messen (dh die Anzahl von nukleierten Zellen pro Querschnittsfläche) unter Verwendung von halbautomatischen Bildverarbeitungstechniken auf Mikrophotographien von Surrogat histologischen Schnitte angewendet gefärbt mit Hämatoxylin und Eosin (H & E). Die Zelldichte kann als ein Indikator der relativen Änderung der Zellzahl über die Zeit verwendet werden, oder dass die Ergebnisse von unterschiedlichen Wachstumsbedingungen und Behandlungen.
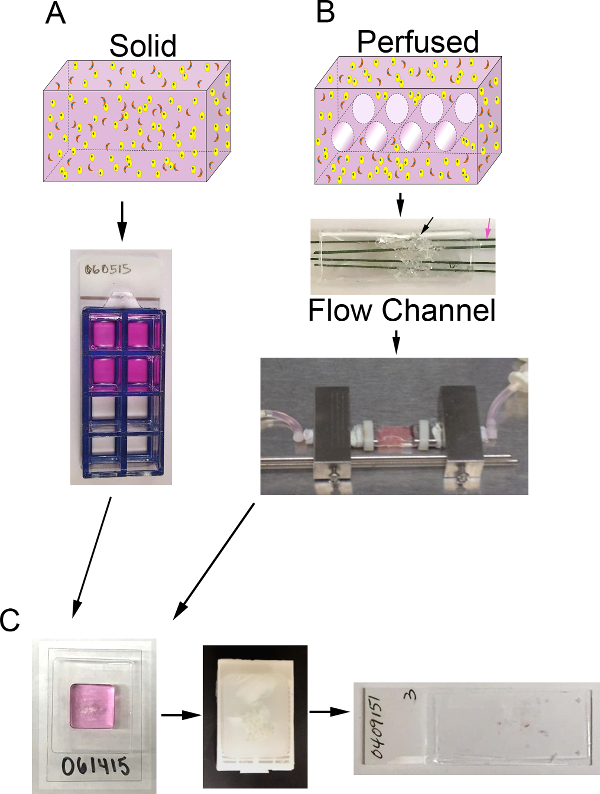
Abbildung 1. 3D - Volumen und Bioreaktorsystem. A) Schematische Darstellung des Prozesses solide 3D - Surrogate zu erzeugen. Top: Karikatur von festen 3D-Volumen enthalten, ECM (pink), epithelialen Karzinomzellen (gelb) und CAF (orange); Unten:. Draufsicht auf 8-Well - Kammer - Folie mit Surrogaten B) Schematische Darstellung des Prozesses 3D Surrogate durchbluteten zu erzeugen. Top: cartoon von 3D-Volumen mit Kanälen für mittlere Perfusion und enthält ECM (pink), epithelialen Karzinomzellen (gelb) und CAF (orange) zu ermöglichen; Mitte: Bild von PDMS Strömungskanal enthält PDMS Schaum (schwarzer Pfeil), um mit Zelle injiziert + ECM und drang durch polymerbeschichteten rostfreien Stahldrähten (pink Pfeil) Messung 400 & mgr; m im Durchmesser; Unten:. Bild des PDMS Strömungskanal einen Surrogat und mit dem Bioreaktorsystem zu ermöglichen , für die kontinuierliche Mediumperfusion (Schlauchpumpe und Medienspeicher nicht dargestellt) C) Bilder von Verarbeitungsschritten für sowohl feste als auch perfundiert Surrogate nach Kultur enthält. Links: Bild des cryomold Probenverarbeitung Gel und Surrogat enthält; Mitte: Bild eines Paraffinblock eine feste und verarbeitet Surrogat enthält; Rechts:. Bild von einem Glasträger mit einem H & E-gefärbten histologischen Schnitt eines Ersatz Bitte hier klicken , um anzuzeigenGrößere Version der Figur.
Protokoll
1. Zellkultur
- Auftauen BM-Komponente über Nacht bei 4 ° C auf Eis.
- Warme Medium auf 37 ° C. Zur Unterstützung des Wachstums beider 231-Zellen und CAF verwenden Dulbeccos modifiziertem Eagle-Medium (DMEM) plus 10% fötalem Rinderserum (FBS).
Hinweis: Die verwendeten Medien auf den Zelltyp und den experimentellen Ziele abhängen. - Entfernen Sie Medium von der Kulturschale (10 cm) von nahezu konfluenten 231 Zellen und fügen Sie 1,5 ml Trypsin / EDTA. Inkubieren für 1 bis 3 min bei 37 ° C, die Überwachung für die Zellablösung. Sobald Zellen, die Platte zu runden und kommen aus starten, durch Zugabe von 3 ml des Medium, das Serum die Reaktion zu stoppen. Pipette das Medium und die Zellen in einem 15 ml konischen Röhrchen.
- Zentrifugieren Sie das Medium und die Zellen bei 150 xg für 5 min. Entfernen Sie den Überstand und resuspendieren das Zellpellet in 2 ml Medium.
- Zählen Sie die Anzahl der Zellen pro Volumen unter Verwendung von Trypanblau und einer Zählkammer. Zelllebensfähigkeit sollte mehr als 90% betragen.
- Wiederholen Sie dieVerfahren mit anderen Zelltypen in dem Surrogat einbezogen werden. Für den Surrogat hier beschrieben ist, wird der Prozess mit dem CAF wiederholt.
- Festlegung einer geeigneten Volumen jeder Zellsuspension der gewünschten Anzahl an Zellen zu erhalten.
Anmerkung: Für den Surrogat hier beschrieben, einer Zelldichte von 2,1 x 10 6 Zellen pro 100 & mgr; l ECM, mit einem 2: 1 - Verhältnis von Epithelzellen Fibroblasten (1,4 x 10 6 231 - Zellen und 7 x 10 5 CAF pro 100 ul ECM), verwendet. Diese Zelldichte ist ein guter Ausgangspunkt; jedoch wird die optimale Zelldichte auf der Zelltyp abhängen, der Dauer der Kultur, und den Zielen des Experiments. - Platzieren Sie die entsprechenden Volumen jeder Zellsuspension in ein 15 ml konisches Röhrchen (ein Rohr für jeden Zelltyp). Zentrifugieren Sie das Medium und die Zellen bei 150 xg für 5 min.
- Nach der Zentrifugation den Überstand, resuspendieren einen Zelltyp in der ZelleKultur-Wasser (178,8 & mgr; l, siehe Tabelle 1) und die andere Zelltyp in 10x DMEM (100 & mgr; l, siehe Tabelle 1, Phenolrot enthält , pH - Wert zu überwachen). Die Röhrchen, die Zellen auf Eis und gehen schnell auf die Herstellung von ECM enthält unten. Begrenzen Sie die Zeit, die die Zellen in Wasser bleiben Lebensfähigkeit zu erhalten.
Hinweis: Die beiden 10x DMEM und die Zellkultur Wasser benötigt Komponenten der ECM; Daher haben wir resuspendieren Zellen in beiden ausgewählt. Hier wählten wir willkürlich erneut zu suspendieren die 231 - Zellen in Zellkultur Wasser und CAF in 10x DMEM, obwohl beide Zelltyp erneut suspendiert in einem dieser beiden Komponenten werden könnte.
2. Herstellung von Zellen, die in ECM (6 mg / ml bovinem Kollagen Typ I + 10% BM)
Hinweis: Ein ECM besteht aus 90% Kollagen I + 10% BM gewählt wurde invasiven Brustkarzinom zu modellieren , da der Tumor - Stroma in dieser Bösartigkeit in erster Linie aus Kollagen bestehtI mit Komponenten des BM, wie Laminin, Kollagen IV, Entactin und einen kleineren Teil des ECM 12,13,18,19 umfasst.
- Auf dem Eis, fügen Sie in der Tabelle 1 aufgeführt , um Komponenten, in ein 2 ml Mikrozentrifugenröhrchen.
Hinweis: Dieser Betrag für 8 feste Surrogate genug ist , oder mit Hilfe des Bioreaktorsystems hier beschrieben, 4 durchbluteten Surrogate.
| Herstellung von Zellen in ECM (6 mg / ml bovinem Kollagen Typ I + 10% BM) | |
| 178,8 μl | Zellkultur Wasser die gewünschte Anzahl von 231-Zellen, die (bestimmt oben) |
| 606 & mgr; l | Kollagen I (10 mg / ml Rinder), fügen tropfen |
| 100 ul | Basalmembran, aufgetaut |
| 100 ul | 10x DMEM (mit Phenolrot) mit der gewünschten Anzahl von CAF (bestimmt oben) |
| 15,2 ul | 7,5% (v / v) Natriumbicarbonat, fügen tropfen |
Tabelle 1. Herstellung von Zellen in ECM.
- Sanft durch Pipettieren mischen, Blasenbildung vermeiden. Überwachen Sie den pH-Wert des Phenolrot im 10x DMEM verwenden. Überprüfen Sie, ob die Mischung eine orange / rosa Farbe anzeigt, einen pH-Wert von ~ 7. Wenn der pH zu niedrig ist (zu gelb), langsam mit zusätzlichen 7,5% Natriumbicarbonat einen Tropfen zu einer Zeit (~ 5 & mgr; l), bis die entsprechende Farbe erreicht ist.
- Halten Sie Mischung auf Eis und arbeiten schnell vorzeitige ECM Polymerisation zu verhindern.
3. Surrogate Vorbereitung
- Für feste 3D - Kulturen (1A):
- Arbeiten in einer Zellkultur Haube sterile Technik, beschriften Sie den Deckel einer sterilen 8-Well-Kammerobjektträger jede experimentelle Variation in Surrogate anzuzeigen.
- Halten Sie die Kammer gleiten auf Eis zu einer vorzeitigen ECM Polymerisation zu verhindern, Pipette langsam 100 ul der Zell + ECM-Mischung in jede Vertiefung der 8-Well-Kammer-Folie.
Hinweis: Pipettieren der Zelle + ECM - Gemisch um die Ränder der Vertiefung ersten besser hilft , um die Zelle + ECM Mischung in das Bohrloch zu verteilen. - Inkubieren Surrogate bei 37 ° C, 5% CO 2 für 45 min ECM Polymerisation zu ermöglichen.
- Folgende ECM Polymerisation werden 100 ul Kulturmedium zu jeder Vertiefung und Inkubation bei 37 ° C, 5% CO 2 für die Dauer des Experiments,alle zwei Tage ändernden Kulturmedium.
- Für perfundiert 3D Kulturen in einem Bioreaktorsystem (1B):
- Sterilisieren alle Bioreaktor Komponenten für die 3D - Kultur - Setup (dh Bioreaktor, Schläuche, Zange und Armaturen , die für Bioreaktor - Setup) unter Verwendung des Verfahrens spezifisch für den Bioreaktor verwendet werden.
- Für das Beispiel hier Bioreaktorsystem verwendet werden , verwenden eine Kombination aus dem Autoklavieren (beispielsweise 12 min Exposition bei 121,1 ° C mit 15 min Trocknung) und für 1 Stunde in 70% Ethanol inkubiert.
- Vorbereiten und den Teil des Bioreaktorsystem zusammenstellen, die das Surrogat beherbergen wird.
- Für das Beispiel Bioreaktorsystem hier verwendet wird, ein PDMS-Schaum-Backbone in den PDMS Strömungskanal einsetzen Schlauch mit einer Pinzette. Push vier (400 um) polymerbeschichteten rostfreien Stahldrähten in das PDMS Schaum parallel Mikrokanäle zu erzeugen.
- In einer Zellkultur Kapuze, mit Sterile Technik und eine 26-Gauge-Nadel mit der Spritze, injizieren die Zelle + ECM-Gemisch in den Bereich des Perfusionsbioreaktor enthalten Zellen entwickelt. Gehen schnell zum nächsten Schritt.
- Um sicherzustellen, dass eine gleichmäßigere Verteilung der Zellen innerhalb der Surrogate, stellen Sie den Bioreaktor Komponente die Surrogate in einem 50 ml konischen Röhrchen Gehäuse (unter der Zellkultur Haube) und drehen Sie kontinuierlich bei ~ 18 Umdrehungen pro Minute während 45 Minuten bei 37 ° C inkubiert ECM zu ermöglichen Polymerisation.
Hinweis: Rotation abgeschlossen werden kann , eine Drehvorrichtung in den Inkubator verwendet oder ein Ofen mit einem in Rotator eingebaut, wie beispielsweise einem Hybridisierungsofen bei 37 ° C eingestellt. - Schließen Sie den Bioreaktor Montage des Stellvertreters in der Transfusionspumpe mit den Anweisungen des Herstellers enthält.
Anmerkung: Die Einzelheiten dieses Prozesses wird in Abhängigkeit von dem Bioreaktor abhängig und die Pumpe verwendet wird.- Für das Beispiel Bioreaktorsystem hier verwendet wird, entfernen Sie die Edelstahldrähte vor dem biorea zu verbindenCtor Anordnung an der Pumpe.
- Startmedium Perfusion (bulk Strömungsgeschwindigkeit von 167,1 & mgr; l / min; Mikrokanalwandschubspannung von 1 dyn / cm 2) in einem Inkubator bei 37 ° C, 5% CO 2.
Anmerkung: Die Rate der Mediumperfusion eingestellt werden kann, abhängig von dem Bioreaktor Aufbau und die Ziele und die Gestaltung des Experiments. - Weiterhin Mediumperfusion für die Dauer des Experiments Kulturmedium ändert alle sieben Tage.
- Sterilisieren alle Bioreaktor Komponenten für die 3D - Kultur - Setup (dh Bioreaktor, Schläuche, Zange und Armaturen , die für Bioreaktor - Setup) unter Verwendung des Verfahrens spezifisch für den Bioreaktor verwendet werden.
4. Surrogate Fixierung und Verarbeitung (1C)
- Etiketten cryomolds und Kunststoff Gewebekassetten für Surrogat Fixierung und Verarbeitung.
- Als nächstes encase Surrogate in der Probenverarbeitung Gel, das ein wässriges Material, das bei warmen Temperaturen flüssig ist, aber erstarrt bei Raumtemperatur. Die Probenverarbeitung Gel hilft bei der Surrogate während der Verarbeitung intakt zu halten und erleichtert histologischen Schnitt 14,20-22.
- Melt Probe Verarbeitung Gel in einem 60 ° C Wasserbad es zu verflüssigen, bei dieser Temperatur, bis sie bereit halten zu verwenden. Bewegen Sie den Bioreaktor mit dem Surrogat zu einem Bio-Sicherheitsschrank.
- Pipette ca. 300 & mgr; l Probenverarbeitung Gel in die Unterseite des markierten cryomold (1C, linkes Feld).
- eine Skalpellklinge (Nr 10 bevorzugt) und einer Pinzette vorsichtig die Surrogat aus dem Bioreaktor oder aus dem Brunnen eines 8-Well-Kammerobjektträger zu entfernen und legen Sie sie in die cryomold Verwendung enthält Probe Gel verarbeitet.
Hinweis: Gewebemarkierungsfarbstoffe (siehe Materialien / Ausrüstungsliste für ein bestimmtes Beispiel) von verschiedenen Farben verwendet werden Surrogate zu markieren, wodurch mehrere Proben in einer Gewebekassette in einer unterscheidbaren Art und Weise aufgenommen werden. - Pipette ca. 300 & mgr; l Probe Gel Verarbeitung des Surrogat im cryomold zu decken und für 30 Minuten bei 4 ° C inkubieren bis solidify.
- Sobald die Probenverarbeitung Gel erstarrt ist, entfernen Sie die Probenverarbeitung Gel das Surrogat aus dem cryomold enthält, und in eine Gewebekassette platzieren.
- Legen Sie die Gewebekassette die Leihmutter in 10% neutral gepuffertem Formalin für 10 bis 12 Stunden bei Raumtemperatur mit vollständigen Fixierung zu ermöglichen.
- Nach der Fixierung, bewegen Sie die Gewebekassette das Surrogat zu 70% Ethanol enthalten, bis zu Paraffin verarbeitet.
Hinweis: Die Übertragung der Ersatz von Formalin zu Ethanol verhindert eine Über Fixierung mit Formalin , die 23 Verlust der Immunreaktivität einiger Epitope führen kann. Die Zeitdauer , in Ethanol ist nicht kritisch. Diese Änderung der Fixiermittel ist wichtig , wenn die Leihmutter für die Immunhistochemie oder Immun verwendet werden. Der feste Surrogat ist nun bereit für die Verarbeitung zu Paraffin (1C, Mitte). Diese Verarbeitung wird typischerweise in einem Gewebeprozessor durchgeführt wird in einer ca. befindetopriately Histologie Labor ausgestattet. Eine kürzere Programm ist aufgrund der Größe und empfindliche Natur der Surrogate empfohlen. 24
5. Sectioning und H & E-Färbung (1C, rechts)
- Nach der Verarbeitung der Surrogate zu einem Paraffinblock, Abschnitt mit ihnen eine Standard - Mikrotom zum Schneiden von Formalin-fixierten und in Paraffin eingebetteten Gewebe 24,25.
Hinweis: Dies kann in einem qualifizierten Histologie Labor durchgeführt werden, oder in einem Forschungslabor, wenn sie richtig ausgerüstet und erfahren. Die Dicke der histologischen Schnitte können in Abhängigkeit von der beabsichtigten Verwendung der Abschnitte variieren; jedoch verwenden wir typischerweise Abschnitte , die 5 um dick sind. Die PDMS - Schaum hier in den perfundierten Surrogate verwendet wird leicht mit einem Mikrotom geschnitten. - Platzieren Sie Abschnitte auf normalem Glas histologische Dias.
- Nach dem Schneiden, backen die histologischen Schnitten bei 58 ° C für 10-12 Stunden für die Färbung vorzubereitenmit Hämatoxylin und Eosin (H & E). Backen schmilzt das Paraffin und ermöglicht auch eine bessere Einhaltung der Abschnitte auf den Glasträger.
- H & E-Färbung:
- Richten Sie die beschriebenen Stationen in Tabelle 2 in einem Färbetrog oder Glas färbekasten, abhängig von der Anzahl der Folien zu färben. Sobald Reagenzien eingerichtet werden, bewegen sich die Abschnitte durch jede Station, um für die Zeit unter 24 angegeben inkubiert.
- Montieren Sie einen Deck zu jeder Folie mittels Befestigungs Medien.
- Lassen Sie Montage Medien vor der Abbildung, um zu trocknen.
| H & E - Färbung | ||
| Station | Lösung | Zeit |
| 1 | Xylen | 5 Minuten |
| 2 | Xylen | 5 min |
| 3 | Xylen | 5 Minuten |
| 4 | 100% Ethanol | 5 Minuten |
| 5 | 100% Ethanol | 5 Minuten |
| 6 | 95% Ethanol | 5 Minuten |
| 7 | 95% Ethanol | 5 Minuten |
| 8 | Leitungswasser | 5 Minuten |
| 9 | Deionisiertes Wasser | 5 Minuten |
| 10 | Hematoxylin 7211 | 5 Minuten |
| 11 | Leitungswasser | 5 Minuten |
| 12 | Erheller * | 10 Dips |
| * Richard Allan # 7401 oder 70% Ethanol + 0,5% HCl | ||
| 13 | Leitungswasser | 5 Minuten |
| 14 | Bluing Reagenz | 30 sec |
| 15 | Leitungswasser | 5 Minuten |
| 16 | 95% Ethanol | 10 Dips |
| 17 | Eosin-Y | 1 Minute |
| 18 | 95% Ethanol | 10 Dips |
| 19 | 95% Ethanol | 10 Dips |
| 20 | 100% Ethanol | 10 Dips |
| 21 | 100% Ethanol | 10 Dips |
| 22 | 100% Ethanol | 5 Minuten |
| 23 | Xylen | 10 Dips |
| 24 | Xylen | 5 Minuten |
Tabelle 2 H & E - Färbung.
6. Messzelldichte
- Bild mindestens eine gesamte H & E-gefärbten histologischen Schnitt des Surrogat mit Hellfeldmikroskopie bei 400-facher Vergrößerung, die Bilder als TIF-Dateien zu speichern.
Hinweis: Die Bildverarbeitung beschrieben ist erst beendet Farbbilder verwenden. Während ungetestet, glauben wir , die gleiche Verarbeitung auch für Graustufenbilder sein sollten. - Herunterladen CellProfiler vom Broad Institute 26 (http://cellprofiler.org/download.shtml) und ImageJ von den National Institutes of Health (http://rsb.info.nih.gov/ij/download.html), die beide die sind kostenlos öffentlich zugänglich.
- Um den Bereich des Surrogat in jedem Bild zu messen, offene ImageJ, wählen Sie "Messungen" (unter der Registerkarte "Analysieren"), wählen Sie "Bereich", und wählen Sie dann "Okay & #34 ;.
- Öffnen Sie ein Bild (TIF-Datei) des Surrogat. Mit dem Polygon - Werkzeug in ImageJ (siehe Abbildung 2), skizzieren die Fläche des Surrogat im Bild durch Ziehen mit der Maus und klicken Sie auf Ankerpunkte zu machen. Verwenden Sie die Ränder des ECM als Leitfaden. Einmal ausgeführt, wählen Sie "Messen" im "Analyze" Registerkarte.
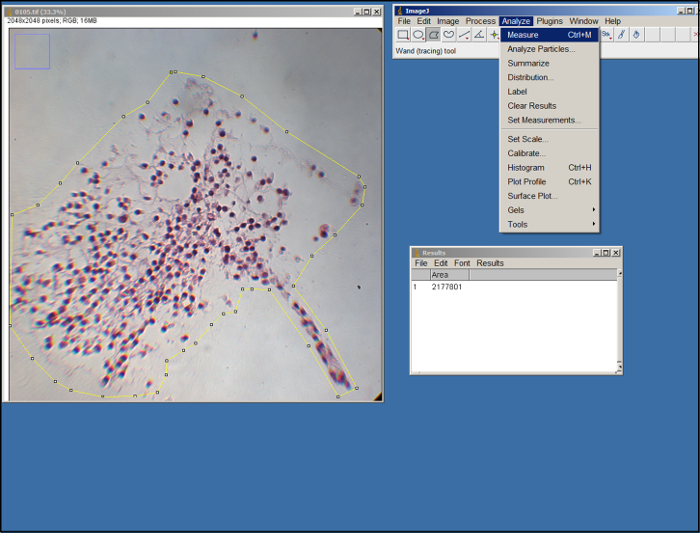
Abbildung 2. ImageJ Analyse. Screenshot von ImageJ Verarbeitung. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
- Wiederholen Sie für jedes Bild des Gewebes Surrogat. Speichern Sie Messungen und entsprechende Bildkennungen in ein Tabellenkalkulationsprogramm.
- Laden Sie Bilddateien Bereich zu messen in ImageJ in CellProfiler durch Ziehen Bilddateien auf den "Dateiliste". Vergeben Sie einen Namen für die importierten Bilder indie "NamesAndTypes" Eingangsmodul und wählen Sie den Bildtyp (dh "Farbbild").
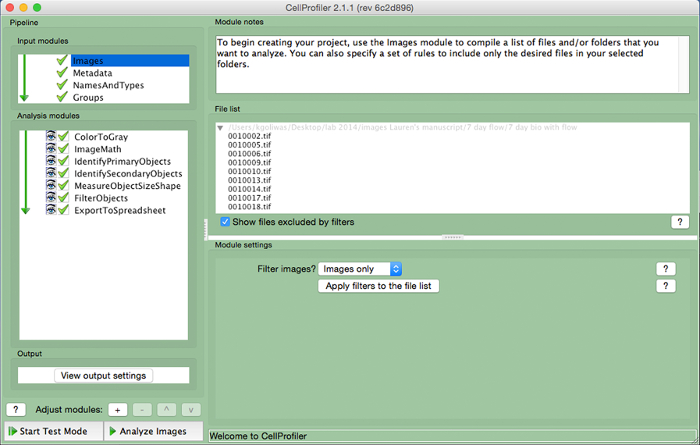
Abbildung 3. CellProfiler Beispiel Pipeline. Screenshot der Pipeline entwickelt , um die Zahl der kernhaltigen Zellen in CellProfiler zu messen. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
- Erstellen Sie eine Analyse - Pipeline , die die folgenden Module umfassen die Anzahl der Zellen pro Bild zu berechnen, indem Sie auf das "+" Zeichen neben "Adjust - Modul" (Abbildung 3, im unteren Bereich der linken Seite). In jedem der Module unten.
- Wählen "ColorToGray" (Abbildung 4).
- Wählen Sie den Eingangsbildnamen aus dem Dropdown-Menü, benennen Sie das Ausgangsbild, und wählen Sie das Originalbildtyp ( dh RGB , wenn Farbbildeingang).
Hinweis: Dieses Modul wäre nicht erforderlich, wenn Graustufenbilder mit
- Wählen Sie den Eingangsbildnamen aus dem Dropdown-Menü, benennen Sie das Ausgangsbild, und wählen Sie das Originalbildtyp ( dh RGB , wenn Farbbildeingang).
- Wählen "ImageMath" (Abbildung 5).
- Wählen Sie die "Invert" Betrieb, benennen Sie das Ausgangsbild, und wählen Sie das Graustufenbild im "wählen Sie zuerst Bild" aus.
- Wählen "IdentifyPrimaryObjects" (Abbildung 6).
- Wählen Sie Eingabebild (Bild nach dem Mathe-Korrektur), nennen Sie die primäre Aufgabe identifiziert werden (Kerne) und geben Sie den Durchmesserbereich für die Objekte in Pixeleinheiten (ca. 25 bis 65) gemessen werden. Wählen Sie "adaptive" Schwellenstrategie mit "Otsu" Schwellwertverfahren mit "drei Klassen". Verwenden Sie keine anderen Parameter aus den Standardeinstellungen zu ändern.
Anmerkung: Die optimale Durchmesserbereich sollte durch Öffnen eines Bildes in dem Eingabebild Modul und Messen des Durchmessers der Kerne (dh bestimmt werden,das primäre Ziel) das Maß Länge Werkzeug.
- Wählen Sie Eingabebild (Bild nach dem Mathe-Korrektur), nennen Sie die primäre Aufgabe identifiziert werden (Kerne) und geben Sie den Durchmesserbereich für die Objekte in Pixeleinheiten (ca. 25 bis 65) gemessen werden. Wählen Sie "adaptive" Schwellenstrategie mit "Otsu" Schwellwertverfahren mit "drei Klassen". Verwenden Sie keine anderen Parameter aus den Standardeinstellungen zu ändern.
- Wählen "IdentifySecondaryObjects" (Abbildung 7).
- Wählen Sie das Eingangsbild (Bild nach dem Mathe-Korrektur), wählen Sie die Eingabeobjekte (Kerne), und nennen Sie die Objekte identifiziert (Zellen) werden. Wählen Sie die "Ausbreitung" Methode sekundäre Objekte zu identifizieren und nutzen die "adaptive" Schwellenstrategie und "Otsu" Methode mit "zwei Klassen" minimiert "gewichtete Varianz". Wählen Sie "keine Glättung" und einen Schwellenwert-Korrekturfaktor von 1, untere und obere Grenze von 0 und 1, und ein Regularisierungsfaktor von 0,05. Verwenden Sie keine anderen Parameter aus den Standardeinstellungen zu ändern.
- Wählen Sie "MeasureObjectSizeShape" (Abbildung 8).
- Markieren Sie die Zellen (sekundäre Objekt) und Kerne (primäres Ziel) als die Objekte gemessen werden.
- Wählen Sie "FILTER" (Abbildung 9 ).
- Benennen Sie die Ausgabeobjekte und wählen Sie die Kerne (primäres Ziel) als das Objekt zu filtern.
- Halten Sie die nächsten beiden Parameter gemäß den Standardeinstellungen. Wählen Sie "AreaShape", wie die Messung nach Kategorien zu filtern, und "Formfactor", wie die Messung.
- Wählen Sie "Ja" zu filtern, um eine minimale Messwert verwendet und einen Minimalwert von 0,52 hinzuzufügen.
- Wählen Sie "Nein" zu filtern, um eine maximale Messung.
- Wählen Sie "Ja", um die Umrisse der gefilterten Objekte behalten und das skizzierte Bild nennen.
- Wählen Sie "ExportToSpreadsheet" (Abbildung 10)
- Wählen Sie, wo Sie die Datei und den Namen "Output-Dateien" zu speichern.
- Nach der Analyse Pipeline (Schritte 6.7.1 bis 6.7.7.1) erzeugt wird, "Test Mode" in CellProfiler beginnen und jeden Schritt zu bewerten, einschließlich, dass die Kerne in dem Testbild in geeigneter Weise gefiltert werden, um sicherzustellen, optimal parameter wurden ausgewählt , um Zellen zu identifizieren. Figur 11 zeigt ein Ausgabebild aus CellProfiler folgenden Filtern, wo Kerne korrekt identifiziert (in grün eingekreist) sind, und der Hintergrund wird herausgefiltert.
- Sobald Parameter ausreichend sein werden ausgewertet und bestimmt, speichern Sie das Projekt und klicken Sie dann auf "Bilder Analyze". Dieses Projekt kann immer wieder für eine spätere Analyse verwendet werden.
Hinweis: Wenn Parameter festgelegt wurden, wird das Programm eingestellt , alle Bilder in der "Dateiliste" zu analysieren, der Reihe nach . Dies wird in mehreren Fenstern ergeben sich für jedes Bild Öffnen analysiert, die eine längere Verarbeitungszeit verursacht.- Um eine längere Verarbeitungszeit zu vermeiden, klicken Sie auf das Augensymbol auf alle Module mit Ausnahme von "ExportToSpreadsheet" unter dem "Analysis Module" Abschnitt.
- Sobald alle Surrogat Bilder von CellProfiler verarbeitet wurden, öffnen Sie die Tabelle, die Bilddaten, die durch Zelle enthält, Profiler und die Tabelle den Bereich gemessen mit ImageJ enthält. Kopieren Sie die gefilterten Kerne Daten (Spalte D in der CellProfiler-Tabelle) und die Bildkennungen (Spalte R) und fügen Sie sie in der Tabelle die gemessenen Bereichsdaten enthält.
- Berechne die Summe aller der Messungen für die Anzahl der Kerne pro Bild des Surrogat erhalten.
- Berechnen Sie die Summe der für Surrogat-Bereich erhaltenen Messungen von jedem Bild des Surrogat. Teilen Sie die gesamte Fläche gemessen von 1x10 6.
- Teilen die Gesamtzahl der Kerne , die durch die Gesamtfläche Messung im Schritt über einen Wert für die Anzahl der Zellen 2 pro 1x10 6 Pixeln zu erhalten.
- Wählen "ColorToGray" (Abbildung 4).
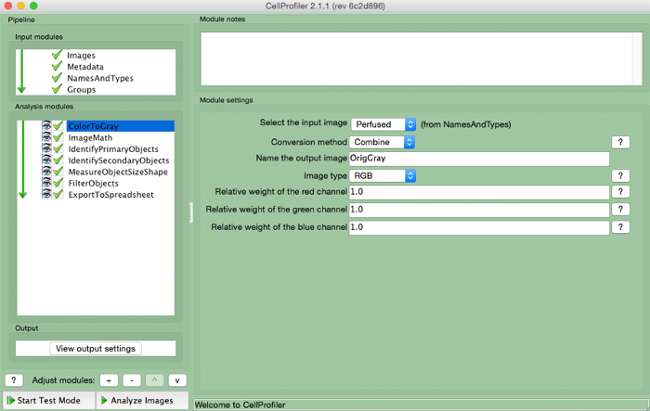
Abbildung 4. CellProfiler Pipeline: Ändern Bild in Graustufen Screenshot von "ColortoGray" Modul..s: //www.jove.com/files/ftp_upload/54004/54004fig4highres.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
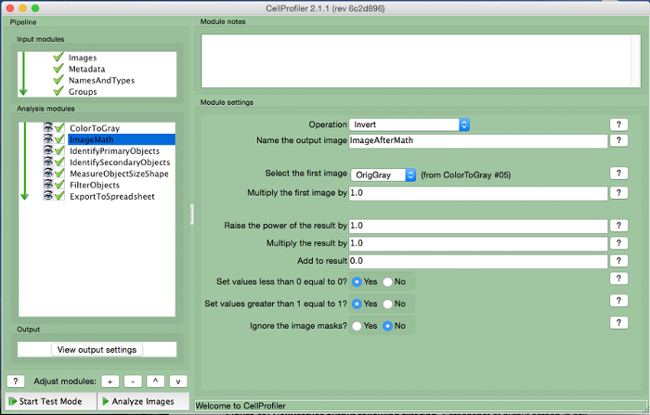
Abbildung 5. CellProfiler Pipeline:.. Umkehren Bild Screenshot von "ImageMath" Modul Bitte klicken Sie hier um eine größere Version dieser Figur zu sehen.

Abbildung 6. CellProfiler Pipeline:.. Identifizierung Kerne Screenshot von "IdentifyPrimaryObjects" Modul Bitte klicken Sie hier um eine größere Version dieser Figur zu sehen.
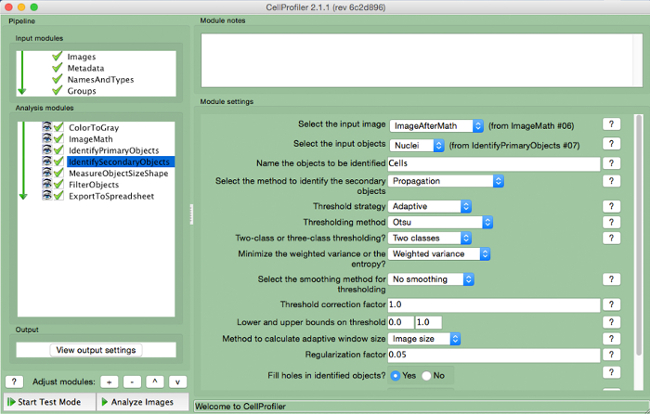
Abbildung 7. CellProfiler Pipeline:.. Identifizieren von Zellen Screenshot von "IdentifySecondaryObjects" Modul Bitte klicken Sie hier um eine größere Version dieser Figur zu sehen.
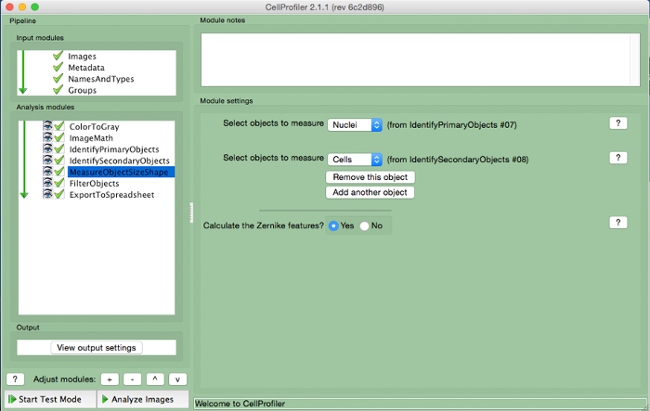
Abbildung 8. CellProfiler Pipeline:.. Messobjekte Screenshot von "MeasureObjectSizeShape" Modul Bitte klicken Sie hier um eine größere Version dieser Figur zu sehen.
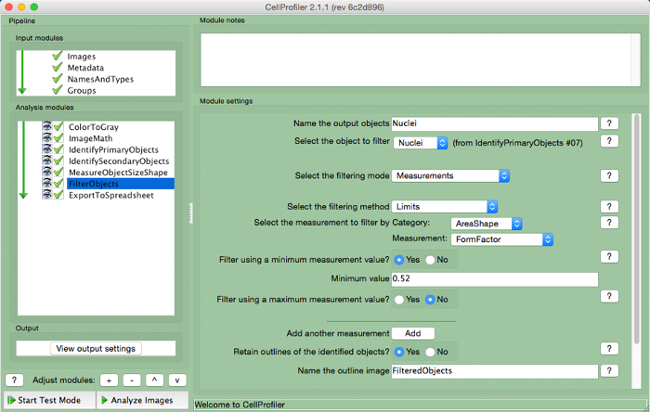
Abbildung 9. CellProfiler Pipeline. Filtern von Objekten Screenshot von "FilterObjects "Modul. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Abbildung 10. CellProfiler Pipeline:.. Exportieren von Daten Screenshot von "ExportToSpreadsheet" Modul Bitte klicken Sie hier um eine größere Version dieser Figur zu sehen.
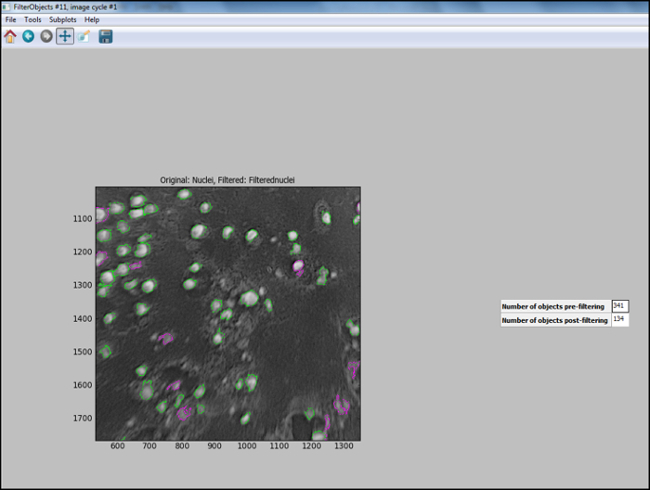
Abbildung 11. CellProfiler Ausgabe folgende Filterung. Screenshot von Ausgabebildschirm in Zelle Profiler folgende Objektfilterung. Bitte klicken Sie hier um einen größeren versi anzuzeigenauf dieser Figur.
Ergebnisse
Sowohl feste und durchbluteten Surrogate 3D Brustkrebs wurden wie oben beschrieben hergestellt und gezüchtet für 7 Tage. Anschließend wurden Surrogate fixiert, verarbeitet zu Paraffin, geschnitten und gefärbt mit Hämatoxylin und Eosin, wie oben beschrieben. Die Zahl der kernhaltigen Zellen pro Fläche (beide 231-Zellen und CAF) jedes Surrogat wurde gemessen. Wie in Figur 12 repräsentativ Photomikrographien der H & E-gefärbten Schnitten zeigen eine höhere Konz...
Diskussion
Hierin wurde ein Verfahren der 3D-Kultur beschrieben, die Komponenten des Gewebemikroumgebung beinhaltet, einschließlich der extrazellulären Matrix (ECM) und menschliche Stromazellen Fibroblasten, in einem Volumen, das genauer Modelle menschlichen Brustkrebs für die Entwicklung eines zusammenfassenden 3D-Morphologie zu ermöglichen, . Die 3D-Kultivierungsverfahren beschrieben ist repräsentativer für menschliche Krankheiten als herkömmliche 2D-Zellkultur, dass mehrere Zelltypen werden in einem 3D-Volumen von ECM in...
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
The University of Alabama at Birmingham Center for Metabolic Bone Disease performed the histologic processing and sectioning of surrogates. Southern Research (Birmingham, AL) provided support for the manufacture of the bioreactor system. Funding was provided by the United States Department of Defense Breast Cancer Research Program (BC121367).
Materialien
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagel Medium 1x (DMEM) | Corning CellGro | 10-014-CV | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | |
| 0.25% Trypsin + 2.21 mM EDTA 1x | Corning | 25-053-CI | |
| Tissue Culture plates, 100 mm | CellTreat Scientific Products | 229620 | Sterile |
| Tissue Culture plates, 35 mm | CellTreat Scientific Products | 229638 | For PDMS foam formation |
| 9" Glass pipette | Fisher | 13-678-20D | Sterile |
| 10 ml pipette | CellTreat Scientific Products | 229210B | Sterile |
| 1,000 µl piptette tips | FisherBrand | 02-717-166 | Sterile Filtered |
| 200 µl pipette tips | FisherBrand | 02-717-141 | Sterile Filtered |
| 10 µl pipette tips | FisherBrand | 02-717-158 | Sterile Filtered |
| 15 ml conical tubes | CellTreat Scientific Products | 229410 | Sterile |
| 50 ml conical tubes | CellTreat Scientific Products | 229422 | Sterile |
| 1.5 ml microcentrifuge tubes | FisherBrand | 05-408-129 | Sterile |
| Trypan blue | Corning Cellgro | 25-900-CI | Sterile |
| Sylgard 184 | Electron Microscopy Sciences | 24236-10 | PDMS elastomer and curing agent. Used for our in-house bioreactor. |
| PDMS Foam | Made in-house for use in our in-house bioreactor. | ||
| High Concentration Bovine Collagen Type I | Advanced Biomatrix | 5133-A | FibriCol ~10 mg/ml |
| Growth Factor Reduced Matrigel (Basement Membrane) | Corning | 354230 | Basement membrane material |
| Sodium Bicarbonate | Sigma | S8761 | |
| Molecular Biology Grade Water | Fisher | BP2819-1 | |
| DMEM 10x | Sigma-Aldrich | D2429 | |
| Nunc Lab-Tek Chamber Slide System | Thermo Scientific | 177402 | 8-well |
| Bioreactor | Made in-house. | ||
| Spring-Back 304 Stainless Steel—Coated with PTFE polymer | McMaster-Carr | 1749T19 | Stainless steel wires to generate microchannels in our in-house bioreactor system. 0.016" Diameter |
| BioPharm Plus platinum-cured silicone pump tubing, L/S 14 | Masterflex | EW-96440-14 | For use in our in-house bioreactor system. Tubing ID: 1.6 mm, Hose barb size: 1/16 in. |
| 2-Stop Tubing Sets, non-flared PVC, 1.52 mm ID | Cole-Parmer | EW-74906-36 | For use in our in-house bioreactor system (with microperistalitic pump). |
| Six Channel precision micro peristaltic pump | Cole-Parmer | EW-74906-04 | For use with our in-house bioreactor system |
| Tuberculin Syringes | BD Medical | 309625 | 26 gauge 3/8 in. needle; Sterile |
| Dissecting Tissue Forceps | FisherBrand | 13-812-36 | 5.5 inch |
| Mini Tube Rotator | Boekel Scientific | 260750 | Equipment option for surrogate rotation. Used with carousel for 50 ml tubes (model number 260753) |
| 50 ml tube carousel | Boekel Scientific | 260753 | Used with mini tube rotator |
| Bambino Hybridization Oven | Boekel Scientific | 230301 | Equipment option for surrogate rotation |
| HistoGel Specimen Processing Gel | Thermo Scientific | HG-4000-012 | Specimen Processing Gel described in Step 5.2 |
| Cryomold | Andwin Scientific | 4566 | 15 mm x 15 mm x 5 mm |
| Tissue Marking Dye | Cancer Diagnostics, inc. | 03000P | Can be used to mark surrogates, allowing multiple samples to be included in one tissue cassette |
| Hinged tissue cassettes | FisherBrand | 22-272-416 | |
| Formalin | Fisher | 23-245-685 | |
| GoldSeal Plain Glass Slides | Thermo Scientific | 3048-002 | |
| Xylene | Fisher | X3P-1GAL | |
| Ethanol, 200 proof (100%), USP | Decon Laboratories, Inc. | 2805M | |
| Hematoxylin | Thermo Scientific Richard-Allan Scientific | 7211 | |
| Clarifier | Thermo Scientific Richard-Allan Scientific | 7401 | |
| Bluing Solution | Thermo Scientific Richard-Allan Scientific | 7301 | |
| Eosin Y | Thermo Scientific Richard-Allan Scientific | 7111 | |
| Cytoseal XYL mounting media | Thermo Scientific Richard-Allan Scientific | 83124 | |
| Coverslips | Fisher Scientific | 12-548-5G |
Referenzen
- Hakanson, M., Textor, M., Charnley, M. Engineered 3D environments to elucidate the effect of environmental parameters on drug response in cancer. Integr Biol (Camb). 3 (1), 31-38 (2011).
- Horning, J. L., et al. 3-D tumor model for in vitro evaluation of anticancer drugs. Mol Pharm. 5 (5), 849-862 (2008).
- Dhiman, H. K., Ray, A. R., Panda, A. K. Three-dimensional chitosan scaffold-based MCF-7 cell culture for the determination of the cytotoxicity of tamoxifen. Biomaterials. 26 (9), 979-986 (2005).
- Place, A. E., Jin Huh, S., Polyak, K. The microenvironment in breast cancer progression: biology and implications for treatment. Breast Cancer Res. 13 (6), 227 (2011).
- Mao, Y., Keller, E. T., Garfield, D. H., Shen, K., Wang, J. Stromal cells in tumor microenvironment and breast cancer. Cancer Metastasis Rev. 32 (1-2), 303-315 (2013).
- Paulsson, J., Micke, P. Prognostic relevance of cancer-associated fibroblasts in human cancer. Semin Cancer Biol. 25, 61-68 (2014).
- Roskelley, C. D., Desprez, P. Y., Bissell, M. J. Extracellular matrix-dependent tissue-specific gene expression in mammary epithelial cells requires both physical and biochemical signal transduction. Proc. Natl. Acad. Sci. 91, 12378-12382 (1994).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2008).
- Ivascu, A., Kubbies, M. Rapid generation of single-tumor spheroids for high-throughput cell function and toxicity analysis. J Biomol Screen. 11 (8), 922-932 (2006).
- Lovitt, C. J., Shelper, T. B., Avery, V. M. Advanced cell culture techniques for cancer drug discovery. Biology (Basel). 3 (2), 345-367 (2014).
- Bergamaschi, A., et al. Extracellular matrix signature identifies breast cancer subgroups with different clinical outcome. J Pathol. 214 (3), 357-367 (2008).
- Oskarsson, T. Extracellular matrix components in breast cancer progression and metastasis. The Breast. 22, S66-S72 (2013).
- Kelley, L. C., Lohmer, L. L., Hagedorn, E. J., Sherwood, D. R. Traversing the basement membrane in vivo: A diversity of strategies. JBC. 204 (3), 291-301 (2014).
- Sadlonova, A., et al. Breast fibroblasts modulate epithelial cell proliferation in three-dimensional in vitro co-culture. Breast Cancer Res. 4, (2004).
- Wendt, D., Marsano, A., Jakob, M., Heberer, M., Martin, I. Oscillating perfusion of cell suspensions through three-dimensional scaffolds enhances cell seeding efficiency and uniformity. Biotechnol Bioeng. 84 (2), 205-214 (2003).
- Marshall, L. E., et al. Flow-perfusion bioreactor system for engineered breast cancer surrogates to be used in preclinical testing. J Tissue Eng Regen Med. , (2015).
- Calcagnile, P., Fragouli, D., Mele, E., Ruffilli, R., Athanassiou, A. Polymeric foams with functional nanocomposite cells. RSC Adv. 4, 19177-19182 (2014).
- Naba, A., Clauser, K. R., Lamar, J. M., Carr, S. A., Hynes, R. O. Extracellular matrix signatures of human mammary carcinoma identify novel metastasis promoters. eLife. 3, (2014).
- Lochter, A., Bissell, M. J. Involvement of extracellular matrix constituents in breast cancer. Semin Cancer Biol. 6 (3), 165-173 (1995).
- Joiner, K. S., Spangler, E. A. Evaluation of HistoGel-embedded specimens for use in veterinary diagnostic pathology. J Vet Diagn Invest. 24 (4), 710-715 (2012).
- Varsegi, G. M., Shidham, V. Cell Block Preparation from Cytology Specimen with Predominance of Individually Scattered Cells. J Vis Exp. (29), e1316 (2009).
- Sadlonova, A., et al. Human Breast Fibroblasts Inhibit Growth of the MCF10AT Xenograft Model of Proliferative Breast Disease. Am J Pathol. 170 (3), (2007).
- Otali, D., He, Q., Stockard, C. R., Grizzle, W. E. Preservation of immunorecognition by transferring cells from 10% neutral buffered formalin to 70% ethanol. Biotech Histochem. 88, 170-180 (2013).
- Webster, S. S., Jenkins, L., Burg, K. J. L. Histological Techniques for Porous, Absorbable, Polymeric Scaffolds, Used in Tissue Engineering. J Histotechnol. 26 (1), 57-65 (2003).
- Troy, T. -. C., Arabzadeh, A., Enikanolaiye, A., Lariviere, N., Turksen, K. Immunohistochemistry on Paraffin Sections of Mouse Epidermis Using Fluorescent Antibodies. J Vis Exp. (11), (2008).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Kwon, Y. -. J., et al. Gli1 enhances migration and invasion via up-regulation of MMP-11 and promotes metastasis in ERa negative breast cancer cell lines. Clin Exp Metastasis. (28), (2011).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for Immunohistochemistry on Cryosectioned Rat Brain Tissue: Example Staining for Microglia and Neurons. J Vis Exp. (99), e52293 (2015).
- Pal, A., Kleer, C. G. Three dimensional cultures: a tool to study normal acinar architecture vs. malignant transformation of breast cells. J Vis Exp. (86), e51311 (2014).
- Hasselbach, L. A., et al. Optimization of High Grade Glioma Cell Culture from Surgical Specimens for Use in Clinically Relevant Animal Models and 3D Immunochemistry. J Vis Exp. (83), e51088 (2014).
- Foty, R. A Simple Hanging Drop Cell Culture Protocol for Generation of 3D Spheroids. J Vis Exp. (51), e2720 (2011).
- Materne, E. -. M., et al. The Multi-organ Chip - A Microfluidic Platform for Long-term Multi-tissue Coculture. J Vis Exp. (98), e52526 (2015).
- Sadlonova, A., et al. Identification of Molecular Distinctions Between Normal Breast-Associated Fibroblasts and Breast Cancer-Associated Fibroblasts. Cancer Microenviron. 2, 9-21 (2009).
- Wang, J. D., Douville, N. J., Takayama, S., ElSayed, M. Quantitative analysis of molecular absorption into PDMS microfluidic channels. Ann Biomed Eng. 40 (9), 1862-1873 (2012).
- Halldorsson, S., Lucumi, E., Gomez-Sjoberg, R., Fleming, R. M. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosens Bioelectron. 63, 218-231 (2015).
- Regehr, K. J., et al. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab Chip. 9 (15), 2132-2139 (2009).
- Burdett, E., Kasper, F. K., Mikos, A. G., Ludwig, J. A. Engineering tumors: a tissue engineering perspective in cancer biology. Tissue Eng Part B Rev. 16 (3), 351-359 (2010).
- Caruso, R. A., et al. Mechanisms of coagulative necrosis in malignant epithelial tumors (Review). Oncol Lett. 8 (4), 1397-1402 (2014).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicol Pathol. 35 (4), 495-516 (2007).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 146 (1), 3-15 (1995).
- Ogino, S., et al. Molecular pathological epidemiology of epigenetics: emerging integrative science to analyze environment, host, and disease. Mod Pathol. 26 (4), 465-484 (2013).
- Otali, D., et al. Combined effects of formalin fixation and tissue processing on immunorecognition. Biotech Histochem. 84 (5), 223-247 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten