Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hazırlama ve Analizler
Bu Makalede
Özet
We demonstrate a method to generate 3D breast cancer surrogates, which can be cultured using a perfusion bioreactor system to deliver oxygen and nutrients. Following growth, surrogates are fixed and processed to paraffin for evaluation of parameters of interest. The evaluation of one such parameter, cell density, is explained.
Özet
Üç boyutlu (3D) bir kültür, iki boyutlu kültüründen in vitro hücre davranışını model fizyolojik olarak daha uygun bir yöntemdir. Meme karsinomu kapsayan karsinomları, fibroblastlar ve hücre dışı matrisin (ECM) de dahil olmak üzere kanser epitelyal hücreleri ve stromal bileşenleri içeren karmaşık 3D dokulardır. Ancak, meme kanserinin en in vitro modeller nedenle stroma atlama sadece kanser epitelyal hücrelerden oluşur ve in vivo olarak tümör 3D mimari. karsinom uygun 3D modelleme tümör biyolojisi, davranış ve tedaviye yanıtın doğru anlaşılması için önemlidir. Ancak, kültür ve 3D modelleri hacmi süresi kültürü içinde oksijen ve besin mevcudiyeti ile sınırlıdır. Burada, meme kanseri, epitelyal hücreleri ve stromal fibroblastlann stroma içeren bir şekilde kültüre edilebilir 3B meme kanseri vekil üretmek üzere ECM'nin dahil edildiği bir yöntem ortaya koymaktadırKatı 3D yapı veya oksijen ve besin sağlamak için bir perfüzyon biyoreaktör sistemi kullanılarak. kurulum ve ilk büyüme döneminden sonra, suretler klinik öncesi ilaç testleri için de kullanılabilir. Seçenek olarak ise, bir vekil hücresel ve matris bileşenleri, biyolojik çeşitli sorular gidermek için modifiye edilebilir. kültürden sonra, suretler sabit ve ilgi parametrelerinin değerlendirilmesi için klinik göğüs karsinoma örneklerinin işleme benzer bir şekilde, parafin için işlenir. ImageJ ve CellProfiler görüntü analiz yazılım sistemleri suretler histolojik kesitlerinin fotomikrograflarının uygulanır, açıklanmıştır Bu tür bir parametre, bu hücre yoğunluğu değerlendirmesi alan başına çekirdekli hücrelerin sayısını belirlemek için. Bu, zaman içinde hücre sayısı değişikliği veya değişen büyüme koşulları ve tedavi sonucunda, hücre sayısındaki değişim bir göstergesi olarak da kullanılabilir.
Giriş
Daha doğru bir şekilde in vivo olarak tümör mimarisi ve mikro-taklit üç boyutlu (3D) kültür modelleri hücreler ile bunların mikro çevreleri arasındaki karmaşık etkileşimler incelemek için ve aday terapilerinin etkinliğini test etmek için amaçlanmıştır çalışmaları için önemlidir. Tümör boyut etkiler oksijen ve besin eğimleri, ilaç maruziyeti, interstisyel basınç / kan akımı ve 3D mimarisi 1-4 tekdüzelik. Uygun bir stromal mikroçevresinin varlığı tümör boyutluluğu ve etkileri, hücre-ECM sinyalizasyon ve stromal hücreleri ve malign epitel hücreleri arasındaki parakrin sinyalizasyon katkıda bulunur. Tümör boyutluluk ve hücresel fonksiyonu üzerindeki mikro-etkileri de ilaç yanıtı 1,3,5-8 değiştiren her iki faktörün birlikte, kurulur. Buna ek olarak, hücresel büyüme kinetiği, metabolik oranları ve hücre sinyal affe bu faktörler ile, 3D, iki boyutlu (2D) kültür ve kültür arasındaki farklılıkhücresel yanıtı 1,3,8-10 cting.
İn vitro olarak, tümör taşıyıcı mikro-Örnek ECM bileşenleri ve stromal hücre popülasyonları da dahil olmak üzere modüle edilebilir. Malign epitel hücreleri tümörün daha fazla yayılma 5,6,10 inhibe ECM ve kanserle ilişkili stromal hücreler tarafından ya da tümör progresyonunu teşvik etmek için sinerjik / koruyucu bir şekilde ya da bastırıcı bir şekilde etkilenmektedir. Her iki çerçevede, stroma ilaç dağıtım 1,6 azalma parakrin sinyalizasyonu ile ve / veya elde edilen tümör geçiş basıncı artırarak terapötik cevabı ve ilaç olarak etkileyebilir. Bu nedenle, klinik öncesi modellerin içine ECM ve stromal hücrelerin eklenmesi 2B kültüründe de model olamaz tümörün yönlerini özetlemek yardımcı olacaktır.
Burada bir yöntem olup, ECM bileşenleri ve s de dahil olmak üzere, bir mikro-ortam rekapitülasyon dahil meme kanseri temsilciler, kurma3B hacimde tromal hücreler tarif edilir. Meme kanserinde, stromal hücre popülasyonu baskın kanserle ilişkili fibroblastlar (CAF), stromal ECM oluşan büyük ölçüde laminin ve kolajen tip IV dahil olmak üzere, bazal membran bulunan matris bileşenlerinin küçük bir oran ile kollajen tip I oluşmaktadır 1,4,11-13. Bu nedenle, göğüs karsinoması mikro bu bileşenlerin (yani, CAF, kolajen I ve bazal membran) suretler halinde dahil edilmiştir. Bu yöntem, bir katı, un perfüze 3D suretler (Şekil 1A) oluşturmak için ya da biyoreaktör sisteminde (Şekil 1B) ile vekil ile orta perfüzyon, uyarlanabilir kullanılabilir. Her iki yaklaşım da burada açıklanmıştır. Bu yöntem, aynı zamanda, tümör ile ilişkili makrofaj gibi stromal elemanları içerecek şekilde ya da uygun olduğu şekilde, hücresel ve ECM bileşenleri ayarlayarak diğer katı tümörler modellemek için modifiye edilebilir.
Burada tarif edilen, MDA-MB-231 (231), meme kanseri hücre soyu, CAF daha önce insan göğüs karsinoma 14 izole kullanmışlardır ve bir ECM (% 90 kolajen I oluşan 6 mg / ml) ve% 10 büyüme faktörü indirgenmiş bazal membran malzemesi (BM). taşıyıcı ya da 8 oyuklu oda slayt (katı vekil) yetiştirilir veya biyoreaktör sistemi sürekli bir besin perfüzyon (perfüze vekil) temin etmek üzere kullanılır. ECM içeren bir hücre hacmine uygun herhangi bir perfüzyon biyoreaktör sistemi 15 kullanılabilir. Örnek olarak, bizim biyoreaktör sistemi doku suretler hazırlanmasını tarif etmektedir. Bu sistem, in-house geliştirilmiş ve ticari olarak mevcut değildir edildi. bizim odak burada 3D doku suretler hazırlanması ve analizi olduğundan, bizim biyoreaktör sistemi imalatı ve montajı özelliklerine ilişkin geniş detaya gitmiş değil. Ancak, ayrıntılı bir açıklamasıBu sistem ve gelişimi 16 yayımlanmıştır. Bu biyoreaktör sistemi içinde, bir polidimetilsiloksan (PDMS) akış kanalı PDMS köpük tarafından desteklenen vekil, ev için kullanılan (Calcagnile ve ark., 17 tarafından tarif edilenlere benzer yöntemler kullanılarak oluşturulan). Bu hacmi sürekli vekil oksijen ve besin kaynağı bir microphysiologic pompası vasıtasıyla ortamı ile perfüze 4 Mikrokanallarda (çapı her 400 mikron) tarafından nüfuz edilir.suretler uygun analiz tedavisi veya diğer manipülasyonlar yanıt olarak hücresel fonksiyonun ilgili önemli bilgileri elde etmek çok önemlidir. Suretler fiksasyon ve işlendikten sonra salgılanan ürünleri veya histolojik bölümlerde analiz için, konfokal mikroskopi veya non-invaziv görüntüleme diğer araçlar, koşullu ortam, ya da perfüzyon tahlil dolaylı hücresel analizi kullanılarak sağlam suretler doğrudan görüntüleme de dahil olmak üzere çeşitli yöntemlerle analiz edilebilir içinparafin. histolojik bölümlerde değerlendirilebilir Bu tür bir parametre, hücre yoğunluğu. Bu hücre yoğunluğu ölçmek için bir yaklaşım sunmaktayız (yani, kesit alanı başına çekirdekli hücrelerin sayısı) hematoksilin ve eozin (H & E) ile boyandı vekil histolojik kesitlerinin fotomikrograflarının uygulanan yarı-otomatik bir görüntü işleme teknikleri kullanılarak. Hücre yoğunluğu zamanla hücre sayısı nispi değişimin bir göstergesi olarak kullanılabilir ya da farklı büyüme koşulları ve tedavi kaynaklanır.
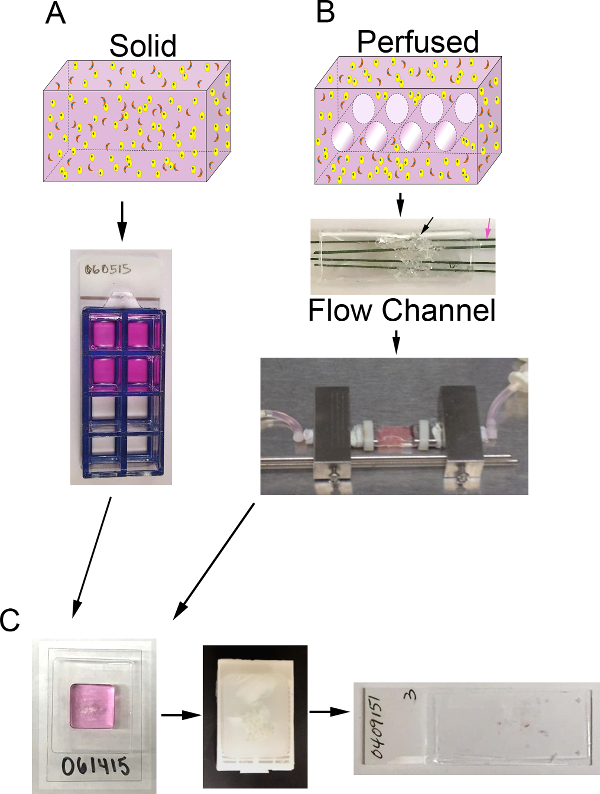
Şekil 1. 3D ses ve biyoreaktör sistemi. Sürecin A) şematik katı 3D suretlerimi oluşturmak için. En: ECM (pembe), (sarı) epitel karsinoma hücreleri ve CAF (turuncu) içeren katı 3D hacmi karikatür; Alt:. 8-iyi odasının slayt içeren suretler üstten görünümü B) şematik sürecinin 3D suretlerimi perfüze üretir. En: cakanallı 3D hacmin rtoon orta perfüzyon ve içeren ECM (pembe), epitel karsinoma hücreleri (sarı) ve CAF (turuncu) için izin vermek; Orta: PDMS köpük (siyah ok) içeren PDMS akış kanalının görüntü hücresi + ECM enjekte ve çapı 400 mikron ölçme polimer kaplı paslanmaz çelik tel (pembe ok) tarafından nüfuz edilecek; Alt:., Suret ihtiva eden ve sürekli ortam perfüzyon için izin vermek için biyoreaktör sistemine bağlı PDMS akış kanalının görüntüsü (peristaltik pompa ve ortam haznesi gösterilmemiştir) C) kültürden sonra, katı ve perfüze suretler hem de işlem adımları görüntüleri. Sol: jel ve vekil işlem örneği içeren cryomold görüntü; Orta: Sabit ve işlenmiş vekil içeren bir parafin blok görüntü; Sağ:. Bir vekil bir H & E boyalı histolojik kesiti olan bir cam slayt görüntüsü bir görmek için buraya tıklayınızBu rakamın daha büyük bir versiyonu.
Protokol
1. Hücre Kültürü
- buz üzerinde 4 ° C'de gece boyunca BM bileşeni çözülme.
- 37 ° C'ye ısınmaya araç. Her iki 231 hücreleri ve CAF büyümesini desteklemek için, Dulbecco Modifiye Eagle ortamı (DMEM) artı% 10 fetal sığır serumu (FBS) kullanın.
Not: kullanılan ortam hücre tipi ve deneysel hedeflerine bağlı olacaktır. - civarındaki konfluent 231 hücre kültür kabı (10 cm) orta çıkarın ve 1.5 ml tripsin / EDTA ekleyin. Hücre ayrılması için izleme 37 ° C'de 1 dakika ila 3 inkübe edin. Hücreler yuvarlak ve plaka dökülmek başladığınızda, orta içeren serum 3 ml ilave etmek suretiyle reaksiyonu durdurun. 15 ml konik tüp içine orta ve hücreleri pipetle.
- 5 dakika boyunca 150 xg'de orta ve hücreleri Santrifüj. Süpernatantı ve 2 ml ortamında hücre pelet yeniden askıya.
- tripan mavisi ve hemasitometre kullanarak hacim başına hücre sayısını sayın. Hücre canlılığı,% 90 daha fazla olmalıdır.
- Tekrarladiğer hücre tipleri ile işlem vekil dahil edilmesi. Burada açıklanan vekili için işlem CAF tekrarlanır.
- hücrelerin istenilen sayıda elde etmek için her hücre süspansiyonu uygun hacmi belirlemek.
Not: 1 fibroblastlar epitelyal hücrelerin oranı (1.4 x 10 6 231 hücreleri ve 100 ul başına 7 x 10 5 CAF: 2, burada tarif edilen vekili, ECM 100 ul başına 2,1 x 10 6 hücre bir hücre yoğunluğu için, ECM) kullanılır. Bu hücre yoğunluğu iyi bir başlangıç noktasıdır; Bununla birlikte, en iyi hücre yoğunluğu, hücre tipi, kültür süresi ve deney amaçları bağlıdır. - 15 ml konik bir tüp (her hücre tipi için bir boru) her bir hücre süspansiyonu hacmi, uygun yerleştirin. 5 dakika boyunca 150 xg'de orta ve hücreleri Santrifüj.
- Santrifüj işleminin ardından Süpernatantı hücrede hücre tipi yeniden askıyakültürü dereceli su (pH izlemek için kırmızı fenol ihtiva eden, Tablo 1, 100 uL) ve 10x DMEM diğer hücre tipi (178.8 ul, Tablo 1 e bakınız). buz üzerinde hücreleri içeren tüpler yerleştirin ve aşağıdaki ECM hazırlanması hızla devam edin. Hücreler canlılığını korumak için suda kalması zamanı sınırlayın.
Not: ECM ikisi 10x DMEM ve hücre kültürü dereceli su gerekli bileşenler; Bu nedenle, biz de yeniden askıya hücreleri seçtiniz. Her iki hücre tipi, bu iki bileşenden birini yeniden süspansiyon haline olabilir, ancak burada keyfi hücre kültürü dereceli su ve 10x DMEM CAF yeniden askıya 231 hücreleri tercih etti.
ECM hücrelerin 2. Hazırlık (6 mg / ml sığır kollajeni tip I +% 10 BM)
Not:% 90 kollajen oluşan bir ECM bu malignite tümör stroma öncelikle kollajen oluşur çünkü% 10 BM invaziv meme kanseri modellemek için seçildi +ECM, 12,13,18,19 daha küçük bir kısmını içeren bu tür laminin, kollajen IV ve Entactin olarak BM bileşenleri, I.
- Buz üzerinde, 2 ml mikrosantrifüj tüpü içine sırayla, Tablo 1 'de listelenen bileşenler eklemek.
4 perfüze suretler burada açıklanan biyoreaktör sistemi kullanılarak, bu tutar 8 katı suretler için yeterli ya da Not:.
| ECM hücrelerin hazırlanması (6 mg / ml sığır kollajeni tip I +% 10 BM) | |
| 178,8 μl | 231 hücre, istenen sayıda içeren hücre kültürü dereceli su (yukarıda belirlenen) |
| 606 ul | Kolajen I (10 mg / ml büyükbaş hayvan), damla damla ekleme |
| 100 ul | Bazal membran çözülmüş |
| 100 ul | CAF istenilen sayı ile 10x DMEM (içeren fenol kırmızısı) (yukarıda belirlenen) |
| 15.2 ul | % 7.5 (h / h) sodyum bikarbonat, damla damla ekleme |
Tablo ECM'deki 1. Hücre hazırlanması.
- Yavaşça kabarcık oluşumunu önlemek, pipetleme ile karıştırın. 10x DMEM kırmızı fenol kullanılarak pH seviyesini izleyin. Karışım, bir pH-gösteren bir turuncu / pembe renkli olup olmadığını kontrol 7. pH (çok sarı) çok düşük ise, uygun bir renk elde edilene kadar, yavaş yavaş bir süre (~ 5 ul) ilave% 7.5 sodyum bikarbonat, bir damla ekleme.
- buz karışımı tutun ve erken ECM polimerizasyonu önlemek için hızlı bir şekilde çalışır.
3. Vekil Hazırlık
- Katı 3D kültürler (Şekil 1A) için:
- steril tekniği kullanarak bir hücre kültürü kaputu çalışan, suretler herhangi deneysel varyasyonu göstermek için steril bir 8-iyi odasının slayt kapağını etiket.
- buz üzerinde bölme slayt tutarak yavaşça, erken ECM polimerizasyonu önlemek 8-iyi odasının slayt her kuyuya hücre + ECM karışımı 100 ul pipet için.
Not: iyi ilk kenarlarında hücre + ECM karışımı Pipetleme daha iyi hücre + ECM karışımı dağıtmak için yardımcı olur. - ECM, polimerizasyonun izin vermek için 37 ° C,% 5 CO2 45 dk suretler kuluçkalayın.
- ECM, polimerizasyon sonunda, her bir göze 100 ul kültür ortamı ekleyip 37 ° C'de inkübe deney süresince% 5 CO2,Her iki gün kültür ortamı değiştirilmesi.
- Bir biyoreaktör sisteminde (Şekil 1B) perfüze 3D kültürleri için:
- 3D kültür kurulumu için tüm biyoreaktör bileşenleri sterilize (yani, biyoreaktör kurulum için gerekli olan biyoreaktör, boru, forseps, ve bağlantı parçaları) biyoreaktör için özel işlem kullanılarak kullanılacak.
- Burada kullanılan, örneğin biyoreaktör sistemi için (örneğin, 12 dakika, 15 dakika kurutma ile 121.1 ° C de maruz kalma) ve 1 saat boyunca% 70 etanol içinde inkübe otoklavda bir kombinasyonunu kullanır.
- Hazırlayın ve vekil ev sahipliği yapacak biyoreaktör sistemi kısmını birleştirin.
- Burada kullanılan örnek biyoreaktör sistemi için kullanarak forseps tüp PDMS akış kanalı içine PDMS köpük omurgası yerleştirin. Paralel mikrokanalların oluşturmak için PDMS köpük içine dört (400 mikron) polimer kaplı paslanmaz çelik teller itin.
- Bir hücre kültürü kaputu, steril kullanarakE tekniği ve şırınga ile bir 26 iğne hücreleri ihtiva etmek üzere tasarlanmış perfüzyon biyoreaktör alana hücre + ECM karışımı enjekte edilir. bir sonraki aşamada hızlı devam edin.
- ECM izin vermek için 45 dakika boyunca 37 ° C'de inkübe ise suretler içindeki hücrelerin daha eşit dağılımını sağlamak için, (hücre kültürü kaputu altında) 50 ml konik bir tüp içine suretler konut biyoreaktör bileşeni yerleştirmek sürekli ~ 18 rpm'de döndürün polimerizasyon.
Not: Dönme örneğin fırında 37 ° C'de ayarlanmış bir hibridizasyonu gibi kuluçka makinesi içinde bir rotator veya döndürücü inşa, bir fırın kullanarak tamamlanabilir. - Üreticinin talimatlarını kullanarak perfüzyon pompası vekil içeren biyoreaktör tertibatını bağlayın.
Not: Bu işlemin özelliklerini biyoreaktör bağlı olarak değişebilir ve kullanılan pompalayacak.- Burada kullanılan örnek biyoreaktör sistemi için, biorea bağlamadan önce paslanmaz çelik teller kaldırmakpompaya ctor düzeneği.
- Ortam perfüzyon (167.1 ul / dakika kütle akış hızı, 1 din / cm2 arasında mikrokanal duvar kayma gerilmesi) başlatın 37 ° C'de bir inkübatör içinde,% 5 CO2.
Not: orta perfüzyon oranı ayarlanabilir, biyoreaktör kurulum ve hedefleri ve deney tasarımına bağlı. - her yedi günde bir kültür ortamını değiştirerek, deney süresince ortam perfüzyon devam edin.
- 3D kültür kurulumu için tüm biyoreaktör bileşenleri sterilize (yani, biyoreaktör kurulum için gerekli olan biyoreaktör, boru, forseps, ve bağlantı parçaları) biyoreaktör için özel işlem kullanılarak kullanılacak.
4. Yedek Fiksasyon ve İşleme (Şekil 1C)
- Etiket cryomolds ve vekil fiksasyon ve işlenmesi için plastik doku kasetleri.
- Daha sonra, sıcak sıcaklıklarda sıvı olan sulu bir malzemedir, ama oda sıcaklığında katılaşan örnek işleme jel bölgesi sarmak temsilciler. Örnek işleme jel işleme sırasında sağlam temsilciler tutarak asist ve kolaylaştırır histolojik 14,20-22 kesit.
- 60 ° C'lik bir su banyosu içerisinde jel işleme örnek Kullanıma hazır olana kadar bu sıcaklıkta tutulması, bunu sıvılaştırmak için eritin. Bir biyogüvenlik kabine vekil ile biyoreaktör taşıyın.
- Pipet yaklaşık 300 ul etiketli cryomold (Şekil 1C, sol panel) altına işlem jel numune.
- Bir neşter bıçak (No. 10 tercih edilir) ve forseps kullanarak dikkatli bir biyoreaktör veya bir 8-iyi odasının slayt kuyudan vekil çıkarmak ve jel işleme örneği içeren cryomold içine yerleştirin.
Not: Doku işaretleme boyaları (Malzeme / Ekipman listesi, belirli bir örnek için) farklı renklerde ve böylece çoklu numuneler ayırt edici bir şekilde bir doku kaset dahil edilmesi için izin temsilciler işaretlemek için de kullanılabilir. - Pipet yaklaşık 300 ul numune cryomold vekil kapağı ve katılaştırma için 30 dakika boyunca 4 ° C'de inkübe etmek jel işlemeY.
- örnek işleme jel katılaşmış sonra, cryomold gelen vekil içeren örnek işleme jel kaldırmak ve bir doku kaset içine yerleştirin.
- Tam sabitleşmesi için oda sıcaklığında 10 ila 12 saat için% 10 nötr tamponlu formalin içine vekil içeren bir doku kasetini yerleştirin.
- tespit eden, parafin sonra işlemden geçirilene kadar% 70 etanol içeren bir doku vekil kaseti hareket ettirin.
Not: etanole formalin gelen vekil aktarma bazı epitopların 23 immünoreaktivitede kaybına neden olabilir formalin ile aşırı tespitin engeller. Etanol süre kritik değildir. Taşıyıcı immünohistokimya veya imüno kullanılacaksa fiksatif Bu değişiklik önemlidir. Işleme (Şekil 1C, orta panel) Parafin için sabit vekil hazırdır. Bu işlem, tipik olarak bir yakl bulunan doku işlemci gerçekleştiriliropriately histoloji laboratuvar donanımlı. Daha kısa bir program, boyutu ve suretler hassas doğası nedeniyle tavsiye edilmektedir. 24
5. Kesit ve H & E Boyama (Şekil 1C, Sağ Panel)
- Parafin blok suretler işlenmesini takiben, bölüm onları formalin ile fikse, parafine gömülü dokularda 24,25 arasında kesit için standart bir mikrotom kullanılarak.
Not: Düzgün donanımlı ve deneyimli Bu, nitelikli histoloji laboratuarında gerçekleştirilen veya bir araştırma laboratuvarında edilebilir. Histolojik bölümler kalınlığı bölümleri amaçlanan kullanımına bağlı olarak değişebilir; Ancak, biz genellikle kalınlığı 5 mikron olan bölümleri kullanın. Perfüze suretler burada kullanılan PDMS köpük kolayca mikrotom ile kesitli. - Düz cam histolojik slaytlar üzerinde bölümleri yerleştirin.
- kesit sonra, boyama için hazırlanması için 10-12 saat boyunca 58 ° C 'de histolojik bölümler fırındahematoksilen ve eozin (H & E). Pişirme parafin erir ve ayrıca cam slayt bölümlerin daha iyi yapışmasını sağlar.
- H & E boyama:
- Leke slaytların sayısına bağlı olarak, coplin kavanoz veya cam boyama yemekleri Tablo 2'de anlatılan istasyonları kurmak. Reaktifler ayarlandıktan sonra, 24 aşağıda belirtilen süre inkübe amacıyla, her bir istasyon ile bölümleri hareket ettirin.
- montaj medyayı kullanarak her slayt bir lamel monte edin.
- montaj medya görüntüleme önce kurumasını bekleyin.
| H & E Boyama | ||
| İstasyon | Çözüm | Zaman |
| 1 | Ksilen | 5 dakika |
| 2 | Ksilen | 5 dk |
| 3 | Ksilen | 5 dakika |
| 4 | % 100 Etanol | 5 dakika |
| 5 | % 100 Etanol | 5 dakika |
| 6 | % 95 Etanol | 5 dakika |
| 7 | % 95 Etanol | 5 dakika |
| 8 | Musluk suyu | 5 dakika |
| 9 | Deiyonize su | 5 dakika |
| 10 | hematoksilen 7211 | 5 dakika |
| 11 | Musluk suyu | 5 dakika |
| 12 | Arındırıcı * | 10 dips |
| * Richard Allan 74.01 ya da% 70 etanol +% 0.5 HCI | ||
| 13 | Musluk suyu | 5 dakika |
| 14 | bluing Reaktif | 30 sn |
| 15 | Musluk suyu | 5 dakika |
| 16 | % 95 Etanol | 10 dips |
| 17 | Eozin-Y | 1 dakika |
| 18 | % 95 Etanol | 10 dips |
| 19 | % 95 Etanol | 10 dips |
| 20 | % 100 Etanol | 10 dips |
| 21 | % 100 Etanol | 10 dips |
| 22 | % 100 Etanol | 5 dakika |
| 23 | Ksilen | 10 dips |
| 24 | Ksilen | 5 dakika |
Tablo 2. H & E Boyama.
6. Hücre Yoğunluk Ölçme
- dosyaları tif olarak görüntüleri kaydetme, 400X büyütmede aydınlık mikroskopi kullanılarak vekil Görüntü en az bir bütün H & E lekeli histolojik bölüm.
Not: açıklanan görüntü işleme sadece renkli görüntüler kullanılarak tamamlanmıştır. Denenmemiş olsa da, biz aynı işlem gri tonlu görüntüleri için geçerli olması gerektiğine inanıyoruz. - Her iki Ulusal Sağlık Enstitüleri Geniş Enstitüsü 26 (http://cellprofiler.org/download.shtml) ve ImageJ (http://rsb.info.nih.gov/ij/download.html), dan CellProfiler indirin hangi hiçbir ücret ödemeden kamuya mevcuttur.
- Her görüntüde vekil alanını ölçmek için, açık ImageJ, seçme "Alan" ( "Analiz" sekmesi altında) "Ölçümler ayarla" seçin ve sonra "Tamam & # seçin34 ;.
- vekil bir görüntü (.tif dosyası) açın. ImageJ çokgen aracını kullanarak fareyi sürükleyerek ve çapa noktaları yapmak tıklayarak görüntüde vekil alanını anahat, (bakınız Şekil 2). Bir kılavuz olarak ECM kenarlarını kullanın. Bir kez "Analiz" sekmesi altında, "Tedbir" seçeneğini sıraladı.
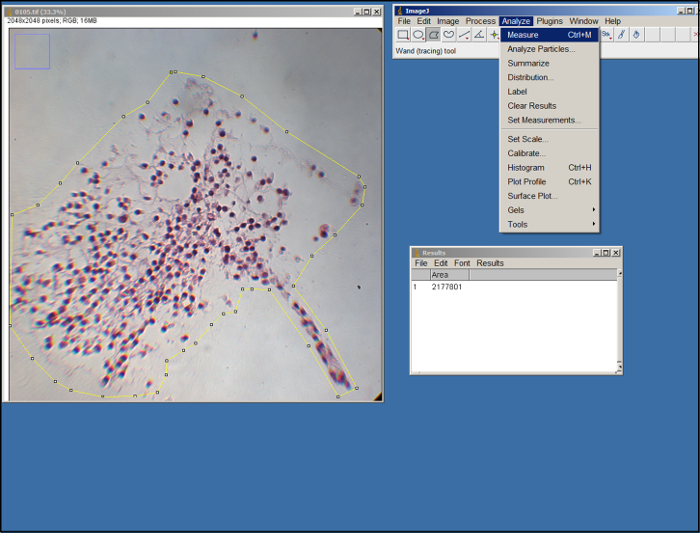
Şekil 2. ImageJ analizi. ImageJ işleme ekran görüntüsü. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- Doku vekil her görüntü için tekrarlayın. Bir elektronik tablo programına ölçümleri ve ilgili görüntü tanımlayıcıları kaydedin.
- "Dosya Listesi" görüntü dosyaları sürükleyerek CellProfiler içine ImageJ alanı ölçmek için kullanılan görüntü dosyalarını yükleyin. ithal görüntülere bir ad atayın"NamesAndTypes" giriş modülü ve görüntü türünü (yani, "Renkli Görüntü") seçin.
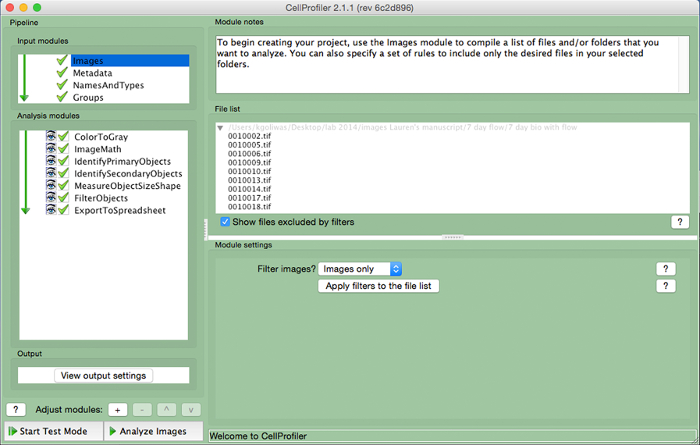
Şekil 3. CellProfiler örneği boru hattı. CellProfiler içinde çekirdekli hücrelerin sayısını ölçmek için tasarlanmış boru hattının ekran görüntüsü. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- Sonraki (Sol panelin alt kısmında Şekil 3) "Modülü ayarlama" için "+" işaretini tıklayarak, görüntü başına hücre sayısını hesaplamak için aşağıdaki modülleri içeren bir analiz boru hattı oluşturun. Aşağıdaki modüllerin her ekleyin.
- "ColorToGray" (Şekil 4) seçin.
- <(Açılan menüden giriş görüntü adını seçin çıkış görüntü isim ve orijinal görüntü türünü seçinem> yani RGB) renk görüntü girişi ise.
Not: Bu modül gerekli olmaz gri tonlu görüntüleri kullanıyorsanız
- <(Açılan menüden giriş görüntü adını seçin çıkış görüntü isim ve orijinal görüntü türünü seçinem> yani RGB) renk görüntü girişi ise.
- "ImageMath" (Şekil 5) seçin.
- "Invert" işletimini seçin çıkış görüntü adı ve "ilk görüntü seçin" sekmesinde gri tonlama görüntüyü seçin.
- "IdentifyPrimaryObjects" (Şekil 6) seçin.
- Seç girdi görüntüsü (matematik düzeltmesinden sonra resim), tespit edilmesi, birincil nesne (çekirdekleri) isim ve nesneler piksel cinsinden ölçülecek için (yaklaşık 25 ila 65) çap aralığı girin. "Üç sınıfa" ile "Otsu" eşikleme yöntemi ile "adaptif" eşik stratejisini seçin. Varsayılan ayarlar herhangi bir diğer parametreleri değiştirmeyin.
Not: çaplarda Optimal aralığı yani (giriş görüntü modülünde bir görüntü açılması ve çekirdeklerin çapını ölçerek tespit edilmelidir,tedbir uzunluğu aracını kullanarak birincil nesne).
- Seç girdi görüntüsü (matematik düzeltmesinden sonra resim), tespit edilmesi, birincil nesne (çekirdekleri) isim ve nesneler piksel cinsinden ölçülecek için (yaklaşık 25 ila 65) çap aralığı girin. "Üç sınıfa" ile "Otsu" eşikleme yöntemi ile "adaptif" eşik stratejisini seçin. Varsayılan ayarlar herhangi bir diğer parametreleri değiştirmeyin.
- "IdentifySecondaryObjects" (Şekil 7) seçin.
- giriş görüntüsünü (matematik düzeltmesinden sonra resim) seçin, giriş nesneleri (çekirdekleri) seçin ve nesneleri tespit edilmesi (hücreler) adlandırın. Ikincil nesneleri tanımlamak "ağırlıklı varyans" minimize "iki sınıf" ile "adaptif" eşik stratejisi ve "Otsu" yöntemi kullanmak "yayılma" yöntemini seçin. , "Hayır yumuşatma" ve 1 bir eşik düzeltme faktörü seçin düşürmek ve 0 ile 1 üst sınırları ve 0.05 düzenlilestirme faktörü. Varsayılan ayarlar herhangi bir diğer parametreleri değiştirmeyin.
- "MeasureObjectSizeShape" (Şekil 8) seçin.
- Hücreleri seçin (ikincil nesne) ve nesneler olarak çekirdekleri (birincil nesne) ölçülecek.
- "FilterObjects" (Şekil 9 seç ).
- çıkış nesneleri adlandırın ve filtre nesne olarak çekirdek (birincil nesne) seçin.
- Varsayılan ayarları olarak başına gelecek iki parametre tutun. ölçümü gibi kategorilere göre filtrelemek için ölçü olarak "AreaShape" ve "FormFactor" seçeneğini seçin.
- "Evet" minimum ölçüm değerini kullanarak filtre ve 0.52 minimum değer katmak.
- Seç "Hayır" maksimum ölçüm kullanarak filtrelemek için.
- "Evet" süzülmüş nesnelerin ana hatlarını korumak ve belirtilen görüntüyü isim.
- Seç "ExportToSpreadsheet" (Şekil 10)
- nerede dosya ve adı "Çıktı Dosyalar" kaydetmek için seçin.
- analiz boru hattı (Adımlar 6.7.7.1 için 6.7.1) oluşturulduktan sonra, optimum pa sağlamak için test görüntüde çekirdekleri uygun süzülür de dahil olmak üzere, her adımı CellProfiler "Test Modu" başlatmak ve değerlendirmeknütrisyonel parametrelerin değerlendirilerek nütrisyonel 11 çekirdek doğru tespit (yeşil daire içerisine alınmış) olan filtreleme, aşağıdaki CellProfiler bir çıkış görüntü göstermektedir. hücreleri tanımlamak için seçildi ve arka plan dışarı süzülür.
- parametreler değerlendirildi ve yeterli olduğu belirlendikten sonra, projeyi kaydedin ve sonra "Görüntüler analiz" i tıklayın. Bu proje gelecekteki analiz için tekrar tekrar kullanılabilir.
Not: parametreler tespit edildikten sonra, program sırayla, "Dosya Listesi" tüm görüntüleri analiz etmek için ayarlanır. Bu uzun bir işlem süresi neden analiz her görüntü, açılış birden fazla pencere neden olacaktır.- daha uzun bir işlem süresini önlemek için, "Analiz modülleri" bölümünde "ExportToSpreadsheet" dışındaki tüm modüllerin üzerine göz simgesini tıklatın.
- tüm vekil görüntüleri CellProfiler tarafından işlendikten sonra, Cell tarafından üretilen görüntü verileri içeren e-tabloyu açın Profiler ve ImageJ ile ölçülen alanı içeren tablo. süzülmüş çekirdekler verileri (CellProfiler e-tabloda sütun D) ve görüntü tanımlayıcıları (sütun R) kopyalayın ve ölçülen alan verilerini içeren e-tabloya yapıştırın.
- vekil görüntü başına çekirdek sayısı için elde edilen ölçümlerin toplamını hesaplayın.
- vekil her görüntüden vekil alanı için elde edilen ölçümlerin toplamı hesaplayın. 1x10 6 ile ölçülen toplam alanı bölün.
- 1x10 6 piksel 2 başına hücre sayısı için bir değer elde etmek için yukarıdaki adımda toplam alan ölçümü ile çekirdeklerin sayısı bölün.
- "ColorToGray" (Şekil 4) seçin.
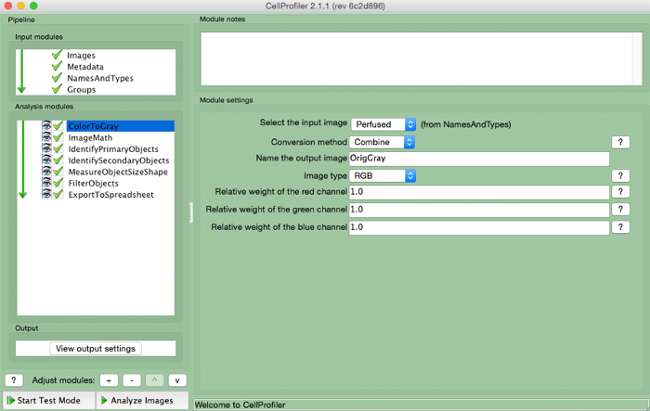
Şekil 4. CellProfiler boru hattı. "ColortoGray" modülün gri tonlama Screenshot görüntü değişiyor.s: //www.jove.com/files/ftp_upload/54004/54004fig4highres.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
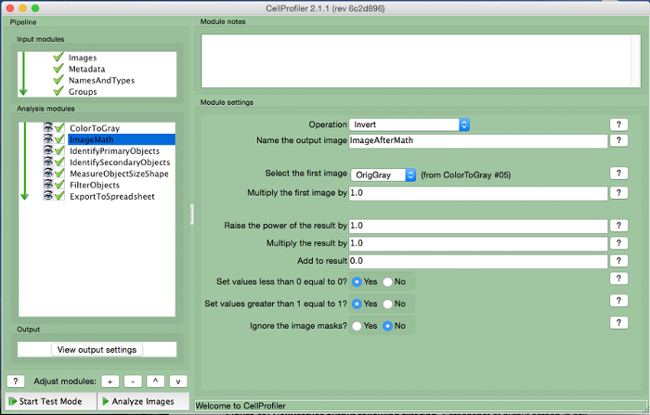
Şekil 5. CellProfiler boru hattı.:. "ImageMath" modülün tersini görüntü ekran görüntüsü bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.

Şekil 6. CellProfiler boru hattı.:. "IdentifyPrimaryObjects" modülünün belirlenmesi çekirdekleri Screenshot bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
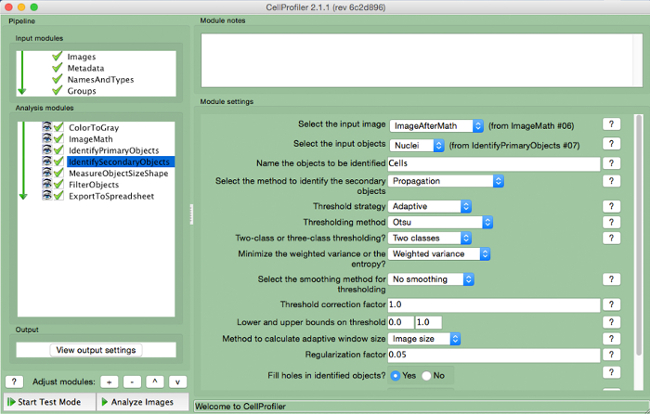
Şekil 7. CellProfiler boru hattı.:. "IdentifySecondaryObjects" modülünün belirlenmesi hücreleri Screenshot bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
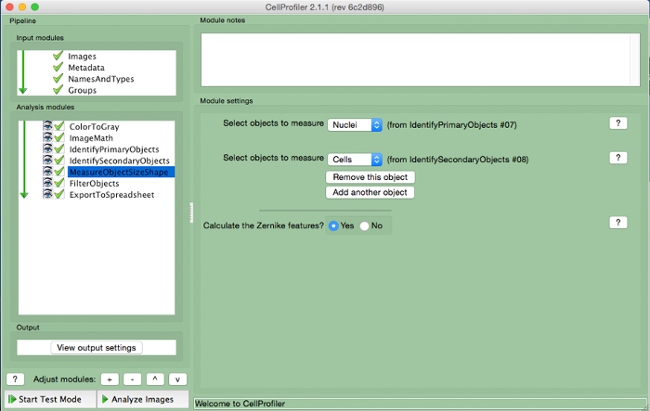
Şekil 8. CellProfiler boru hattı.:. "MeasureObjectSizeShape" modülünün ölçme nesneleri Screenshot bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
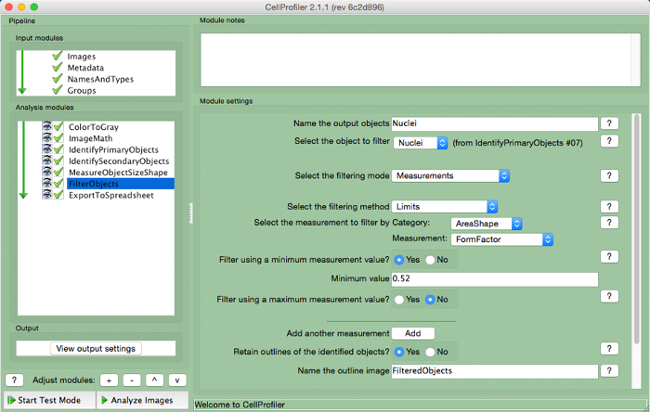
Şekil 9. CellProfiler boru hattı. F "nesneleri filtreleyerek ekran görüntüsüilterObjects "modülü. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Şekil 10. CellProfiler boru hattı.:. "ExportToSpreadsheet" modülün veri verme Screenshot bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
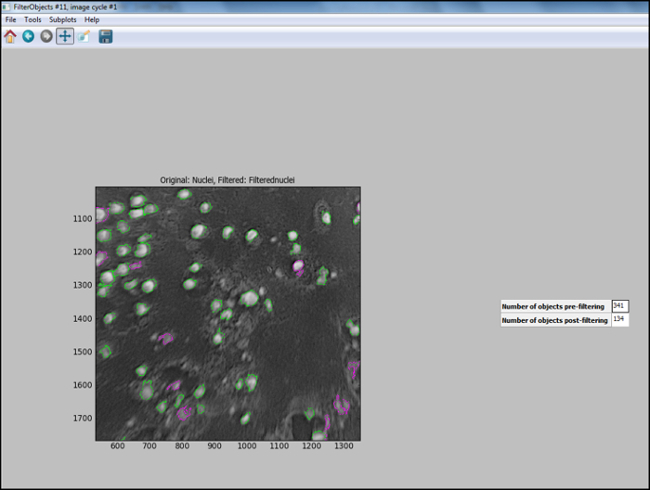
Filtreleme aşağıdaki Şekil 11. CellProfiler çıktı. Nesne filtreleme aşağıdaki hücre profiler çıkış ekranının görüntüsü. Daha büyük bir versi görmek için buraya tıklayınızbu rakamın üzerinde.
Sonuçlar
7 gün yukarıda tarif yetiştirilen hem katı hem de perfüze 3D meme kanseri suretler hazırlanmıştır. Daha sonra, suretler, tespit edilmiş parafine işlenmiş, kesit ve yukarıda tarif edildiği gibi, hematoksilin ve eosin ile boyandı. çekirdekli alan başına hücreleri (her ikisi de 231 hücre ve CAF) her vekil sayısı ölçüldü. Şekil 12'de görülebileceği gibi, H & E ile boyanmış bölümlerin temsil edici fotomikrografikler hücre yoğunluğu...
Tartışmalar
Burada 3D kültür için bir yöntem daha yakın modeller, insan meme kanseri rekapitülasyon 3D morfoloji gelişimine izin vermek için bir hacim içinde, hücre dışı matrisin (ECM) ile, insan da dahil olmak üzere stromal fibroblastlann doku çevresinde bileşenlerinin içerdiğini tarif edilmiştir . tarif edilen 3D kültür yöntemi ECM'nin 3B hacmi içine dahil edilen birden çok hücre tipinde geleneksel 2B hücre kültürü daha insan hastalığının daha iyi temsil eder. Mimari dokusu, mikroçevresinin v...
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
The University of Alabama at Birmingham Center for Metabolic Bone Disease performed the histologic processing and sectioning of surrogates. Southern Research (Birmingham, AL) provided support for the manufacture of the bioreactor system. Funding was provided by the United States Department of Defense Breast Cancer Research Program (BC121367).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagel Medium 1x (DMEM) | Corning CellGro | 10-014-CV | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | |
| 0.25% Trypsin + 2.21 mM EDTA 1x | Corning | 25-053-CI | |
| Tissue Culture plates, 100 mm | CellTreat Scientific Products | 229620 | Sterile |
| Tissue Culture plates, 35 mm | CellTreat Scientific Products | 229638 | For PDMS foam formation |
| 9" Glass pipette | Fisher | 13-678-20D | Sterile |
| 10 ml pipette | CellTreat Scientific Products | 229210B | Sterile |
| 1,000 µl piptette tips | FisherBrand | 02-717-166 | Sterile Filtered |
| 200 µl pipette tips | FisherBrand | 02-717-141 | Sterile Filtered |
| 10 µl pipette tips | FisherBrand | 02-717-158 | Sterile Filtered |
| 15 ml conical tubes | CellTreat Scientific Products | 229410 | Sterile |
| 50 ml conical tubes | CellTreat Scientific Products | 229422 | Sterile |
| 1.5 ml microcentrifuge tubes | FisherBrand | 05-408-129 | Sterile |
| Trypan blue | Corning Cellgro | 25-900-CI | Sterile |
| Sylgard 184 | Electron Microscopy Sciences | 24236-10 | PDMS elastomer and curing agent. Used for our in-house bioreactor. |
| PDMS Foam | Made in-house for use in our in-house bioreactor. | ||
| High Concentration Bovine Collagen Type I | Advanced Biomatrix | 5133-A | FibriCol ~10 mg/ml |
| Growth Factor Reduced Matrigel (Basement Membrane) | Corning | 354230 | Basement membrane material |
| Sodium Bicarbonate | Sigma | S8761 | |
| Molecular Biology Grade Water | Fisher | BP2819-1 | |
| DMEM 10x | Sigma-Aldrich | D2429 | |
| Nunc Lab-Tek Chamber Slide System | Thermo Scientific | 177402 | 8-well |
| Bioreactor | Made in-house. | ||
| Spring-Back 304 Stainless Steel—Coated with PTFE polymer | McMaster-Carr | 1749T19 | Stainless steel wires to generate microchannels in our in-house bioreactor system. 0.016" Diameter |
| BioPharm Plus platinum-cured silicone pump tubing, L/S 14 | Masterflex | EW-96440-14 | For use in our in-house bioreactor system. Tubing ID: 1.6 mm, Hose barb size: 1/16 in. |
| 2-Stop Tubing Sets, non-flared PVC, 1.52 mm ID | Cole-Parmer | EW-74906-36 | For use in our in-house bioreactor system (with microperistalitic pump). |
| Six Channel precision micro peristaltic pump | Cole-Parmer | EW-74906-04 | For use with our in-house bioreactor system |
| Tuberculin Syringes | BD Medical | 309625 | 26 gauge 3/8 in. needle; Sterile |
| Dissecting Tissue Forceps | FisherBrand | 13-812-36 | 5.5 inch |
| Mini Tube Rotator | Boekel Scientific | 260750 | Equipment option for surrogate rotation. Used with carousel for 50 ml tubes (model number 260753) |
| 50 ml tube carousel | Boekel Scientific | 260753 | Used with mini tube rotator |
| Bambino Hybridization Oven | Boekel Scientific | 230301 | Equipment option for surrogate rotation |
| HistoGel Specimen Processing Gel | Thermo Scientific | HG-4000-012 | Specimen Processing Gel described in Step 5.2 |
| Cryomold | Andwin Scientific | 4566 | 15 mm x 15 mm x 5 mm |
| Tissue Marking Dye | Cancer Diagnostics, inc. | 03000P | Can be used to mark surrogates, allowing multiple samples to be included in one tissue cassette |
| Hinged tissue cassettes | FisherBrand | 22-272-416 | |
| Formalin | Fisher | 23-245-685 | |
| GoldSeal Plain Glass Slides | Thermo Scientific | 3048-002 | |
| Xylene | Fisher | X3P-1GAL | |
| Ethanol, 200 proof (100%), USP | Decon Laboratories, Inc. | 2805M | |
| Hematoxylin | Thermo Scientific Richard-Allan Scientific | 7211 | |
| Clarifier | Thermo Scientific Richard-Allan Scientific | 7401 | |
| Bluing Solution | Thermo Scientific Richard-Allan Scientific | 7301 | |
| Eosin Y | Thermo Scientific Richard-Allan Scientific | 7111 | |
| Cytoseal XYL mounting media | Thermo Scientific Richard-Allan Scientific | 83124 | |
| Coverslips | Fisher Scientific | 12-548-5G |
Referanslar
- Hakanson, M., Textor, M., Charnley, M. Engineered 3D environments to elucidate the effect of environmental parameters on drug response in cancer. Integr Biol (Camb). 3 (1), 31-38 (2011).
- Horning, J. L., et al. 3-D tumor model for in vitro evaluation of anticancer drugs. Mol Pharm. 5 (5), 849-862 (2008).
- Dhiman, H. K., Ray, A. R., Panda, A. K. Three-dimensional chitosan scaffold-based MCF-7 cell culture for the determination of the cytotoxicity of tamoxifen. Biomaterials. 26 (9), 979-986 (2005).
- Place, A. E., Jin Huh, S., Polyak, K. The microenvironment in breast cancer progression: biology and implications for treatment. Breast Cancer Res. 13 (6), 227 (2011).
- Mao, Y., Keller, E. T., Garfield, D. H., Shen, K., Wang, J. Stromal cells in tumor microenvironment and breast cancer. Cancer Metastasis Rev. 32 (1-2), 303-315 (2013).
- Paulsson, J., Micke, P. Prognostic relevance of cancer-associated fibroblasts in human cancer. Semin Cancer Biol. 25, 61-68 (2014).
- Roskelley, C. D., Desprez, P. Y., Bissell, M. J. Extracellular matrix-dependent tissue-specific gene expression in mammary epithelial cells requires both physical and biochemical signal transduction. Proc. Natl. Acad. Sci. 91, 12378-12382 (1994).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2008).
- Ivascu, A., Kubbies, M. Rapid generation of single-tumor spheroids for high-throughput cell function and toxicity analysis. J Biomol Screen. 11 (8), 922-932 (2006).
- Lovitt, C. J., Shelper, T. B., Avery, V. M. Advanced cell culture techniques for cancer drug discovery. Biology (Basel). 3 (2), 345-367 (2014).
- Bergamaschi, A., et al. Extracellular matrix signature identifies breast cancer subgroups with different clinical outcome. J Pathol. 214 (3), 357-367 (2008).
- Oskarsson, T. Extracellular matrix components in breast cancer progression and metastasis. The Breast. 22, S66-S72 (2013).
- Kelley, L. C., Lohmer, L. L., Hagedorn, E. J., Sherwood, D. R. Traversing the basement membrane in vivo: A diversity of strategies. JBC. 204 (3), 291-301 (2014).
- Sadlonova, A., et al. Breast fibroblasts modulate epithelial cell proliferation in three-dimensional in vitro co-culture. Breast Cancer Res. 4, (2004).
- Wendt, D., Marsano, A., Jakob, M., Heberer, M., Martin, I. Oscillating perfusion of cell suspensions through three-dimensional scaffolds enhances cell seeding efficiency and uniformity. Biotechnol Bioeng. 84 (2), 205-214 (2003).
- Marshall, L. E., et al. Flow-perfusion bioreactor system for engineered breast cancer surrogates to be used in preclinical testing. J Tissue Eng Regen Med. , (2015).
- Calcagnile, P., Fragouli, D., Mele, E., Ruffilli, R., Athanassiou, A. Polymeric foams with functional nanocomposite cells. RSC Adv. 4, 19177-19182 (2014).
- Naba, A., Clauser, K. R., Lamar, J. M., Carr, S. A., Hynes, R. O. Extracellular matrix signatures of human mammary carcinoma identify novel metastasis promoters. eLife. 3, (2014).
- Lochter, A., Bissell, M. J. Involvement of extracellular matrix constituents in breast cancer. Semin Cancer Biol. 6 (3), 165-173 (1995).
- Joiner, K. S., Spangler, E. A. Evaluation of HistoGel-embedded specimens for use in veterinary diagnostic pathology. J Vet Diagn Invest. 24 (4), 710-715 (2012).
- Varsegi, G. M., Shidham, V. Cell Block Preparation from Cytology Specimen with Predominance of Individually Scattered Cells. J Vis Exp. (29), e1316 (2009).
- Sadlonova, A., et al. Human Breast Fibroblasts Inhibit Growth of the MCF10AT Xenograft Model of Proliferative Breast Disease. Am J Pathol. 170 (3), (2007).
- Otali, D., He, Q., Stockard, C. R., Grizzle, W. E. Preservation of immunorecognition by transferring cells from 10% neutral buffered formalin to 70% ethanol. Biotech Histochem. 88, 170-180 (2013).
- Webster, S. S., Jenkins, L., Burg, K. J. L. Histological Techniques for Porous, Absorbable, Polymeric Scaffolds, Used in Tissue Engineering. J Histotechnol. 26 (1), 57-65 (2003).
- Troy, T. -. C., Arabzadeh, A., Enikanolaiye, A., Lariviere, N., Turksen, K. Immunohistochemistry on Paraffin Sections of Mouse Epidermis Using Fluorescent Antibodies. J Vis Exp. (11), (2008).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Kwon, Y. -. J., et al. Gli1 enhances migration and invasion via up-regulation of MMP-11 and promotes metastasis in ERa negative breast cancer cell lines. Clin Exp Metastasis. (28), (2011).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for Immunohistochemistry on Cryosectioned Rat Brain Tissue: Example Staining for Microglia and Neurons. J Vis Exp. (99), e52293 (2015).
- Pal, A., Kleer, C. G. Three dimensional cultures: a tool to study normal acinar architecture vs. malignant transformation of breast cells. J Vis Exp. (86), e51311 (2014).
- Hasselbach, L. A., et al. Optimization of High Grade Glioma Cell Culture from Surgical Specimens for Use in Clinically Relevant Animal Models and 3D Immunochemistry. J Vis Exp. (83), e51088 (2014).
- Foty, R. A Simple Hanging Drop Cell Culture Protocol for Generation of 3D Spheroids. J Vis Exp. (51), e2720 (2011).
- Materne, E. -. M., et al. The Multi-organ Chip - A Microfluidic Platform for Long-term Multi-tissue Coculture. J Vis Exp. (98), e52526 (2015).
- Sadlonova, A., et al. Identification of Molecular Distinctions Between Normal Breast-Associated Fibroblasts and Breast Cancer-Associated Fibroblasts. Cancer Microenviron. 2, 9-21 (2009).
- Wang, J. D., Douville, N. J., Takayama, S., ElSayed, M. Quantitative analysis of molecular absorption into PDMS microfluidic channels. Ann Biomed Eng. 40 (9), 1862-1873 (2012).
- Halldorsson, S., Lucumi, E., Gomez-Sjoberg, R., Fleming, R. M. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosens Bioelectron. 63, 218-231 (2015).
- Regehr, K. J., et al. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab Chip. 9 (15), 2132-2139 (2009).
- Burdett, E., Kasper, F. K., Mikos, A. G., Ludwig, J. A. Engineering tumors: a tissue engineering perspective in cancer biology. Tissue Eng Part B Rev. 16 (3), 351-359 (2010).
- Caruso, R. A., et al. Mechanisms of coagulative necrosis in malignant epithelial tumors (Review). Oncol Lett. 8 (4), 1397-1402 (2014).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicol Pathol. 35 (4), 495-516 (2007).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 146 (1), 3-15 (1995).
- Ogino, S., et al. Molecular pathological epidemiology of epigenetics: emerging integrative science to analyze environment, host, and disease. Mod Pathol. 26 (4), 465-484 (2013).
- Otali, D., et al. Combined effects of formalin fixation and tissue processing on immunorecognition. Biotech Histochem. 84 (5), 223-247 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır