A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تدفق الفرز وإكسوم التسلسل من خلايا ريد-ستيرنبرغ من الليمفاوية الكلاسيكي هودجكين
In This Article
Summary
هنا، نحن تصف مجتمعة التدفق الخلوي سايتوميتريك الفرز والمدخلات المنخفضة، الجيل المقبل من بروتوكول بناء مكتبة مصممة لإنتاج عالية الجودة، بيانات كاملة إكسوم من خلايا هودجكين ريد-سترنبيرغ (هرس) من سرطان الغدد الليمفاوية الكلاسيكي هودجكين (تشل).
Abstract
خلايا هودجكين ريد-ستيرنبرج من سرطان الغدد الليمفاوية الكلاسيكي هودجكين توزع بشكل ضئيل ضمن خلفية من الخلايا الليمفاوية الالتهابية وعادة ما تشكل أقل من 1٪ من كتلة الورم. المواد المشتقة من الورم السائب يحتوي على محتوى الورم في تركيز غير كاف للتوصيف. لذلك، يتم وصف مضان تنشيط خلية الفرز باستخدام ثمانية الأجسام المضادة، وكذلك الجانب إلى الأمام مبعثر، هنا كوسيلة للفصل بسرعة والتركيز مع آلاف عالية النقاء من الخلايا هرس من الورم لدراسة لاحقة. وفي الوقت نفسه، لأن البروتوكولات القياسية لتسلسل إكسوم عادة ما تتطلب 100-1،000 نانوجرام من الحمض النووي المدخلات، والتي غالبا ما تكون مرتفعة جدا، حتى مع تدفق الفرز، ونحن نقدم أيضا الأمثل، وانخفاض المدخلات بروتوكول بناء مكتبة قادرة على إنتاج عالية الجودة البيانات من أقل من 10 نانوغرام من الحمض النووي المدخلات. هذا المزيج قادر على إنتاج مكتبات الجيل التالي مناسبة لالتقاط التهجين لكامل هزوم الطعوم أو أكثر تركيزا لوحات المستهدفة، كما هو مطلوب. تسلسل إكسوم من الخلايا هرس، عند مقارنته مع خلايا صحية أو T إنتراتومور، يمكن التعرف على التعديلات الجسدية، بما في ذلك الطفرات، والإدراج والحذف، ونسخة نسخ التعديلات. هذه النتائج توضح البيولوجيا الجزيئية للخلايا هرس وقد تكشف عن سبل للعلاج المخدرات المستهدفة.
Introduction
وقد أدى التقدم في علم الجينوم السرطان نتيجة لتسلسل الجيل القادم إلى اختراقات كبيرة في تحديد الأهداف العلاجية وفي التكهن للعديد من الأورام الدموية وغير الدموية. يتم إدخال استراتيجيات جديدة للعلاج الفردي على أساس التعديلات الجينية محددة في العديد من أنواع الورم (مراجعة في المراجع 1 ، 2 ). على الرغم من التقدم الملحوظ في علم الجينوم اللمفاوية، الجينوم من الخلايا هرس الورم في هيمجكين الكلاسيكيه الكلاسيكي (تشل) لم تستكشف. وقد عرقلت التحقيقات من ندرة الخلايا هرس الأورام ضمن المكروية رد الفعل، مما يجعل من الصعب عزل السكان خلية هرس النقي 3 .
وقد تم تطوير طريقة لعزل خلايا هرس قابلة للحياة من الأورام الأولية من قبل فروم وآخرون. 4 ،المرجع "> 5 ، 6. يستخدم الأسلوب كوكتيل ثمانية الأجسام المضادة، والتي تتكون من CD30، CD15، CD40، CD95، CD45 CD20، CD5، و CD64، لتحديد لا لبس فيه خلايا هرس من تعليق الورم تشل.باستخدام هذه المنهجية، ونحن قادرة على عزل ما لا يقل عن 1000 خلية هرس قابلة للحياة من تعليق خلية جديدة أو مجمدة من خزعات الورم تتكون من ما لا يقل عن 10 7 خلايا (حوالي 10 ملغ من الأنسجة)، والنقاء أكبر من 90٪ عن طريق تحليل التدفق الخلوي ويقدر أن يكون أقل من 80٪ من قبل التحليل الجيني إكسوم من عشر حالات متتالية.
لقد صقلنا تقنية عزل الخلايا الخلوية الخلوية التي خففت كثيرا من العملية، مما يسمح للعزلة السريعة لآلاف الخلايا القابلة للحياة من الخلايا الجذعية الأولية من الأورام تشل الأولية 7 . لقد استخدمنا هذه التقنية لإنتاج ما يعتقد أنه أول تسلسل إكسوم كامل من الخلايا السرطانية في الحالات الأولية من سرطان الغدد الليمفاوية هودجكين. دراساتنا تثبت ثه جدوى عالية الإنتاجية والدراسات على نطاق الجينوم من الحالات تشل الفردية وأدت بالفعل إلى التعرف على التعديلات الجينية الجديدة مع إمكانية تفسير جوانب تشل المرضية.
كما طورنا خط أنابيب للاستفادة من الحمض النووي المستخرج للدراسات الجينية عالية الإنتاجية. من أجل تحقيق نتائج موثوقة من عدد قليل من 1000 خلايا هرس فرزها (الحد الأدنى التي تم الحصول عليها من الحالات المتسلسلة)، كما قمنا بتطوير تعديل الجيل القادم من الحمض النووي إجراء بناء مكتبة 8 التي سمحت لنا لزيادة كفاءة ربط المحول وتوليد مكتبات قسم الحمض النووي دون تضخيم المفرط. هذا الأسلوب يسمح لتحليل العينات السريرية الروتينية والكشف عن الطفرات المتكررة والتغيرات الكروموسومية 7 .
Access restricted. Please log in or start a trial to view this content.
Protocol
1. تجهيز الأنسجة وتجميدها
- جمع الأنسجة العقدة الليمفاوية في الفوسفات مخزنة المالحة (بس) أو روزويل بارك المعهد التذكاري المتوسطة (رمي) وعملية في غضون 24 ساعة من جمع. نقل استئصال الأنسجة العقدة الليمفاوية 9 إلى طبق بتري تحتوي على 10 مل من رمي مع 2٪ مصل العجل الجنين (فس) وتفتتح بدقة مع شفرة مشرط جديدة. استخدام الجزء الخلفي من المكبس حقنة 10 مل لمزيد من طحن / فصل الأنسجة.
- نقل السائل إلى أنبوب مخروطي 50 مل من خلال مصفاة الخلية 100 ميكرون. شطف طبق بتري والمرشح مع 10 مل إضافية من رمي 2٪ فس.
- الحصول على عدد الخلايا باستخدام إما عداد خلية الآلي أو عدادة الكريات.
ملاحظة: عموما، على الأقل 2 × 10 7 خلايا من المتوقع من حوالي 5 مم 3 من الأنسجة العقدة الليمفاوية تشل. ومن المتوقع وجود أكثر من 80٪، ولكن قد تختلف حسب العينة. - تدور أسفل الخلايا في 400 x ج لمدة 10 دقيقة و أسبيراتي طاف. وضع أنبوب يحتوي على بيليه الخلية على الجليد.
- قبل البرد تجميد المتوسطة على الجليد. ريسوسبيند الخلايا في وسط تجميد الباردة بتركيز 2 × 10 7 / مل و ريسوسبيند أنه بيبتينغ. لا دوامة. احتضان تعليق على الجليد لمدة 10 دقيقة.
- قسامة العينة 1 مل / قارورة كريو (قبل المبردة على الجليد). نقل قارورة إلى -80 درجة مئوية الفريزر لمدة 1-2 أيام ونقلها مرة أخرى إلى النيتروجين السائل.
2. إعداد تعليق خلية لفرز الخلية
ملاحظة: كل لوط من الأجسام المضادة يجب أن يكون بشكل صحيح باستخدام 10 مليون خلية في حجم تلطيخ 300- μ.. ويمكن استخدام الدم المحيطي لجميع الأجسام المضادة باستثناء CD30، الذي خط الخلية KMH2 ارتفعت إلى الدم المحيطي يمكن أن تستخدم لمعايرة 10 . نبدأ عموما مع حجم الموصى بها الصانع من الأجسام المضادة وأداء اثنين من التخفيفات اثنين أضعاف وزيادة اثنين أضعاف (أربع نقاط البيانات)لكل الكثير من المعايرة الأجسام المضادة. على سبيل المثال، إذا كان المصنع يوصي حجم 10 ميكرولتر، ونحن إجراء المعايرة باستخدام 2، 5، 10، و 20 ميكرولتر وحدات التخزين.
- تعيين حمام مائي إلى 37 درجة مئوية. بريمكس كمية تيترد من الأجسام المضادة في قارورة زجاجية داكنة وإضافة بس + 2٪ بسا لحجم كوكتيل الكلي من 100 ميكرولتر.
ملاحظة: على الرغم من أننا نوصي عيار الأجسام المضادة، ويمكن استخدام المجلدات التالية كنقطة انطلاق: CD64، 20 ميكرولتر. CD95، 5 ميكرولتر. CD30، 20 ميكرولتر. CD5، 10 ميكرولتر. CD20، 10 ميكرولتر. CD15، 20 ميكرولتر. CD40، 5 ميكرولتر. و CD45، 10 ميكرولتر. - نقل القارورة من النيتروجين السائل في دلو الثلج التي تحتوي على الجليد الجاف لمنع الذوبان. قبل الحارة 50 مل من ذوبان المتوسطة التي تحتوي على رمي / 20٪ فس / الدناز (100 ميكروغرام / مل) في أنبوب مخروطي 50 مل في حمام مائي 37 درجة مئوية.
- نقل 45 مل من ذوبان المتوسطة إلى أنبوب جديد والحفاظ عليه عند 37 درجة مئوية. ذوبان الجليد بسرعة الخلايا عن طريق عقد قارورة المبردة في الخفافيش المياه 37 درجة مئويةساعة حتى يبقى جزء صغير جدا المجمدة.
- صب محتويات قارورة في أنبوب يحتوي على 45 مل من ذوبان المتوسطة. شطف قارورة المبردة فارغة 2 مرات مع 1 مل من ذوبان المتوسطة والجمع بين الشطف.
- احتضان الخلايا في درجة حرارة الغرفة لمدة 15 دقيقة للسماح للهضم الدناز وإعادة توازن الخلية. تدور أسفل الخلايا في 500 x ج لمدة 10 دقيقة، ونضح طاف.
- ريسوسبيند الخلايا في حوالي 200 ميكرولتر من ذوبان المتوسطة عقد الظهر (5 مل) والسماح لها موازنة لدرجة حرارة الغرفة لمدة 2-3 دقائق. استرداد> 70٪ من الخلايا القابلة للحياة المجمدة ومن المتوقع.
ملاحظة: اختياريا، لمزيد من نقاء الخلايا هرس فرزها التي قد تكون روزيتد من قبل الخلايا التائية المرفقة، كوكتيل من الأجسام المضادة غير المسماة يمكن أن تضاف في هذه الخطوة (انظر البروتوكول الاختياري). - إضافة 100 ميكرولتر من كوكتيل الأجسام المضادة واحتضان لمدة 15 دقيقة في درجة حرارة الغرفة (رت)، محمية من الضوء. إضافة 3 مل من الفرز المتوسطة، وتدور أسفل الخلايا في 500 x جلمدة 10 دقيقة، ونضح طاف.
- ريسوسبيند الخلايا في 1 مل من الفرز المتوسطة ونقلها إلى 5 مل أنبوب تدفق أعلى مصفاة.
- شطف كل من أنبوب مخروطي 50 مل ومصفاة الخلية مع 1 مل إضافية من فرز الخلايا المتوسطة والمكان على الجليد.
3. (بروتوكول اختياري) T خلية حجب روزيت
ملاحظة: يتم روت الخلايا هرس الخلايا التائية في أقسام الأنسجة وتعليق الخلية، وهذه الخلايا التائية قد يحتمل أن تلوث جزء هرس فرزها. يتم بوساطة هذه التفاعلات CD54 و CD58 على خلية هرس ملزمة ل لفا-1 و CD2 على الخلايا التائية 4 ، 11 . يمكن منع هذه التفاعلات مع الأجسام المضادة غير المسماة لهذه الجزيئات الالتصاق.
- قسامة 100،000 إلى 500،000 الخلايا في 100 ميكرولتر من رمي.
- احتضان تعليق الخلية مع الأجسام المضادة غير المسماة ل CD2، CD54، CD58، و لفا-1 (10 ميكرولتر لكل منهما) على الجليد لمدة 1 ساعة. تييمكن تعليقه الآن تعليق خلية مع الأجسام المضادة الفلورسنت.
4. HRS-، B-، و T- خلية العزلة باستخدام فرز الخلايا
ملاحظة: على الرغم من أننا استخدمنا أداة ترتيب البحوث الخاصة باستخدام 5 أشعة الليزر (انظر جدول المواد)، أي فارز مع القدرة على الكشف عن فلوروكروميس المستخدمة في لوحة الأجسام المضادة يجب أن تكون كافية. تنفيذ الخطوات أدناه يتطلب الألفة مع برنامج 12 وظيفة والمعرفة الأساسية لعمليات فرز فارز الخلية. يرجى الرجوع إلى دليل البرامج عبر الإنترنت للحصول على تعليمات مفصلة.
- إعداد عداد الكريات:
- تشغيل الكمبيوتر وتسجيل الدخول. السلطة على بسك (ومنافذ بسك)، ومن ثم السلطة على مقياس الكريات. انتظر 90 ثانية على الأقل لوحدة المعالجة المركزية الداخلية من عداد الكريات لبدء، ومن ثم فتح برنامج التحكم بالليزر والتحقق من أن يتم تشغيل جميع الليزر على. إطلاق برنامج عداد الكريات 13 وتسجيل الدخول.
- ضمن برنامج عداد الكريات، انقر على "مقياس الكريات → عرض تكوينات." عند فتح مربع الحوار الخاص بالبرنامج الفرعي للتكوين، قم بتمييز التكوين المخصص 130 ميكرون ثم انقر فوق "تعيين التكوين" و "موافق". قم بإنهاء برنامج التكوين الفرعي.
- لاحظ مربع الحوار في برنامج عدادات الكريات وانقر على "استخدام إعدادات كس & T". تثبيت فوهة 130 ميكرون في الصك وتحويل تيار على من خلال النقر على زر "X" الأحمر في نافذة تيار. السماح للأداة إلى الاحماء لمدة 30 دقيقة على الأقل.
- قم بتشغيل فحص األداء على األداة باستخدام الطريقة المطلوبة) يتم تضمين وحدة برامج تتبع األداء مع فارز الموصوف هنا، راجع دليل البرامج) ص 117 - 122 (والمعيار المرجعي) راجع مواد المعيار المستخدم في هذا الإعداد).
- انقر فوق "عداد الكريات → ست"، تأكد من أن يتم تعيين الحقل "تشاراكتريز" إلى "تشيكk "الأداء" في القائمة المنسدلة، ثم انقر فوق "تشغيل". عند المطالبة بواسطة البرنامج، قم بتحميل أنبوب من الجسيمات المرجعية على مرحلة العينة وانقر على "موافق".
- بعد اكتمال تشغيل، انقر فوق "إنهاء" وإغلاق وحدة البرنامج. بعد الانتهاء من برنامج عداد الكريات إعادة الاتصال إلى عداد الكريات، انقر فوق "استخدام إعدادات كس & T" في مربع الحوار الذي يظهر.
- حدد التأخير الصحيح للتخفيض باستخدام ميزة تأخير الإفلات التلقائي لبرنامج الكهربية (انظر ص 154 - 161 من دليل البرامج).
- افتح تجربة "دروب ديلاي" في نافذة "بروزر" الخاصة ببرنامج مقياس الكريات، وقم بتثبيت أنبوب من جسيمات المعايرة في مرحلة العينة، وانقر على "تحميل" في نافذة "داتابوارد أكيسيتيون داشبوارد". تشغيل ميزة مراقبة تيار تلقائي من خلال النقر على زر "بقعة حلوة" في نافذة "تيار". ترك هذه الميزة في جميع الأوقات لجميع المتابعينز الخطوات.
- بدوره على الجهد لوحة انحراف عن طريق النقر على زر "الجهد" في نافذة الجانب تيار، ومن ثم تشغيل الفرز اختبار عن طريق النقر على زر "اختبار فرز" مباشرة بجوار زر "الجهد".
- اضبط جميع إعدادات البث الجانبي على الصفر باستثناء تيار الجانب الأيسر. اضبط إعداد دفق الجانب الأيسر بحيث تكون مرئيات تيار مرئية في نافذة البث الجانبي. انقر فوق الزر "فلتر البصرية" وتحقق من أن الجانب الأيسر بقعة تيار تقع داخل المربع الأيسر الذي يظهر في المنطقة السوداء من نافذة تيار الجانب.
- اضبط إعداد تيار الجانب الأيسر إذا لزم الأمر. إيقاف فرز الاختبار عن طريق النقر على زر "اختبار نوع" مرة أخرى. في نافذة "المتصفح"، قم بتوسيع عنصر "أوراق العمل العالمية" من تجربة "دروب ديلاي" من خلال النقر على "+".
- انقر نقرا مزدوجا على "سورت layout_001" لفتح تخطيط الترتيب، تحقق من الفحص البصريأيون أن السكان الفرز الأيسر لديه "P1" المخصصة له، وانقر على "فرز" في إطار "فرز تخطيط". في نافذة "تصنيف التنسيق"، انقر على "التأخير التلقائي" ثم "تشغيل".
- عند اكتمال التشغيل، انقر على "إنهاء". تثبيت أنبوب من الماء منزوع الأيونات معقم على مرحلة العينة وانقر على "تحميل" في نافذة "اقتناء لوحة". تشغيل أنبوب الماء لمدة 5 دقائق على الأقل لمسح جزيئات الاختبار المتبقية من الصك قبل الشروع.
- قم بتشغيل ضوابط التعويض) باستخدام حبات التعويض من جدول بيانات المواد أو ما يعادلها (باستخدام إعداد تعويض مضمن في برنامج الفرز) انظر ص 131 - 137 من دليل البرامج للحصول على تفاصيل إضافية (.
- أنشئ تجربة جديدة بالنقر على "تجربة جديدة للتجربة". في علامة التبويب "معلمات" من نافذة "حالة الأداة"، حذف المعلمات غير المستخدمة، إن وجدت. انقر على "كومبنسات التجربة"إعداد أيون إنشاء عناصر التحكم في التعويض ".
- في نافذة "المتصفح"، قم بتوسيع عينة "عناصر التحكم بالتعويض" بالنقر فوق علامة "+". تشغيل أنابيب التحكم التعويض دون تسجيل البيانات، وإذا لزم الأمر، وضبط الفولتية الكاشف (في علامة التبويب "معلمات" من نافذة "حالة الصك") بحيث السكان حبة ملطخة بشكل إيجابي لكل ملون بين قناة 10،000 و 100،000 و هي ألمع في قناة الكشف الأولية.
- اكتب الفولتية اللازمة لكل معلمة لكل أنبوب. تسليط الضوء على "السيطرة غير ملوثين" أنبوب تحت عينة "عناصر التحكم التعويض" من قبل واحد اليسار النقر عليه. تحميل أنبوب التحكم غير ملوثين على مرحلة العينة وانقر على "تحميل" في نافذة "السيطرة اقتناء".
- إدخال يدويا الفولتية تحديدها عن طريق تشغيل الضوابط التعويض الفردية في مجالات الجهد للكشف عن جميع المعلمات، وثم انقر فوق "تسجيل" في نافذة "التحكم في الاستحواذ". تشغيل جميع الضوابط التعويض المتبقية، وتسجيل البيانات دون تغيير أي إعدادات كاشف. تركيب أنبوب من الماء المعقم، منزوع الأيونات لمدة 5 دقائق لمسح أي المواد المتبقية من الصك قبل الشروع.
- هرس خلية التباعد:
- الحصول على وتسجيل ما لا يقل عن 100،000 الأحداث للابحار الأولي في حين ضبط معدل التدفق للحصول على 3000-4،000 الأحداث / ثانية (انظر الخطوة 4.1).
ملاحظة: قد يكون من الضروري إضافة إضافية فرز المتوسطة لتخفيف الخلايا إذا كان تركيز الخلية مرتفع جدا. وقف الاستحواذ. - خلايا هرس بوابة باستخدام الخطوات المبينة في الشكل 1
ملاحظة: في معظم الحالات تشل، بين 0.01٪ و 0.1٪ من الخلايا ستكون خلايا هرس.
- الحصول على وتسجيل ما لا يقل عن 100،000 الأحداث للابحار الأولي في حين ضبط معدل التدفق للحصول على 3000-4،000 الأحداث / ثانية (انظر الخطوة 4.1).
- B- و T- خلية التباعد:
- تحديد الضوابط الجسدية (B والخلايا التائية) عن طريق النابضة من CD20 و CD5، ريسب(الخلايا اللمفاوية عن طريق CD45 / سش)، تليها CD20 مقابل CD5 (انظر الشكل 1 ).
- تيارات جمع الهدف إلى أنابيب جمع في ما قبل المبردة اتجاهين أو أربعة في اتجاه جمع الرف. قم بتعبئة أنابيب التدفق أو أنابيب الطرد المركزي 15 مل على الأقل في منتصف الطريق مع وسط جمع.
- تعيين هرس ومراقبة السكان إلى أنابيب جمع المناسبة في الإعداد نوع التالية تعليمات البائع. إعادة تشغيل اكتساب الخلية وبدء هذا النوع.
- جمع كل الخلايا هرس وتصل إلى 1 مليون ب والخلايا التائية. استهدف مجاري التجميع إلى أنابيب التجميع في رف تجميع رباعي أو ثنائي الاتجاه مبرد مسبقا.
5. استخراج الحمض النووي
- بيليه الخلايا التي تم جمعها بواسطة الطرد المركزي في 1.5 مل أنابيب مخروطية في 3000 x ج لمدة 10 دقيقة و ريسوسبيند مرة واحدة مع 1 مل من برنامج تلفزيوني لغسل الخلايا.
- بيليه مرة أخرى في 3000 x ج لمدة 10 دقيقة وإزالة طاف. كن حذرا جدا عدم الإزعاجبيليه صغيرة.
- إضافة 150 ميكرولتر من العازلة تحلل (أو حجم مناسب للعدة المستخدمة) إلى الخلايا غسلها والمزيج من قبل بيبتينغ صعودا وهبوطا.
ملاحظة: يمكن للمرء تخزين المحللة الخلية في -70 درجة مئوية عند هذه النقطة، إذا لزم الأمر. - بناء تجميع العمود عن طريق وضع عمود التصفية داخل الأنبوب وإضافة المحللة من الخطوة 5.5 إلى العمود. تدور التجمع في 13000 x ج لمدة 3 دقائق.
- إزالة مينيكولومن من التجمع وتجاهل السائل في أنبوب جمع. استبدال عمود صغير في أنبوب جمع.
- إضافة 650 ميكرولتر من حل غسل العمود إلى كل التجمع. أجهزة الطرد المركزي لمدة 1 دقيقة في 13،000 × ز. تجاهل السائل من أنبوب جمع. كرر هذه الخطوة لما مجموعه 4 يغسل.
- تجاهل السائل من أنبوب جمع وإعادة تجميع التجمع مينيكولومن. أجهزة الطرد المركزي لمدة 2 دقيقة في 13،000 x ج لتجفيف مصفوفة ملزمة.
- نقل مينيكولومن إلى أنبوب 1.5 مل جديدة وإضافة 25 ميكرولتر من 10 ملي تريس كل، والتيويفضل خطوة صوتنة لاحقة، أو نوكليس خالية من المياه ساخنة إلى 65 درجة مئوية. احتضان لمدة 2 دقيقة في درجة حرارة الغرفة وأجهزة الطرد المركزي التجمع في 13000 x ج لمدة 1 دقيقة. كرر مرة أخرى مع 25 ميكرولتر لما مجموعه 50 ميكرولتر.
- مزيج من شطف الحمض النووي عن طريق بيبتينغ صعودا وهبوطا وكمية باستخدام فلوريمتري 14 .
6. بناء المكتبة
- التحضير قبل البدء:
- إعداد سونيكاتور على مستوى المياه 12، كثافة 5، دورات / انفجار 200، ودرجة الحرارة 7.
- استنادا إلى كمية الحمض النووي المتاحة التي يحددها فلوريمتري وعلى التصميم التجريبي، وتحديد كمية من الحمض النووي لاستخدامها لبناء المكتبة.
ملاحظة: نضع في اعتبارنا أنه إذا تم استخدام الحمض النووي قليلا جدا وجودة المكتبة للخطر، قد يكون هناك تطبيق القليل للمواد التي تركت وراءها لأغراض التحقق من الصحة. بالنسبة لكميات المدخلات دون المستوى المطلوب، كلما زادت كتلة المدخلات، كلما زادت الكمياتكلفة مكتبة التسلسل الناتجة. بعض المبادئ التوجيهية لهذا البروتوكول هي كما يلي: 10 نانوغرام ينبغي أن تسفر عن نتائج جيدة، و 50 نانوغرام يمكن اعتبار الحد الأقصى الخام. - تقرر على المحول: إدراج نسبة المولي استنادا فضفاضة على القيم في الجدول 1 .
- حساب مقدار المهايئ لاستخدامه في الأزياء التالية:
ملاحظة: عدد الشامات من المدخلات الحمض النووي، ن
أنا. ن = 1.54e-12 -12 * كتلة الإدخال (بالنيوغرام) / (يعني حجم الشظية)
ثانيا. عندما يكون متوسط حجم الشظية 200 نقطة أساس، وهذا يبسط:
n = 7.7e-15 * كتلة الإدخال (بالنيغرام)
عدد الشامات من المحول لتشمل، a
أنا. a = n * r
حجم محول الأسهم لاستخدامها في محول خطوة الربط، v
أنا. v (في μL ) = a / [ 10 -12 * محول الأسهمتركيز (في ميكرومتر )]
ملاحظة: إذا كان تركيز محول منخفضة، لضمان أن المبلغ اللازم من محول يتم تضمينها، ويمكن استخدام حل محول لتخفيف الكواشف إصلاح نهاية بدلا من الماء.
مثال: للحصول على 100 نانوغرام من الحمض النووي المدخلات مع حجم شظية متوسط 200 نقطة أساس، لمحول المولي المطلوب: إدراج نسبة 15: 1 ومحول تركيز الأسهم من 2 ميكرومتر، وحجم الموصى بها من محول لاستخدام 5.8 ميكرولتر. - تعيين الباركود المفهرسة إلى العينات.
ملاحظة: يجب ألا تحتوي المكتبات التي سيتم تجميعها معا في تفاعل تهجين أو حارة على خلية تدفق المنظم على أية مؤشرات زائدة عن الحاجة.
- بناء مكتبة - القص الحمض النووي:
- إضافة كمية كاملة من الحمض النووي لاستخدامها في أنبوب سونيكيشن. إذا كان حجم العينة التي تحتوي على الحمض النووي المدخلات وحدها هو أقل من 50 ميكرولتر، إضافة المخزن المؤقت إب يصل إلى 50 ميكرولتر الحجم الكلي والمزيج.
- يصوتن لمدة 30 s.
- إزالة الأنبوب وأداء سريع تدور في جهاز طرد مركزي مصغرة فقط بما فيه الكفاية لجمع أي رذاذ من الجزء العلوي من جدران ميكروتوب.
- كرر الخطوات من 6.2.2-6.2.3 لما مجموعه سبع جلسات صوت 30 ثانية لما مجموعه 210 ثانية من سونيكيشن.
ملاحظة : لا تتردد في تجربة تقسيم 210 ثانية في جلسات أقل.
- بناء المكتبة - إصلاح نهاية، A- تايلينغ، ومحول ربط:
ملاحظة: تجنب القيام بأي اختيار حجم قبل خطوة ير التضخيم مكتبة.- اتبع تعليمات الشركة المصنعة 19 لإصلاح نهاية و A- تايلينغ بعد سونيكاتيون من الحمض النووي العينة.
- بعد A- تايلينغ، استخدم العدد المناسب من الشامات من محول (المحسوبة في الخطوة 6.1.3) في رد فعل. الجمع بين محول، شظايا الحمض النووي A-تايلد، والانزيم، والعازلة واحتضان بين عشية وضحاها في 20 درجة مئوية لمدة 16 ساعة تقريبا.
- ليبراري البناء - مكتبة التضخيم:
- إجراء تنظيف حبة من محول ربط رد فعل. بعد إضافة الخرز إلى المنتج ير، انتظر 5 دقائق في درجة حرارة الغرفة. وضعه ضد موقف المغناطيسي وإزالة السوائل، وغسل مرتين في 200 ميكرولتر من الايثانول 80٪، وتجفيف حبات طويلة بما فيه الكفاية لإزالة معظم السائل دون الإفراط في التجفيف، وأزل الحمض النووي الخروج من الخرز بواسطة بيبتينغ 25 ميكرولتر من نوكليس خالية من المياه، كما اقترح، على الخرز بينما يبقى أنبوب ضد موقف المغناطيسي.
ملاحظة: قد يكون من الممكن لتجربة مع الحفاظ على الخرز في البولي ايثيلين جلايكول
(بيج) حتى بعد التضخيم بدلا من التخلص منها، ولكن هذا لم يتم اختبارها. - وتشمل 0.6 ميكرولتر من 1: 1،000 التخفيف من الصبغة الخضراء لكل 50 ميكرولتر من مزيج الرئيسي ير. بدلا من ذلك، استخدم في الوقت الحقيقي ير متوافق مع صبغ صبغ الاختيار في الحجم المناسب للمعدات.
- برنامج تفاعل ير في 98 درجة مئوية ل45 ثانية من أجل تمسخ الأولي، تليها دورة من تمسخ، الصلب، وتمديد في 98 درجة مئوية لمدة 15 ثانية، 60 درجة مئوية لمدة 30 ثانية، و 72 درجة مئوية لمدة 30 ثانية، أو اختيار البرنامج المناسب إذا كان استخدام بديل انزيم البلمرة.
- تعيين الجهاز لاتخاذ بيانات مضان في 72 درجة مئوية لكل دورة. برنامج تمديد النهائي في 72 درجة مئوية لمدة 1 دقيقة تليها عقد في 4 درجات مئوية لمدة غير محددة من الوقت. الاشعال ير لتضخيم المكتبة محول ليغاتد باستخدام الكواشف في الجدول التكميلي هي: أوليغو 1، آتغاتاسغكاكغاغا و أوليغو 2، كاغكاغاغاكاتاسغاغ
- تضخيم المكتبة باستخدام ظروف ير المذكورة أعلاه مع مراعاة قيم شدة مضان في الوقت الحقيقي مع البرنامج قر، ووقف قبل نهاية مرحلة النمو الأسي.
- بعد التضخيم، القيام تنظيف حبة القياسية (انظر الخطوة 6.4.1) باستخدام 0.8x حجم رد فعل التضخيم ريكوفإريد، عادة 0.8 × 50 = 40 ميكرولتر من الخرز. إضافة الخرز إلى المنتج ير والانتظار 5 دقائق في درجة حرارة الغرفة.
- وضعه ضد موقف المغناطيسي وإزالة السوائل، وغسل مرتين في 200 ميكرولتر من الايثانول 80٪، وتجفيف حبات طويلة بما فيه الكفاية لإزالة معظم السائل دون الإفراط في التجفيف، وأزل عن طريق إضافة نوكليس خالية من المياه إلى الخرز الجاف.
- تحديد الحمض النووي الناتج باستخدام قياس الفلور. تصور شظايا المكتبة للحجم؛ انظر القسم الخاص بتوقعات مراقبة الجودة لمزيد من التفاصيل.
- إجراء تنظيف حبة من محول ربط رد فعل. بعد إضافة الخرز إلى المنتج ير، انتظر 5 دقائق في درجة حرارة الغرفة. وضعه ضد موقف المغناطيسي وإزالة السوائل، وغسل مرتين في 200 ميكرولتر من الايثانول 80٪، وتجفيف حبات طويلة بما فيه الكفاية لإزالة معظم السائل دون الإفراط في التجفيف، وأزل الحمض النووي الخروج من الخرز بواسطة بيبتينغ 25 ميكرولتر من نوكليس خالية من المياه، كما اقترح، على الخرز بينما يبقى أنبوب ضد موقف المغناطيسي.
7. إكسوم التهجين
- الجمع بين أربع مكتبات مع رموز شريط محول متميزة.
ملاحظة: يتم استخدام كتلة من قبل فلوريمتري وحجم بواسطة هلام لحساب مولاريتي، ومن ثم يتم الجمع بين المكتبات في كميات متساوي الأقطاب لمجموع كتلة 1000 نانوغرام من المكتبة المجمعة. فمن الأفضل للحفاظ على جميع أزواج الورم العادي معا بدلا من فصلها إلى برك منفصلة. - تطبيق بروتوكول التقاط إكسوم أوب كلاس = "كريف"> 15 والقيام 8 دورات ير بعد تنظيف الالتقاط. خيارات أخرى من أهداف الالتقاط قد يكون ممكنا.
8. تسلسل المضاعفة
- تسلسل التقاط تهجين واحد يحتوي على أربع مكتبات متعددة الإرسال في حارة واحدة على منصة التسلسل المشار إليها في جدول بيانات المواد 16 .
ملاحظة: تكوينات بديلة ممكنة للمستخدمين المتقدمين الذين يرغبون في مزيد من التخطيط وتحسين الهدف قراءة عمق التغطية.
9 - التحليل (يمكن الاستعاضة عنها بخطوط أنابيب بديلة إذا رغبت في ذلك)
- سنبس والإندلس الصغيرة:
- بيانات الخريطة الخام إلى الجينوم المرجعي البشري، أوسك hg19، وذلك باستخدام الجحيم ويلر ألينر (بوا) 17 أو خوارزمية بديلة من الاختيار. تصفية أو علامة يقرأ مع نقاط جودة تعيين أقل من 20 و ير التكرارات باستخدام سامتولس 18 أو بيكاردريف "> 19.
- كشف المتغيرات النوكليوتيدات الجسدية والصغيرة إندلس في عينات هرس بالمقارنة مع الضوابط الجسدية خلية T باستخدام ستريلكا 20 أو المتصل البديل من الاختيار. تطبيق سنبف 21 للتعليق على الإخراج ستريلكا. إذا رغبت في ذلك، فحص منهجي موقع البديل عن التحف باستخدام عارض الجينوم المتكاملة (إيغف) 22 ، 23 .
- نسخ عدد التعديلات:
- حساب نسبة سجل تحويل " لتر " لكل الفاصل الزمني إكسوم الهدف " ط " من داخل المكتبة التعداد قراءة العادي في الورم ضد تلك من الطبيعي بالطريقة التالية:
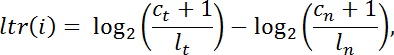
ملاحظة: c هو عدد من يقرأ تعيين لفاصل التقاط معين، ل هو إجمالي حجم المكتبة، ر يدل على الورم، و n يدل على وضعها الطبيعي. - تصفية الفواصل مع عدم كفاية التغطية ( C t + C ن <100 يقرأ) لمزيد من التحليل. إجراء تجزئة الفاصل الزمني باستخدام دناكوبي v.1.0 24 من الموصل الحيوي في R.
ملاحظة: النظر في الشرائح التي تكون فيها القيمة المطلقة للمتوسط لتر أقل من 0.5 لتكون محايدة للنسخ. ويمكن تصنيف الأجزاء المتبقية كمكاسب عدد النسخ، إذا كانت علامة متوسط لتر إيجابية (وبعبارة أخرى، هناك أكثر بكثير يقرأ في عينة الورم مما كانت عليه في العينة العادية بعد التطبيع)، أو نسخ عدد الخسائر، إذا كانت علامة من متوسط لتر سالب.
- حساب نسبة سجل تحويل " لتر " لكل الفاصل الزمني إكسوم الهدف " ط " من داخل المكتبة التعداد قراءة العادي في الورم ضد تلك من الطبيعي بالطريقة التالية:
Access restricted. Please log in or start a trial to view this content.
النتائج
وينبغي أن تؤخذ مؤامرة بيواناليزر بعد التضخيم مكتبة و 0.8 حبة تنظيف حبة. ينبغي للمرء أن يرى توزيع "عادي مثل" من أحجام الشظايا في النطاق المطلوب ( الشكل 2A ). الانحرافات من هذا الشكل، مثل "الكتف" واضحة في المنحنى، تشير إلى وجود عا?...
Access restricted. Please log in or start a trial to view this content.
Discussion
التطبيقات أو الاتجاهات المستقبلية بعد اتقان هذه التقنية
هذا العمل يسمح تسلسل إكسوم من العينات التي تحتوي على 10 نانوغرام على الأقل من الحمض النووي. في السياق السريري، هذا الحد يستبعد معظم عينات طموح إبرة غرامة بسبب عدم ك...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
وقد تم تمويل تطوير هذا المشروع المشروع من قبل قسم علم الأمراض والطب المخبري من كلية طب وايل كورنيل. ونحن نعترف برنامج التدريب المؤسسي الثلاثي في علم الأحياء الحاسوبية والطب للتمويل الجزئي. نود أن نشكر العلماء الذين تقاسموا وقتهم ومعرفتهم معنا، وخاصة ماريك أبيل؛ دان بورغيس؛ إيوانكا كوزاريوا؛ تشاد لوكلار؛ والجميع من المؤسسة الأساسية لعلم الجينوم في كلية طب وايل كورنيل، بما في ذلك جيني تشانغ، وشياوبو (شون) ليانغ، ودونغ شو، وي تشانغ، وهويمين شانغ، وتاتيانا باتسون، وتوو تشانغ.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Petri or Cell Culture Dish (sterile) | |||
| RPMI-1640 Media | Roswell Park Memorial Institute | ||
| Fetal Calf Serum (FCS), (heat inactivated) | |||
| Freezing Media (RPMI, 20% FCS, 10% dimethylsulfoxide (DMSO))-make fresh and keep sterile | |||
| RPMI with 2% FCS (make fresh or store for up to 1 month) | |||
| scalpel with fresh blade | |||
| 10 mL syringe (no needle) | |||
| Cryogenic vials | |||
| 50 mL conical centrifuge tubes, force | |||
| Centrifuge | capable of handling 50 mL conical centrifuge tubes and providing 400g | ||
| Hepes buffer(1 M, cell culture grade) | |||
| phosphate buffered saline (PBS) | |||
| Pluoronic-F68 | Thermo-Fisher | 24040-032 | |
| DNAase-I | Sigma-Aldrich, St. Louis, MO | D4527-10KU | store as 5 mg/mL in RPMI in -200 °C |
| Bovine Serum Albumin (BSA) | |||
| Sort Media (PBS + 2% BSA + 25 mM HEPES + Pluoronic –F68 (1x)) | |||
| CD64-FITC (22) | Beckman Coulter, Miami, FL | 20 μL suggested starting volume; Titering is suggested | |
| CD30-PE (BerH83) | BD Biosciences, San Jose, CA | 20 μL suggested starting volume; Titering is suggested | |
| CD5-ECD (BL1a) | Beckman Coulter, Miami, FL | 10 μL suggested starting volume; Titering is suggested | |
| CD40-PerCP-eFluor 710 (1C10) | Ebiosciences, San Diego, CA | 5 μL suggested starting volume; Titering is suggested | |
| CD20-PC7 (B9E9) | Beckman Coulter, Miami, FL | 10 μL suggested starting volume; Titering is suggested | |
| CD15-APC (HI98) | BD Biosciences, San Jose, CA | 20 μL suggested starting volume; Titering is suggested | |
| CD45 APC-H7 (2D1) | BD Biosciences, San Jose, CA | Can be substituted with 10 μL suggested volume of CD45-Krome Orange (J.33, Beckman Coulter); Titering is suggested | |
| CD95-Pacific Blue (DX2) | Life Technologies, Grand Island, NY | 5 μL suggested starting volume; Titering is suggested | |
| CD2 (5 μg; clone RPA-2.10) | Biolegend, San Diego, CA | For optional protocol; Titering is suggested | |
| CD54 (10 μg; clone 84H10) | Serotec, Oxford, United Kingdom | For optional protocol; Titering is suggested | |
| CD58 (10 μg; clone TS2/9) | eBioscience, San Diego, CA | For optional protocol; Titering is suggested | |
| LFA-1 (12 μg; clone MHM23) | Novus Biologicals, Littleton, CO | For optional protocol; Titering is suggested | |
| BD CS&T Beads | BD Biosciences, San Jose, CA | ||
| BD Accudrop Beads | BD Biosciences, San Jose, CA | ||
| BC Versa Comp antibody capture beads | Beckman Coulter, Miami, FL | Compensation Beads | |
| BD-FACS ARIA special research order instrument using 5 lasers | BD Biosciences, San Jose, CA | any BD-FACS aria with capabilities to detect the fluorochromes in the antibody panel should be sufficient | |
| Wizard | Promega | A2360 | |
| 10 mM Tris-Cl buffer | NA | ||
| Qubit dsDNA HS Assay kit | Life Technologies, Carlsbad, CA | ||
| S2 Sonicator | Covaris, Woburn, MA | Alternatives may be substituted | |
| microTUBE | Covaris, Woburn, MA | ||
| Low-Throughput Library Preparation Kit | Kapa Biosystems, Wilmington, MA | KK8221 | |
| Sybr Green | Sigma-Aldrich, St. Louis, MO | S9430 | |
| Agencourt AMPure XP Beads | Beckman Coulter, Miami, FL | ||
| Bioanalyzer | Agilent Technologies, Santa Clara, CA | ||
| SeqCap EZ Exome v.3.0 | Roche Nimblegen | 6465684001 | |
| HiSeq | Illumina | ||
| TruSeq-style Universal adapter | Integrated DNA Technologies (IDT), Coralville, Iowa | HPLC purification; AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGAT*C*T | |
| TruSeq-style index adapter | Integrated DNA Technologies (IDT), Coralville, Iowa | HPLC purification; /5Phos/GATCGGAAGAGCACACGTCTGAACTCCAGTCACNNNNNNATCTCGTATGCCGTCTTCTGCTTG | |
| TruSeq-style PCR primer 1 | Integrated DNA Technologies (IDT), Coralville, Iowa | AATGATACGGCGACCACCGAGA | |
| TruSeq-style PCR primer 2 | Integrated DNA Technologies (IDT), Coralville, Iowa | CAAGCAGAAGACGGCATACGAG | |
| Nuclease Free Duplex Buffer | Integrated DNA Technologies (IDT), Coralville, Iowa | ||
| BD FACSDIVA software | BD Biosciences, San Jose, CA | ||
| BD Falcon Tubes | BD Biosciences, San Jose, CA | ||
| BD Flow Tubes | BD Biosciences, San Jose, CA |
References
- Abrams, J. National Cancer Institute's Precision Medicine Initiatives for the new National Clinical Trials Network. American Society of Clinical Oncology educational book / ASCO. American Society of Clinical Oncology. Meeting. , 71-76 (2014).
- Gagan, J., Van Allen, E. M. Next-generation sequencing to guide cancer therapy. Genome medicine. 7, 80(2015).
- Matsuki, E., Younes, A. Lymphomagenesis in Hodgkin lymphoma. Seminars in cancer biology. 34, 14-21 (2015).
- Fromm, J. R., Kussick, S. J., Wood, B. L. Identification and purification of classical Hodgkin cells from lymph nodes by flow cytometry and flow cytometric cell sorting. Am J Clin Pathol. 126 (5), 764-780 (2006).
- Fromm, J. R., Thomas, A., Wood, B. L. Flow cytometry can diagnose classical hodgkin lymphoma in lymph nodes with high sensitivity and specificity. Am J Clin Pathol. 131 (3), 322-332 (2009).
- Roshal, M., Wood, B. L., Fromm, J. R. Flow cytometric detection of the classical hodgkin lymphoma: clinical and research applications. Advances in hematology. 2011, 387034(2011).
- Reichel, J., et al. Flow sorting and exome sequencing reveal the oncogenome of primary Hodgkin and Reed-Sternberg cells. Blood. 125 (7), 1061-1072 (2015).
- Kozarewa, I. A Modified Method for Whole Exome Resequencing from Minimal Amounts of Starting DNA. PLoS ONE. 7 (3), e32617(2012).
- Brunicardi, F. C. Schwartz's Principles of Surgery. , 10th ed, McGraw-Hill Education / Medical. (2014).
- Kantor, A. B., Roederer, M. FACS analysis of leukocytes. Handbook of Experimental Immunology. 2, Blackwell Scientific. (1996).
- Sanders, M. E. Molecular pathways of adhesion in spontaneous rosetting of T-lymphocytes to the Hodgkin's cell line L428. Cancer Res. 48 (1), 37-40 (1988).
- Biosciences. FACSDiva Software v6.0. , Available from: http://www.bdbiosciences.com/in/instruments/software/facsdiva/resources/overview.jsp (2007).
- Biosciences. FACSAria II User's Guide. Part No. 644832, Revision A. , (2009).
- Life Technologies. Qubit 3.0 Fluorometer, Catalog Number Q33216. , Available from: https://www.thermofisher.com/order/catalog/product/Q33216 (2017).
- Roche Nimblegen. SeqCap EZ Library SR User's Guide ver. 4.1. , (2013).
- Illumina. HiSeq High-Throughput Sequencing System. , Available from: http://www.illumina.com/systems/hiseq_2500_1500.html (2016).
- Li, H., Durbin, R. Fast and accurate short read alignment with Burrows-Wheeler transform. Bioinformatics. 25 (14), 1754-1760 (2009).
- Li, H. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25 (16), 2078-2079 (2009).
- The Broad Institute. Picard Tools. , Available from: http://broadinstitute.github.io/picard/ (2016).
- Saunders, C. T. Strelka: accurate somatic small-variant calling from sequenced tumor-normal sample pairs. Bioinformatics. 28 (14), 1811-1817 (2012).
- Cingolani, P., et al. A program for annotating and predicting the effects of single nucleotide polymorphisms, SnpEff: SNPs in the genome of Drosophila melanogaster strain w1118; iso-2; iso-3. Fly (Austin). 6 (2), 80-92 (2012).
- Dobin, A. STAR: ultrafast universal RNA-seq aligner. Bioinformatics. 29 (1), 15-21 (2013).
- Thorvaldsdottir, H., Robinson, J. T., Mesirov, J. P. Integrative Genomics Viewer (IGV): high-performance genomics data visualization and exploration. Briefings in bioinformatics. 14 (2), 178-192 (2013).
- DNA copy number data analysis. v.R package version 1.34.0. , Available from: https://omictools.com/dnacopy-tool (2013).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved