Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Le tri de flux et le séquençage Exome des cellules de Reed-Sternberg du lymphome de Hodgkin classique
Dans cet article
Résumé
Ici, nous décrivons un protocole de calcul de la cellule de cytométrie à flux combiné et un protocole de construction de bibliothèque de prochaine génération conçu pour produire des données de haute qualité et exhaustives des cellules Hodgkin Reed-Sternberg (HRS) du lymphome de Hodgkin classique (CHL).
Résumé
Les cellules Hodgkin Reed-Sternberg du lymphome de Hodgkin classique sont dispersées dans un fond de lymphocytes inflammatoires et comprennent généralement moins de 1% de la masse tumorale. Les matières dérivées de la tumeur en vrac contiennent une teneur en tumeur à une concentration insuffisante pour la caractérisation. Par conséquent, le tri cellulaire activé par fluorescence utilisant huit anticorps, ainsi que des dispersions latérales et antérieures, est décrit ici comme une méthode de séparation rapide et de concentration avec des milliers de cellules HRS à haute pureté de la tumeur pour une étude ultérieure. Dans le même temps, car les protocoles standard pour le séquençage exome nécessitent généralement 100-1 000 ng d'ADN d'entrée, ce qui est souvent trop élevé, même avec le tri de flux, nous fournissons également un protocole de construction de bibliothèque optimisé et à faible entrée capable de produire une qualité élevée Des données provenant de seulement 10 ng d'ADN d'entrée. Cette combinaison est capable de produire des bibliothèques de prochaine génération adaptées à la capture d'hybridation de tout-eXome appâts ou plus ciblés panneaux ciblés, comme désiré. Exome du séquençage des cellules HRS, comparées aux cellules T ou B intratumorales saines, peuvent identifier les altérations somatiques, y compris les mutations, les insertions et les suppressions, et les modifications des numéros de copies. Ces résultats expliquent la biologie moléculaire des cellules HRS et peuvent révéler des voies pour les traitements ciblés.
Introduction
Les progrès dans la génomique du cancer à la suite du séquençage de la prochaine génération ont conduit à des percées significatives dans l'identification des cibles thérapeutiques et dans le pronostic pour de nombreux néoplasmes hématologiques et non hématologiques. De nouvelles stratégies de traitement individualisées basées sur des modifications génomiques spécifiques sont rapidement introduites dans de nombreux types de tumeurs (examinés dans les références 1 , 2 ). Malgré des progrès significatifs dans la génomique des lymphomes, le génome des cellules HRS néoplasiques dans le lymphome Hodgkin classique (CHL) avait été sous-exploré. Les recherches ont été entravées par la pénurie de cellules HRS néoplasiques dans un micro-environnement réactif, ce qui rend difficile l'isolement des populations de cellules HRS purifiées 3 .
La méthode pour isoler des cellules HRS viables à partir de tumeurs primaires a été développée par Fromm et al. 4 ,La méthode utilise un cocktail à huit anticorps, composé de CD30, CD15, CD40, CD95, CD45 CD20, CD5 et CD64, pour identifier de manière non équivoque les cellules HRS à partir d'une suspension de tumeur CHL. En utilisant cette méthodologie, nous Sont capables d'isoler au moins 1 000 cellules HRS viables à partir de suspensions cellulaires fraîches ou congelées à partir de biopsies tumorales constituées d'au moins 10 cellules (environ 10 mg de tissu). La pureté est supérieure à 90% par analyse cytométrique en flux et est estimée comme étant Au moins 80% par une analyse génomique exome de dix cas consécutifs.
Nous avons raffiné une technique d'isolement de cellules cytométriques en flux qui a considérablement facilité le processus, ce qui permet l'isolement rapide de milliers de cellules HRS viables à partir de tumeurs CHL primaires 7 . Nous avons utilisé la technique pour produire ce qui est censé être la première séquence complète des cellules tumorales dans les cas primaires de lymphome de Hodgkin. Nos études démontrent queLa faisabilité des études à grande échelle sur le génome des cas individuels de la LCH et ont déjà conduit à l'identification de nouvelles altérations génomiques avec le potentiel d'expliquer les aspects de la pathogenèse de la LCH.
Nous avons développé un pipeline pour utiliser l'ADN extrait pour des études génomiques à haut débit. Afin d'obtenir des résultats fiables à partir de 1 000 cellules HRS triées (le minimum obtenu à partir de cas séquentiels), nous avons développé une procédure de construction de bibliothèque d'ADN de prochaine génération modifiée 8 qui nous a permis d'augmenter l'efficacité de ligature d'adaptateur et de générer des bibliothèques de fragments d'ADN Sans amplification excessive. Cette méthode permet l'analyse d'échantillons cliniques de routine et la détection de mutations récurrentes et d'altérations chromosomiques 7 .
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Traitement et congélation des tissus
- Recueillir des tissus ganglionnaires dans du sérum physiologique tamponné au phosphate (PBS) ou au milieu de l'Institut Roswell Park Memorial (RPMI) et traiter dans les 24 h de la collecte. Transférer le tissu de ganglion lymphatique excisé 9 dans une boîte de Pétri contenant 10 mL de RPMI avec 2% de sérum de veau fœtal (FCS) et l'hacher finement avec une lame de scalpel fraîche. Utilisez le dos d'un piston de seringue de 10 ml pour broyer / dissocier le tissu.
- Transférer le liquide dans un tube conique de 50 ml à travers une crépine cellulaire de 100 μm. Rincer la boîte à pétri et le filtre avec 10 ml supplémentaire de RPMI 2% FCS.
- Obtenez un nombre de cellules en utilisant un compteur de cellules automatisé ou un hémocytomètre.
REMARQUE: Généralement, au moins 2 x 10 7 cellules seraient attendues d'environ 5 mm 3 de tissu ganglionnaire CHL. On s'attend à une viabilité de plus de 80%, mais elle peut varier selon l'échantillon. - Faites tourner les cellules à 400 xg pendant 10 min et aspiratezLe surnageant. Placez le tube contenant du culot cellulaire sur de la glace.
- Moyen de congélation pré-refroidissement sur glace. Remettre en suspension les cellules dans un milieu de congélation à froid à une concentration de 2 x 10 7 / mL et ré-endiguer par pipettage. Ne tournez pas dans le vortex. Incuber la suspension sur de la glace pendant 10 min.
- Aliquotez l'échantillon 1 mL / flacon de cryo (pré-refroidi sur glace). Transférer les flacons à un congélateur de -80 ° C pendant 1-2 jours et les transférer à nouveau à l'azote liquide.
2. Préparation des suspensions cellulaires pour le tri des cellules
NOTE: Chaque lot d'anticorps doit être correctement intitulé en utilisant 10 millions de cellules dans un volume de coloration de 300 μΛ. Le sang périphérique peut être utilisé pour tous les anticorps, à l'exception du CD30, pour lequel la lignée cellulaire KMH2 injectée dans le sang périphérique peut être utilisée pour le titrage 10 . Nous commençons généralement par le volume d'anticorps recommandé par le fabricant et effectuons deux dilutions à deux fois et une augmentation de deux fois (quatre points de données)Pour chaque lot de titrage d'anticorps. Par exemple, si le fabricant recommande un volume de 10 μL, nous effectuons le titrage en utilisant des volumes de 2, 5, 10 et 20 μL.
- Mettre un bain-marie à 37 ° C. Préparer la quantité titrée d'anticorps dans un flacon de verre sombre et ajouter PBS + 2% de BSA pour un volume total de cocktail de 100 μL.
REMARQUE: Bien que nous recommandons de classer les anticorps, les volumes suivants peuvent être utilisés comme point de départ: CD64, 20 μL; CD95, 5 μL; CD30, 20 μL; CD5, 10 μl; CD20, 10 μL; CD15, 20 μL; CD40, 5 μL; Et CD45, 10 μL. - Transférer le flacon de l'azote liquide dans un seau à glace contenant de la glace carbonique pour éviter la décongélation. Préchauffer 50 ml de milieu de décongélation contenant du RPMI / 20% de FCS / DNase (100 μg / mL) dans un tube conique de 50 ml dans un bain d'eau à 37 ° C.
- Transférer 45 ml de milieu de décongélation dans un tube frais et le garder à 37 ° C. Décongeler rapidement les cellules en maintenant un flacon cryogénique dans une bataille d'eau à 37 ° CH jusqu'à ce qu'il ne reste qu'une très petite portion congelée.
- Verser le contenu du flacon dans le tube contenant 45 ml de milieu de décongélation. Rincer le flacon cryogénique vide 2 fois avec 1 ml de milieu de décongélation et combiner les rinçages.
- Incuber les cellules à température ambiante pendant 15 minutes pour permettre la digestion par DNase et la rééquilibrage cellulaire. Faire tourner les cellules à 500 xg pendant 10 min et aspirer le surnageant.
- Remettre en suspension les cellules dans environ 200 μL du milieu de décongélation retenu (5 mL) et laisser refroidir à température ambiante pendant 2 à 3 minutes. La récupération de> 70% des cellules viables congelées est attendue.
REMARQUE: optionnellement, pour une plus grande pureté des cellules HRS classées qui peuvent être introduites par des lymphocytes T attachés, un cocktail d'anticorps non marqués peut être ajouté à cette étape (voir le protocole facultatif). - Ajouter 100 μl d'un cocktail d'anticorps et incuber pendant 15 minutes à température ambiante (RT), protégé de la lumière. Ajouter 3 ml de milieu de tri, centrifuger les cellules à 500 xgPendant 10 min, et aspirer le surnageant.
- Remettre en suspension les cellules dans 1 ml de milieu de tri et les transférer dans un filtre supérieur de 5 ml.
- Rincer à la fois le tube conique de 50 ml et le filtre cellulaire avec 1 mL supplémentaire de milieu de tri et placer les cellules sur de la glace.
3. (Protocole facultatif) Blocage de la rosette à cellules T
NOTE: Les cellules HRS sont présentées par des lymphocytes T dans des coupes de tissus et une suspension de cellules, et ces cellules T peuvent potentiellement contaminer la fraction de HRS triée. Ces interactions sont médiées par CD54 et CD58 sur la liaison de la cellule HRS à LFA-1 et CD2 sur les cellules T 4 , 11 . Ces interactions peuvent être bloquées avec des anticorps non marqués contre ces molécules d'adhésion.
- Aliquote de 100 000 à 500 000 cellules dans 100 μL de RPMI.
- Incuber la suspension cellulaire avec des anticorps non marqués contre CD2, CD54, CD58 et LFA-1 (10 μL chacun) sur de la glace pendant 1 h. TLa suspension de cellules peut maintenant être marquée avec des anticorps fluorescents.
4. Isolation des cellules HRS, B et T à l'aide du tri cellulaire
REMARQUE: Bien que nous utilisions un instrument de commande de recherche spécial en utilisant 5 lasers (voir la feuille de calcul des matériaux), tout trieur capable de détecter les fluorochromes utilisés dans le panneau d'anticorps devrait être suffisant. L'exécution des étapes ci-dessous nécessite une familiarité avec la fonction du logiciel 12 et une connaissance de base des opérations de trieur de cellule. Veuillez consulter le manuel du logiciel en ligne pour obtenir des instructions détaillées.
- Configuration du cytomètre:
- Allumez l'ordinateur et connectez-vous. Allumez les prises BSC (et BSC), puis allumez le cytomètre. Attendez au moins 90 s pour que la CPU interne du cytomètre commence, puis ouvrez le logiciel de contrôle laser et vérifiez que tous les lasers sont sous tension. Lancez le logiciel cytomètre 13 et connectez-vous.
- Dans le logiciel cytomètre, cliquez sur "Cytomètre → Afficher les configurations". Lorsque la boîte de dialogue du sous-programme de configuration s'ouvre, mettez en surbrillance la configuration personnalisée de 130 μm et cliquez sur "configurer la configuration" et "OK". Quittez le sous-programme de configuration.
- Observez la boîte de dialogue dans le logiciel cytomètre et cliquez sur "utiliser les paramètres CS & T". Installez une buse de 130 μm dans l'instrument et activez le flux en cliquant sur le bouton rouge "X" dans la fenêtre du flux. Laissez l'instrument s'échauffer pendant au moins 30 min.
- Effectuez une vérification de performance sur l'instrument en utilisant la méthode souhaitée (un module logiciel de suivi des performances est inclus avec le trieur décrit ici, voir le manuel du logiciel (p. 117 à 122) et référence standard (voir les Matériaux pour la norme utilisée dans Cette configuration).
- Cliquez sur "Cytomètre → CST", assurez-vous que le champ "Caractériser" est réglé sur "ChecK Performance "dans le menu déroulant, et cliquez sur" Exécuter ". Lorsque vous êtes invité par un logiciel, chargez un tube de particules de référence sur l'étage d'échantillonnage et cliquez sur" OK ".
- Une fois l'exécution terminée, cliquez sur "Terminer" et fermez le module logiciel. Une fois que le logiciel cytomètre a fini de se reconnecter au cytomètre, cliquez sur "utiliser les paramètres CS & T" dans la boîte de dialogue qui s'affiche.
- Déterminez le délai de chute correct à l'aide de la fonction de délai de chute automatique du logiciel du cytomètre (voir les pages 154 à 161 du manuel du logiciel).
- Ouvrez l'expérience «Dépasser le délai» dans la fenêtre «Navigateur» du logiciel cytomètre, installez un tube de particules d'étalonnage sur l'étage d'échantillonnage et cliquez sur «Charger» dans la fenêtre «Tableau de bord d'acquisition». Activez la fonction de surveillance automatique du flux en cliquant sur le bouton "Sweet Spot" dans la fenêtre "Stream". Laissez cette fonction activée en tout temps pour tous les suivisG étapes.
- Allumez la tension de la plaque de déviation en cliquant sur le bouton "Voltage" dans la fenêtre de flux latéral, puis activez le tri de test en cliquant sur le bouton "Test de tri" immédiatement adjacent au bouton "Voltage".
- Ajustez tous les paramètres du flux secondaire à zéro sauf pour le flux côté gauche. Réglez le réglage du flux du côté gauche de telle sorte que deux points d'écoulement soient visibles dans la fenêtre côté flux. Cliquez sur le bouton "Filtre optique" et vérifiez que le point du flux latéral gauche tombera dans la zone de gauche qui apparaît dans la zone noire de la fenêtre côté flux.
- Réglez le réglage du côté gauche si nécessaire. Éteignez le tri des tests en cliquant à nouveau sur le bouton "Test Tri". Dans la fenêtre "Navigateur", développez l'élément "Global Worksheets" de l'expérience "Drop Delay" en cliquant sur "+."
- Double-cliquez sur "Sort Layout_001" pour ouvrir la disposition de tri, vérifiez par inspection visuelleQue la population de tri gauche a "P1" affectée à elle, et cliquez sur "Trier" dans la fenêtre "Sort Layout". Dans la fenêtre "Sort Layout", cliquez sur "Auto Delay", puis sur "Run".
- Une fois la course terminée, cliquez sur "Quitter". Installez un tube d'eau désionisée stérile sur l'étape d'échantillonnage et cliquez sur "Charger" dans la fenêtre "Tableau de bord d'acquisition". Faites passer le tube d'eau pendant au moins 5 minutes pour éliminer les particules résiduelles d'essai de l'instrument avant de procéder.
- Exécutez les contrôles de compensation (en utilisant des blocs de compensation à partir de la feuille de calcul des matériaux ou de l'équivalent) en utilisant une configuration de compensation intégrée dans le logiciel de trieur (voir les pages 131 à 137 du manuel du logiciel pour plus de détails).
- Créez une nouvelle expérience en cliquant sur "Expérience Nouvelle expérience". Dans l'onglet "Paramètres" de la fenêtre "Etat de l'instrument", supprimez les paramètres inutilisés, le cas échéant. Cliquez sur "Experiment CompensatIon Setup Créer des contrôles de compensation. "
- Dans la fenêtre "Navigateur", développez le spécimen "Compensation Controls" en cliquant sur le signe "+". Exécutez des tubes de contrôle de compensation sans enregistrer les données, et si nécessaire, ajustez les tensions du détecteur (dans l'onglet "Paramètres" de la fenêtre "Etat de l'instrument") afin que les populations de perles colorées positivement pour chaque fluorochrome soient entre le canal 10 000 et 100 000 et sont Les plus brillants dans leur canal de détection primaire.
- Notez les tensions nécessaires pour chaque paramètre pour chaque tube. Mettez en surbrillance le tube "Contrôle non contrôlé" sous l'échantillon "Compensation Controls" en faisant un seul clic gauche. Chargez le tube de contrôle non étagé sur l'étage d'échantillonnage et cliquez sur "Charger" dans la fenêtre "Contrôle d'acquisition".
- Entrez manuellement les tensions déterminées en exécutant des contrôles de compensation individuels dans les champs de tension du détecteur pour tous les paramètres, etPuis cliquez sur "Enregistrer" dans la fenêtre "Acquisition Control". Exécutez tous les contrôles de compensation restants, enregistrant les données sans modifier les paramètres du détecteur. Installez un tube d'eau stérile et désionisée pendant 5 minutes pour éliminer toute matière résiduelle de l'instrument avant de procéder.
- HRS-cell gating:
- Acquérir et enregistrer au moins 100 000 événements pour le déclenchement initial tout en ajustant le débit pour acquérir 3 000 à 4 000 événements / s (voir étape 4.1).
REMARQUE: il peut être nécessaire d'ajouter un autre moyen de tri pour diluer les cellules si la concentration de la cellule est trop élevée. Arrêtez l'acquisition. - Placez les cellules HRS en utilisant les étapes décrites à la Figure 1
NOTE: Dans la plupart des cas de CHL, entre 0,01% et 0,1% des cellules seront des cellules HRS.
- Acquérir et enregistrer au moins 100 000 événements pour le déclenchement initial tout en ajustant le débit pour acquérir 3 000 à 4 000 événements / s (voir étape 4.1).
- Verrouillage des cellules B et T:
- Identifier les contrôles somatiques (cellules B et T) par le déclenchement de CD20 et CD5,Ctively (activation des lymphocytes par CD45 / SSH), suivi de CD20 par rapport au CD5 (voir la figure 1 ).
- Les flux de collecte de cibles aux tubes de collecte dans un rack de collecte pré-refroidi à deux ou quatre voies. Remplissez soit des tubes à écoulement soit des tubes à centrifuger de 15 ml au moins à mi-chemin avec un support de collecte.
- Assignez HRS et contrôlez les populations aux tubes de collecte appropriés dans la configuration de tri suivant les instructions du fournisseur. Redémarrez l'acquisition de la cellule et commencez le tri.
- Recueillir toutes les cellules HRS et jusqu'à 1 million de cellules B et T. Cibler les flux de collecte vers les tubes de collecte dans un rack de collecte pré-refroidi à quatre voies (ou à deux sens).
5. Extraction d'ADN
- Le culot a recueilli des cellules par centrifugation dans 1,5 ml de tubes coniques à 3 000 xg pendant 10 min et réusé une fois avec 1 ml de PBS pour laver les cellules.
- Pellet une fois de plus à 3 000 xg pendant 10 minutes et enlever le surnageant; Faites très attention à ne pas dérangerLa minuscule pastille.
- Ajouter 150 μL de tampon de lyse (ou un volume approprié pour le kit utilisé) aux cellules lavées et mélanger en pipetant vers le haut et vers le bas.
REMARQUE: on peut stocker le lysat cellulaire à -70 ° C à ce stade, si nécessaire. - Construire un assemblage de colonne en plaçant la colonne de filtre dans le tube et ajouter le lysat à partir de l'étape 5.5 à la colonne. Tournez l'assemblage à 13 000 xg pendant 3 min.
- Retirez la minicolonne de l'assemblage et jeter le liquide dans le tube de collecte. Remplacez la minicolonne dans le tube de collecte.
- Ajouter 650 μL de solution de lavage en colonne à chaque assemblage. Centrifuger pendant 1 min à 13 000 x g. Jeter le liquide du tube de collecte. Répétez cette étape pour un total de 4 lavages.
- Jeter le liquide du tube de collecte et remonter l'assemblage de la minicolonne. Centrifuger pendant 2 min à 13 000 xg pour sécher la matrice de liaison.
- Transférer la minicolonne dans un nouveau tube de 1,5 ml et ajouter 25 μL de 10 mM de Tris-Cl, quiEst préféré pour une étape de sonication ultérieure, ou de l'eau libre de nuclease chauffée à 65 ° C. Incuber pendant 2 min à température ambiante et centrifuger l'assemblage à 13 000 xg pendant 1 min. Répétez encore une fois avec 25 μL pour un total de 50 μL.
- Mélanger l'élution de l'ADN en pipetant vers le haut et vers le bas et quantifier en utilisant la fluorimétrie 14 .
6. Construction de bibliothèques
- Préparation avant de commencer:
- Configurez le sonicateur au niveau de l'eau 12, Intensité 5, Cycles / éclatement 200 et Temp 7.
- Sur la base de la quantité d'ADN disponible déterminée par la fluorimétrie et sur la conception expérimentale, déterminer la quantité d'ADN à utiliser pour la construction de la bibliothèque.
REMARQUE: Gardez à l'esprit que si trop peu d'ADN est utilisé et que la qualité de la bibliothèque est compromise, il peut y avoir peu d'application pour le matériel laissé pour des raisons de validation. Pour les quantités d'entrée de mauvaise qualité, plus la masse d'entrée est élevée, plus la compLaxisme de la bibliothèque de séquençage résultante. Certaines lignes directrices pour ce protocole sont les suivantes: 10 ng devraient donner de bons résultats et 50 ng peuvent être considérés comme un maximum approximatif. - Décidez de l'adaptateur: insérez le rapport molaire basé sur les valeurs du tableau 1 .
- Calculez la quantité d'adaptateur à utiliser de la façon suivante:
NOTE: Nombre de moles d'apport d'ADN, n
je. N = 1,54e-12 -12 * masse d'entrée (en ng) / (taille de fragment moyen)
Ii. Lorsque la taille moyenne des fragments est de 200 pb, cela simplifie:
N = 7.7e-15 * masse d'entrée (en ng)
Nombre de moles d'adaptateur à inclure, un
je. A = n * r
Volume de l'adaptateur à utiliser dans l'étape de ligature de l'adaptateur, v
je. V (en μL ) = un / [ 10 -12 * adaptateurConcentration (en μM )]
REMARQUE: si la concentration de l'adaptateur est faible, assurez-vous que la quantité nécessaire d'adaptateur est incluse, la solution d'adaptateur peut être utilisée pour diluer les réactifs de réparation finale au lieu de l'eau.
Exemple: Pour 100 ng d'ADN d'entrée avec une taille de fragment moyenne de 200 pb, pour un adaptateur molaire désiré: rapport d'insertion de 15: 1 et une concentration de stock d'adaptateur de 2 μM, le volume d'adaptateur recommandé à utiliser est de 5,8 μl. - Affectez des codes-barres indexés aux échantillons.
REMARQUE: Les bibliothèques qui seront rassemblées dans une réaction d'hybridation ou une voie sur la cellule d'écoulement d'un séquenceur ne doivent pas contenir d'indices redondants.
- Construction de la bibliothèque - cisaillement de l'ADN:
- Ajouter la quantité totale d'ADN à utiliser dans un tube à sonication. Si le volume d'échantillon contenant l'ADN d'entrée seul est inférieur à 50 μL, ajoutez le tampon EB jusqu'à un volume total de 50 μL et mélangez.
- Sonicate pour 30 s.
- Retirez le tube et effectuez un virage rapide dans une mini centrifugeuse juste pour collecter tout vaporisateur de la partie supérieure des parois du microtube.
- Répétez les étapes 6.2.2-6.2.3 pour un total de sept sessions de sonication de 30 s pour un total de 210 s de sonication.
REMARQUE : n'hésitez pas à expérimenter en divisant les 210 s en moins de sessions.
- Construction de la bibliothèque - Réparation finale, A-tailing et ligature de l'adaptateur:
REMARQUE: Évitez d'effectuer une sélection de taille avant l'étape d'amplification par PCR de la bibliothèque.- Suivez les instructions du fabricant 19 pour la réparation finale et la queue arrière après la sonication de l'échantillon d'ADN.
- Après A-tailing, utilisez le nombre approprié de moles d'adaptateur (calculé à l'étape 6.1.3) dans la réaction. Combinez l'adaptateur, les fragments d'ADN à queue A, l'enzyme et le tampon et incubés pendant une nuit à 20 ° C pendant environ 16 h.
- LibConstruction récente - Amplification de la bibliothèque:
- Effectuer un nettoyage des cordons de la réaction de ligature de l'adaptateur. Après avoir ajouté des billes au produit de PCR, attendez 5 minutes à température ambiante. Placez-le contre un support magnétique et retirez les liquides, lavez-les deux fois dans 200 μL d'éthanol à 80%, séchez les perles assez longtemps pour enlever la plupart du liquide sans séchage excessif et éluez l'ADN des billes en pipetant 25 μL de Eau exempte de nuclease, comme suggéré, sur les perles alors que le tube reste contre un support magnétique.
REMARQUE: il est possible d'expérimenter la conservation des perles dans le polyéthylène glycol
(PEG) jusqu'à l'amplification au lieu de les jeter, mais cela n'a pas été testé. - Inclure 0,6 μL d'une dilution 1: 1 000 de colorant vert par 50 μL de mélange de maïs PCR. Alternativement, utilisez un colorant intercolant compatible avec la PCR en temps réel de choix dans le volume approprié pour l'équipement.
- Programmer la réaction de PCR à 98 ° C pour45 s pour la dénaturation initiale, suivie d'un cycle de dénaturation, de recuit et d'extension à 98 ° C pendant 15 s, 60 ° C pendant 30 s et 72 ° C pendant 30 s, ou choisissez le programme approprié si vous utilisez une alternative Polymerase enzyme.
- Réglez la machine pour prendre des données de fluorescence à 72 ° C pour chaque cycle. Programmer une extension finale à 72 ° C pendant 1 min suivie d'une prise à 4 ° C pendant une durée indéterminée. Les amorces de PCR pour l'amplification de la bibliothèque ligaturée à l'adaptateur utilisant des réactifs dans le tableau supplémentaire sont: Oligo 1, AATGATACGGCGACCACCGAGA et Oligo 2, CAAGCAGAAGACGGCATACGAG
- Amplifier la bibliothèque en utilisant les conditions de PCR décrites ci-dessus tout en observant les valeurs d'intensité de fluorescence en temps réel avec le logiciel qPCR, s'arrêtant juste avant la fin de la phase de croissance exponentielle.
- Après l'amplification, effectuez un nettoyage standard du talon (voir étape 6.4.1) en utilisant 0.8x le volume de la réaction d'amplification récupérée, Typiquement 0,8 x 50 = 40 μL de perles. Ajouter les perles au produit de PCR et attendre 5 minutes à température ambiante.
- Placez-le contre un support magnétique et enlevez les liquides, lavez-les deux fois dans 200 μL d'éthanol à 80%, séchez les perles assez longtemps pour enlever la plupart du liquide sans séchage excessif et éluciez en ajoutant de l'eau libre de nuclease aux perles sèches.
- Quantifier l'ADN résultant en utilisant la fluorimétrie. Visualisez les fragments de la bibliothèque pour la taille; Consultez la section sur les attentes de QC des données pour plus de détails.
- Effectuer un nettoyage des cordons de la réaction de ligature de l'adaptateur. Après avoir ajouté des billes au produit de PCR, attendez 5 minutes à température ambiante. Placez-le contre un support magnétique et retirez les liquides, lavez-les deux fois dans 200 μL d'éthanol à 80%, séchez les perles assez longtemps pour enlever la plupart du liquide sans séchage excessif et éluez l'ADN des billes en pipetant 25 μL de Eau exempte de nuclease, comme suggéré, sur les perles alors que le tube reste contre un support magnétique.
7. Exome Hybridization
- Combinez quatre bibliothèques avec des codes de barre d'adaptateur distincts.
NOTE: La masse par fluorimétrie et la taille par gel sont utilisées pour calculer la molarité, puis les bibliothèques sont combinées en quantités équimolaires pour un total de 1 000 ng de masse de bibliothèque groupée. Il est préférable de garder ensemble toutes les paires de tumeurs normales plutôt que de les séparer en groupes séparés. - Appliquer le protocole de capture exome Up class = "xref"> 15 et faire 8 cycles de PCR après le nettoyage de la capture. D'autres choix de cibles de capture peuvent être possibles.
8. Séquençage multiplexé
- Séquence d'une seule capture d'hybridation contenant quatre bibliothèques multiplexées dans une seule voie sur la plate-forme de séquençage référencée dans la feuille de calcul Matériels 16 .
REMARQUE: des configurations alternatives sont possibles pour les utilisateurs avancés qui souhaitent planifier et optimiser leur profondeur de couverture cible.
9. Analyse (peut être remplacé par des pipelines alternatifs si désiré)
- Snps et petits indels:
- Déposez les données brutes au génome de référence humain, UCSC hg19, en utilisant l'Aligner Burrows-Wheeler (BWA) 17 ou un autre algorithme de choix. Filtrer ou marquer des lectures avec un score de qualité de cartographie inférieur à 20 et des doublons PCR en utilisant Samtools 18 ou PicardRef "> 19.
- Détecter les variantes de nucléotides somatiques et les petites indelles dans les échantillons HRS par rapport aux contrôles somatiques des cellules T en utilisant Strelka 20 ou un appelant variant de choix. Appliquez snpEff 21 pour annoter la sortie Strelka. Si vous le souhaitez, inspectez systématiquement les loci variants pour les artefacts à l'aide de Integrated Integrator Viewer (IGV) 22 , 23 .
- Copier les modifications de numéros:
- Calculez le rapport log-transformé " ltr " pour chaque intervalle de cible " i " parmi les nombres de lecture normalisés intra-bibliothèque dans la tumeur par rapport à ceux de la normale de la manière suivante:
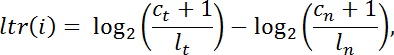
NOTE: c est le nombre de lectures de mappage à un intervalle de capture donné, l est la taille totale de la bibliothèque, t indique la tumeur et n indique la normale. - Filtrer les intervalles avec une couverture insuffisante ( C t + C n <100 lectures) pour une analyse plus approfondie. Effectuer une segmentation à intervalle à l'aide d'ADNcopie v.1.0 24 de Bioconductor dans R.
REMARQUE: Considérons des segments où la valeur absolue du ltr moyen est inférieure à 0,5 pour être neutre en fonction de la copie. Les segments restants peuvent être désignés comme gains de nombre de copies, si le signe du ltr moyen est positif (en d'autres termes, il y a significativement plus de lectures dans l'échantillon de tumeur que dans l'échantillon normal après la normalisation) ou des pertes de numéros de copie, si le signe Du ltr moyen est négatif.
- Calculez le rapport log-transformé " ltr " pour chaque intervalle de cible " i " parmi les nombres de lecture normalisés intra-bibliothèque dans la tumeur par rapport à ceux de la normale de la manière suivante:
Access restricted. Please log in or start a trial to view this content.
Résultats
Un diagramme de bioanalyseur devrait être pris après l'amplification de la bibliothèque et le nettoyage des perles 0,8x. On devrait voir une distribution "normale" des tailles de fragments dans la gamme souhaitée ( Figure 2a ). Les écarts par rapport à cette forme, tels qu'un "épaule" visible dans la courbe, indiquent la présence d'un artefact de poids moléculaire élevé ou faible. Par exemple, la
Access restricted. Please log in or start a trial to view this content.
Discussion
Applications ou directions futures après maîtriser cette technique
Ce travail permet un exoma de séquençage à partir d'échantillons contenant au moins 10 ng d'ADN. Dans le contexte clinique, cette limite exclut la plupart des échantillons d'aspiration à l'aiguille fine en raison d'un matériel insuffisant, mais comprend des biopsies de noyau adéquates et des échantillons de biopsie excisionnelle. Cela permettra l'acquisition de données à p...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Le développement de cette méthode de projet a été financé par le Département de pathologie et de médecine de laboratoire du Collège médical Weill Cornell. Nous reconnaissons le programme de formation tri-institutionnelle en biologie et médecine computationnelle pour un financement partiel. Nous tenons à remercier les scientifiques qui ont partagé leur temps et nos connaissances avec nous, en particulier Maryke Appel; Dan Burgess; Iwanka Kozarewa; Chad Locklear; Et tous les membres du Weill Cornell Medical College Genomics Core Facility, y compris Jenny Zhang, Xiaobo (Shawn) Liang, Dong Xu, Wei Zhang, Huimin Shang, Tatiana Batson et Tuo Zhang.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Petri or Cell Culture Dish (sterile) | |||
| RPMI-1640 Media | Roswell Park Memorial Institute | ||
| Fetal Calf Serum (FCS), (heat inactivated) | |||
| Freezing Media (RPMI, 20% FCS, 10% dimethylsulfoxide (DMSO))-make fresh and keep sterile | |||
| RPMI with 2% FCS (make fresh or store for up to 1 month) | |||
| scalpel with fresh blade | |||
| 10 mL syringe (no needle) | |||
| Cryogenic vials | |||
| 50 mL conical centrifuge tubes, force | |||
| Centrifuge | capable of handling 50 mL conical centrifuge tubes and providing 400g | ||
| Hepes buffer(1 M, cell culture grade) | |||
| phosphate buffered saline (PBS) | |||
| Pluoronic-F68 | Thermo-Fisher | 24040-032 | |
| DNAase-I | Sigma-Aldrich, St. Louis, MO | D4527-10KU | store as 5 mg/mL in RPMI in -200 °C |
| Bovine Serum Albumin (BSA) | |||
| Sort Media (PBS + 2% BSA + 25 mM HEPES + Pluoronic –F68 (1x)) | |||
| CD64-FITC (22) | Beckman Coulter, Miami, FL | 20 μL suggested starting volume; Titering is suggested | |
| CD30-PE (BerH83) | BD Biosciences, San Jose, CA | 20 μL suggested starting volume; Titering is suggested | |
| CD5-ECD (BL1a) | Beckman Coulter, Miami, FL | 10 μL suggested starting volume; Titering is suggested | |
| CD40-PerCP-eFluor 710 (1C10) | Ebiosciences, San Diego, CA | 5 μL suggested starting volume; Titering is suggested | |
| CD20-PC7 (B9E9) | Beckman Coulter, Miami, FL | 10 μL suggested starting volume; Titering is suggested | |
| CD15-APC (HI98) | BD Biosciences, San Jose, CA | 20 μL suggested starting volume; Titering is suggested | |
| CD45 APC-H7 (2D1) | BD Biosciences, San Jose, CA | Can be substituted with 10 μL suggested volume of CD45-Krome Orange (J.33, Beckman Coulter); Titering is suggested | |
| CD95-Pacific Blue (DX2) | Life Technologies, Grand Island, NY | 5 μL suggested starting volume; Titering is suggested | |
| CD2 (5 μg; clone RPA-2.10) | Biolegend, San Diego, CA | For optional protocol; Titering is suggested | |
| CD54 (10 μg; clone 84H10) | Serotec, Oxford, United Kingdom | For optional protocol; Titering is suggested | |
| CD58 (10 μg; clone TS2/9) | eBioscience, San Diego, CA | For optional protocol; Titering is suggested | |
| LFA-1 (12 μg; clone MHM23) | Novus Biologicals, Littleton, CO | For optional protocol; Titering is suggested | |
| BD CS&T Beads | BD Biosciences, San Jose, CA | ||
| BD Accudrop Beads | BD Biosciences, San Jose, CA | ||
| BC Versa Comp antibody capture beads | Beckman Coulter, Miami, FL | Compensation Beads | |
| BD-FACS ARIA special research order instrument using 5 lasers | BD Biosciences, San Jose, CA | any BD-FACS aria with capabilities to detect the fluorochromes in the antibody panel should be sufficient | |
| Wizard | Promega | A2360 | |
| 10 mM Tris-Cl buffer | NA | ||
| Qubit dsDNA HS Assay kit | Life Technologies, Carlsbad, CA | ||
| S2 Sonicator | Covaris, Woburn, MA | Alternatives may be substituted | |
| microTUBE | Covaris, Woburn, MA | ||
| Low-Throughput Library Preparation Kit | Kapa Biosystems, Wilmington, MA | KK8221 | |
| Sybr Green | Sigma-Aldrich, St. Louis, MO | S9430 | |
| Agencourt AMPure XP Beads | Beckman Coulter, Miami, FL | ||
| Bioanalyzer | Agilent Technologies, Santa Clara, CA | ||
| SeqCap EZ Exome v.3.0 | Roche Nimblegen | 6465684001 | |
| HiSeq | Illumina | ||
| TruSeq-style Universal adapter | Integrated DNA Technologies (IDT), Coralville, Iowa | HPLC purification; AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGAT*C*T | |
| TruSeq-style index adapter | Integrated DNA Technologies (IDT), Coralville, Iowa | HPLC purification; /5Phos/GATCGGAAGAGCACACGTCTGAACTCCAGTCACNNNNNNATCTCGTATGCCGTCTTCTGCTTG | |
| TruSeq-style PCR primer 1 | Integrated DNA Technologies (IDT), Coralville, Iowa | AATGATACGGCGACCACCGAGA | |
| TruSeq-style PCR primer 2 | Integrated DNA Technologies (IDT), Coralville, Iowa | CAAGCAGAAGACGGCATACGAG | |
| Nuclease Free Duplex Buffer | Integrated DNA Technologies (IDT), Coralville, Iowa | ||
| BD FACSDIVA software | BD Biosciences, San Jose, CA | ||
| BD Falcon Tubes | BD Biosciences, San Jose, CA | ||
| BD Flow Tubes | BD Biosciences, San Jose, CA |
Références
- Abrams, J. National Cancer Institute's Precision Medicine Initiatives for the new National Clinical Trials Network. American Society of Clinical Oncology educational book / ASCO. American Society of Clinical Oncology. Meeting. , 71-76 (2014).
- Gagan, J., Van Allen, E. M. Next-generation sequencing to guide cancer therapy. Genome medicine. 7, 80(2015).
- Matsuki, E., Younes, A. Lymphomagenesis in Hodgkin lymphoma. Seminars in cancer biology. 34, 14-21 (2015).
- Fromm, J. R., Kussick, S. J., Wood, B. L. Identification and purification of classical Hodgkin cells from lymph nodes by flow cytometry and flow cytometric cell sorting. Am J Clin Pathol. 126 (5), 764-780 (2006).
- Fromm, J. R., Thomas, A., Wood, B. L. Flow cytometry can diagnose classical hodgkin lymphoma in lymph nodes with high sensitivity and specificity. Am J Clin Pathol. 131 (3), 322-332 (2009).
- Roshal, M., Wood, B. L., Fromm, J. R. Flow cytometric detection of the classical hodgkin lymphoma: clinical and research applications. Advances in hematology. 2011, 387034(2011).
- Reichel, J., et al. Flow sorting and exome sequencing reveal the oncogenome of primary Hodgkin and Reed-Sternberg cells. Blood. 125 (7), 1061-1072 (2015).
- Kozarewa, I. A Modified Method for Whole Exome Resequencing from Minimal Amounts of Starting DNA. PLoS ONE. 7 (3), e32617(2012).
- Brunicardi, F. C. Schwartz's Principles of Surgery. , 10th ed, McGraw-Hill Education / Medical. (2014).
- Kantor, A. B., Roederer, M. FACS analysis of leukocytes. Handbook of Experimental Immunology. 2, Blackwell Scientific. (1996).
- Sanders, M. E. Molecular pathways of adhesion in spontaneous rosetting of T-lymphocytes to the Hodgkin's cell line L428. Cancer Res. 48 (1), 37-40 (1988).
- Biosciences. FACSDiva Software v6.0. , Available from: http://www.bdbiosciences.com/in/instruments/software/facsdiva/resources/overview.jsp (2007).
- Biosciences. FACSAria II User's Guide. Part No. 644832, Revision A. , (2009).
- Life Technologies. Qubit 3.0 Fluorometer, Catalog Number Q33216. , Available from: https://www.thermofisher.com/order/catalog/product/Q33216 (2017).
- Roche Nimblegen. SeqCap EZ Library SR User's Guide ver. 4.1. , (2013).
- Illumina. HiSeq High-Throughput Sequencing System. , Available from: http://www.illumina.com/systems/hiseq_2500_1500.html (2016).
- Li, H., Durbin, R. Fast and accurate short read alignment with Burrows-Wheeler transform. Bioinformatics. 25 (14), 1754-1760 (2009).
- Li, H. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25 (16), 2078-2079 (2009).
- The Broad Institute. Picard Tools. , Available from: http://broadinstitute.github.io/picard/ (2016).
- Saunders, C. T. Strelka: accurate somatic small-variant calling from sequenced tumor-normal sample pairs. Bioinformatics. 28 (14), 1811-1817 (2012).
- Cingolani, P., et al. A program for annotating and predicting the effects of single nucleotide polymorphisms, SnpEff: SNPs in the genome of Drosophila melanogaster strain w1118; iso-2; iso-3. Fly (Austin). 6 (2), 80-92 (2012).
- Dobin, A. STAR: ultrafast universal RNA-seq aligner. Bioinformatics. 29 (1), 15-21 (2013).
- Thorvaldsdottir, H., Robinson, J. T., Mesirov, J. P. Integrative Genomics Viewer (IGV): high-performance genomics data visualization and exploration. Briefings in bioinformatics. 14 (2), 178-192 (2013).
- DNA copy number data analysis. v.R package version 1.34.0. , Available from: https://omictools.com/dnacopy-tool (2013).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon