Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Clasificación de flujo y secuenciación exome de las células Reed-Sternberg del linfoma de Hodgkin clásico
En este artículo
Resumen
En este trabajo describimos una clasificación combinada de células de citometría de flujo y un protocolo de construcción de biblioteca de próxima generación, de bajo ingreso, diseñado para producir datos de exome de alta calidad de las células Hodgkin Reed-Sternberg (HRS) del linfoma de Hodgkin clásico (CHL).
Resumen
Las células de Hodgkin Reed-Sternberg del linfoma de Hodgkin clásico se distribuyen escasamente dentro de un fondo de linfocitos inflamatorios y típicamente comprenden menos del 1% de la masa tumoral. El material derivado del tumor a granel contiene contenido de tumor a una concentración insuficiente para la caracterización. Por lo tanto, la clasificación de células activadas por fluorescencia utilizando ocho anticuerpos, así como la dispersión lateral y hacia adelante, se describe aquí como un método de separación y concentración rápidas con miles de células HRS de alta pureza del tumor para estudio posterior. Al mismo tiempo, debido a que los protocolos estándar para la secuenciación de exome típicamente requieren 100-1,000 ng de ADN de entrada, que a menudo es demasiado alto, incluso con clasificación de flujo, también proporcionamos un protocolo optimizado de construcción de biblioteca de entrada baja capaz de producir alta calidad Datos de tan poco como 10 ng de ADN de entrada. Esta combinación es capaz de producir bibliotecas de próxima generación adecuadas para la captura de hibridación de todo-eXome o más enfocados paneles de destino, como se desee. La secuenciación exome de las células HRS, cuando se compara con células T o B intratumor sanas, puede identificar alteraciones somáticas, incluyendo mutaciones, inserciones y deleciones, y alteraciones del número de copias. Estos hallazgos aclaran la biología molecular de las células HRS y pueden revelar vías para los tratamientos de fármacos dirigidos.
Introducción
Los avances en genómica del cáncer como resultado de la próxima generación de secuenciación han llevado a avances significativos en la identificación de objetivos terapéuticos y en el pronóstico de muchas neoplasias hematológicas y no hematológicas. Se están introduciendo rápidamente nuevas estrategias de tratamiento individualizadas basadas en alteraciones genómicas específicas en muchos tipos de tumores (revisadas en las referencias 1 , 2 ). A pesar de los avances significativos en la genómica del linfoma, el genoma de las células HRS neoplásicas en el linfoma de Hodgkin clásico (CHL) había sido subexplorado. Las investigaciones se han visto obstaculizadas por la escasez de células HRS neoplásicas dentro de un microambiente reactivo, lo que dificulta el aislamiento de células purificadas HRS poblaciones [ 3] .
El método para aislar células HRS viables de tumores primarios fue desarrollado por Fromm et al. 4 ,El método utiliza un cóctel de ocho anticuerpos, que consta de CD30, CD15, CD40, CD95, CD45 CD20, CD5 y CD64, para identificar inequívocamente células HRS a partir de una suspensión tumoral CHL. Son capaces de aislar al menos 1.000 células HRS viables de suspensiones de células frescas o congeladas a partir de biopsias tumorales que consisten en al menos 10 ^ { 7 } células (aproximadamente 10 mg de tejido). La pureza es superior al 90% mediante análisis citométrico de flujo y se estima que es Al menos 80% por exome análisis genómico de diez casos consecutivos.
Hemos refinado una técnica de aislamiento de células de citometría de flujo que ha facilitado enormemente el proceso, lo que permite el rápido aislamiento de miles de células HRS viables de los tumores primarios CHL [ 7] . Hemos utilizado la técnica para producir lo que se cree que es la primera secuencia de todo el exome de las células tumorales en los casos primarios de linfoma de Hodgkin. Nuestros estudios demuestranE viabilidad de alto rendimiento, el genoma de los estudios de los casos individuales CHL y ya han llevado a la identificación de nuevas alteraciones genómicas con el potencial de explicar los aspectos de la patogénesis CHL.
Desarrollamos una tubería para utilizar el ADN extraído para estudios genómicos de alto rendimiento. Con el fin de obtener resultados fiables de tan sólo 1.000 células HRS clasificadas (el mínimo obtenido a partir de casos secuenciales), hemos desarrollado un procedimiento modificado de construcción de biblioteca de ADN de próxima generación 8 que nos permitió aumentar la eficiencia de ligadura adaptador y generar bibliotecas de fragmentos de ADN Sin amplificación excesiva. Este método permite el análisis de muestras clínicas de rutina y la detección de mutaciones recurrentes y alteraciones cromosómicas 7 .
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Tratamiento y congelación de tejidos
- Recoja el tejido de los ganglios linfáticos en solución salina tamponada con fosfato (PBS) o en el medio del Instituto Memorial de Roswell Park (RPMI) y procese dentro de las 24 horas de su recolección. Transferir el tejido 9 de ganglios linfáticos extirpados a una placa de Petri que contiene 10 ml de RPMI con 2% de suero fetal de ternera (FCS) y picar finamente con una cuchilla de bisturí fresca. Utilice la parte posterior de un émbolo de jeringa de 10 ml para moler / disociar más el tejido.
- Transfiera el líquido a un tubo cónico de 50 ml a través de un filtro de células de 100 μm. Enjuague la placa de Petri y el filtro con 10 mL adicionales de RPMI 2% FCS.
- Obtenga un recuento de células usando un contador de células automatizado o un hemocitómetro.
NOTA: Generalmente, se esperaría al menos 2 x 107 células de aproximadamente 5 mm ^ { 3} de tejido de ganglio linfático de CHL. Se espera una viabilidad de más del 80%, pero puede variar según la muestra. - Girar las células a 400 xg durante 10 min y aspirarTe el sobrenadante. Coloque el tubo que contiene el sedimento celular sobre hielo.
- Precaliente el medio de congelación en hielo. Resuspender las células en medio de congelación fría a una concentración de 2 x 107 / ml y resuspenderlo por pipeteo. No vórtice. Incubar la suspensión en hielo durante 10 min.
- Alícuota de la muestra 1 ml / frasco de cryo (pre-enfriado en hielo). Transferir los viales a un congelador de -80 ° C durante 1-2 días y transferirlos de nuevo a nitrógeno líquido.
2. Preparación de suspensiones celulares para clasificación celular
NOTA: Cada lote de anticuerpos debe estar adecuadamente titulado usando 10 millones de células en un volumen de tinción de 300 μ μ. Se puede usar sangre periférica para todos los anticuerpos excepto CD30, para los cuales la línea celular KMH2 inyectada en sangre periférica puede ser usada para la titulación 10 . Generalmente comenzamos con el volumen de anticuerpos recomendado por el fabricante y realizamos dos diluciones de dos veces y un aumento de dos veces (cuatro puntos de datos)Para cada lote de titulación de anticuerpos. Por ejemplo, si el fabricante recomienda un volumen de 10 μL, realizamos la valoración usando volúmenes de 2, 5, 10 y 20 μL.
- Coloque un baño de agua a 37 ° C. Premezclar la cantidad titulada de anticuerpos en un vial de vidrio oscuro y añadir PBS + 2% de BSA para un volumen de cóctel total de 100 μl.
NOTA: Aunque se recomienda titular los anticuerpos, los siguientes volúmenes pueden utilizarse como punto de partida: CD64, 20 μl; CD95, 5 mu l; CD30, 20 mu l; CD _ {5}, 10 mu L; CD20, 10 mu l; CD15, 20 mu L; CD40, 5 mu l; Y CD45, 10 mu l. - Transfiera el vial del nitrógeno líquido a un cubo de hielo que contenga hielo seco para prevenir el deshielo. Pre-caliente 50 ml de medio de descongelación que contenga RPMI / FCS / DNasa al 20% (100 μg / mL) en un tubo cónico de 50 ml en un baño de agua a 37 ° C.
- Transferir 45 ml de medio de descongelación a un tubo nuevo y mantenerlo a 37 ° C. Descongelar rápidamente las células sosteniendo un vial criogénico en un chorro de agua a 37 ° CH hasta que sólo queda una porción congelada muy pequeña.
- Vierta el contenido del vial en el tubo que contiene 45 ml de medio de descongelación. Enjuague el vial criogénico vacío 2 veces con 1 mL de medio de descongelación y combine los enjuagues.
- Incubar las células a temperatura ambiente durante 15 min para permitir la digestión de ADNasa y reequilibrio celular. Girar las células a 500 xg durante 10 min y aspirar el sobrenadante.
- Resuspender las células en aproximadamente 200 μl del medio de descongelación retenido (5 ml) y dejar que se equilibre a temperatura ambiente durante 2-3 minutos. Se espera una recuperación de> 70% de las células viables congeladas.
NOTA: Opcionalmente, para una mayor pureza de las células HRS clasificadas que pueden ser rosetadas por células T unidas, se puede añadir un cóctel de anticuerpos no marcados en este paso (véase el protocolo opcional). - Añadir 100 μl de un cóctel de anticuerpos e incubar durante 15 min a temperatura ambiente (RT), protegido de la luz. Añadir 3 ml de medio de clasificación, centrifugar las células a 500 xgDurante 10 min, y aspirar el sobrenadante.
- Resuspender las células en 1 ml de medio de clasificación y transferirlas a un colador superior de 5 ml.
- Enjuague tanto el tubo cónico de 50 mL y el filtro de células con un adicional de 1 mL de medio de clasificación y coloque las células sobre hielo.
3. (Protocolo opcional) Bloqueo de rosetas de células T
NOTA: Las células HRS son rosetadas por células T en secciones de tejido y suspensión de células, y estas células T pueden potencialmente contaminar la fracción HRS clasificada. Estas interacciones están mediadas por CD54 y CD58 en la unión de células HRS a LFA-1 y CD2 en las células T 4 , 11 . Estas interacciones pueden bloquearse con anticuerpos no marcados para estas moléculas de adhesión.
- Alícuota de 100.000 a 500.000 células en 100 μL de RPMI.
- Incubar la suspensión celular con anticuerpos no marcados a CD2, CD54, CD58 y LFA-1 (10 μl cada uno) en hielo durante 1 h. TLa suspensión celular puede ahora estar marcada con anticuerpos fluorescentes.
4. Aislamiento de células HRS, B y T mediante Clasificación de Células
NOTA: Aunque usamos un instrumento especial de orden de investigación usando 5 láseres (vea la hoja de cálculo Materiales), cualquier clasificador con la capacidad de detectar los fluorocromos usados en el panel de anticuerpos debe ser suficiente. La ejecución de los pasos siguientes requiere una familiaridad con la función del software 12 y un conocimiento básico de las operaciones del clasificador de células. Consulte el manual del software en línea para obtener instrucciones detalladas.
- Configuración del citómetro:
- Encienda el ordenador e inicie sesión. Encienda el BSC (y las salidas BSC) y luego encienda el citómetro. Espere al menos 90 s para que inicie la CPU interna del citómetro y luego abra el software de control del láser y verifique que todos los láseres estén encendidos. Iniciar el software de citómetro 13 e iniciar sesión.
- Dentro del software del citómetro, haga clic en "Citómetro → Ver configuraciones". Cuando se abra el cuadro de diálogo del subprograma de configuración, resalte la configuración personalizada de 130 μm y haga clic en "configurar configuración" y "Aceptar". Salga del subprograma de configuración.
- Observe el cuadro de diálogo en el software del citómetro y haga clic en "Utilizar la configuración de CS & T". Instale una boquilla de 130 μm en el instrumento y active la corriente haciendo clic en el botón rojo "X" en la ventana de flujo. Deje que el instrumento se caliente durante al menos 30 min.
- Ejecute una comprobación de rendimiento en el instrumento utilizando el método deseado (se incluye un módulo de software de seguimiento de rendimiento con el clasificador descrito aquí, consulte el manual del software (págs. 117-122) y el estándar de referencia (consulte Materiales para el estándar utilizado en Esta configuración).
- Haga clic en "Citómetro → CST", asegúrese de que el campo "Caracterizar" esté establecido en "ChecK Rendimiento "en el menú desplegable y haga clic en" Ejecutar ". Cuando se lo solicite el software, cargue un tubo de partículas de referencia en la etapa de muestra y haga clic en" Aceptar ".
- Una vez completada la ejecución, haga clic en "Finalizar" y cierre el módulo de software. Después de que el software del citómetro haya terminado de volver a conectarlo al citómetro, haga clic en "Utilizar la configuración de CS & T" en el cuadro de diálogo que aparece.
- Determine el retardo de caída correcto utilizando la función de retardo automático de caída del software del citómetro (consulte las páginas 154-161 del manual del software).
- Abra el experimento "Drop Delay" en la ventana "Browser" del software del citómetro, instale un tubo de partículas de calibración en la etapa de muestra y haga clic en "Load" en la ventana "Acquisition Dashboard". Active la función de monitorización automática de flujo haciendo clic en el botón "Sweet Spot" en la ventana "Stream". Deja esta función encendida en todo momento para todos los followinG pasos.
- Encienda el voltaje de la placa de desviación haciendo clic en el botón "Voltaje" en la ventana de flujo lateral y luego active la clasificación de prueba haciendo clic en el botón "Clasificar prueba" inmediatamente adyacente al botón "Voltaje".
- Ajuste todas las configuraciones de flujo lateral a cero, excepto para el flujo del lado izquierdo. Ajuste la configuración de la corriente lateral izquierda de tal manera que dos puntos de flujo sean visibles en la ventana de flujo lateral. Haga clic en el botón "Filtro óptico" y compruebe que el lado izquierdo del flujo lateral caerá dentro del cuadro izquierdo que aparece en el área negra de la ventana de flujo lateral.
- Ajuste la opción de flujo lateral izquierdo si es necesario. Desactive la clasificación de prueba haciendo clic de nuevo en el botón "Test Sort". En la ventana "Browser", expanda el elemento "Global Worksheets" del experimento "Drop Delay" haciendo clic en el signo "+".
- Haga doble clic en "Ordenar Layout_001" para abrir el diseño de ordenación, verificar mediante inspección visualQue la población de clasificación izquierda tiene asignada "P1" y haga clic en "Ordenar" en la ventana "Ordenar diseño". En la ventana "Ordenar diseño", haga clic en "Retardo automático" y luego en "Ejecutar".
- Cuando se complete la ejecución, haga clic en "Salir". Instale un tubo de agua desionizada estéril en la etapa de muestra y haga clic en "Load" en la ventana "Acquisition Dashboard". Ejecutar el tubo de agua durante al menos 5 minutos para eliminar partículas residuales de prueba del instrumento antes de proceder.
- Ejecute controles de compensación (utilizando perlas de compensación de la hoja de cálculo Materiales o equivalentes) utilizando una configuración de compensación incorporada en el software de clasificación (consulte las páginas 131-137 del manual del software para obtener más detalles).
- Cree un experimento nuevo haciendo clic en "Experimento nuevo experimento". En la pestaña "Parámetros" de la ventana "Estado del instrumento", borre los parámetros no utilizados, si los hubiera. Haga clic en "Experimento CompensatIón Crear controles de compensación. "
- En la ventana "Navegador", expanda el espécimen "Controles de Compensación" haciendo clic en el signo "+". Ejecute los tubos de control de compensación sin registrar los datos y, si es necesario, ajuste las tensiones del detector (en la pestaña "Parámetros" de la ventana "Estado del instrumento") de manera que las poblaciones de los cordones teñidos positivamente para cada fluorocromo estén entre el canal 10.000 y 100.000. Los más brillantes en su canal de detección principal.
- Anote los voltajes necesarios para cada parámetro para cada tubo. Resalte el tubo "Unstained Control" debajo de la muestra "Compensation Controls" haciendo clic con el botón izquierdo del ratón. Cargue el tubo de control sin color en la etapa de muestra y haga clic en "Cargar" en la ventana "Control de adquisición".
- Introduzca manualmente los voltajes determinados ejecutando controles de compensación individuales en los campos de voltaje del detector para todos los parámetros yLuego haga clic en "Grabar" en la ventana "Control de adquisición". Ejecute todos los controles de compensación restantes, registrando los datos sin cambiar los ajustes del detector. Instale un tubo de agua estéril desionizada durante 5 minutos para limpiar cualquier material residual del instrumento antes de proceder.
- HRS-cell gating:
- Adquirir y registrar por lo menos 100.000 eventos para la apertura inicial mientras ajusta el caudal para adquirir 3.000-4.000 eventos / s (ver paso 4.1).
NOTA: Puede ser necesario agregar un medio de clasificación adicional para diluir las células si la concentración celular es demasiado alta. Detenga la adquisición. - Puerta HRS células utilizando los pasos descritos en la Figura 1
NOTA: En la mayoría de los casos de CHL, entre 0,01% y 0,1% de células serán células HRS.
- Adquirir y registrar por lo menos 100.000 eventos para la apertura inicial mientras ajusta el caudal para adquirir 3.000-4.000 eventos / s (ver paso 4.1).
- B y T:
- Identificar los controles somáticos (células B y T) por el gating de CD20 y CD5, respe(CD74 / SSH), seguido de CD20 frente a CD5 (véase la figura 1 ).
- Dirija los flujos de recolección a los tubos de recolección en un bastidor de recolección pre-refrigerado de dos vías o de cuatro vías. Llene los tubos de flujo o los tubos de centrifugadora de 15 ml al menos a la mitad con el medio de recogida.
- Asigne HRS y controle las poblaciones a los tubos de recolección apropiados en la configuración de clasificación siguiendo las instrucciones del proveedor. Reinicie la adquisición de celdas e inicie la ordenación.
- Recoger todas las células HRS y hasta 1 millón de células B y T. Dirija los flujos de recolección a los tubos de recolección en un bastidor de recogida pre-refrigerado de cuatro vías (o dos vías).
5. Extracción de ADN
- El gránulo recogió células por centrifugación en tubos cónicos de 1,5 ml a 3000 xg durante 10 minutos y resuspendió una vez con 1 ml de PBS para lavar las células.
- Pellet una vez más a 3.000 xg durante 10 min y eliminar el sobrenadante; Ten cuidado de no molestarEl diminuto pellet.
- Añadir 150 μL de tampón de lisis (o un volumen apropiado para el kit utilizado) a las células lavadas y mezclar pipeteando hacia arriba y hacia abajo.
NOTA: Se puede almacenar el lisado celular a -70 ° C en este punto, si es necesario. - Construir un conjunto de columna colocando la columna de filtro dentro del tubo y añadir el lisado del paso 5.5 a la columna. Girar el conjunto a 13.000 xg durante 3 min.
- Retire la minicolumna del conjunto y deseche el líquido en el tubo de recogida. Reemplace la minicolumna en el tubo de recogida.
- Añadir 650 μl de solución de lavado de columna a cada ensamblaje. Centrifugar durante 1 min a 13.000 x g. Deseche el líquido del tubo de recogida. Repita este paso para un total de 4 lavados.
- Deseche el líquido del tubo de recogida y vuelva a montar el conjunto de minicolumna. Centrifugar durante 2 min a 13.000 xg para secar la matriz de unión.
- Transferir la minicolumna a un nuevo tubo de 1,5 ml y agregar 25 μl de Tris-Cl 10 mM, queSe prefiere para la siguiente etapa de sonicación, o agua libre de nucleasa calentada a 65 ° C. Incubar durante 2 min a temperatura ambiente y centrifugar el conjunto a 13.000 xg durante 1 min. Repetir una vez más con 25 μL para un total de 50 μL.
- Mezclar la elución de ADN pipeteando hacia arriba y hacia abajo y cuantificar mediante fluorimetría [ 14] .
6. Construcción de la biblioteca
- Preparación antes de comenzar:
- Instale el sonicador en el nivel de agua 12, Intensidad 5, Ciclos / ráfaga 200 y Temp 7.
- Con base en la cantidad de ADN disponible determinada por fluorimetría y en el diseño experimental, determine la cantidad de ADN que se utilizará para la construcción de la biblioteca.
NOTA: Tenga en cuenta que si se utiliza muy poco ADN y la calidad de la biblioteca se ve comprometida, puede haber poca aplicación para el material que se deja para fines de validación. Para cantidades de entrada deficiente, cuanto mayor es la masa de entrada, mayor es la compLexidad de la biblioteca de secuenciación resultante. Algunas directrices para este protocolo son las siguientes: 10 ng debe dar buenos resultados, y 50 ng puede considerarse un máximo aproximado. - Decidir sobre el adaptador: insertar la relación molar basada libremente en los valores de la Tabla 1 .
- Calcular la cantidad de adaptador a utilizar de la siguiente manera:
NOTA: Número de moles de entrada de ADN, n
yo. N = 1,54e-12 -12 * masa de entrada (en ng) / (tamaño medio del fragmento)
Ii. Cuando el tamaño medio del fragmento es 200 pb, esto simplifica a:
N = 7.7e-15 * masa de entrada (en ng)
Número de moles de adaptador a incluir, a
yo. A = n * r
Volumen del stock del adaptador a utilizar en el paso de ligadura del adaptador, v
yo. V (en μL ) = a / [ 10 -12 * adaptador de stockConcentración (en μM )]
NOTA: Si la concentración del adaptador es baja, para asegurar que se incluya la cantidad necesaria de adaptador, se puede usar una solución adaptadora para diluir los reactivos de reparación final en lugar de agua.
Ejemplo: Para 100 ng de ADN de entrada con un tamaño medio de fragmento de 200 pb, para un adaptador molar deseado: proporción de inserto de 15: 1 y una concentración de adaptador de 2 μM, el volumen recomendado de adaptador a usar es de 5,8 μl. - Asigne códigos de barras indexados a las muestras.
NOTA: Las bibliotecas que se agruparán en una reacción de hibridación o un carril en la celda de flujo de un secuenciador no deben contener índices redundantes.
- Construcción de la biblioteca - Cizallamiento de ADN:
- Añadir la cantidad completa de ADN que se va a utilizar a un tubo de sonicación. Si el volumen de la muestra que contiene solo el ADN de entrada es inferior a 50 μl, agregue el Tampón EB hasta un volumen total de 50 μL y mezcle.
- Sonicate para 30 s.
- Retire el tubo y realice un centrifugado rápido en una mini centrífuga lo suficiente para recoger cualquier pulverización de la parte superior de las paredes del microtubo.
- Repita los pasos 6.2.2-6.2.3 para un total de siete sesiones de sonicación de 30 segundos para un total de 210 s de sonicación.
NOTA : Siéntase libre de experimentar con dividir los 210 s en menos sesiones.
- Construcción de la biblioteca - Reparación final, A-tailing, y ligadura del adaptador:
NOTA: Evite hacer cualquier selección de tamaño antes del paso de amplificación de PCR de la biblioteca.- Siga las instrucciones del fabricante 19 para la reparación final y la cola A después de la sonicación del ADN de la muestra.
- Después de la cola A, utilice el número apropiado de moles de adaptador (calculado en el paso 6.1.3) en la reacción. Combinar el adaptador, fragmentos de ADN con cola A, enzima y tampón e incubar durante la noche a 20 ° C durante aproximadamente 16 h.
- LibRary construction - Amplificación de la biblioteca:
- Realizar una limpieza de perlas de la reacción de ligación adaptador. Después de agregar perlas al producto de PCR, espere 5 min a temperatura ambiente. Colóquelo sobre un soporte magnético y retire los líquidos, lave dos veces en 200 μl de etanol al 80%, seque las perlas el tiempo suficiente para eliminar la mayor parte del líquido sin sobreesecado y eluente el ADN de las perlas pipeteando 25 μl de Libre de nucleasa, como se sugiere, sobre las perlas mientras el tubo permanece contra un soporte magnético.
NOTA: puede ser posible experimentar con la conservación de las perlas en polietilenglicol
(PEG) hasta después de la amplificación en lugar de descartarlos, pero esto no ha sido probado. - Incluya 0,6 μl de una dilución 1: 1.000 de colorante verde por 50 μl de mezcla madre de PCR. Alternativamente, utilice un colorante interco- lador compatible con PCR en tiempo real en el volumen apropiado para el equipo.
- Programar la reacción de PCR a 98 ° C para45 s para la desnaturalización inicial, seguido por un ciclo de desnaturalización, recocido y extensión a 98 ° C durante 15 s, 60 ° C durante 30 s, y 72 ° C durante 30 s, o elegir el programa adecuado si se utiliza una alternativa Polimerasa.
- Ajuste la máquina para tomar datos de fluorescencia a 72 ° C para cada ciclo. Programar una extensión final a 72 ° C durante 1 min seguido de una retención a 4 ° C durante un tiempo indefinido. Los cebadores de PCR para la amplificación de la biblioteca ligada al adaptador usando reactivos en la tabla suplementaria son: Oligo 1, AATGATACGGCGACCACCGAGA y Oligo 2, CAAGCAGAAGACGGCATACGAG
- Amplificar la biblioteca utilizando las condiciones de PCR descritas anteriormente mientras se observan los valores de intensidad de fluorescencia en tiempo real con el software qPCR, deteniéndose justo antes del final de la fase de crecimiento exponencial.
- Después de la amplificación, realice una limpieza estándar del cordón (véase el paso 6.4.1) usando 0,8 veces el volumen de la reacción de amplificación recovTípicamente 0,8 x 50 = 40 μL de perlas. Añadir las perlas al producto de PCR y esperar 5 min a temperatura ambiente.
- Colóquelo sobre un soporte magnético y extraiga los líquidos, lave dos veces en 200 μl de etanol al 80%, seque las perlas el tiempo suficiente para eliminar la mayor parte del líquido sin secarse en exceso y eluye añadiendo agua libre de nucleasa a las perlas secas.
- Cuantificar el ADN resultante mediante fluorimetría. Visualice los fragmentos de la biblioteca para el tamaño; Consulte la sección sobre las expectativas de control de datos para obtener más detalles.
- Realizar una limpieza de perlas de la reacción de ligación adaptador. Después de agregar perlas al producto de PCR, espere 5 min a temperatura ambiente. Colóquelo sobre un soporte magnético y retire los líquidos, lave dos veces en 200 μl de etanol al 80%, seque las perlas el tiempo suficiente para eliminar la mayor parte del líquido sin sobreesecado y eluente el ADN de las perlas pipeteando 25 μl de Libre de nucleasa, como se sugiere, sobre las perlas mientras el tubo permanece contra un soporte magnético.
7. Exome Hybridization
- Combine cuatro bibliotecas con distintos códigos de barras de adaptador.
NOTA: La masa por fluorimetría y el tamaño por gel se usan para calcular la molaridad, y luego las bibliotecas se combinan en cantidades equimolares para un total de una masa de 1.000 ng de la biblioteca combinada. Lo mejor es mantener todos los pares tumor-normales juntos en lugar de separarlos en piscinas separadas. - Aplicar el protocolo de captura exome Up de la clase = "xref"> 15 y hacer 8 ciclos de PCR después de la limpieza de la captura. Otras opciones de objetivos de captura pueden ser posibles.
8. Secuenciación multiplexada
- Secuencia de una sola captura de hibridación que contiene cuatro bibliotecas multiplexadas en un solo carril en la plataforma de secuenciación referida en la hoja de cálculo de Materiales 16 .
NOTA: Las configuraciones alternativas son posibles para usuarios avanzados que desean planificar y optimizar la profundidad de lectura objetivo de la cobertura.
9. Análisis (se puede sustituir con tuberías alternativas si se desea)
- Snps y pequeños indeles:
- Mapear los datos sin procesar al genoma humano de referencia, UCSC hg19, utilizando Burrows-Wheeler Aligner (BWA) 17 o un algoritmo alternativo de elección. Filtrar o marcar lecturas con un puntaje de calidad de mapeo inferior a 20 y duplicados de PCR usando Samtools 18 o PicardRef "> 19.
- Detectar las variantes de nucleótidos somáticos y los pequeños indeles en muestras de HRS en comparación con los controles somáticos de células T usando Strelka 20 o una variante de llamada de elección. Aplicar snpEff 21 para anotar la salida Strelka. Si se desea, inspeccionar sistemáticamente loci variante de artefactos utilizando el Visor de Genoma Integrado (IGV) 22 , 23 .
- Copia de las alteraciones numéricas:
- Calcular la relación log-transformada " ltr " para cada exome del intervalo objetivo " i " de los recuentos de lectura normalizados dentro de la biblioteca en el tumor contra los de la normal de la siguiente manera:
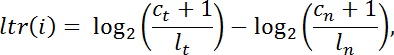
NOTA: c es el número de lecturas que mapean a un intervalo de captura dado, l es el tamaño total de la biblioteca, t representa el tumor yn denota normal. - Filtrar los intervalos con cobertura insuficiente ( C t + C n <100 lecturas) para un análisis posterior. Llevar a cabo la segmentación de pan-intervalo utilizando DNAcopy v.1.0 24 de Bioconductor en R.
NOTA: Considere los segmentos en los que el valor absoluto de la media ltr es inferior a 0,5 para ser neutro de copia. Los segmentos restantes pueden ser designados como ganancias de número de copias, si el signo de la media de ltr es positivo (en otras palabras, hay lecturas significativamente más en la muestra de tumor que en la muestra normal después de la normalización) o pérdidas de número de copias si el signo De la media ltr es negativa.
- Calcular la relación log-transformada " ltr " para cada exome del intervalo objetivo " i " de los recuentos de lectura normalizados dentro de la biblioteca en el tumor contra los de la normal de la siguiente manera:
Access restricted. Please log in or start a trial to view this content.
Resultados
Se debe tomar un diagrama de bioanalizador después de la amplificación de la biblioteca y limpieza de gránulos de 0,8x. Uno debería ver una distribución "normal-como" de tamaños de fragmento en el rango deseado ( Figura 2a ]. Las desviaciones de esta forma, tales como un "hombro" visible en la curva, indican la presencia de un artefacto de alto o bajo peso molecular. Por ejemplo, la Figura 2b- 2...
Access restricted. Please log in or start a trial to view this content.
Discusión
Aplicaciones o direcciones futuras después de dominar esta técnica
Este trabajo permite la secuenciación exome de muestras que contienen al menos 10 ng de ADN. En el contexto clínico, este límite excluye la mayoría de las muestras de aspiración con aguja fina debido a un material insuficiente, pero incluye biopsias de núcleo adecuadas y muestras de biopsia por escisión. Esto permitirá la adquisición de datos de un conjunto más grande de posibles muestras.
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
El desarrollo de este método de proyecto fue financiado por el Departamento de Patología y Medicina de Laboratorio de Weill Cornell Medical College. Reconocemos el Programa de Formación Tri-Institucional en Biología Computacional y Medicina para la financiación parcial. Quisiéramos agradecer a los científicos que compartieron su tiempo y conocimiento con nosotros, especialmente Maryke Appel; Dan Burgess; Iwanka Kozarewa; Chad Locklear; Y todos los miembros de la Fundación Genómica de la Facultad de Medicina de Weill Cornell, incluyendo Jenny Zhang, Xiaobo (Shawn) Liang, Dong Xu, Wei Zhang, Huimin Shang, Tatiana Batson y Tuo Zhang.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Petri or Cell Culture Dish (sterile) | |||
| RPMI-1640 Media | Roswell Park Memorial Institute | ||
| Fetal Calf Serum (FCS), (heat inactivated) | |||
| Freezing Media (RPMI, 20% FCS, 10% dimethylsulfoxide (DMSO))-make fresh and keep sterile | |||
| RPMI with 2% FCS (make fresh or store for up to 1 month) | |||
| scalpel with fresh blade | |||
| 10 mL syringe (no needle) | |||
| Cryogenic vials | |||
| 50 mL conical centrifuge tubes, force | |||
| Centrifuge | capable of handling 50 mL conical centrifuge tubes and providing 400g | ||
| Hepes buffer(1 M, cell culture grade) | |||
| phosphate buffered saline (PBS) | |||
| Pluoronic-F68 | Thermo-Fisher | 24040-032 | |
| DNAase-I | Sigma-Aldrich, St. Louis, MO | D4527-10KU | store as 5 mg/mL in RPMI in -200 °C |
| Bovine Serum Albumin (BSA) | |||
| Sort Media (PBS + 2% BSA + 25 mM HEPES + Pluoronic –F68 (1x)) | |||
| CD64-FITC (22) | Beckman Coulter, Miami, FL | 20 μL suggested starting volume; Titering is suggested | |
| CD30-PE (BerH83) | BD Biosciences, San Jose, CA | 20 μL suggested starting volume; Titering is suggested | |
| CD5-ECD (BL1a) | Beckman Coulter, Miami, FL | 10 μL suggested starting volume; Titering is suggested | |
| CD40-PerCP-eFluor 710 (1C10) | Ebiosciences, San Diego, CA | 5 μL suggested starting volume; Titering is suggested | |
| CD20-PC7 (B9E9) | Beckman Coulter, Miami, FL | 10 μL suggested starting volume; Titering is suggested | |
| CD15-APC (HI98) | BD Biosciences, San Jose, CA | 20 μL suggested starting volume; Titering is suggested | |
| CD45 APC-H7 (2D1) | BD Biosciences, San Jose, CA | Can be substituted with 10 μL suggested volume of CD45-Krome Orange (J.33, Beckman Coulter); Titering is suggested | |
| CD95-Pacific Blue (DX2) | Life Technologies, Grand Island, NY | 5 μL suggested starting volume; Titering is suggested | |
| CD2 (5 μg; clone RPA-2.10) | Biolegend, San Diego, CA | For optional protocol; Titering is suggested | |
| CD54 (10 μg; clone 84H10) | Serotec, Oxford, United Kingdom | For optional protocol; Titering is suggested | |
| CD58 (10 μg; clone TS2/9) | eBioscience, San Diego, CA | For optional protocol; Titering is suggested | |
| LFA-1 (12 μg; clone MHM23) | Novus Biologicals, Littleton, CO | For optional protocol; Titering is suggested | |
| BD CS&T Beads | BD Biosciences, San Jose, CA | ||
| BD Accudrop Beads | BD Biosciences, San Jose, CA | ||
| BC Versa Comp antibody capture beads | Beckman Coulter, Miami, FL | Compensation Beads | |
| BD-FACS ARIA special research order instrument using 5 lasers | BD Biosciences, San Jose, CA | any BD-FACS aria with capabilities to detect the fluorochromes in the antibody panel should be sufficient | |
| Wizard | Promega | A2360 | |
| 10 mM Tris-Cl buffer | NA | ||
| Qubit dsDNA HS Assay kit | Life Technologies, Carlsbad, CA | ||
| S2 Sonicator | Covaris, Woburn, MA | Alternatives may be substituted | |
| microTUBE | Covaris, Woburn, MA | ||
| Low-Throughput Library Preparation Kit | Kapa Biosystems, Wilmington, MA | KK8221 | |
| Sybr Green | Sigma-Aldrich, St. Louis, MO | S9430 | |
| Agencourt AMPure XP Beads | Beckman Coulter, Miami, FL | ||
| Bioanalyzer | Agilent Technologies, Santa Clara, CA | ||
| SeqCap EZ Exome v.3.0 | Roche Nimblegen | 6465684001 | |
| HiSeq | Illumina | ||
| TruSeq-style Universal adapter | Integrated DNA Technologies (IDT), Coralville, Iowa | HPLC purification; AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGAT*C*T | |
| TruSeq-style index adapter | Integrated DNA Technologies (IDT), Coralville, Iowa | HPLC purification; /5Phos/GATCGGAAGAGCACACGTCTGAACTCCAGTCACNNNNNNATCTCGTATGCCGTCTTCTGCTTG | |
| TruSeq-style PCR primer 1 | Integrated DNA Technologies (IDT), Coralville, Iowa | AATGATACGGCGACCACCGAGA | |
| TruSeq-style PCR primer 2 | Integrated DNA Technologies (IDT), Coralville, Iowa | CAAGCAGAAGACGGCATACGAG | |
| Nuclease Free Duplex Buffer | Integrated DNA Technologies (IDT), Coralville, Iowa | ||
| BD FACSDIVA software | BD Biosciences, San Jose, CA | ||
| BD Falcon Tubes | BD Biosciences, San Jose, CA | ||
| BD Flow Tubes | BD Biosciences, San Jose, CA |
Referencias
- Abrams, J. National Cancer Institute's Precision Medicine Initiatives for the new National Clinical Trials Network. American Society of Clinical Oncology educational book / ASCO. American Society of Clinical Oncology. Meeting. , 71-76 (2014).
- Gagan, J., Van Allen, E. M. Next-generation sequencing to guide cancer therapy. Genome medicine. 7, 80(2015).
- Matsuki, E., Younes, A. Lymphomagenesis in Hodgkin lymphoma. Seminars in cancer biology. 34, 14-21 (2015).
- Fromm, J. R., Kussick, S. J., Wood, B. L. Identification and purification of classical Hodgkin cells from lymph nodes by flow cytometry and flow cytometric cell sorting. Am J Clin Pathol. 126 (5), 764-780 (2006).
- Fromm, J. R., Thomas, A., Wood, B. L. Flow cytometry can diagnose classical hodgkin lymphoma in lymph nodes with high sensitivity and specificity. Am J Clin Pathol. 131 (3), 322-332 (2009).
- Roshal, M., Wood, B. L., Fromm, J. R. Flow cytometric detection of the classical hodgkin lymphoma: clinical and research applications. Advances in hematology. 2011, 387034(2011).
- Reichel, J., et al. Flow sorting and exome sequencing reveal the oncogenome of primary Hodgkin and Reed-Sternberg cells. Blood. 125 (7), 1061-1072 (2015).
- Kozarewa, I. A Modified Method for Whole Exome Resequencing from Minimal Amounts of Starting DNA. PLoS ONE. 7 (3), e32617(2012).
- Brunicardi, F. C. Schwartz's Principles of Surgery. , 10th ed, McGraw-Hill Education / Medical. (2014).
- Kantor, A. B., Roederer, M. FACS analysis of leukocytes. Handbook of Experimental Immunology. 2, Blackwell Scientific. (1996).
- Sanders, M. E. Molecular pathways of adhesion in spontaneous rosetting of T-lymphocytes to the Hodgkin's cell line L428. Cancer Res. 48 (1), 37-40 (1988).
- Biosciences. FACSDiva Software v6.0. , Available from: http://www.bdbiosciences.com/in/instruments/software/facsdiva/resources/overview.jsp (2007).
- Biosciences. FACSAria II User's Guide. Part No. 644832, Revision A. , (2009).
- Life Technologies. Qubit 3.0 Fluorometer, Catalog Number Q33216. , Available from: https://www.thermofisher.com/order/catalog/product/Q33216 (2017).
- Roche Nimblegen. SeqCap EZ Library SR User's Guide ver. 4.1. , (2013).
- Illumina. HiSeq High-Throughput Sequencing System. , Available from: http://www.illumina.com/systems/hiseq_2500_1500.html (2016).
- Li, H., Durbin, R. Fast and accurate short read alignment with Burrows-Wheeler transform. Bioinformatics. 25 (14), 1754-1760 (2009).
- Li, H. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25 (16), 2078-2079 (2009).
- The Broad Institute. Picard Tools. , Available from: http://broadinstitute.github.io/picard/ (2016).
- Saunders, C. T. Strelka: accurate somatic small-variant calling from sequenced tumor-normal sample pairs. Bioinformatics. 28 (14), 1811-1817 (2012).
- Cingolani, P., et al. A program for annotating and predicting the effects of single nucleotide polymorphisms, SnpEff: SNPs in the genome of Drosophila melanogaster strain w1118; iso-2; iso-3. Fly (Austin). 6 (2), 80-92 (2012).
- Dobin, A. STAR: ultrafast universal RNA-seq aligner. Bioinformatics. 29 (1), 15-21 (2013).
- Thorvaldsdottir, H., Robinson, J. T., Mesirov, J. P. Integrative Genomics Viewer (IGV): high-performance genomics data visualization and exploration. Briefings in bioinformatics. 14 (2), 178-192 (2013).
- DNA copy number data analysis. v.R package version 1.34.0. , Available from: https://omictools.com/dnacopy-tool (2013).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados