JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
고전적인 Hodgkin 림프종의 Reed-Sternberg 세포의 흐름 정렬 및 Exome 시퀀싱
요약
여기에서는 고전적인 Hodgkin lymphoma (CHL)의 Hodgkin Reed-Sternberg (HRS) 세포로부터 고품질, 전체 exome 데이터를 생산하도록 고안된 결합 된 유동 세포 계측법 세포 분류 및 저 입력, 차세대 라이브러리 구성 프로토콜을 설명합니다.
초록
고전적인 Hodgkin 림프종의 Hodgkin Reed-Sternberg 세포는 염증성 림프구의 배경 내에 희박하게 분포하며 전형적으로 종양 질량의 1 % 미만을 구성합니다. 벌크 종양에서 유래 한 물질은 특성화하기에 충분하지 않은 농도의 종양 함량을 포함합니다. 따라서 8 개의 항체를 이용한 형광 활성 세포 선별 및 측방 및 전방 산란은 후속 연구를 위해 종양에서 수천 개의 HRS 세포를 신속하게 분리 및 농축하는 방법으로 여기에 설명됩니다. 동시에 exome 시퀀싱을위한 표준 프로토콜은 일반적으로 흐름 정렬을 사용하는 경우에도 종종 100-1000 ng의 입력 DNA를 필요로하기 때문에 우리는 고품질의 생산이 가능한 최적화 된 저 입력 라이브러리 구성 프로토콜을 제공합니다 최소 10 ng의 입력 DNA로부터의 데이터. 이 조합은 전체 전자의 하이브리드 화 캡처에 적합한 차세대 라이브러리를 생성 할 수 있습니다.xome baits 또는 더 집중된 대상 패널을 원하는대로 선택할 수 있습니다. 건강한 종양의 T 또는 B 세포와 비교할 때 HRS 세포의 exome sequencing은 돌연변이, 삽입 및 결실, 사본 번호 변경을 포함한 신체적 변화를 확인할 수 있습니다. 이러한 발견은 HRS 세포의 분자 생물학을 밝혀주고 표적 약물 치료를위한 방법을 제시 할 수 있습니다.
서문
차세대 시퀀싱의 결과로서의 암 유전체학의 진보는 치료 표적의 확인 및 많은 혈액학 및 비 혈액 종양의 예후에 중요한 돌파구를 가져왔다. 특정 게놈 변형에 기초한 새로운 개별 치료 전략이 많은 종양 유형에 급속히 도입되고있다 (참고 문헌 1 , 2 에서 검토 됨). 림프종 유전체학에서 상당한 발전에도 불구하고, 고전적 Hodgkin lymphoma (CHL)에서 종양 HRS 세포의 게놈은 과소 평가되었다. 이 연구는 반응성 미세 환경 내에서 신생 HRS 세포의 부족으로 인해 어려움을 겪었으므로 정제 된 HRS 세포 집단을 분리하기가 어렵습니다 3 .
원발성 종양에서 생존 가능한 HRS 세포를 분리하는 방법은 Fromm et al. 도 4에 도시 된 바와 같이,이 방법은 CD30, CD15, CD40, CD95, CD45 CD20, CD5 및 CD64로 구성된 8 가지 항체 칵테일을 사용하여 CHL 종양 현탁액에서 HRS 세포를 확실하게 식별합니다. 는 적어도 10 7 개의 세포 (약 10 mg 조직)로 구성된 종양 생검에서 얻은 신선 또는 고정 세포 현탁액에서 최소 1,000 개의 생존 가능한 HRS 세포를 분리 할 수 있습니다. 순도는 유세포 분석을 통해 90 % 이상이며 10 개의 연속적인 사례의 exome 게놈 분석에 의해 최소 80 %.
당사는 초기의 CHL 종양에서 수천 개의 생존 가능한 HRS 세포를 신속하게 분리 할 수 있도록 프로세스를 대폭 개선 한 유세포 분석기 분리 기술을 개선했습니다. 우리는 호 지킨 림프종의 일차적 인 경우에서 종양 세포의 첫 번째 전체 exome 서열로 여겨지는 것을 생산하는 기술을 이용했습니다. 우리의 연구는 일개별적인 CHL 사례에 대한 높은 처리량, 게놈 차원의 연구의 타당성 및 CHL 발병 기전의 측면을 설명 할 수있는 잠재력을 지닌 새로운 게놈 변형의 확인을 이끌어 냈다.
우리는 고 처리량 게놈 연구를 위해 추출 된 DNA를 활용하는 파이프 라인을 개발했습니다. 순차적으로 발견 된 최소 1,000 개의 HRS 세포로부터 안정적인 결과를 얻기 위해 Adaptor Ligation 효율을 높이고 DNA 단편 라이브러리를 생성 할 수있는 변형 된 차세대 DNA 라이브러리 제작 절차 8 을 개발했습니다 과도한 증폭없이. 이 방법은 일상적인 임상 시료의 분석과 재발 성 돌연변이 및 염색체 변형의 검출을 가능하게합니다 7 .
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 조직 처리 및 냉동
- 인산염 완충 식염수 (PBS) 또는 로스웰 파크 기념 연구소 (RPMI)에서 림프절 조직을 수집하고 수집 24 시간 이내에 처리하십시오. excised 림프절 조직 9 2 % 태아 송아지 혈청 (FCS)와 RPMI 10 ML을 포함하고 페트 접시에 신선한 가늘게 칼로 잘게 썰어. 10 ML 주사기 플런저의 뒷면을 사용하여 조직을 추가로 분쇄 / 해리합니다.
- 100 μm 셀 여과기를 통과하여 50 mL 원추형 튜브에 액체를 옮깁니다. 페트리 접시와 RPMI 2 % FCS 10 ML 추가로 필터를 씻어.
- 자동화 된 셀 카운터 또는 hemocytometer를 사용하여 세포 수를 구하십시오.
참고 : 일반적으로 CHL 림프절 조직의 약 5 mm 3 에서 적어도 2 x 10 7 세포가 예상됩니다. 80 % 이상의 생존율이 예상되지만 샘플마다 다를 수 있습니다. - 400 xg에서 10 분간 세포를 스핀시키고 aspira상등액을 닦아 라. 얼음에 세포 펠렛이 담긴 튜브를 놓습니다.
- 얼음 위에서 미리 차가워지는 얼기 매체. 2 x 10 7 / mL의 농도로 추운 냉동 매체에 세포를 Resuspend하고 pipetting하여 resuspend. 와동하지 마십시오. 얼음 현탁액을 10 분 동안 품는다.
- 샘플 1 mL / cryo 바이알 (얼음 위에서 미리 냉각)을 분액합니다. 바이알을 1-2 일 동안 -80 ° C의 냉동고에 옮기고 액체 질소로 다시 옮깁니다.
2. 세포 정렬을위한 세포 현탁액 준비
참고 : 항체의 각 로트는 300 μA의 염색 볼륨에서 1 천만 개의 세포를 사용하여 적절히 적정해야합니다. 말초 혈액은 KMH2 세포주가 말초 혈에 첨가되어 적정에 사용될 수있는 CD30을 제외한 모든 항체에 사용할 수 있습니다 10 . 우리는 일반적으로 제조사가 권장하는 항체 양으로 시작하여 2 배의 2 배 희석과 1 배의 2 배 증가 (4 데이터 포인트)항체가 적정의 각 로트에 대해. 예를 들어, 제조업체가 10 μL 볼륨을 권장하면 2, 5, 10 및 20 μL 볼륨을 사용하여 적정을 수행합니다.
- 수욕을 37 ° C로 설정하십시오. 어두운 유리 병에 항체의 titered 금액을 premix하고 100 μL의 총 칵테일 볼륨 PBS + 2 % BSA를 추가합니다.
참고 : 우리는 항체를 titering하는 것이 좋습니다 있지만 다음과 같은 볼륨을 시작점으로 사용할 수 있습니다 : CD64, 20 μL; CD95, 5 μL; CD30, 20 ㎕; CD5, 10 μL; CD20, 10 ㎕; CD15, 20 μL; CD40, 5 μL; 및 CD45, 10 μL. - 바이알을 액체 질소에서 드라이 아이스가 들어있는 얼음 통에 넣고 해동을 방지하십시오. RPMI / 20 % FCS / DNase (100 μg / ML)가 함유 된 해동 배지 50 mL를 37 ° C 수 욕조에서 50 mL 원추형 튜브에 담그십시오.
- 해동 배지 45 mL를 신선한 튜브에 옮기고 37 ° C에 유지한다. 37 ° C 워터 박쥐에 극저온 바이알을 담아 세포를 빠르게 녹입니다.아주 작은 동결 된 부분 만 남아있을 때까지.
- 45 mL의 해동 배지가 들어있는 튜브에 약병 내용물을 붓는다. 비어있는 극저온 바이알을 2 mL의 해동 매질로 헹구고 린스를 합칩니다.
- DNase 소화 및 세포 재 평형을 허용하기 위해 15 분 동안 실온에서 세포를 품어. 10 분 500 XG에서 세포를 스핀과 뜨는을 대기음.
- 해동 매체 (5 ML)의 약 200 μL에 세포를 Resuspend하고 2-3 분 실온으로 평형하자. 냉동 생존 세포의 70 % 이상 회복이 예상됩니다.
참고 : 선택적으로 부착 된 T 세포에 의해 rosetted 될 수있는 정렬 된 HRS 세포의 순도를 높이기 위해이 단계에서 표지되지 않은 항체의 칵테일을 추가 할 수 있습니다 (선택 프로토콜 참조). - 항체 칵테일 100 μL를 추가하고 빛으로부터 보호 된 실온 (RT)에서 15 분 동안 품어 라. 정렬 매체 3 ML을 추가, 500 XG에서 세포를 스핀 다운10 분간 배양 한 후 상등액을 흡인한다.
- 세포를 정렬 매체 1 ML에 Resuspend하고 5 ML 흐름 튜브 상단 스트레이너로 전송.
- 50 ML 원뿔 튜브와 얼음에 장소 세포와 장소 세포의 추가 1 ML로 세포 스트레이너를 모두 씻어.
3. (선택 프로토콜) T Cell Rosette Blocking
참고 : HRS 세포는 조직 절편 및 세포 현탁액에서 T 세포에 의해 로셋되며 이러한 T 세포는 분류 된 HRS 분획을 잠재적으로 오염시킬 수 있습니다. 이러한 상호 작용은 TRS 4 , 11 에서 LFA-1과 CD2에 결합하는 HRS 세포에서 CD54와 CD58에 의해 매개됩니다. 이러한 상호 작용은 이러한 접착 분자에 대한 표지되지 않은 항체로 차단 될 수 있습니다.
- RPMI 100 μL 중 분취 량 100,000 ~ 500,000 개.
- 얼음에서 1 시간 동안 CD2, CD54, CD58 및 LFA - 1 (각 10 μL)에 레이블이 지정되지 않은 항체와 세포 현탁액을 품어. 티그는 세포 현탁액을 이제 형광 항체로 분류 할 수 있습니다.
4. 세포 정렬을 이용한 HRS-, B-, T- 세포 단리
참고 : 우리는 5 개의 레이저를 사용하는 특별한 연구 주문 기기 (재료 스프레드 시트 참조)를 사용했지만, 항체 패널에 사용 된 형광색을 검출 할 수있는 분류기로 충분해야합니다. 아래의 단계를 실행하려면 소프트웨어 분류기 기능에 대한 지식과 셀 분류기 작업에 대한 기본 지식이 필요합니다. 자세한 지침은 온라인 소프트웨어 설명서를 참조하십시오.
- 사이토 미터 설정 :
- 컴퓨터를 켜고 로그인하십시오. BSC (및 BSC 아울렛)의 전원을 켜고 cytometer의 전원을 켭니다. cytometer의 내부 CPU가 시작될 때까지 적어도 90 초 동안 기다린 다음 레이저 제어 소프트웨어를 열고 모든 레이저의 전원이 켜져 있는지 확인하십시오. cytometer 소프트웨어를 시작하고 로그인하십시오..
- cytometer 소프트웨어 내에서 "Cytometer → View Configurations"를 클릭하십시오. 구성 서브 프로그램 대화 상자가 열리면 130 μm 사용자 정의 구성을 강조 표시하고 "구성 설정"및 "확인"을 클릭하십시오. 구성 서브 프로그램을 종료하십시오.
- cytometer 소프트웨어의 대화 상자를 관찰하고 "CS & T 설정 사용"을 클릭하십시오. 130 μm 노즐을 장비에 설치하고 스트림 창에서 빨간색 "X"버튼을 클릭하여 스트림을 켜십시오. 장비를 최소 30 분 동안 예열하도록하십시오.
- 원하는 방법을 사용하여 장비의 성능 검사를 실행하십시오 (성능 추적 소프트웨어 모듈은 여기에 설명 된 분류기에 포함되어 있습니다. 소프트웨어 설명서 (117-112 페이지) 및 참조 표준을 참조하십시오 (참조 자료 이 설정).
- "Cytometer → CST"를 클릭하고 "Characterize"필드가 "Chec"로 설정되었는지 확인하십시오k 성능 "을 선택하고"실행 "을 클릭하십시오. 소프트웨어에서 묻는 메시지가 나타나면 참조 스테이지의 튜브를 샘플 스테이지에로드하고"확인 "을 클릭하십시오.
- 실행이 완료되면 "마침"을 클릭하고 소프트웨어 모듈을 닫습니다. cytometer 소프트웨어가 cytometer에 다시 연결되면, 나타나는 대화 상자에서 "use CS & T settings"를 클릭하십시오.
- cytometer 소프트웨어의 자동 드롭 지연 기능을 사용하여 올바른 드롭 지연을 결정하십시오 (소프트웨어 설명서의 154-161 페이지 참조).
- cytometer 소프트웨어의 "Browser"창에서 "Drop Delay"실험을 열고 샘플 스테이지에 교정 입자의 튜브를 설치 한 다음 "Acquisition Dashboard"창에서 "Load"를 클릭하십시오. "Stream"창에서 "Sweet Spot"버튼을 클릭하여 자동 스트림 모니터링 기능을 켭니다. 모든 팔로우 인을 위해 항상이 기능을 켜 놓으십시오.g 단계.
- 사이드 스트림 창에서 "전압"버튼을 클릭하여 편향 판 전압을 켜고 "전압"버튼 바로 옆의 "테스트 정렬"버튼을 클릭하여 테스트 정렬을 켜십시오.
- 왼쪽 사이드 스트림을 제외하고 모든 사이드 스트림 설정을 0으로 조정하십시오. 사이드 스트림 창에서 두 개의 스트림 스팟이 보이도록 왼쪽 사이드 스트림 설정을 조정하십시오. "광학 필터"버튼을 클릭하고 왼쪽 스트림 지점이 사이드 스트림 창의 검은 영역에 나타나는 왼쪽 상자 안에 있는지 확인하십시오.
- 필요한 경우 왼쪽 사이드 스트림 설정을 조정하십시오. 테스트 정렬을 끄려면 "테스트 정렬"버튼을 다시 클릭하십시오. "브라우저"창에서 "+"를 클릭하여 "지연 지연"실험의 "전역 워크 시트"요소를 확장하십시오.
- "Sort Layout_001"을 두 번 클릭하여 정렬 레이아웃을 열고 시각적 검사로 확인하십시오.왼쪽 분류 집단에 "P1"이 할당되어있는 경우, "정렬 정렬"창에서 "정렬"을 클릭하십시오. "레이아웃 정렬"창에서 "자동 지연"을 클릭 한 다음 "실행"을 클릭하십시오.
- 실행이 완료되면 '종료'를 클릭하십시오. 샘플 스테이지에 살균 탈 이온수 튜브를 설치하고 "Acquisition Dashboard"창에서 "Load"를 클릭하십시오. 계속하기 전에 물 튜브를 최소 5 분 동안 작동시켜 잔류 시험 입자를 제거하십시오.
- 분류기 소프트웨어에 내장 된 보정 설정을 사용하여 보정 컨트롤 (재료 스프레드 시트 또는 이와 동등한 재료의 보정 비드 사용)을 실행하십시오 (자세한 내용은 소프트웨어 설명서의 131-137 페이지 참조).
- '새로운 실험 실험'을 클릭하여 새 실험을 만듭니다. "Instrument Status"창의 "Parameters"탭에서 사용하지 않는 매개 변수가 있으면 삭제하십시오. '실험 보정'을 클릭하십시오.이온 셋업 보상 컨트롤 생성. "
- "Browser"창에서 "Compensation Controls"표본을 "+"기호를 클릭하여 확장하십시오. 데이터를 기록하지 않고 보정 제어 튜브를 작동시키고, 필요한 경우, 각 형광 물질에 대한 양성 염색 된 비드가 채널 10,000 ~ 100,000 사이에 있도록 검출기 전압을 조정하십시오 ( "장비 상태"창의 "매개 변수"탭에서). 그들의 1 차 탐지 채널에서 가장 밝은.
- 각 튜브에 대한 각 매개 변수에 필요한 전압을 기록하십시오. 왼쪽 버튼을 한 번 클릭하여 "보정 컨트롤"견본 아래의 "염색되지 않은 컨트롤"튜브를 선택하십시오. 얼룩이없는 컨트롤 튜브를 샘플 스테이지에 놓고 "Acquisition Control"창에서 "Load"를 클릭하십시오.
- 모든 파라미터에 대한 검출기 전압 필드에 개별 보상 제어를 실행하여 결정된 전압을 수동으로 입력하십시오."Acquisition Control"창에서 "Record"를 클릭하십시오. 검출기 설정을 변경하지 않고 데이터를 기록하면서 나머지 보정 컨트롤을 모두 실행하십시오. 진행하기 전에 장비의 잔유물을 없애기 위해 5 분 동안 멸균 탈 이온수 튜브를 설치하십시오.
- HRS- 셀 게이팅 :
- 초기 게이팅을 위해 최소 10 만 건의 이벤트를 수집하고 기록하며 3,000-4,000 건의 이벤트를 수집하기 위해 유속을 조정하십시오 (4.1 단계 참조).
참고 : 세포 농도가 너무 높으면 세포를 희석하기 위해 추가 배지를 추가해야 할 수도 있습니다. 획득을 중지하십시오. - 그림 1 에 설명 된 단계를 사용하여 게이트 HRS 셀
참고 : 대부분의 CHL 경우에는 0.01 %에서 0.1 % 사이의 세포가 HRS 세포입니다.
- 초기 게이팅을 위해 최소 10 만 건의 이벤트를 수집하고 기록하며 3,000-4,000 건의 이벤트를 수집하기 위해 유속을 조정하십시오 (4.1 단계 참조).
- B- 및 T- 세포 게이팅 :
- CD20과 CD5의 게이팅 (게이팅)에 의한 체세포 컨트롤 (B 세포와 T 세포)ctively (CD45 / SSH에 의한 게이팅 림프구), CD20 대 CD5 ( 그림 1 참조).
- 사전 냉각 된 양방향 또는 4 방향 수집 랙에서 수집 튜브를 수집 튜브로 향하게하십시오. 콜렉션 매질로 적어도 도중에 튜브 또는 15 mL 원심 분리 관을 채 웁니다.
- 공급 업체 지침에 따라 정렬 설정에서 HRS 및 대조군을 적절한 수집 튜브에 지정하십시오. 셀 획득을 다시 시작하고 정렬을 시작하십시오.
- 모든 HRS 세포와 최대 1 백만개의 B 및 T 세포를 수집하십시오. 미리 냉각 된 4 방향 (또는 2 방향) 수집 랙에서 수집 튜브를 수집 튜브로 향하게하십시오.
5. DNA 추출
- 펠렛은 10 분 3,000 XG 1.5 ML 원뿔 튜브에서 원심 분리하여 세포를 수집하고 세포를 씻어 PBS 1 ML로 한번 resuspend.
- 다시 펠렛을 3,000 xg에서 10 분간 뜨고 상층 액을 제거합니다. 방해하지 않도록 아주 조심해야한다.작은 알갱이.
- 씻은 세포에 용해 버퍼 (또는 키트 사용에 적합한 볼륨)의 150 μL를 추가하고 위아래로 pipetting하여 섞는다.
참고 : 필요한 경우이 시점에서 -70 ° C에서 세포 용 해물을 저장할 수 있습니다. - 튜브 내부에 필터 컬럼을 넣어 컬럼 어셈블리를 만들고 5.5 단계의 lysate를 컬럼에 첨가하십시오. 어셈블리를 13,000 xg에서 3 분간 돌립니다.
- 어셈블리에서 minicolumn을 제거하고 수집 튜브에 액체를 폐기하십시오. 수집 튜브에있는 minicolumn을 교체하십시오.
- 각 어셈블리에 컬럼 세척 용액 650 μL를 첨가하십시오. 13,000 x g에서 1 분간 원심 분리하십시오. 수집 튜브에서 액체를 버립니다. 이 단계를 반복하여 총 4 회 세척합니다.
- 수거 튜브에서 액체를 버리고 미니 칼럼 어셈블리를 다시 조립하십시오. 바인딩 매트릭스를 건조 13,000 XG에서 2 분 동안 원심 분리기.
- minicolumn을 새로운 1.5 mL 튜브에 옮기고 10 μM Tris-Cl 25 μL를 첨가한다.후속 초음파 처리 단계에서 바람직하며, 65 ℃로 가열 된 Nuclease-Free Water가있다. 실온에서 2 분 동안 품어두고 13,000 xg에서 1 분간 원심 분리한다. 총 50 μL에 대해 25 μL로 한 번 더 반복합니다.
- pipette 위아래로 DNA 용출액을 혼합하고 형광 측정법을 사용하여 정량하십시오 14 .
6. 도서관 건설
- 시작 전 준비 :
- 수위 12, 강도 5, 사이클 / 버스트 200, 온도 7에서 초음파 분해 장치를 설치하십시오.
- 형광 측정법 및 실험 설계에 의해 결정된 이용 가능한 DNA 양에 기초하여, 라이브러리 구축에 사용할 DNA의 양을 결정한다.
참고 : 너무 적은 DNA를 사용하고 라이브러리 품질이 손상되면 유효성 확인을 위해 남아있는 재료에 대한 적용이 거의 없을 수 있습니다. 표준 이하 입력량 일수록 입력 질량이 클수록 계산량이 많아집니다.결과 시퀀싱 라이브러리의 어휘. 이 프로토콜에 대한 몇 가지 지침은 다음과 같습니다. 10 ng은 좋은 결과를 가져오고 50 ng는 대략 최대 값으로 간주됩니다. - 어댑터 결정 : 표 1 의 값에 따라 느슨하게 몰비를 삽입하십시오.
- 다음과 같은 방식으로 사용할 어댑터의 양을 계산하십시오.
참고 : DNA 입력 몰수, n
나는. n = 1.54e-12 -12 * 입력 질량 (ng) / (평균 단편 크기)
ii. 평균 단편 크기가 200bp 인 경우 다음과 같이 단순화됩니다.
n = 7.7e-15 * 입력 질량 (ng)
포함 할 어댑터의 몰수, a
나는. a = n * r
어댑터 연결 단계에서 사용할 어댑터 스톡의 양, v
나는. v ( μL ) = a / [ 10 -12 * 어댑터 스톡농도 (μM )]
참고 : 어댑터 농도가 낮 으면 필요한 양의 어댑터가 포함되도록하기 위해 어댑터 솔루션을 사용하여 물 대신에 최종 복구 시약을 희석 할 수 있습니다.
예 : 원하는 대구 아답터 : 삽입 비율 15 : 1 및 2 μM의 어댑터 스톡 농도에 대해, 평균 단편 크기가 200 bp 인 입력 DNA 100 ng의 경우 권장 어댑터 사용량은 5.8 μL입니다. - 샘플에 인덱싱 된 바코드를 지정하십시오.
참고 : 하이브 리다이 제이션 반응이나 시퀀서의 플로우 셀에있는 차선으로 함께 모으는 라이브러리에는 중복 색인이 없어야합니다.
- 도서관 건설 - DNA 절단 :
- 사용할 sonication 튜브의 전체 양을 추가하십시오. 입력 DNA가 들어있는 시료의 부피가 50 μL 미만인 경우, Buffer EB를 총 부피 50 μL까지 넣고 혼합하십시오.
- 3 대를위한 Sonicate0 초.
- 튜브를 제거하고 마이크로 튜브의 벽 상부에서 스프레이를 모으기에 충분한 크기의 미니 원심 분리기에서 빠른 스핀을 수행하십시오.
- 총 210 초의 초음파 처리에 대해 총 7 회의 30 초 초음파 세션에 대해 6.2.2-6.2.3 단계를 반복합니다.
참고 : 210 초를 더 적은 세션으로 나누어 실험 해보십시오.
- 도서관 건설 - 최종 수리, A-tailing 및 어댑터 연결 :
참고 : 라이브러리 PCR 증폭 단계 전에 크기를 선택하지 마십시오.- 샘플 DNA의 초음파 처리 후 최종 수정 및 A-tailing에 대해서는 제조업체의 지침 19 를 따르십시오.
- A-tailing 후, 적절한 몰수의 아답터 (6.1.3에서 계산)를 반응에 사용하십시오. 어댑터, 꼬리가 달린 DNA 단편, 효소 및 완충액을 합치고 20 ° C에서 밤새도록 약 16 시간 동안 배양하십시오.
- LibRary construction - 라이브러리 증폭 :
- 어댑터 연결 반응의 비드 클린업을 수행하십시오. PCR 제품에 비즈를 첨가 한 후 실온에서 5 분간 기다리십시오. 자성 스탠드에 놓고 액체를 제거하고 80 % 에탄올 200 μL로 두 번 씻어서 과다 건조없이 대부분의 액체를 제거 할만큼 충분히 구슬을 말린 다음 25 μL의 피펫 팅으로 DNA를 구형에서 제거합니다 튜브가 자석 스탠드에 대해 유지되는 동안 제안 된 것처럼 비 핵연료가없는 물.
참고 : 폴리에틸렌 글리콜에 비드를 보존하여 실험 할 수도 있습니다
(PEG)를 버리는 대신에 증폭시킨 후 테스트 할 수있다. - PCR 마스터 믹스 50 μL 당 1 : 1,000 희석액 0.6 μL를 포함하십시오. 또는 장비에 알맞은 양으로 실시간 PCR 호환 염료를 사용하십시오.
- 98 ° C에서 PCR 반응을 프로그램하십시오.초기 변성을위한 45 초 후 변성, 어닐링 및 98 ℃에서 15 초, 60 ℃에서 30 초, 72 ℃에서 30 초 동안의 사이클을 반복하거나 대안을 사용할 경우 적절한 프로그램을 선택하십시오 폴리머 라제 효소.
- 각주기마다 72 ° C에서 형광 데이터를 취하도록 기계를 설정하십시오. 최종 확장을 72 ° C에서 1 분 동안 프로그래밍하고 4 ° C에서 무기한 유지하십시오. 보완 테이블에 시약을 사용하여 어댑터 연결 라이브러리의 증폭을위한 PCR 프라이머는 다음과 같습니다 Oligo 1, AATGATACGGCGACCACCGAGA 및 Oligo 2, CAAGCAGAAGACGGCATACGAG
- 기하 급수적 인 성장 단계가 끝나기 바로 전에 qPCR 소프트웨어로 실시간으로 형광 강도 값을 관찰하면서 위에서 설명한 PCR 조건을 사용하여 라이브러리를 증폭시킵니다.
- 증폭 후 증폭 반응의 용량 인 0.8 배를 사용하여 표준 비드 클린업 (6.4.1 단계 참조)일반적으로 0.8 x 50 = 40 μL의 구슬을 사용합니다. PCR 제품에 비즈를 추가하고 실온에서 5 분 기다립니다.
- 자성 스탠드에 놓고 액체를 제거하고 80 % 에탄올 200 μL로 두 번 씻어서 과다 건조하지 않고 대부분의 액체를 제거 할만큼 충분히 구슬을 말리십시오. 건조한 구슬에 nuclease가없는 물을 넣어 용리하십시오.
- 형광 측정법을 사용하여 결과 DNA를 정량하십시오. 크기에 대한 라이브러리 조각을 시각화하십시오. 자세한 내용은 데이터 품질 관리 기대치 섹션을 참조하십시오.
- 어댑터 연결 반응의 비드 클린업을 수행하십시오. PCR 제품에 비즈를 첨가 한 후 실온에서 5 분간 기다리십시오. 자성 스탠드에 놓고 액체를 제거하고 80 % 에탄올 200 μL로 두 번 씻어서 과다 건조없이 대부분의 액체를 제거 할만큼 충분히 구슬을 말린 다음 25 μL의 피펫 팅으로 DNA를 구형에서 제거합니다 튜브가 자석 스탠드에 대해 유지되는 동안 제안 된 것처럼 비 핵연료가없는 물.
7. 엑솜 하이브리드 화
- 별개의 어댑터 바코드가있는 4 개의 라이브러리를 결합하십시오.
참고 : fluorimetry에 의한 질량과 겔에 의한 크기를 사용하여 몰 농도를 계산 한 다음, 1,000 ng의 풀 라이브러리의 총량에 대해 라이브러리를 등 몰량으로 결합합니다. 모든 종양 - 정상 쌍을 별도의 웅덩이로 분리하는 것이 아니라 함께 보관하는 것이 가장 좋습니다. - exome 캡처 프로토콜 적용 up class = "xref"> 15 그리고 캡쳐 정리 후 8 PCR주기를 수행하십시오. 캡처 대상의 다른 선택이 가능할 수 있습니다.
8. 멀티 플렉스 시퀀싱
- Materials 스프레드 시트 16 에서 참조하는 시퀀싱 플랫폼의 단일 레인에 네 개의 다중화 라이브러리가 포함 된 단일 하이브 리다이 제이션 캡처를 시퀀싱합니다.
참고 : 대상 판독 깊이 범위를보다 자세히 계획하고 최적화하려는 고급 사용자는 다른 구성을 사용할 수 있습니다.
9. 분석 (원하는 경우 대체 파이프 라인으로 대체 가능)
- 콧노래와 작은 indels :
- Burrows-Wheeler Aligner (BWA) 17 또는 다른 대체 알고리즘을 사용하여 원시 데이터를 인간 참조 게놈 UCSC hg19에 매핑합니다. Samtools 18 또는 Picard를 사용하여 20보다 낮은 매핑 품질 스코어와 PCR 중복을 필터링하거나 표시합니다.ref "> 19.
- Strelka 20 또는 변형 된 호출자를 사용하여 T 세포 체세포 대조군과 비교하여 HRS 샘플에서 체세포 뉴클레오티드 변이 및 작은 indels을 검출합니다. snpEff 21 을 적용하여 Strelka 출력에 주석을 답니다. 원하는 경우 IGV (Integrated Genome Viewer) 22 , 23을 사용하여 변형 궤적을 체계적으로 검사합니다.
- 번호 변경 복사 :
- 다음과 같은 방식으로 종양의 표준화 된 판독 수에 대한 종양 내 라이브러리 정규화 판독 수의 모든 exome 표적 간격 " i "에 대한 로그 변환 비율 " ltr "을 계산하십시오 :
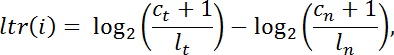
참고 : c 는 주어진 캡처 간격에 매핑되는 읽기 수입니다. l 은 전체 라이브러리 크기이고, t 는 종양을 나타내며, n 은 정상을 나타냅니다. - 추가 분석을 위해 불충분 한 범위 ( C t + C n <100)로 간격을 필터링하십시오. R의 Bioconductor에서 DNAcopy v.1.0 24 를 사용하여 팬 간격 분할을 수행합니다.
참고 : 평균 ltr 의 절대 값이 0.5 이하인 세그먼트를 복사 중립으로 간주합니다. 남아있는 분절은 평균 ltr 의 부호가 양성인 경우 (즉, 정상화 후에 정상 샘플보다 종양 샘플에서 유의하게 더 많은 독성이 있음) 사본 번호 증가로 지정되거나, 의 평균 ltr 은 음수이다.
- 다음과 같은 방식으로 종양의 표준화 된 판독 수에 대한 종양 내 라이브러리 정규화 판독 수의 모든 exome 표적 간격 " i "에 대한 로그 변환 비율 " ltr "을 계산하십시오 :
Access restricted. Please log in or start a trial to view this content.
결과
생물학적 분석기 플롯은 라이브러리 증폭 및 0.8x 비드 세정 후에 수행해야합니다. 원하는 범위에서 단편 크기의 "정상적인"분포를보아야합니다 ( 그림 2a ). 커브의 눈에 보이는 "어깨"와 같은이 모양의 편차는 고 분자량 또는 저 분자량 아티팩트의 존재를 나타냅니다. 예를 들어, 그림 2b -2d 는 이상적...
Access restricted. Please log in or start a trial to view this content.
토론
이 기술을 습득 한 이후의 응용 프로그램 또는 지시 사항
이 작품은 적어도 10 NG의 DNA를 포함하는 샘플에서 exome 시퀀싱을 허용합니다. 임상 적 맥락에서이 한계는 불충분 한 물질로 인해 대부분의 미세 바늘 흡인 표본을 제외하지만 적절한 핵심 생검 및 절제 생검 표본을 포함합니다. 이렇게하면 더 많은 샘플 세트에서 데이터를 수집 할 수 있습니다.
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 프로젝트 방법의 개발은 Weill Cornell Medical College의 병리학 및 실험 의학과에서 지원되었습니다. 우리는 전산 생물학 및 의학에서의 삼중 제도 연수 프로그램을 부분 기금으로 인정합니다. 우리는 시간과 지식을 우리와 공유 한 과학자, 특히 Maryke Appel에게 감사드립니다. Dan Burgess; 일간카 코자 레와; 차드로 클리어; Jenny Zhang, Xiaobo (Shawn) Liang, Dong Xu, Wei Zhang, Huimin Shang, Tatiana Batson 및 Tuo Zhang을 포함하여 Weill Cornell Medical College Genomics 핵심 시설의 모든 사람들이 있습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Petri or Cell Culture Dish (sterile) | |||
| RPMI-1640 Media | Roswell Park Memorial Institute | ||
| Fetal Calf Serum (FCS), (heat inactivated) | |||
| Freezing Media (RPMI, 20% FCS, 10% dimethylsulfoxide (DMSO))-make fresh and keep sterile | |||
| RPMI with 2% FCS (make fresh or store for up to 1 month) | |||
| scalpel with fresh blade | |||
| 10 mL syringe (no needle) | |||
| Cryogenic vials | |||
| 50 mL conical centrifuge tubes, force | |||
| Centrifuge | capable of handling 50 mL conical centrifuge tubes and providing 400g | ||
| Hepes buffer(1 M, cell culture grade) | |||
| phosphate buffered saline (PBS) | |||
| Pluoronic-F68 | Thermo-Fisher | 24040-032 | |
| DNAase-I | Sigma-Aldrich, St. Louis, MO | D4527-10KU | store as 5 mg/mL in RPMI in -200 °C |
| Bovine Serum Albumin (BSA) | |||
| Sort Media (PBS + 2% BSA + 25 mM HEPES + Pluoronic –F68 (1x)) | |||
| CD64-FITC (22) | Beckman Coulter, Miami, FL | 20 μL suggested starting volume; Titering is suggested | |
| CD30-PE (BerH83) | BD Biosciences, San Jose, CA | 20 μL suggested starting volume; Titering is suggested | |
| CD5-ECD (BL1a) | Beckman Coulter, Miami, FL | 10 μL suggested starting volume; Titering is suggested | |
| CD40-PerCP-eFluor 710 (1C10) | Ebiosciences, San Diego, CA | 5 μL suggested starting volume; Titering is suggested | |
| CD20-PC7 (B9E9) | Beckman Coulter, Miami, FL | 10 μL suggested starting volume; Titering is suggested | |
| CD15-APC (HI98) | BD Biosciences, San Jose, CA | 20 μL suggested starting volume; Titering is suggested | |
| CD45 APC-H7 (2D1) | BD Biosciences, San Jose, CA | Can be substituted with 10 μL suggested volume of CD45-Krome Orange (J.33, Beckman Coulter); Titering is suggested | |
| CD95-Pacific Blue (DX2) | Life Technologies, Grand Island, NY | 5 μL suggested starting volume; Titering is suggested | |
| CD2 (5 μg; clone RPA-2.10) | Biolegend, San Diego, CA | For optional protocol; Titering is suggested | |
| CD54 (10 μg; clone 84H10) | Serotec, Oxford, United Kingdom | For optional protocol; Titering is suggested | |
| CD58 (10 μg; clone TS2/9) | eBioscience, San Diego, CA | For optional protocol; Titering is suggested | |
| LFA-1 (12 μg; clone MHM23) | Novus Biologicals, Littleton, CO | For optional protocol; Titering is suggested | |
| BD CS&T Beads | BD Biosciences, San Jose, CA | ||
| BD Accudrop Beads | BD Biosciences, San Jose, CA | ||
| BC Versa Comp antibody capture beads | Beckman Coulter, Miami, FL | Compensation Beads | |
| BD-FACS ARIA special research order instrument using 5 lasers | BD Biosciences, San Jose, CA | any BD-FACS aria with capabilities to detect the fluorochromes in the antibody panel should be sufficient | |
| Wizard | Promega | A2360 | |
| 10 mM Tris-Cl buffer | NA | ||
| Qubit dsDNA HS Assay kit | Life Technologies, Carlsbad, CA | ||
| S2 Sonicator | Covaris, Woburn, MA | Alternatives may be substituted | |
| microTUBE | Covaris, Woburn, MA | ||
| Low-Throughput Library Preparation Kit | Kapa Biosystems, Wilmington, MA | KK8221 | |
| Sybr Green | Sigma-Aldrich, St. Louis, MO | S9430 | |
| Agencourt AMPure XP Beads | Beckman Coulter, Miami, FL | ||
| Bioanalyzer | Agilent Technologies, Santa Clara, CA | ||
| SeqCap EZ Exome v.3.0 | Roche Nimblegen | 6465684001 | |
| HiSeq | Illumina | ||
| TruSeq-style Universal adapter | Integrated DNA Technologies (IDT), Coralville, Iowa | HPLC purification; AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGAT*C*T | |
| TruSeq-style index adapter | Integrated DNA Technologies (IDT), Coralville, Iowa | HPLC purification; /5Phos/GATCGGAAGAGCACACGTCTGAACTCCAGTCACNNNNNNATCTCGTATGCCGTCTTCTGCTTG | |
| TruSeq-style PCR primer 1 | Integrated DNA Technologies (IDT), Coralville, Iowa | AATGATACGGCGACCACCGAGA | |
| TruSeq-style PCR primer 2 | Integrated DNA Technologies (IDT), Coralville, Iowa | CAAGCAGAAGACGGCATACGAG | |
| Nuclease Free Duplex Buffer | Integrated DNA Technologies (IDT), Coralville, Iowa | ||
| BD FACSDIVA software | BD Biosciences, San Jose, CA | ||
| BD Falcon Tubes | BD Biosciences, San Jose, CA | ||
| BD Flow Tubes | BD Biosciences, San Jose, CA |
참고문헌
- Abrams, J. National Cancer Institute's Precision Medicine Initiatives for the new National Clinical Trials Network. American Society of Clinical Oncology educational book / ASCO. American Society of Clinical Oncology. Meeting. , 71-76 (2014).
- Gagan, J., Van Allen, E. M. Next-generation sequencing to guide cancer therapy. Genome medicine. 7, 80(2015).
- Matsuki, E., Younes, A. Lymphomagenesis in Hodgkin lymphoma. Seminars in cancer biology. 34, 14-21 (2015).
- Fromm, J. R., Kussick, S. J., Wood, B. L. Identification and purification of classical Hodgkin cells from lymph nodes by flow cytometry and flow cytometric cell sorting. Am J Clin Pathol. 126 (5), 764-780 (2006).
- Fromm, J. R., Thomas, A., Wood, B. L. Flow cytometry can diagnose classical hodgkin lymphoma in lymph nodes with high sensitivity and specificity. Am J Clin Pathol. 131 (3), 322-332 (2009).
- Roshal, M., Wood, B. L., Fromm, J. R. Flow cytometric detection of the classical hodgkin lymphoma: clinical and research applications. Advances in hematology. 2011, 387034(2011).
- Reichel, J., et al. Flow sorting and exome sequencing reveal the oncogenome of primary Hodgkin and Reed-Sternberg cells. Blood. 125 (7), 1061-1072 (2015).
- Kozarewa, I. A Modified Method for Whole Exome Resequencing from Minimal Amounts of Starting DNA. PLoS ONE. 7 (3), e32617(2012).
- Brunicardi, F. C. Schwartz's Principles of Surgery. , 10th ed, McGraw-Hill Education / Medical. (2014).
- Kantor, A. B., Roederer, M. FACS analysis of leukocytes. Handbook of Experimental Immunology. 2, Blackwell Scientific. (1996).
- Sanders, M. E. Molecular pathways of adhesion in spontaneous rosetting of T-lymphocytes to the Hodgkin's cell line L428. Cancer Res. 48 (1), 37-40 (1988).
- Biosciences. FACSDiva Software v6.0. , Available from: http://www.bdbiosciences.com/in/instruments/software/facsdiva/resources/overview.jsp (2007).
- Biosciences. FACSAria II User's Guide. Part No. 644832, Revision A. , (2009).
- Life Technologies. Qubit 3.0 Fluorometer, Catalog Number Q33216. , Available from: https://www.thermofisher.com/order/catalog/product/Q33216 (2017).
- Roche Nimblegen. SeqCap EZ Library SR User's Guide ver. 4.1. , (2013).
- Illumina. HiSeq High-Throughput Sequencing System. , Available from: http://www.illumina.com/systems/hiseq_2500_1500.html (2016).
- Li, H., Durbin, R. Fast and accurate short read alignment with Burrows-Wheeler transform. Bioinformatics. 25 (14), 1754-1760 (2009).
- Li, H. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25 (16), 2078-2079 (2009).
- The Broad Institute. Picard Tools. , Available from: http://broadinstitute.github.io/picard/ (2016).
- Saunders, C. T. Strelka: accurate somatic small-variant calling from sequenced tumor-normal sample pairs. Bioinformatics. 28 (14), 1811-1817 (2012).
- Cingolani, P., et al. A program for annotating and predicting the effects of single nucleotide polymorphisms, SnpEff: SNPs in the genome of Drosophila melanogaster strain w1118; iso-2; iso-3. Fly (Austin). 6 (2), 80-92 (2012).
- Dobin, A. STAR: ultrafast universal RNA-seq aligner. Bioinformatics. 29 (1), 15-21 (2013).
- Thorvaldsdottir, H., Robinson, J. T., Mesirov, J. P. Integrative Genomics Viewer (IGV): high-performance genomics data visualization and exploration. Briefings in bioinformatics. 14 (2), 178-192 (2013).
- DNA copy number data analysis. v.R package version 1.34.0. , Available from: https://omictools.com/dnacopy-tool (2013).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유