A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تطوير أكثر حساسية وخصوصية اللونية آجار المتوسطة للكشف عن
In This Article
Summary
Detection and isolation of clinically relevant Vibrio species require selective and differential culture media. This study evaluated the ability of a new chromogenic medium to detect and identify V. parahaemolyticus and other related species. The new medium was found to have better sensitivity and specificity than the conventional medium.
Abstract
وقد أظهرت العدوى تنتقل عن طريق الأغذية في الولايات المتحدة التي تسببها أنواع الضمة اتجاها تصاعديا. في جنس الضمة، V. نظيرة الحالة للدم هو المسؤول عن غالبية الإصابات -associated الضمة. وهكذا، والتفريق الدقيق بين الضمة النيابة. وكشف V. نظيرة الحالة للدم هو في غاية الأهمية لضمان سلامة الإمدادات الغذائية لدينا. على الرغم من أن التقنيات الجزيئية شائعة على نحو متزايد، لا تزال تفعل أساليب اعتمادا الثقافة بشكل روتيني وأنها تعتبر الأساليب القياسية في ظروف معينة. وبالتالي، تم اختبار رواية المتوسطة أجار مولد اللون مع الهدف المتمثل في توفير أفضل طريقة لعزل والتفريق بين النيابة الضمة ذات الصلة سريريا. مقارنة بروتوكول الحد الحساسية والنوعية والكشف للكشف عن V. نظيرة الحالة للدم بين المتوسطة مولد اللون الجديد والمتوسطة التقليدية. خامسا مختلف سلالات نظيرة الحالة للدم (ن = 22) إعادةعرض الأنماط المصلية ومصدر من أصول مختلفة استخدمت. كانوا تحديدها من قبل إدارة الغذاء والدواء (FDA) ومراكز السيطرة على الأمراض والوقاية منها (CDC)، وكذلك التحقق في مختبرنا من قبل TLH -PCR. في أربعة على الأقل محاكمات منفصلة، تم تلقيح هذه السلالات على اللونية أجار ووحمض-سترات الصفراء أملاح-السكروز (TCBS) أجار، التي هي وسيلة الموصى بها لزراعة هذا النوع، تليها الحضانة في 35-37 درجة مئوية لمدة 24 -96 ساعة. ثلاثة V. لم سلالات نظيرة الحالة للدم (13.6٪) لا ينمو بالشكل الأمثل على TCBS، ومع ذلك أظهرت مستعمرات خضراء إذا كان هناك نمو. لم سلالتين (9.1٪) لم تسفر المستعمرات السماوي المتوقعة على أجار مولد اللون. خامسا عدم تم اختبار سلالات نظيرة الحالة للدم (ن = 32) أيضا لتحديد خصوصية أجار مولد اللون. ومن بين هذه السلالات، لم لا تنمو 31 أو عرضت الأشكال التضاريسية مستعمرة أخرى. يعني استرداد V. نظيرة الحالة للدم على chromogeكانت شركة الاستثمارات الوطنية أجار ~ 96.4٪ بالمقارنة مع أجار الصويا زيتية تستكمل مع 2٪ كلوريد الصوديوم. في الختام، أجار مولد اللون الجديد هو وسيلة فعالة للكشف عن V. نظيرة الحالة للدم ولتمييزه عن ضمات أخرى.
Introduction
كعضو من جنس الضمة، V. نظيرة الحالة للدم هو، المنحني، على شكل قضيب البكتيريا سالبة الجرام، وتشكيل غير بوغ. فإنه يسلك حركية عالية في كل من البيئات السائلة وشبه الصلبة. معظم V. سلالات نظيرة الحالة للدم هي غير الممرضة للإنسان، ومع ذلك فقد الأنواع الفرعية الممرضة تسبب الأوبئة والجوائح، وبالتالي يعتبر هذا النوع أن يكون الممرض تنتقل عن طريق الأغذية في العديد من البلدان 1،2. وقد أظهرت حدوث العدوى الضمة في الولايات المتحدة اتجاها تصاعديا منذ عام 2000 3. ومن بين الضمة النيابة.، V. نظيرة الحالة للدم هو النوع الأكثر ذكرت في كثير من الأحيان تسبب الأمراض في الولايات المتحدة 4،5. وتشمل الأنواع الأخرى ذات الصلة سريريا خامسا alginolyticus، V. vulnificus، V. الكوليرا، وما يحدث هناك نسبة صغيرة من الأمراض عن طريق أنواع متعددة في وقت واحد.
خامسا نظيرة الحالة للدم هو ط الطبيعيnhabitant من المياه البحرية، وبالتالي توزيعها على نطاق واسع في المياه البحرية في جميع أنحاء العالم بما في ذلك مصبات الأنهار. تم اكتشاف الأنواع في عام 1950 بعد تفشي التسمم الغذائي في اليابان. في الولايات المتحدة، والأنواع عزله للمرة الأولى في مياه البحر والرواسب، والمحار في المنطقة بوجيه ساوند 6،7. مرشح مغذيات في الموائل البحرية مثل المحار الصدفتين، يمكن أن تأوي V. نظيرة الحالة للدم كجزء من النباتات الطبيعية 8. على هذا النحو، V. وغالبا ما ترتبط العدوى نظيرة الحالة للدم في الانسان الى استهلاك الأغذية البحرية الملوثة، وخاصة المحار النيئ أو. يحدث الطريق أقل شيوعا من دخول عندما يتعرض الجرح مفتوحا لمياه البحر، مما يؤدي إلى إصابة الجلد. معظم V. سلالات نظيرة الحالة للدم لا تسبب الأمراض التي تصيب البشر، ولكن بعض الأنواع الفرعية إيواء عوامل الفوعة مثل دموية بالحرارة مباشرة (TDH) والمسببة للأمراض. الأعراض الأكثر شيوعا من الأمراض المنقولة بالغذاء V. عدوى نظيرة الحالة للدم همالاسهال وآلام في البطن، تليها الغثيان والقيء، والحمى. كما تم الإبلاغ عن الصداع والقشعريرة. فترة الحضانة متوسط هو 15 ساعة، ولكن يمكن أن تصل إلى 96 ساعة بعد استهلاك كمية كافية من السلالات المسببة للأمراض 9. يستمر المرض من سنتين إلى ثلاث أيام. أعراض التهاب المعدة والأمعاء الناجمة عن V. نظيرة الحالة للدم وإلى حد كبير محدودة ذاتيا والعلاج وبالتالي الخاصة ليست ضرورية. الحالات الخفيفة من التهاب المعدة والأمعاء ويمكن علاجها على نحو فعال من خلال معالجة الجفاف عن طريق الفم. ويمكن علاج أمراض خطيرة أكثر من المضادات الحيوية مثل التتراسيكلين أو سيبروفلوكساسين 10. معدل وفيات حوالي 2٪ للحالات التهاب المعدة والأمعاء، ولكن قد يصل إلى 29٪ لأولئك الذين يطورون عدوى مجرى الدم أو تسمم الدم. أي الشخص الذي يستهلك المأكولات البحرية أو لديه جرح مفتوح تتعرض لمياه البحر في خطر من V. عدوى نظيرة الحالة للدم. شكل أكثر شدة من الأمراض، وتسمم الدم تهدد الحياة، هو أكثر شيوعا في جزء من السكان مع زملاء الطبي الأساسيnditions 11، والتي تشمل إدمان الكحول، وأمراض الكبد، ومرض السكري، وأمراض الكلى والأورام الخبيثة، وغيرها من الشروط التي تؤدي إلى استجابة مناعية ضعيفة. والجدير بالذكر أن هذه المجموعة من الأفراد هي أيضا في خطر أعلى للتعاقد الأمراض الحادة الناجمة عن V. vulnificus، التي يمكن العثور عليها في الموائل الطبيعية مشابهة لV. نظيرة الحالة للدم.
يتم عزل خامسا نظيرة الحالة للدم بشكل روتيني باستخدام وحمض-سترات الصفراء أملاح-السكروز (TCBS) أجار كوسيلة انتقائية والتفاضلية. تخصيب اليورانيوم في البيبتون القلوية قد تسبق العزلة على TCBS أجار. وثم مزيد من الاختبارات المستعمرات الظني على TCBS في سلسلة من الاختبارات البيوكيميائية و / أو المقايسات الجزيئية التي تستهدف وجود جينات الأنواع المحددة. وغالبا ما تستخدم أساليب PCR القائم لتأكيد هوية V. نظيرة الحالة للدم عن طريق تضخيم الجين دموية بالحرارة، TLH 12.
بغض النظر عن الفصلOICE أساليب تأكيد، فمن المهم أن يكون وسيلة فعالة لعزل وتمييز V. نظيرة الحالة للدم من ضمات البحرية الأخرى في المقام الأول. وقد استخدمت بشكل روتيني TCBS للتمييز الأنواع داخل جنس الضمة وفقا لقدراتهم للتخمر السكروز 12. ويرافق رد فعل إيجابي التخمير عن تغيير لون مؤشر الرقم الهيدروجيني زرقة البروموثيمول. ف. المستعمرات نظيرة الحالة للدم هي مميزة إلى حد ما على TCBS، واظهار اللون الأزرق إلى اللون الأخضر. ومع ذلك، هذه الوسيلة لا يمكن التفريق بسهولة V. alginolyticus والخامس. الكوليرا. الأنواع بروتيوس-تخمر السكروز قد ينتج مستعمرات صفراء تشبه V. الكوليرا أو V. alginolyticus 13. على العزلة الأولية على TCBS، V. ويمكن أيضا أن أخطأ في التعرف نظيرة الحالة للدم كما الإيروموناس هايدروفيلا، القوربية الشيغيلانية، وأنواع الزائفة 14. سلالات مع سعر الصرف الثابت السكروز تأخرقد يتم الخلط بين entation مع السكروز الآخرين nonfermenting الضمة 13، والتي تشمل V. نظيرة الحالة للدم. تم العثور على TCBS أن تكون ليست حساسة ضد كولاي، الجرية الزائفة، من بين أمور أخرى. تسفر عن العديد من الأنواع الأخرى خضراء إلى رمادية المستعمرات التي يحتمل الخلط بينه وبين V. نظيرة الحالة للدم أو V. vulnificus 15. ونتيجة لذلك، فمن المستحسن لتطوير وسائل الإعلام ثقافة بديلة مع أفضل حساسية وخصوصية نحو كشف وعزل خامسا نظيرة الحالة للدم وغيرها من الأنواع ذات صلة وثيقة.
وقد وضعت مؤخرا عدة بدائل وسائل الإعلام. بالإضافة إلى إدراج وكلاء انتقائية، فإن معظم إدماج ركائز اللونية للتمييز الأنواع على أساس الأنشطة الإنزيمية التفاضلية الخاصة بهم. على سبيل المثال، استخدمت الإندوكسيل-β-جلوكوسيدي والإندوكسيل-β-غالاكتوزيد باعتبارها ركائز اللونية للتمييز V. الفقرةالمستعمرات لدم (والتي تظهر لون أخضر مزرق) من تلك التي V. الكوليرا (الأرجواني) بسبب قدراته التفاضلي على إنتاج بيتا جلوكوزيد وβ غالاكتوزيداز 16. تم تقييم تركيبات مختلفة من أجار مولدات اللون وضعت من قبل العديد من الجماعات ووذكرت لأداء نسبيا أو أفضل من TCBS 17،18،19. ميزة استخدام وسيلة مولد اللون هو أن التلوين من الوسط المحيط هو الحد الأدنى مما يسهل عزل المستعمرات معينة. في هذه الدراسة، قمنا بتقييم قدرة متوسطة مولد اللون وضعت حديثا لكشف وعزل خامسا الكوليرا، V. نظيرة الحالة للدم، والخامس vulnificus. مع التركيز بشكل خاص على قدرته على التفريق V. نظيرة الحالة للدم من الأنواع الأخرى.
Protocol
1. وسائل الإعلام والتثقيف من الميكروبية سلالات
ملاحظة: استخدام تقنيات العقيم في جميع التجارب. استخدام المواد المعقمة. تعقيم جميع الحاويات والأدوات وكاشف قبل استخدامها. الأوتوكلاف جميع النفايات قبل التخلص منها لأنها تعتبر biohazardous. درجة الحرارة الأوتوكلاف ووقت الجمع هو ≥121 ° C س ≥15 دقيقة لكافة الإجراءات التالية.
- لجعل ~ 1-L زيتية الصويا أجار (TSA)، أولا إضافة 1 لتر ماء منزوع الأيونات في دورق مخروطي سعة 2 لتر تحتوي على شريط مغناطيسي. استخدام قارورة وهذا هو على الأقل مرتين أكبر من الحجم النهائي. إضافة 30 غراما من مسحوق فول الصويا مرق زيتية و 20 غ أجار حبيبات في قارورة.
ملاحظة: استخدام 2٪ أجار بدلا من 1.5٪ للحد يحتشدون بعض الضمة النيابة.- مزيج دقيق من قبل تحول على النمام. مع التحريك، بدوره على الحرارة حتى يغلي الخليط. إزالة قارورة من سخان حالما يبدأ الخليط في الغليان. تغطية فضفاضة عشرالبريد قارورة مع رقائق القصدير. الشريط احباط لضمان الحصول عليها إلى القارورة قبل الأوتوكلاف.
- لجعل زيتية مرق الصويا (TSB)، بحذف أجار من وصفة في الخطوة 1.1.
ملاحظة: قد تستخدم زجاجات بدلا من دورق مخروطي. - لجعل أجار الصويا زيتية تستكمل مع 2٪ كلوريد الصوديوم أو كلوريد الصوديوم (TSAS)، إضافة 20 غرام من كلوريد الصوديوم في الخليط قبل التحريك والتدفئة. لجعل مرق الصويا زيتية تستكمل مع 2٪ كلوريد الصوديوم (الهيئات الفرعية المؤقتة)، بحذف أجار، إضافة 20 غرام من كلوريد الصوديوم في الخليط قبل التحريك والتدفئة.
- لجعل ضخ القلب الدماغ (BHI) أجار أو تعليق 37 غرام من مسحوق BHI و 15 غرام حبيبات أجار في 1 لتر من المياه النقية. الحرارة مع التحريض المتكرر بحل مسحوق. الأوتوكلاف. حذف أجار لجعل BHI مرق.
- لجعل TCBS أجار، تعليق 89 غرام من مسحوق TCBS في 1 لتر من المياه النقية. الحرارة مع التحريض المتكرر ويغلي لمدة 1 دقيقة لتذوب تماما المسحوق. لا الأوتوكلاف.
- لجميع وسائل الإعلام أجار، تبريد أجار الساخن ل45-50 درجة مئوية في حمام مائي. ترتيب لوحات بيتري فارغة في أكوام من 5-6 لوحات. بدءا من الجزء السفلي من المكدس، صب أجار المنصهر في كل لوحة بيتري لتصل إلى نحو نصف كاملة. إغلاق لوحة غطاء بيتري بعد صب. السماح للأجار ليصلب عن طريق السماح لوحات الجلوس في درجة حرارة الغرفة.
- استخدام لوحات أجار في اليوم التالي أو بعد 12 ساعة. تخزين لوحات غير المستخدمة في الثلاجة لمدة تصل إلى أسبوعين. قبل الاستخدام، وإزالة لوحات من الثلاجة ويوازن بينها في درجة حرارة الغرفة لمدة 15 دقيقة على الأقل.
ملاحظة: ليتر واحد أجار يجعل ~ 45 أجار لوحات. السماح لوحات أجار لتجف بشكل كاف في يوم من التحضير، وتتوازن لهم لدرجة حرارة الغرفة بعد التخزين البارد لفعالا في الحد من انتشار المستعمرات.
- استخدام لوحات أجار في اليوم التالي أو بعد 12 ساعة. تخزين لوحات غير المستخدمة في الثلاجة لمدة تصل إلى أسبوعين. قبل الاستخدام، وإزالة لوحات من الثلاجة ويوازن بينها في درجة حرارة الغرفة لمدة 15 دقيقة على الأقل.
- الحصول على الشوكولاته وأجار مولدات اللون لوحات ويوازن بينها في درجة حرارة الغرفة قبل كل تجربة.
- ثقافة فرعية كل السلالات الجرثومية 54 هو مبين في الجدول رقم 1 كل قليل دايس.
- استخدام حلقة بتلقيح معقمة لنقل الثقافات من الأسهم المجمدة أو دفعة سابقة إلى وسائل الإعلام غير الانتقائية مثل BHI مكتب تقييس الاتصالات / TSA أو الشوكولاته أجار. تنمو ملوحة الضمة النيابة. على الهيئات الفرعية التقنية المؤقتة / TSAS.
- للتحقق من نقاء الثقافة، خط جميع السلالات في نمط من شأنها أن تسمح للمراقبة من المستعمرات المعزولة. على سبيل المثال، استخدام تسليط الضوء على نمط من ثلاث مراحل لتخفيف كمية كبيرة من البكتيريا إلى كمية أقل، مما أسفر في نهاية المطاف المستعمرات المعزولة.
- احتضان لوحات رأسا على عقب في 35-37 درجة مئوية لمدة تصل إلى 48 ساعة. للالنيابة العطيفة، احتضان أنابيب أو لوحات في وعاء مغلق غطاء يحتوي على الحقيبة الغاز لإنتاج بيئة microaerophilic. مراقبة مستعمرة التشكل بعد الحضانة. يجب ثقافات نقية تسفر عن المستعمرات التي تظهر مشابهة مورفولوجيا مستعمرة.
ملاحظة: احتضان جميع لوحات رأسا على عقب لمنع قطرات الماء المختصرة تشكلت على الجانب السفلي من غطاء من السقوط على عمودonies.
2. الأنواع تحديد بواسطة PCR
- إجراء TLH -PCR لتأكيد هوية V. سلالات نظيرة الحالة للدم. استخدام بادئات TLH -F (5 'AAA GCG GAT TAT الائتلاف غا الائتلاف CTG 3') و-R TLH (5 'GCT ACT عقاري TAG CAT TTT جنة مكافحة الإرهاب TGC 3') لتضخيم شظية 450-BP من بالحرارة دموية جين 20 .
- استخدام حلقة بتلقيح معقمة لنقل بعض المستعمرات المعزولة من كل V. نظيرة الحالة للدم سلالة من TSAS إلى 5 مل من الهيئات الفرعية المؤقتة. احتضان في 35-37 درجة مئوية لمدة 16-24 ساعة.
- الثقافات أجهزة الطرد المركزي في 14000 x ج لمدة 1 دقيقة. إزالة طاف ويغسل بيليه مرتين مع الفوسفات مخزنة المالحة (PBS). غلي تعليق لمدة 3 دقائق لانتاج الخلايا المحللة.
ملاحظة: V. نظيرة الحالة للدم من السهل أن هي lysed. لذلك ليس مطلوبا تحلل كاشف. ومن الممكن أيضا استخدام قليلا من مستعمرة مباشرة كقالب. - أداء PCR في رد فعل ضد 25 ميكرولترolume. إعداد خليط التفاعل التي تحتوي على تركيز النهائي من العازلة 1X PCR، 1.5 ملي MgCl 2، 100 ميكرومتر لكل dNTP، 1 ميكرومتر من كل التمهيدي (1)، يو طق البلمرة و 1 ميكرولتر من المحللة الخلية. بعد حضن مسبق على 94 درجة مئوية لمدة 5 دقائق، تشغيل 35 دورات التضخيم من 94 درجة مئوية لمدة 30 ثانية، 58 درجة مئوية لمدة 30 ثانية، و 72 درجة مئوية لمدة 60 ثانية 21.
- قسامات حمولة من amplicon 5 ميكرولتر في 1.5٪ المواد الهلامية الاغاروز. بدوره على امدادات الطاقة لبدء الكهربائي. تصور وجود أو عدم وجود amplicons تحت إضاءة الأشعة فوق البنفسجية بعد تلطيخ بروميد إيثيديوم.
3. النمو على وسائل الإعلام الانتقائي والتفاضلية
- قبل يومين إلى أربعة أيام التجربة، خط كل السلالات الجرثومية هو مبين في الجدول رقم 1 على وسط غير الانتقائية (TSAS، BHI أو الشوكولاته أجار) لعزل مستعمرة. احتضان لوحات في 35-37 درجة مئوية لمدة 48 ساعة. تحقق نقاء الثقافات من خلال مراقبة مستعمرة التشكل بعد الحضانة. يجب ثقافات نقية تسفر عن المستعمرات التي تظهر مشابهة مورفولوجيا مستعمرة.
- نقل بعض المستعمرات المعزولة من الخطوة 3.1 إلى 5 مل من مرق. احتضان الأنابيب عند 35-37 درجة مئوية لمدة 16-24 ساعة.
ملاحظة: استخدام المستعمرات الشباب، والتي هي أقل من أربعة أيام من العمر، لإعداد الثقافات بين عشية وضحاها في جميع التجارب. - خط لملء غانة الثقافات بين عشية وضحاها على وسائل الإعلام الانتقائي والتفضيلية (TCBS وأجار مولدات اللون) لعزل مستعمرة. احتضان لوحات في 35-37 درجة مئوية لمدة تصل إلى 96 ساعة.
- تسجيل نمو الشامل لجميع السلالات من خلال دراسة كل من الكثافة الثقافة على لوحة وحجم مستعمرات معزولة. تسجيل لون المستعمرات تحت الضوء المحيط و / أو الأشعة فوق البنفسجية. ملاحظة الخصائص الأخرى للمستعمرة معزولة مثل الارتفاع، الهامش والنموذج.
الفحص 4. استعادة
- تحديد مجموعة فرعية ممثلة للV. سلالات نظيرة الحالة للدم (ن = 14) التي تشمل الأنماط المصلية وأصول العزلة مختلفة 22. تطعيم الثقافات شابة من لوحات في 5 مل من الهيئات الفرعية المؤقتة. احتضان الأنابيب في 35-37 درجة مئوية لمدة 16-24 ساعة.
- إجراء طريقة العد لوحة قياسي الثقافات بين عشية وضحاها كما هو موضح أدناه.
- دوامة لخلط الثقافات بين عشية وضحاها جيدا. جعل 10 أضعاف أو 10 -1 التخفيف عن طريق نقل 100 ميكرولتر من الثقافة بين عشية وضحاها في أنبوب يحتوي على 900 ميكرولتر برنامج تلفزيوني. دوامة لمزيج جيد.
- استخدام طرف الماصة جديد لنقل 100 ميكرولتر من الأنبوب 10 -1 التخفيف إلى أنبوب آخر يحتوي على 900 ميكرولتر برنامج تلفزيوني. دوامة لمزيج جيد. وهذا يشكل 10 -2 التخفيف. كرر بالتتابع عملية الحصول على 10 -7 التخفيف.
- باستخدام 10 -4 إلى 10 -7 أنابيب التخفيف، لوحة 100 ميكرولتر كل على اللونية، TCBS وTSAS لوحات أجار.
ملاحظة: عامل التخفيف (مدافع) على لوحة يصبح 10 -5 إلى 10 -8، على التوالي. - نشر قسامات بالتساوي على رانه أجار السطح.
ملاحظة: لا بأس في استخدام نفس رش في الضغط على نفس المتوسطة، طالما ينتشر قسامة تضعف معظم أولا (أي من 10 -8 إلى 10 -5). لا تستخدم نفس رش لوسائل الإعلام المختلفة. - احتضان لوحات في 35-37 درجة مئوية لمدة تصل إلى 96 ساعة. عدد المستعمرات على لوحات. تجاهل لوحات تحمل المستعمرات التي هي أكثر من أن تحصى (TNTC) أو أقل من 25. حساب كفو / مل وفقا لما يلي:
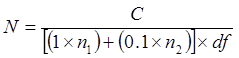
أين
N = عدد الخلايا في الأنبوب غير مخفف، كما أعرب عن كفو / مل أو كفو / ز
C = مجموع عدد المستعمرات عدها على لوحات التي تحمل 25-300 المستعمرات
ن 1 = عدد من لوحة (ق) حيث المستعمرات عدها هي من مدافع أقل
ن 2 = عدد من لوحة (ق) حيث المستعمرات عدها هي من التخفيف 10 أضعاف لاحق
دF = عامل أقل تخفيف (أي تخفيف أكثر تركيزا)
- مقارنة كفو / مل بين وسائل الإعلام المختلفة. استخدام كفو / مل على TSAS إلى 100٪، وحساب الانتعاش٪ من V. نظيرة الحالة للدم تزرع على أجار مولد اللون وTCBS.
5. المنافسة الفحص
- اختيار مجموعة فرعية من السلالات التي تظهر الأشكال التضاريسية مستعمرة مختلفة على أجار مولد اللون وTCBS.
ملاحظة: هذه الطريقة، سيكون من الممكن لحساب مستعمرات نشأت من V. نظيرة الحالة للدم فقط، على الرغم من وجود أنواع أخرى في اللقاح.- اختيار V. سلالة نظيرة الحالة للدم يمكن أن ينتج الفيروز والأزرق السماوي المتوقعة المستعمرات على TCBS وأجار مولد اللون، على التوالي.
- اختيار غير V. نظيرة الحالة للدم والأنواع غير الضمة التي لا تنمو على أي من هذه الوسائل، أو تظهر لون مختلف مستعمرة.
ملاحظة: على سبيل المثال، V. الميتشنيكوفية ينمو ضعيف جدا سن TCBS ولم تنمو على آغار مولد اللون. الشغيلة السونية لا تنمو على TCBS لكن ينتج مستعمرات أرجواني على أجار مولدات اللون.
- بعد اختيار سلالات أعلاه، إعداد الثقافات مرق بين عشية وضحاها باستخدام المستعمرات المعزولة نمت على وسائل الاعلام غير الانتقائية.
- جعل الثقافات بين عشية وضحاها من V. نظيرة الحالة للدم والخامس. الميتشنيكوفية عن طريق نقل عدد قليل من المستعمرات المعزولة من TSAS إلى 5 مل من الهيئات الفرعية المؤقتة. احتضان في 35-37 درجة مئوية لمدة 16-24 ساعة.
- جعل الثقافات بين عشية وضحاها من الشغيلة السونية عن طريق نقل عدد قليل من المستعمرات المعزولة من BHI أجار إلى 5 مل من مرق بهي. احتضان في 35-37 درجة مئوية لمدة 16-24 ساعة.
- لكل سلالة، نفذ سلسلة تخفيف مماثلة لخطوات 4.2.1 و 4.2.2. لوحة التخفيفات المناسبة على TSAS أو BHI لتحديد كفو / مل من الثقافة بين عشية وضحاها، وذلك باستخدام المعادلة هو موضح في الخطوة 4.2.5.
ملاحظة: عادة، و 100 ميكرولتر من التخفيف 10 -5 إلى 10 -7أنابيب تعمل لمعظم الثقافات. استخدام كفو / مل القيم لدعم حساب المبلغ المحدد من الخلايا المستخدمة في الخطوة التالية. ويتم الحصول على القيم كفو / مل محسوبة بعد الحضانة، على الرغم من أن يتم تنفيذ الخطوات التالية على نفس تاريخ الخطوة 5.3. - استخدام الثقافات بين عشية وضحاها وأنابيب التخفيف في خطوات 5.2 و 5.3، خلط كميات مختلفة من V. سلالة نظيرة الحالة للدم وعدم V. الأنواع نظيرة الحالة للدم. على سبيل المثال، مزيج 500 ميكرولتر من الأنبوب 10 -5 تخفيف من V. نظيرة الحالة للدم مع 500 ميكرولتر من الثقافات بين عشية وضحاها من V. الميتشنيكوفية.
ملاحظة: هذا الخليط يحاكي خلفية ميكروبات عالية. لمحاكاة خلفية ميكروبات منخفضة، مزيج 500 ميكرولتر كل من الأنبوب 10 -5 تخفيف من كلا النوعين. - نشر 100 ميكرولتر من الخليط كل يوم على اللونية، TCBS وTSAS لوحات أجار.
- بعد الحضانة عند 35-37 درجة مئوية لمدة تصل إلى 96 ساعة، عد المستعمرات من V. parahaemolyticuالصورة وعدم V. الأنواع نظيرة الحالة للدم على أساس الفرق في النمو والتشكل مستعمرة على أجار مولد اللون وTCBS.
ملاحظة: على سبيل المثال، إذا كان غير V. الأنواع نظيرة الحالة للدم لا تنمو على آغار مولد اللون وTCBS، وجميع المستعمرات يكون من V. نظيرة الحالة للدم. إذا كان غير V. الأنواع نظيرة الحالة للدم ينمو على كل وسائل الإعلام، لن يؤدي إلا إلى المستعمرات الفيروز على TCBS والسماوي المستعمرات على أجار مولد اللون يكون من V. نظيرة الحالة للدم. وعدم V. الأنواع نظيرة الحالة للدم قد أو قد لا يحمل مورفولوجيا مستعمرة مماثلة لV. نظيرة الحالة للدم على TSAS.- إذا كان غير V. الأنواع نظيرة الحالة للدم ينمو على نحو مماثل لV. نظيرة الحالة للدم على هذه الوسيلة غير الانتقائية، يقسم عدد مستعمرة من قبل اثنين من الحصول على أرقام لV. نظيرة الحالة للدم فقط. مقارنة عدد مستعمرة الفعلي مع العد المتوقع المستمدة من الخطوة 5.3.
6. المؤسسة فكرةالنظام الأوروبي من المحار الخليط
- تزن ≥50 ز لحم المحار من المحار ≥12 الرخويات بما في ذلك اللحوم والمشروبات الكحولية.
- إضافة مبلغ مساو من برنامج تلفزيوني لحوم المحار والخمور. مزج الخليط بسرعة عالية لمدة 90 ثانية. وهذا يشكل 2 -1 المخفف جناسة المحار.
- إضافة 100 غرام من 2 -1 المخفف جناسة المحار 400 غرام من برنامج تلفزيوني. استخدام مقياس لقياس الوزن، وليس الحجم. مزج الخليط بسرعة عالية لمدة 1 دقيقة. الأوتوكلاف جناسة المحار.
ملاحظة: سوف يكون هذا جناسة المحار تستخدم لارتفاعه.
- تكرار فحص الاسترداد (الخطوة 4) في وجود جناسة المحار.
- بعد يبرد 500 غرام المحار جناسة أسفل، إضافة 100 ميكرولتر من V. نظيرة الحالة للدم الثقافات بين عشية وضحاها نمت في الهيئات الفرعية المؤقتة لذلك. تحديد المبلغ الفعلي للV. خلايا نظيرة الحالة للدم في اللقاح عن طريق إجراء الإجراءات عدد اللوحة القياسية هو موضح في الخطوة 4.2.
- ممثلأكل فحص مسابقة (الخطوة 5) في وجود جناسة المحار.
- بعد يبرد 500 غرام المحار جناسة أسفل، إضافة 100 ميكرولتر كل الثقافات بين عشية وضحاها من V. نظيرة الحالة للدم وعدم V. نظيرة الحالة للدم لذلك. تحديد المبلغ الفعلي للبكتيريا الخلايا في اللقاح عن طريق إجراء الإجراءات عدد اللوحة القياسية الموضحة في الخطوة 4.2
- مزيج من الخلايا البكتيرية مع جناسة المحار جيدا باستخدام الخالط.
ملاحظة: بعد الاختلاط، جناسة المحار تحتوي على خلايا أضيفت عمدا يسمى ارتفعت المحار جناسة. - جعل التخفيفات جناسة المحار ارتفعت إلى الحصول على 10 -1 إلى 10 -3 أنابيب التخفيف وفقا للإجراءات وصفها في الخطوة 4.2.2. نشر 100 ميكرولتر من كل تخفيف على مولد اللون، TCBS وTSAS أجار. احتضان لوحات في 35-37 درجة مئوية لمدة تصل إلى 96 ساعة.
- مقارنة عدد مستعمرة الفعلي على أجار مولد اللون وTCBS مع السابقينpected مستعمرة العد استخلاصه من خطوات 6.2.1 و 6.3.1.
ملاحظة: على سبيل المثال، إذا كان أنبوب V. تحتوي نظيرة الحالة للدم الثقافة بين عشية وضحاها 10 8 كفو / مل، وهو اللقاح من 100 ميكرولتر يعني أن 10 7 خلايا تضاف إلى ز 500 جناسة المحار، مما أسفر عن 5 × 10 4 خلايا / ز. بعد تخفيف والطلاء، لوحة جود مدافع = 10 -2 يجب أن تسفر عن 500 المستعمرات. في حين أن وجود مدافع = 10 -3 ينبغي أن تسفر 50 المستعمرات. هذه هي التهم مستعمرة المتوقع.
النتائج
في هذه الدراسة، تم تجميع 54 سلالات ميكروبية، والتي شملت 22 سلالات داخل V. الأنواع نظيرة الحالة للدم، 19 نوعا الضمة أخرى، و 13 أنواع الضمة غير (الجدول 1). معظم V. إما تلقى سلالات نظيرة الحالة للدم من ادارة الاغذية والعق?...
Discussion
وتركز هذه الدراسة على تطوير وسائل الإعلام والثقافة، والتقييم. تقليديا، TCBS هو انتقائية والتفضيلية تستخدم سيلة لعزل وكشف V. نظيرة الحالة للدم، ضمة الكوليرا والخامس. vulnificus 12. ومع ذلك، فقد تم الإبلاغ عن القيود لهذه الوسيلة، مثل عدم القدرة على التفريق V. ?...
Disclosures
Some media were generously provided by Hardy Diagnostics, Santa Maria, CA. Thorsen conducted this study while a student at California Polytechnic State University. He is currently an employee of Hardy Diagnostics.
Acknowledgements
نشكر السيد Channey، E. تشاو، و ك توماس لما قدموه من مساعدة في هذا المشروع. وقد تم تمويل وازم المشروع جزئيا من قبل جامعة ولاية كاليفورنيا بوليتكنيك.
Materials
| Name | Company | Catalog Number | Comments |
| Reagent/Equipment | |||
| Agar | Fisher Scientific | DF0140-15-4 | may use other brands |
| Autoclave | Any | ||
| BHI powder | Fisher Scientific | DF0418-17-7 | may use other brands |
| Blender | Any | to blend oyster meat | |
| CampyGen gas generator | Hardy Diagnostics | CN035A | to provide a microaerophilic atmosphere; may use other brands |
| Chocolate agar plates | Hardy Diagnostics | E14 | may use other brands |
| Common PCR reagents (dNTPs, MgCl2, Taq Polymerase) | Any | or use PCR beads (Fisher Sci 46-001-014) | |
| Culture tubes | Fisher Scientific | S50712 | may use other brands |
| Eppendorf tubes | Fisher Scientific | S348903 | may use other brands |
| Gel doc | Any | ||
| HardyChrom Vibrio agar plates | Hardy Diagnostics | G319 | This study evaluates this medium |
| Incubator | Any | ||
| Inoculating loops | Fisher Scientific | 22-363-606 | 10 microliter-size was used in this study |
| NaCl | Fisher Scientific | BP358-212 | may use other brands |
| Oysters | Any | ||
| PBS | Fisher Scientific | R23701 | may use other brands |
| Petri dish | Fisher Scientific | FB0875713 | may use other brands |
| Pipette and tips | Any | Sterilized tips | |
| Primers for tlh | IDT DNA | ||
| Scale | Any | ||
| Spreader | Fisher Scientific | 08-100-11 | Beads may be used instead |
| Stomacher blender | Stomacher | 400 | Samples were homogenized at 200 rpm for 30 sec. Other homogenizer can be used. |
| Sterile filter bags for blenders | Fisher Scientific | 01-812-5 | |
| TCBS powder | Hardy Diagnostics | 265020 | This study evaluates this medium |
| Thermocycler | Any | ||
| TSB powder | Fisher Scientific | DF0370-07-5 | may use other brands |
| UV viewing cabinet | Any | Emit long-wave UV light | |
| Water bath | Any | ||
| Name | Sources | Catalog Number | Comments |
| Bacterial species and strains | |||
| Aeromonas hydrophila | ATCC | ||
| Candida albicans | ATCC | ||
| Campylobacter jejuni | ATCC | ||
| Escherichia coli | ATCC | ||
| Proteus mirabilis | ATCC | ||
| Pseudomonas aeruginosa | ATCC | ||
| Staphylococcus aureus | ATCC | ||
| Salmonella Choleraesuis | ATCC | ||
| Shigella boydii | ATCC | ||
| Shigella flexneri | ATCC | ||
| Shigella sonnei | ATCC | ||
| Vibrio alginolyticus | ATCC | ||
| V. cholerae (serotypes include O139, O1, non O1, El Tor biovars) | FDA, ATCC | ||
| V. damsela | FDA | ||
| V. fisherii | Environment | ||
| V. fluvialis | CDC | ||
| V. furnissii | CDC | ||
| V. hollisae | FDA | ||
| V. metschnikovii | ATCC | ||
| V. mimicus | FDA | ||
| V. parahaemolyticus(serotypes include O3:K6, O1:K56, O4:K8, O5:K15, O8, etc) | ATCC, FDA, CDC, Environment | ||
| V. proteolyticus | FDA | ||
| V. vulnificus | FDA |
References
- Yeung, P. S., Boor, K. J. Epidemiology, pathogenesis, and prevention of foodborne Vibrio parahaemolyticus infections. Foodborne Pathog. Dis. 1 (2), 74-88 (2004).
- Yeung, P. S. M., Boor, K. J., Faruque, S. M. Epidemiology, molecular biology, and detection of foodborne Vibrio parahaemolyticus infections. Foodborne and Waterborne Bacterial pathogens: Epidemiology, Evolution and Molecular Biology. , 153-184 (2012).
- Centers for Disease Control and Prevention. Vital Signs: Incidence and Trends of Infection with Pathogens Transmitted Commonly Through Food - Foodborne Diseases Active Surveillance Network, 10 U.S. Sites, 1996-2010. Morbidity and Mortality Weekly Report. 10, 1996-2010 (2011).
- . Summary of human Vibrio cases reported to CDC, 2008 Available from: https://stacks.cdc.gov/view/cdc/21591 (2008)
- Scallan, E., et al. Foodborne illness acquired in the United States - major pathogens. Emerg. Infect. Dis. 17 (1), 7-15 (2011).
- Baross, J., Liston, J. Occurrence of Vibrio parahaemolyticus and related hemolytic vibrios in marine environments of Washington State. Appl. Microbiol. 20 (2), 179-186 (1970).
- Baross, J., Liston, J. Isolation of Vibrio parahaemolyticus from the Northwest Pacific. Nature. 217 (5135), 1263-1264 (1968).
- Kueh, C. S., Chan, K. Y. Bacteria in bivalve shellfish with special reference to the oyster. J. Appl. Bacteriol. 59 (1), 41-47 (1985).
- Food and Drug Administration. . Bad Bug Book, Foodborne Pathogenic Microorganisms and Natural Toxins. , (2012).
- Qadri, F., et al. Adaptive and inflammatory immune responses in patients infected with strains of Vibrio parahaemolyticus. J. Infect. Dis. 187 (7), 1085-1096 (2003).
- MacFaddin, J. F. . Media for isolation-cultivation-identification-maintenance of medical bacteria. 1, (1985).
- Bottone, E. J., Robin, T. Vibrio parahaemolyticus: suspicion of presence based on aberrant biochemical and morphological features. J. Clin. Microbiol. 8 (6), 760-763 (1978).
- Lotz, M. J., Tamplin, M. L., Rodrick, G. E. Thiosulfate-citrate-bile salts-sucrose agar and its selectivity for clinical and marine vibrio organisms. Ann. Clin. Lab. Sci. 13 (1), 45-48 (1983).
- Hara-Kudo, Y., Nishina, T., Nakagawa, H., Konuma, H., Hasegawa, J., Kumagai, S. Improved method for detection of Vibrio parahaemolyticus in seafood. Appl. Environ. Microbiol. 67 (12), 5819-5823 (2001).
- Eddabra, R., Piemont, Y., Scheftel, J. M. Evaluation of a new chromogenic medium, chromID Vibrio, for the isolation and presumptive identification of Vibrio choleare and Vibrio parahaemolyticus from human clinical specimens. Eur. J. Clin. Microbiol. Infect. Dis. 30 (6), 733-737 (2011).
- Kodaka, H., Teramura, H., Mizuochi, S., Saito, M., Matsuoka, H. Evaluation of the Compact Dry VP method for screening raw seafood for total Vibrio parahaemolyticus. J. Food. Prot. 72 (1), 169-173 (2009).
- Su, Y. C., Duan, J., Wu, W. H. Selectivity and specificity of a chromogenic medium for detecting Vibrio parahaemolyticus. J. Food Prot. 68 (7), 1454-1456 (2005).
- Bej, A. K., Patterson, D. P., Brasher, C. W., Vickery, M. C., Jones, D. D., Kaysner, C. A. Detection of total and hemolysin-producing Vibrio parahaemolyticus in shellfish using multiplex PCR amplification of tl, tdh and trh. J. Microbiol. Methods. 36 (3), 215-225 (1999).
- Yeung, P. S. M., DePaola, A., Kaysner, C. A., Boor, K. J. A PCR assay for specific detection of the pandemic Vibrio parahaemolyticus O3:K6 clone from shellfish. J. Food Sci. 68 (4), 1459-1466 (2003).
- Yeung, P. S. M., Hayes, M. C., DePaola, A., Kaysner, C. A., Kornstein, L., Boor, K. J. Comparative phenotypic, molecular, and virulence characterization of Vibrio parahaemolyticus O3:K6 isolates. Appl. Environ. Microbiol. 68 (6), 2901-2909 (2002).
- Duan, J., Su, Y. -. C. Comparison of a chromogenic medium with thiosulfate-citrate-bile salts-sucrose agar for detecting Vibrio parahaemolyticus. J. Food Sci. 70, M125-M128 (2005).
- Pinto, A. D., Terio, V., Novello, L., Tantillo, G. Comparison between thiosulphate-citrate-bile salt sucrose (TCBS) agar and CHROMagar Vibrio for isolating Vibrio parahaemolyticus. Food Control. 22 (1), 124-127 (2011).
- Canizalez-Roman, A., Flores-Villaseñor, H., Zazueta-Beltran, J., Muro-Amador, S., Leòn-Sicairos, N. Comparative evaluation of a chromogenic agar medium-PCR protocol with a conventional method for isolation of Vibrio parahaemolyticus strains from environmental and clinical samples. Can J Microbiol. 57 (2), 136-142 (2011).
- Kriem, M. R., et al. Prevalence of Vibrio spp. in raw shrimps (Parapenaeus longirostris) and performance of a chromogenic medium for the isolation of Vibrio strains. Lett Appl Microbiol. 61 (3), 224-230 (2015).
- Food Drug Administration. Statistical guidance on reporting results from studies evaluating diagnostic tests. http://www.fda.gov/RegulatoryInformation/Guidances/ucm071148.htm. , (2007).
- Burd, E. M. Validation of laboratory-developed molecular assays for infectious diseases. Clin Microbiol Rev. 23 (3), 550-576 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved