Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Развитие более чувствительным и специфичным хромогенного агаровой среде для обнаружения
В этой статье
Резюме
Detection and isolation of clinically relevant Vibrio species require selective and differential culture media. This study evaluated the ability of a new chromogenic medium to detect and identify V. parahaemolyticus and other related species. The new medium was found to have better sensitivity and specificity than the conventional medium.
Аннотация
Инфекций пищевого происхождения в США , вызванного вида Vibrio показали тенденцию к росту. В роду Vibrio, В. parahaemolyticus отвечает за большинство Vibrio -associated инфекций. Таким образом, четкое разграничение между Vibrio SPP. и обнаружение V. parahaemolyticus является критически важным для обеспечения безопасности наших продуктов питания. Хотя молекулярные методы являются более распространенными, культура, в зависимости от метода до сих пор обычно делается, и они считаются стандартными методами при определенных обстоятельствах. Следовательно, роман хромогенный агар был испытан с целью обеспечения лучшего способа выделения и дифференциации клинически значимых Vibrio SPP. Протокол по сравнению чувствительность, специфичность и предел обнаружения для обнаружения V. parahaemolyticus между новым хромогенного среды и обычной среды. Различные В. штаммы parahaemolyticus (п = 22) повторноиспользовались разнообразные представления серотипов и источник происхождения. Они ранее были идентифицированы с помощью пищевых продуктов и медикаментов (FDA) и Центры по контролю и профилактике заболеваний (CDC), и далее проверяется в нашей лаборатории TLH -PCR. По меньшей мере, четыре отдельных испытаний, эти штаммы высевали на чашках с хромогенных и тиосульфат-цитрат-солей желчных кислот с сахарозой (TCBS) агар, который является рекомендуемым среда для культивирования этого вида, с последующей инкубацией при 35-37 & deg; С в течение 24 -96 ч. Три В. parahaemolyticus штаммов (13,6%) не росли оптимально на TCBS, тем не менее , выставлены зеленые колонии , если был отмечен рост. Два штамма (9,1%) не дали ожидаемых голубых колоний на хромогенного агара. Non- В. parahaemolyticus штаммы (n = 32) были также испытаны для определения специфичности хромогенного агара. Среди этих штаммов, 31 не росли или выставлены другие колонии морфологию. Среднее восстановление V. parahaemolyticus на chromogeНИК агар ~ 96,4% по сравнению с трипсином соевом агаре с добавлением 2% NaCl. В заключение отметим , что новый хромогенный агар является эффективным средством для обнаружения V. parahaemolyticus и дифференцировать его от других вибрионов.
Введение
В качестве члена рода Vibrio, V. parahaemolyticus является грам-отрицательных, не спорообразующих, изогнутые, палочковидные бактерии. Он демонстрирует высокую подвижность в жидких и полутвердых сред. Большинство V. штаммы parahaemolyticus не являются патогенными для человека, но патогенные подтипы вызвали эпидемии и пандемии, следовательно , этот вид считается важным патогеном пищевого происхождения во многих странах 1,2. Частота Vibrio инфекции в США показал тенденцию к росту с 2000 года 3. Среди Vibrio SPP., V. parahaemolyticus является наиболее часто сообщалось видов , вызывающих заболевания в США 4,5. Другие клинически значимые виды включают V. alginolyticus, В. vulnificus, В. вибрион и т.д. Небольшой процент болезней вызывается несколькими видами одновременно.
В. parahaemolyticus является естественным яnhabitant морской воды и, следовательно, широко распространены в морских водах по всему миру, включая эстуарии. Вид был открыт в 1950 году после вспышки пищевого отравления в Японии. В США этот вид был впервые выделен в морской воде, донных отложений, а также ракообразные в регионе Пьюджет - Саунд 6,7. Фильтраторов в морских средах обитания, таких как двустворчатые моллюски, могут питать В. parahaemolyticus как часть своей природной флоры 8. Как таковой, В. parahaemolyticus инфекции у человека часто связаны с потреблением загрязненных морепродуктов, особенно сырые или моллюска. Менее распространенный маршрут входа происходит, когда открытая рана подвергается воздействию морской воды, что приводит к инфекции кожи. Большинство V. штаммы parahaemolyticus не вызывают болезни человека, однако некоторые подтипы укрывательство факторы вирулентности , такие как термостабильной прямой гемолизина (TDH) являются патогенными. Наиболее распространенные симптомы пищевого происхождения V. parahaemolyticus инфекциейпонос и боли в животе, затем тошнота, рвота и лихорадка. Головная боль и озноб также сообщается. Средний инкубационный период составляет 15 ч, но может быть до 96 часов после потребления достаточного количества патогенных штаммов 9. Болезнь длится от двух до трех дней. Симптомы гастроэнтерита , вызванные V. parahaemolyticus в значительной степени самоограничения и поэтому специальная обработка не требуется. Легкие случаи гастроэнтерита можно эффективно лечить с помощью оральной регидратации. Более тяжелые болезни можно лечить с помощью антибиотиков , таких как тетрациклин или ципрофлоксацина 10. Смертность составляет около 2% за исключением случаев гастроэнтерита, но может достигать 29% для тех, кто разрабатывает инфекции кровотока или сепсис. Любой человек , который потребляет морепродукты или имеет открытую рану воздействию морской воды находится под угрозой V. parahaemolyticus инфекция. Чем более тяжелая форма болезни, угрожающей жизни сепсиса, чаще встречается у субпопуляции с основного медицинского сотрудничестваnditions 11, которые включают в себя алкоголизм, заболевания печени, сахарный диабет, заболевания почек, злокачественные опухоли, а также другие условия , приводящие к ослаблению иммунного ответа. Примечательно, что эта группа лиц также подвергаются более высокому риску заражения для тяжелых заболеваний , вызванных V. vulnificus, которые могут быть найдены в естественной среде обитания , похожими на V. parahaemolyticus.
В. parahaemolyticus регулярно выделяли с использованием тиосульфата-цитрата солей желчных кислот с сахарозой (TCBS) агар в качестве селективного и дифференциальной среды. Обогащение в щелочной пептонной воде может предшествовать изоляции на TCBS агар. ФИКСИРОВАННЫЕ колонии на TCBS затем дополнительно протестированы в массиве биохимических тестов и / или молекулярных анализов, ориентированных на присутствие генов видоспецифичных. Основанные на ПЦР методы часто используются для подтверждения личности V. parahaemolyticus путем амплификации гена термолабильный гемолизина, TLH 12.
Независимо от того, чOICE методов подтверждения, важно иметь эффективную среду для выделения и дифференцироваться В. parahaemolyticus от других морских вибрионов в первую очередь. TCBS обычно была использована для дифференциации видов в пределах рода Vibrio в соответствии со своими способностями к ферментируют сахарозу 12. Положительная реакция брожения сопровождается изменением цвета индикатора рН Бромтимоловый синего. V. parahaemolyticus колонии довольно отличительные от TCBS, показывая синего до зеленого цвета. Тем не менее, эта среда не может легко отличить В. alginolyticus и В. вибрион. Сахароза сбраживающие видов Proteus может производить желтые колонии , напоминающие В. вибрион или V. alginolyticus 13. На первоначальном выделении на TCBS, V. parahaemolyticus также может быть ошибочно , как Aeromonas hydrophila, Plesiomonas shigelloides и Pseudomonas SPP 14. Штаммы с задержкой FERM сахарозыентация могут быть спутаны с другими сахарозы неферментирующие Vibrio 13, которые включают в себя В. parahaemolyticus. TCBS оказался не чувствителен к кишечной палочки, Pseudomonas putrefaciens, среди других. Несколько других видов дают зеленого до серых колоний , которые потенциально путают с V. parahaemolyticus или V. vulnificus 15. В результате, желательно разработать альтернативный культуральных сред с лучшей чувствительностью и специфичностью по отношению к обнаружению и изоляции V. parahaemolyticus и других близких видов.
Несколько альтернативных СМИ были недавно разработаны. В дополнение к включению селективных агентов, наиболее включать хромогенных субстратов для дифференциации видов на основе их дифференциальных ферментной активности. Например, индоксил-β-глюкозид и индоксил-β-галактозид, использовались в качестве хромогенных субстратов для дифференциации V. пунктhaemolyticus колонии (которые появляются голубовато-зеленые) от тех , V. вибрион (фиолетовый) из - за их различной способностью производить бета-глюкозидазы и бета-галактозидазы 16. Различные составы хромогенного агара , разработанные несколько групп были оценены и были сообщены для выполнения сравнительно или лучше , чем TCBS 17,18,19. Преимущество использования хромогенного среды является то, что окраска окружающей среды минимальна, таким образом, облегчая выделение отдельных колоний. В данном исследовании мы оценивали способность вновь сформулированной хромогенного среды для обнаружения и изолирования V. вибрион, В. parahaemolyticus и В. vulnificus; с особым акцентом на его способности различать В. parahaemolyticus от других видов.
протокол
1. Средства массовой информации и Культивирование штаммов микроорганизмов
Примечание: Используйте асептических методов во всех экспериментах. Использование стерильных материалов. Стерилизовать все контейнеры, инструменты и реагент перед использованием. Автоклав все материалы отходов перед их утилизацией, поскольку они считаются заразны. Автоклавы температура и время комбинация ≥121 ° С х ≥15 мин для всех следующих процедур.
- Для того, чтобы ~ 1-L трипсиновый соевый агар (ТСА), сначала добавляют 1 л деионизированной воды в 2-литровую колбу Эрленмейера, содержащую магнитную мешалку. Используйте колбу, которая по меньшей мере в два раза больше, чем конечный объем. Добавьте 30 г порошка трипсинизированном соевого бульона и 20 г агара гранул в колбу.
Примечание: Используйте 2% агара вместо 1,5% , чтобы ограничить роения некоторого Vibrio SPP.- Тщательно перемешать путем включения мешалки. При перемешивании, включите тепла до кипения смеси. Выньте колбу от нагревателя, как только смесь начинает кипеть. Неплотно покрытия йе колбу с оловянной фольгой. Лента фольгу, чтобы закрепить его в колбу перед тем автоклаве.
- Для того, чтобы триптические соевый бульон (TSB), опустить агар из рецепта в шаге 1.1.
Примечание: Может использовать бутылки вместо колбы Эрленмейера. - Для того, чтобы трипсинизированном соевый агар с добавлением 2% хлорида натрия или NaCl (ВСТ), добавляют 20 г NaCl в смеси до перемешивании и нагревании. Для того, чтобы трипсинового соевого бульона с добавлением 2% -ного NaCl (ВВО), опустить агар, добавляют 20 г NaCl в смеси до перемешивании и нагревании.
- Для того, чтобы сердце мозга для инфузии (BHI) агара, приостановить 37 г порошка BHI и 15 г гранул агара в 1 л очищенной воды. Нагреть при частом помешивании до растворения порошка. Автоклавы. Опустим агар сделать BHI бульон.
- Для того, чтобы сделать TCBS агар, приостановить 89 г порошка TCBS в 1 л очищенной воды. Нагреть при частом помешивании и кипятить в течение 1 мин до полного растворения порошка. Не автоклав.
- Для всех агаровых средах, охладить горячий агар 45-50 ° С в водяной бане. Устройте пустые чашки Петри в стопках пяти до шести пластин. Начиная с нижней части стопки, заливают расплавленный агар в каждую чашку Петри, чтобы достичь примерно наполовину. Закройте крышку пластины Петри после заливки. Дайте агара затвердевать, позволяя пластины сидеть при комнатной температуре.
- Используйте агаром на следующий день или после 12 часов. Храните неиспользованные пластины в холодильнике до двух недель. Перед использованием снимите пластины из холодильника и уравновешивают их при комнатной температуре в течение не менее 15 мин.
Примечание: Один-литровый агар составляет 45 ~ агар пластины. Дайте агаром, чтобы высушить в достаточной степени на день подготовки, и уравновешивают их до комнатной температуры после холодного хранения, чтобы эффективно уменьшить распространение колоний.
- Используйте агаром на следующий день или после 12 часов. Храните неиспользованные пластины в холодильнике до двух недель. Перед использованием снимите пластины из холодильника и уравновешивают их при комнатной температуре в течение не менее 15 мин.
- Получить шоколад и хромогенный агаром и уравновешивают их при комнатной температуре перед каждым экспериментом.
- Пересевают все 54 штаммов микробов , показанные в таблице 1 каждые несколько даYS.
- Используйте стерильную петлю инокул для передачи культуры из замороженного запаса или предыдущей партии на неселективных средах, таких как BHI, TSB / TSA или шоколадный агар. Grow галофильного Vibrio SPP. на ВВО / ВСТ.
- Для проверки чистоты культуры, полоса все штаммы в виде узора, который позволил бы для наблюдения изолированных колоний. Например, можно использовать шаблон полосатость трехфазную разбавить большое количество бактерий в меньшем количестве, в конечном счете, получают изолированные колонии.
- Инкубируйте пластины вверх-вниз при 35-37 ° С в течение до 48 часов. Для Campylobacter SPP., Инкубировать трубки или пластины в банку закрытой крышкой, содержащей газовый мешок для получения микроаэрофильный среды. Обратите внимание морфологии колоний после инкубации. Чистые культуры должны давать колонии, которые демонстрируют подобную морфологии колоний.
Примечание: Инкубируйте все пластины вверх-вниз, чтобы предотвратить конденсированные капельки воды, образующейся на нижней стороне крышки от падения на Colonies.
2. Виды Определение с помощью ПЦР
- Проведение TLH -PCR , чтобы подтвердить личность В. parahaemolyticus штаммы. С помощью праймеров TLH -F (5 'AAA GCG GAT ТАТ GCA GCA GAA CTG 3') и TLH -R (5 'GCT ACT TTC TAG САТ ТТТ СТС ТГК 3') для амплификации 450 п.н. фрагмент гена термолабильный гемолизина 20 ,
- Используйте стерильную петлю инокул передать несколько изолированных колоний каждого V. штамм parahaemolyticus от ВСТ до 5 мл ЦБС. Выдержите при 35-37 ° С в течение 16-24 ч.
- Центрифуга культуры при 14000 мкг в течение 1 мин. Удалить супернатант и промыть осадок дважды фосфатно-солевым буфером (PBS). Кипение суспензии в течение 3 мин с получением клеточного лизата.
Примечание: V. parahaemolyticus легко быть лизированы. Поэтому лизис реагент не требуется. Кроме того, можно использовать немного колонии непосредственно в качестве шаблона. - Выполните ПЦР в 25-мкл реакции Volume. Готовят реакционную смесь , содержащую конечную концентрацию 1х ПЦР - буфера, 1,5 мМ MgCl 2, 100 мкМ каждого дНТФ, 1 мкМ каждого праймера, 1 ед Taq - полимераза , и 1 мкл клеточного лизата. После предварительной инкубации при 94 ° С в течение 5 мин, бег 35 циклов амплификации 94 ° С в течение 30 сек, 58 ° C в течение 30 сек и при 72 ° С в течение 60 с 21.
- Нагрузка аликвоты 5-мкл ампликонов в 1,5% агарозном геле. Включите питание, чтобы начать электрофорез. Визуализируйте наличие или отсутствие ампликонов под действием УФ-освещении после окрашивания бромистым этидием.
3. Рост на селективной и дифференциальной медиа
- От двух до четырех дней до начала эксперимента, полоса все микробные штаммы , представленные в таблице 1 , на неселективный среде (ВСТ, BHI или шоколадный агар) для выделения колоний. Инкубируют планшеты при 35-37 ° С в течение 48 часов. Проверьте чистоту культур путем наблюдения морфологии колоний после инкубации, Чистые культуры должны давать колонии, которые демонстрируют подобную морфологии колоний.
- Передача нескольких изолированных колоний из шага 3.1 в 5 мл бульона. Инкубируйте пробирки при температуре 35-37 ° С в течение 16-24 ч.
Примечание: Используйте молодые колонии, которые менее чем за четыре дня назад, чтобы подготовить в течение ночи культуры во всех экспериментах. - Серия Петлю овернайт культур на селективной и дифференциальной средах (TCBS и хромогенного агара) для изоляции колонии. Инкубируйте пластины при 35-37 ° С в течение до 96 часов.
- Запишите общий рост всех штаммов, исследуя как плотность культуры на пластине и размер изолированных колоний. Записывают цвет колоний при температуре окружающей и / или УФ-излучения. Обратите внимание, другие характеристики изолированной колонии, такие как возвышение, края и формы.
4. Восстановление анализа
- Выберите репрезентативную подмножество V. штаммы parahaemolyticus (п = 14) , которые охватывают различные серотипы и происхождение изоляции 22. Привить молодых культур из пластин в 5 мл ЦБС. Инкубировать пробирки при 35-37 ° С в течение 16-24 ч.
- Проведение стандартного метода Plate Count из ночных культур, как описано ниже.
- Vortex смешивать в течение ночи культуры хорошо. Выполнить 10 раз или 10 -1 разведение путем переноса 100 мкл ночной культуры в пробирку , содержащую 900 мкл PBS. Vortex хорошо перемешать.
- Используйте новый наконечник пипетки для передачи по 100 мкл из 10 -1 разбавления трубы в другую пробирку , содержащую 900 мкл PBS. Vortex хорошо перемешать. Это составляет 10 -2 разбавления. Повторите этот процесс последовательно , чтобы получить 10 -7 разведения.
- Используя 10 -4 до 10 -7 разведения пробирки, пластина 100 мкл каждого на хромогенных, TCBS и ВСТ чашки с агаром.
Примечание: Коэффициент разбавления (DF) на пластинке будет 10 -5 до 10 -8, соответственно. - Распределите аликвоты равномерно по тон поверхность агара.
Примечание: Это прекрасно , чтобы использовать один и тот же шпатель на штамм на той же среде, до тех пор , как наиболее разбавленный аликвоты распространяется в первую очередь (то есть, от 10 -8 до 10 -5). Не используйте один и тот же шпатель для различных сред. - Инкубируйте пластины при 35-37 ° С в течение до 96 часов. Граф колоний на пластинах. Игнорируйте пластины, несущие колонии, которые слишком много, чтобы считать (tntc) или меньше 25. Вычислить КОЕ / мл в соответствии со следующим:
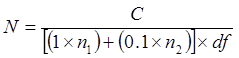
где
N = число клеток в неразбавленном трубки, выраженное в КОЕ / мл или КОЕ / г
C = общее количество колоний , подсчитанных на пластинах , которые несут 25-300 колонии
N 1 = количество пластины (ов) , где подсчитаны колонии из нижней ДФ
N 2 = количество пластины (ов) , где подсчитаны колонии с последующим 10-кратного разведения
dF = коэффициент разбавления ниже (т.е. более концентрированным разведение)
- Сравнение КОЕ / мл среди различных средств массовой информации. Используйте КОЕ / мл на ВСТ как 100%, вычислите восстановление V.% parahaemolyticus вырос на хромогенного и TCBS агар.
5. Конкурс Анализ
- Выберите подмножество штаммов, которые показывают различные морфологии колонии на хромогенных и TCBS агар.
Примечание: Таким образом, можно будет считать колоний возникла из V. parahaemolyticus только, несмотря на наличие других видов в посевного материала .- Выберите V. штамм parahaemolyticus , что дает ожидаемые бирюзовые и голубые цвета колоний на TCBS и хромогенного агара, соответственно.
- Выберите не- V. parahaemolyticus и еще не- видов Vibrio , которые не растут на любой из этих сред, или проявляют различные цвета колонии.
Примечание: Например, В. metschnikovii растет очень слабо оN TCBS и не растут на хромогенного агара. шигеллы Зонне не растут на TCBS но дает фуксина колонии на хромогенного агара.
- После выбора указанных выше штаммов, готовят в течение ночи культуры бульона с использованием выделенных колоний, выросших на неселективных средах.
- Сделать ночные культуры В. parahaemolyticus и В. metschnikovii путем переноса нескольких изолированных колоний от ВСТ до 5 мл ЦБС. Выдержите при 35-37 ° С в течение 16-24 ч.
- Сделать ночные культуры Shigella Зонне путем переноса нескольких изолированных колоний от BHI агаром до 5 мл BHI бульона. Выдержите при 35-37 ° С в течение 16-24 ч.
- Для каждого штамма, выполнить ряд разбавления аналогичны шагам 4.2.1 и 4.2.2. Пластинчатые соответствующие разбавлени в отношении ВСТ или BHI для определения КОЕ / мл ночной культуры, используя уравнение, показанное на шаге 4.2.5.
Примечание: Как правило, 100 мкл от 10 -5 до 10 -7 разбавленияПробирки работает для большинства культур. Используйте значения КОЕ / мл для резервного вычислить точное количество клеток, используемых в следующей стадии. Рассчитанные значения КОЕ / мл получают после инкубации, хотя следующие шаги выполняются в тот же день, как на стадии 5.3. - Использование ночных культур и разведения труб с шагом 5.2 и 5.3, смешивать различные количеств V. штамм parahaemolyticus и не- В. видов parahaemolyticus. Например, смешать 500 мкл 10 -5 разбавления трубки V. parahaemolyticus 500 мкл ночных культур V. metschnikovii.
Примечание: Эта смесь имитирует высокий фон микрофлору. Для имитации низкого фона микрофлору, смешать 500 мкл каждого из 10 -5 разбавления трубки от обоих видов. - Спред 100 мкл смеси каждый на хромогенных, TCBS и ВСТ чашки с агаром.
- После инкубации при 35-37 ° С в течение до 96 часов, подсчет колоний V. parahaemolyticus и не- В. виды parahaemolyticus на основе разницы в их роста и морфологии колоний на хромогенных и TCBS агар.
Примечание: Например, если не- В. виды parahaemolyticus не растут на хромогенного и TCBS агар, все колонии будут иметь V. parahaemolyticus. Если не- V. видов parahaemolyticus растет на обеих средах, только бирюзовые колонии на TCBS и бирюзового колоний на хромогенного агара будет иметь V. parahaemolyticus. Непостоянство В. виды parahaemolyticus могут или не могут проявлять подобную морфологии колонии V. parahaemolyticus на ВСТ.- Если не- V. видов parahaemolyticus растет подобно V. parahaemolyticus на этой неселективного среде, делят количество колоний на два , чтобы получить номера для V. parahaemolyticus только. Сравните фактическое количество колоний с ожидаемым подсчета полученного на стадии 5.3.
6. EffЕКТС устричных гомогенатах
- Взвесьте ≥50 г устриц мясо от ≥12 моллюсков моллюсков в том числе мяса и спиртных напитков.
- Добавить равное количество PBS к мясу устриц и ликеров. Смешайте смесь на высокой скорости в течение 90 сек. Это составляет 2 -1 разбавленный устрицы гомогената.
- Добавьте 100 г 2 -1 разбавленного устрицы гомогената до 400 г PBS. Используйте шкалу для измерения веса, а не объем. Смешать смесь при высокой скорости в течение 1 мин. Автоклава устрицы гомогената.
Примечание: Это будет устрицы гомогенат используется для брать на острие.
- Повторите анализ восстановления (этап 4) в присутствии устрицы гомогената.
- После того , как 500 г устриц гомогенат остывает, добавьте 100 мкл V. parahaemolyticus ночных культур , выращенных в ЦБС к нему. Определить фактическую величину V. parahaemolyticus клетки в прививочного путем проведения стандартных процедур подсчета табличке , описанной в пункте 4.2.
- репссъесть Конкурентный анализ (шаг 5) в присутствии устрицы гомогената.
- После того , как 500 г устриц гомогенат остывает, добавьте 100 мкл каждого из ночных культур V. parahaemolyticus и не- В. parahaemolyticus к нему. Определить фактическое количество бактериальных Клетки в прививочного материала путем проведения стандартных процедур счетной пластинке описано в шаге 4.2
- Смешайте бактериальные клетки с устриц гомогената хорошо с использованием гомогенизатора.
Примечание: После смешивания, устрица гомогенат, содержащий специально добавленных клеток, называется шипами устричные гомогената. - Сделать разведений зубчатым устрицы гомогената , чтобы получить 10 -1 до 10 -3 разведений трубки в соответствии с процедурами , описанными в пункте 4.2.2. Спред по 100 мкл каждого разведения на хромогенного, TCBS и TSAs агар. Инкубируйте пластины при 35-37 ° С в течение до 96 часов.
- Сравните фактическое количество колоний на хромогенных и TCBS агар с эксожидаемому количество колоний выведено из шагов 6.2.1 и 6.3.1.
Примечание: Например, если труба из V. parahaemolyticus Ночную культуру содержит 10 8 КОЕ / мл, инокулят 100 мкл означает , что 10 7 клеток добавляют к 500-г устричных гомогената, получая 5 х 10 4 клеток / г. После разбавления и покрытия, пластины , имеющие DF = 10 -2 должен давать 500 колоний; в то время , что, ФР = 10 -3 должно дать 50 колоний. Таковы ожидаемые подсчет колоний.
Результаты
В этом исследовании 54 штаммы микроорганизмов были собраны, которые включали 22 штаммов в V. виды parahaemolyticus, 19 других видов вибрион, а также 13 видов не- вибриона (таблица 1). Большинство V. штаммы parahaemolyticus либо были получены от FDA, CDC или д?...
Обсуждение
В данном исследовании основное внимание уделяется разработке и оценке культуры средств массовой информации. Обычно TCBS является селективное и дифференциальная среда , используемая для выделения и обнаружения V. parahaemolyticus, В. вибрион и В. vulnificus 12. Тем не менее, ограничения ?...
Раскрытие информации
Some media were generously provided by Hardy Diagnostics, Santa Maria, CA. Thorsen conducted this study while a student at California Polytechnic State University. He is currently an employee of Hardy Diagnostics.
Благодарности
Мы благодарим М. Channey, Э. Чау, К. Томас за их помощь по проекту. Поставленный по проекту были частично финансировалась Политехнический университет штата Калифорния.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagent/Equipment | |||
| Agar | Fisher Scientific | DF0140-15-4 | may use other brands |
| Autoclave | Any | ||
| BHI powder | Fisher Scientific | DF0418-17-7 | may use other brands |
| Blender | Any | to blend oyster meat | |
| CampyGen gas generator | Hardy Diagnostics | CN035A | to provide a microaerophilic atmosphere; may use other brands |
| Chocolate agar plates | Hardy Diagnostics | E14 | may use other brands |
| Common PCR reagents (dNTPs, MgCl2, Taq Polymerase) | Any | or use PCR beads (Fisher Sci 46-001-014) | |
| Culture tubes | Fisher Scientific | S50712 | may use other brands |
| Eppendorf tubes | Fisher Scientific | S348903 | may use other brands |
| Gel doc | Any | ||
| HardyChrom Vibrio agar plates | Hardy Diagnostics | G319 | This study evaluates this medium |
| Incubator | Any | ||
| Inoculating loops | Fisher Scientific | 22-363-606 | 10 microliter-size was used in this study |
| NaCl | Fisher Scientific | BP358-212 | may use other brands |
| Oysters | Any | ||
| PBS | Fisher Scientific | R23701 | may use other brands |
| Petri dish | Fisher Scientific | FB0875713 | may use other brands |
| Pipette and tips | Any | Sterilized tips | |
| Primers for tlh | IDT DNA | ||
| Scale | Any | ||
| Spreader | Fisher Scientific | 08-100-11 | Beads may be used instead |
| Stomacher blender | Stomacher | 400 | Samples were homogenized at 200 rpm for 30 sec. Other homogenizer can be used. |
| Sterile filter bags for blenders | Fisher Scientific | 01-812-5 | |
| TCBS powder | Hardy Diagnostics | 265020 | This study evaluates this medium |
| Thermocycler | Any | ||
| TSB powder | Fisher Scientific | DF0370-07-5 | may use other brands |
| UV viewing cabinet | Any | Emit long-wave UV light | |
| Water bath | Any | | |
| Name | Sources | Catalog Number | Comments |
| Bacterial species and strains | |||
| Aeromonas hydrophila | ATCC | ||
| Candida albicans | ATCC | ||
| Campylobacter jejuni | ATCC | ||
| Escherichia coli | ATCC | ||
| Proteus mirabilis | ATCC | ||
| Pseudomonas aeruginosa | ATCC | ||
| Staphylococcus aureus | ATCC | ||
| Salmonella Choleraesuis | ATCC | ||
| Shigella boydii | ATCC | ||
| Shigella flexneri | ATCC | ||
| Shigella sonnei | ATCC | ||
| Vibrio alginolyticus | ATCC | ||
| V. cholerae (serotypes include O139, O1, non O1, El Tor biovars) | FDA, ATCC | ||
| V. damsela | FDA | ||
| V. fisheri | Environment | ||
| V. fluvialis | CDC | ||
| V. furnissii | CDC | ||
| V. hollisae | FDA | ||
| V. metschnikovii | ATCC | ||
| V. mimicus | FDA | ||
| V. parahaemolyticus (serotypes include O3:K6, O1:K56, O4:K8, O5:K15, O8, etc.) | ATCC, FDA, CDC, Environment | ||
| V. proteolyticus | FDA | ||
| V. vulnificus | FDA |
Ссылки
- Yeung, P. S., Boor, K. J. Epidemiology, pathogenesis, and prevention of foodborne Vibrio parahaemolyticus infections. Foodborne Pathog. Dis. 1 (2), 74-88 (2004).
- Yeung, P. S. M., Boor, K. J., Faruque, S. M. Epidemiology, molecular biology, and detection of foodborne Vibrio parahaemolyticus infections. Foodborne and Waterborne Bacterial pathogens: Epidemiology, Evolution and Molecular Biology. , 153-184 (2012).
- Centers for Disease Control and Prevention. Vital Signs: Incidence and Trends of Infection with Pathogens Transmitted Commonly Through Food - Foodborne Diseases Active Surveillance Network, 10 U.S. Sites, 1996-2010. Morbidity and Mortality Weekly Report. 10, 1996-2010 (2011).
- . Summary of human Vibrio cases reported to CDC, 2008 Available from: https://stacks.cdc.gov/view/cdc/21591 (2008)
- Scallan, E., et al. Foodborne illness acquired in the United States - major pathogens. Emerg. Infect. Dis. 17 (1), 7-15 (2011).
- Baross, J., Liston, J. Occurrence of Vibrio parahaemolyticus and related hemolytic vibrios in marine environments of Washington State. Appl. Microbiol. 20 (2), 179-186 (1970).
- Baross, J., Liston, J. Isolation of Vibrio parahaemolyticus from the Northwest Pacific. Nature. 217 (5135), 1263-1264 (1968).
- Kueh, C. S., Chan, K. Y. Bacteria in bivalve shellfish with special reference to the oyster. J. Appl. Bacteriol. 59 (1), 41-47 (1985).
- Food and Drug Administration. . Bad Bug Book, Foodborne Pathogenic Microorganisms and Natural Toxins. , (2012).
- Qadri, F., et al. Adaptive and inflammatory immune responses in patients infected with strains of Vibrio parahaemolyticus. J. Infect. Dis. 187 (7), 1085-1096 (2003).
- MacFaddin, J. F. . Media for isolation-cultivation-identification-maintenance of medical bacteria. 1, (1985).
- Bottone, E. J., Robin, T. Vibrio parahaemolyticus: suspicion of presence based on aberrant biochemical and morphological features. J. Clin. Microbiol. 8 (6), 760-763 (1978).
- Lotz, M. J., Tamplin, M. L., Rodrick, G. E. Thiosulfate-citrate-bile salts-sucrose agar and its selectivity for clinical and marine vibrio organisms. Ann. Clin. Lab. Sci. 13 (1), 45-48 (1983).
- Hara-Kudo, Y., Nishina, T., Nakagawa, H., Konuma, H., Hasegawa, J., Kumagai, S. Improved method for detection of Vibrio parahaemolyticus in seafood. Appl. Environ. Microbiol. 67 (12), 5819-5823 (2001).
- Eddabra, R., Piemont, Y., Scheftel, J. M. Evaluation of a new chromogenic medium, chromID Vibrio, for the isolation and presumptive identification of Vibrio choleare and Vibrio parahaemolyticus from human clinical specimens. Eur. J. Clin. Microbiol. Infect. Dis. 30 (6), 733-737 (2011).
- Kodaka, H., Teramura, H., Mizuochi, S., Saito, M., Matsuoka, H. Evaluation of the Compact Dry VP method for screening raw seafood for total Vibrio parahaemolyticus. J. Food. Prot. 72 (1), 169-173 (2009).
- Su, Y. C., Duan, J., Wu, W. H. Selectivity and specificity of a chromogenic medium for detecting Vibrio parahaemolyticus. J. Food Prot. 68 (7), 1454-1456 (2005).
- Bej, A. K., Patterson, D. P., Brasher, C. W., Vickery, M. C., Jones, D. D., Kaysner, C. A. Detection of total and hemolysin-producing Vibrio parahaemolyticus in shellfish using multiplex PCR amplification of tl, tdh and trh. J. Microbiol. Methods. 36 (3), 215-225 (1999).
- Yeung, P. S. M., DePaola, A., Kaysner, C. A., Boor, K. J. A PCR assay for specific detection of the pandemic Vibrio parahaemolyticus O3:K6 clone from shellfish. J. Food Sci. 68 (4), 1459-1466 (2003).
- Yeung, P. S. M., Hayes, M. C., DePaola, A., Kaysner, C. A., Kornstein, L., Boor, K. J. Comparative phenotypic, molecular, and virulence characterization of Vibrio parahaemolyticus O3:K6 isolates. Appl. Environ. Microbiol. 68 (6), 2901-2909 (2002).
- Duan, J., Su, Y. -. C. Comparison of a chromogenic medium with thiosulfate-citrate-bile salts-sucrose agar for detecting Vibrio parahaemolyticus. J. Food Sci. 70, M125-M128 (2005).
- Pinto, A. D., Terio, V., Novello, L., Tantillo, G. Comparison between thiosulphate-citrate-bile salt sucrose (TCBS) agar and CHROMagar Vibrio for isolating Vibrio parahaemolyticus. Food Control. 22 (1), 124-127 (2011).
- Canizalez-Roman, A., Flores-Villaseñor, H., Zazueta-Beltran, J., Muro-Amador, S., Leòn-Sicairos, N. Comparative evaluation of a chromogenic agar medium-PCR protocol with a conventional method for isolation of Vibrio parahaemolyticus strains from environmental and clinical samples. Can J Microbiol. 57 (2), 136-142 (2011).
- Kriem, M. R., et al. Prevalence of Vibrio spp. in raw shrimps (Parapenaeus longirostris) and performance of a chromogenic medium for the isolation of Vibrio strains. Lett Appl Microbiol. 61 (3), 224-230 (2015).
- Food Drug Administration. Statistical guidance on reporting results from studies evaluating diagnostic tests. http://www.fda.gov/RegulatoryInformation/Guidances/ucm071148.htm. , (2007).
- Burd, E. M. Validation of laboratory-developed molecular assays for infectious diseases. Clin Microbiol Rev. 23 (3), 550-576 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены