需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
对于检测到的敏感性和特异性显色琼脂培养基发展
摘要
Detection and isolation of clinically relevant Vibrio species require selective and differential culture media. This study evaluated the ability of a new chromogenic medium to detect and identify V. parahaemolyticus and other related species. The new medium was found to have better sensitivity and specificity than the conventional medium.
摘要
造成弧菌美国食源性感染呈上升趋势。在弧菌属,副溶血性弧菌是负责为广大弧菌机相关感染。因此, 弧菌之间的辨证准确。和检测五 。 副溶血性弧菌是非常重要的,以确保食品供应的安全。虽然分子技术也越来越普遍,这取决于培养的方法仍然经常做,他们被认为在某些情况下的标准方法。因此,一种新的生色琼脂培养基用提供用于隔离和临床相关弧菌的分化更好方法的目标测试。该协议相比,检测V的敏感性,特异性和检测限新的显色培养基和传统媒体之间溶血性弧菌 。 五,各副溶血性弧菌菌株(N = 22),重呈现多样化的血清型和起源的源头中使用。他们以前由食品和药物管理局(FDA)和美国疾病控制和预防中心(CDC)鉴定,并通过TLH -PCR在我们的实验室中进一步验证。在至少四个独立的试验中,这些菌株在35-37℃下接种在显色琼脂和硫代 - 柠檬酸盐 - 胆盐 - 蔗糖(TCBS)琼脂,它是用于培养该种类推荐的培养基,然后孵育24 -96小时。三V.溶血性弧菌菌株(13.6%)未对TCBS最优生长,然而表现出绿色菌落是否有增长。两种菌株(9.1%)没有取得对生色琼脂预期青色菌落。 五,非溶血性弧菌菌株(32)也被测试,以确定显色琼脂的特异性。在这些菌株,31没有增长或者表现出其他菌落形态。 五的平均回收率副溶血性弧菌在chromoge网卡琼脂为〜相对于补充有2%的NaCl的胰蛋白酶大豆琼脂96.4%。最后,新的生色琼脂是检测V.有效介质副溶血性弧菌和其他弧菌区别开来。
引言
作为弧菌属,V的构件副溶血是革兰氏阴性,非孢子形成,弯曲的,棒状细菌。它显示出在液体和半固体环境中的高运动性。 五大部分溶血性弧菌菌株是非致病对人类,但致病亚型在许多国家1,2-引起流行和大流行,因此这种被认为是一个重要的食源性病原体。 弧菌感染在美国的发病率自2000年3已经显示出上升的趋势,其中弧菌属,V.副溶血是报道最频繁的物种引起的疾病,在美国4,5。其他临床相关品种包括V.溶藻弧菌 ,V.创伤弧菌 ,V.霍乱 等疾病的一小部分是由多个物种同时引起的。
副溶血性弧菌是一种自然的我海洋水nhabitant,因此广泛分布于世界各地的海洋水域,包括河口。该品种于1950年发现了以下食物中毒在日本爆发。在美国,该物种首次在海水,沉积物和贝类在普吉特海湾地区6,7隔离。在海洋生物栖息地,如双壳贝类滤食动物,能够携带V.副溶血性弧菌作为他们的自然菌群8的一部分。正因为如此, 五在人类溶血性弧菌感染往往与受污染的海鲜,尤其是生的或未煮熟的贝类的消耗。当开放伤口暴露于海水,导致皮肤发生感染进入一个不太常见的途径。 五大部分副溶血性弧菌菌株不会引起人类疾病,但某些亚型窝藏致病因素,如耐热直接溶血素(TDH)是致病。食源性五,最普遍的症状副溶血性弧菌感染的腹泻和腹痛,接着恶心,呕吐,和发热。也报道头痛和发冷。平均潜伏期为15小时,但致病菌株9的足够量的食用后可高达96小时。这种疾病由两至三天持续。该肠胃炎引起的症状V.副溶血性在很大程度上是自限性的,因此,特殊处理是没有必要的。肠胃炎的轻症病例可口服补液得到有效治疗。更严重的疾病可以通过抗生素如四环素或环丙沙星10进行处理。死亡率为胃肠炎例约2%,但也可以是高达29%,为那些谁开发血流感染或败血症。任何人谁消耗的海鲜或有暴露于海水开放的伤口是V.的风险副溶血性弧菌感染。疾病,危及生命的败血症的更严重的形式,多见于有潜在的医疗合作亚群nditions 11,它包括酒精中毒,肝脏疾病,糖尿病,肾病,恶性肿瘤,和其它条件,导致削弱免疫应答。值得注意的是,这一群人也是在为收缩严重的疾病的风险较高所致V.创伤弧菌 ,它可以以类似于五自然栖息地找到副溶血性弧菌 。
副溶血性弧菌 ,使用硫代-柠檬酸盐-胆盐-蔗糖(TCBS)琼脂作为选择性和鉴别介质常规地分离。富集在碱性蛋白胨水可在TCBS琼脂先隔离。上TCBS推定菌落然后进一步在生化检查和/或分子检测靶向的种特异性基因的存在的阵列进行测试。基于PCR的方法经常被用来确认V的身份通过放大耐热溶血毒素基因,TLH 12 溶血性弧菌 。
不管通道的确认方法音色,它有隔离和分化V.的有效媒介是很重要的从副溶血性摆在首位的其他海洋弧菌。 TCBS已经经常被用来根据自己的能力发酵蔗糖12 弧菌属内分化的物种。阳性发酵反应伴随pH指示剂溴百里酚蓝的颜色变化。V.副溶血性弧菌菌落是相当独特的TCBS上,展出蓝绿色。然而,这种介质不能轻易区分V.溶藻弧菌和V.霍乱弧菌,蔗糖发酵变形杆菌可能会产生黄色菌落类似V.霍乱弧菌或V.溶藻弧菌 13。上TCBS, 五初始隔离副溶血性弧菌也可能误认为嗜水,邻单胞shigelloides和假单孢菌属14。迟发蔗糖FERM株entation可以与其它蔗糖非发酵弧菌 13,其包括五相混淆副溶血性弧菌 。 TCBS被发现是对大肠杆菌 , 腐败假单胞菌等等不敏感。其他几个品种产量绿它们可能与五混淆灰色菌落副溶血性弧菌或V.创伤弧菌 15。其结果是,希望开发替代培养基具有更好的灵敏度和特异性朝向检测和分离V.副溶血性弧菌等密切相关的物种。
几个媒体替代最近已开发的。除了包含选择剂的,最掺入生色底物根据它们的差分酶活性来区分物种。例如,吲哚酚-β葡糖苷和吲哚酚β-D-半乳糖苷已被用作显色底物来区分V.第从这些五 ,溶血殖民地(这似乎蓝绿色) 霍乱 (紫色),由于其差的能力,以产生β葡糖苷酶和β半乳糖苷酶16。通过几组开发的显色培养基的不同配方进行了评估,报告履行同等或高于TCBS 17,18,19更好。使用显色介质的一个优点是,周围介质的着色最小从而促进特定菌落的分离。在这项研究中,我们评估了新制定的显色介质的检测和隔离五的能力霍乱弧菌 ,V.副溶血性弧菌和V.创伤弧菌 ;特别注重其分化能力V.副溶血来自其它物种。
研究方案
1.媒体和微生物菌种培养
注:在所有实验使用无菌技术。使用无菌材料。消毒使用前所有容器,工具和试剂。高压灭菌所有废旧物资处置前,因为它们被认为是生物危害。高压釜的温度和时间的组合是≥121℃的点¯x≥15分钟所有的以下过程。
- 让〜1-L中的胰蛋白酶大豆琼脂(TSA)中,首先在含有磁性搅拌棒的2-L的锥形瓶中加1升去离子水。使用的烧瓶中,比最终体积大至少两次。添加30克胰蛋白酶大豆肉汤粉末和20g琼脂颗粒到烧瓶中。
注:使用2%琼脂,而不是1.5%,限制某些弧菌的蜂拥。- 通过接通搅拌器充分混合。在搅拌的同时,打开加热煮沸混合物。一旦除去来自加热器的烧瓶作为混合物开始沸腾。轻轻盖次Ë量瓶中,用锡箔。大盘箔釜前将其固定到烧瓶中。
- 为了使胰蛋白酶大豆肉汤(TSB)中,从配方省略琼脂在步骤1.1。
注意:可以用,而不是锥形瓶中瓶。 - 使补充有2%氯化钠或氯化钠(旅游业附属帐户)胰蛋白酶大豆琼脂,在该混合物搅拌和加热之前加入20克氯化钠。使补充有2%的NaCl(TSB)的胰蛋白酶大豆肉汤,省略琼脂,在该混合物搅拌和加热之前加入20克氯化钠。
- 使脑心脏浸液(BHI)琼脂,暂停37克BHI粉末并在1L的精制水琼脂15克颗粒。热火频繁搅拌溶解粉末。高压灭菌。省略了琼脂,使BHI肉汤。
- 使TCBS琼脂,暂停89克的TCBS粉末在1L纯净水。热火频繁搅拌,煮1分钟,以完全溶解粉末。不要高压。
- 对于所有的琼脂培养基,冷却热琼脂45-50℃下在水浴中。安排五至六个板块栈空培养皿。从堆栈的底部开始,倒入熔融的琼脂到每个培养皿达到约半满。浇筑后关闭培养皿的盖子。允许琼脂通过使板在室温下放置固化。
- 使用第二天或之后12小时的琼脂平板上。存放不用的板在冰箱中长达两周。在使用前,从冰箱取出板并在室温下平衡他们至少15分钟。
注意:一升琼脂使得〜45琼脂平板上。允许琼脂平板,以充分干燥制备的天,然后将它们平衡至室温冷藏后,有效地降低了集落的蔓延。
- 使用第二天或之后12小时的琼脂平板上。存放不用的板在冰箱中长达两周。在使用前,从冰箱取出板并在室温下平衡他们至少15分钟。
- 获得的巧克力和生色琼脂平板和每次实验前在室温下平衡它们。
- 继代表1中每隔几大显示的所有54微生物菌种YS。
- 使用无菌接种环从冷冻的储存或前一批非选择性培养基,如BHI,TSB / TSA或巧克力琼脂转移的文化。成长嗜盐弧菌 。在TSB的/旅游业附属帐户。
- 要检查文化的纯洁性,连胜将允许分离的菌落的观察模式的所有菌株。例如,使用三相条纹图案大量细菌稀释至量较小,最终产生孤立的殖民地。
- 孵育在35-37℃下将板倒置长达48小时。对于弯曲杆菌,培养管或板 在含有气体袋一个闭合盖子罐以产生微需氧环境。观察培养后菌落形态。纯培养应该产生表现出类似的菌落形态菌落。
注:孵育所有平板倒置,以防止形成在盖的下侧,冷凝的水滴掉落在栏onies。
2种测定PCR
- 开展TLH-PCR证实V的身份副溶血性弧菌菌株。使用的引物TLH -F(5'AAA GCG GAT TAT GCA GAA GCA CTG 3')和TLH -R(5'GCT ACT TTC TAG CAT TTT CTC TGC 3')扩增耐热溶血素基因20的450-bp的片段。
- 使用无菌接种环转移的每个V的几个孤立的殖民地副溶血性弧菌菌株从旅游业附属帐户到5ml TSB的的。孵育在35-37℃进行16-24小时。
- 离心培养物以14,000 xg离心1分钟。除去上清液,用磷酸盐缓冲盐水(PBS)洗沉淀两次。煮悬浮液3分钟,得到细胞溶解产物。
注:V.副溶血容易被裂解。因此裂解试剂不是必需的。另外,也可以直接使用比特菌落作为模板。 - 在25微升反应v执行PCRolume。制备含有1x PCR缓冲液中的终浓度,1.5毫氯化镁 ,100μM的每种dNTP,每种引物为1μM,1U的Taq聚合酶和1μl细胞裂解物的反应混合物。预温育在94℃进行5分钟,运行94℃35个扩增循环,30秒,58℃30秒和72℃60秒21后。
- 在1.5%琼脂糖凝胶5微升的扩增子的负载等分试样。接通电源,开始电泳。可视化的扩增子在紫外光照射下的溴化乙锭染色后在存在或不存在。
3.在增长选择性和差异媒体
- 实验前二至四天,条纹在非选择性培养基(旅游业附属帐户,BHI或巧克力琼脂) 表1菌落分离示出的所有的微生物菌株。在35-37℃下孵育板48小时。通过培养后观察菌落形态检查文化的纯洁性。纯培养应该产生表现出类似的菌落形态菌落。
- 从步骤3.1传输几个孤立的殖民地到5毫升肉汤。在35-37℃培养试管16-24小时。
注意:使用年轻人的殖民地,这是不到四天的时候,在所有的实验准备过夜培养。 - 连胜对菌落分离选择性和差异介质(TCBS和显色琼脂)过夜培养的菌环。在35-37°C至96小时孵育板。
- 通过检查两个上盘的文化密度和隔离殖民地的尺寸记录所有菌株的整体增长。记录下的环境和/或紫外光菌落的颜色。注意隔离殖民地的其他特性,如高度,保证金和形式。
4.恢复试验
- 五,选择一个代表性的子集副溶血性弧菌菌株包括不同血清型和孤立的起源(N = 14) 22。从接种板块年轻文化到5毫升TSB的的。孵育在35-37℃下在管16-24小时。
- 如下所述进行过夜培养的标准平板计数法。
- 涡混合过夜培养好。由100微升过夜培养物转移到含有900微升的PBS的管进行10倍或10 -1稀释。涡旋拌匀。
- 使用新的枪头从10 -1稀释管转移100微升含有900微升PBS另一支管。涡旋拌匀。这构成10 -2的稀释。重复过程依次获得10 -7稀释。
- 使用10 -4〜10 -7稀释管,板的发色,TCBS和旅游业附属帐户琼脂平板上每100微升。
注:在板的稀释因子(DF)分别变成10 -5至10 -8。 - 均匀分布等分在T他琼脂表面。
注:它是精细使用每株相同吊具的相同培养基上,只要在最稀释等分试样首先传播( 即从10 -8至10 -5)。不要使用不同的介质相同吊具。 - 在35-37°C至96小时孵育板。指望平板菌落。忽略板轴承菌落是不计其数(TNTC)或小于25计算CFU / ml为根据以下内容:
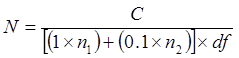
哪里
N = 表示在未稀释的管细胞的数量,表示为CFU / ml或CFU / g的
C =而承受25-300菌落计数平板上菌落总数
N + 1 =式计算菌落从下DF板(S)的数量
N 2 =,其中计数菌落从随后10倍稀释板(多个)的数量
ðF =较低的稀释倍数( 即 ,多集中稀释)
- 比较CFU / ml的不同媒体间。使用CFU /毫升的旅游业附属帐户为100%,计算五回收% 副溶血性弧菌生长在显色和TCBS琼脂。
5.竞争测定法
- 选择表现出对生色和TCBS琼脂不同菌落形态菌株的子集。
注意:此方式,将有可能进行计数菌落来自五只有副溶血性弧菌 ,尽管其他物种的种菌的存在。- 选择一个V.副溶血性弧菌菌株,分别产生于TCBS和显色琼脂预期的绿松石和青色的殖民地。
- 选择一个非V.副溶血并且不在任这些介质的生长,或表现出不同的菌落颜色的非弧菌 。
注:例如,V. metschnikovii增长极弱ØñTCBS并没有生长在琼脂色, 宋内氏痢疾不是从天上TCBS但产生的显色琼脂品红殖民地。
- 上述菌株的选择后,准备用生长在非选择性培养基分离的菌落过夜肉汤培养物。
- 让五 ,过夜培养副溶血性弧菌和V.通过转移一些孤立的菌落从旅游业附属帐户到5ml TSB的的metschnikovii。孵育在35-37℃进行16-24小时。
- 通过将来自BHI琼脂几个孤立的殖民地到5ml BHI肉汤让宋内氏痢疾的过夜培养。孵育在35-37℃进行16-24小时。
- 每一株,执行类似于步骤4.2.1和4.2.2系列稀释。上旅游业附属帐户或BHI板适当稀释,以确定CFU /毫升过夜培养物,使用在步骤4.2.5中所示的方程。
注意:通常情况下,从10 -5至10 -7稀释100μl的管适用于大多数文化。使用CFU / ml的值来计算回用于下一步细胞的确切数额。计算出的CFU / ml的值,温育后获得的,尽管以下的步骤与步骤5.3在同一日期进行。 - 利用在步骤5.2和5.3过夜培养和稀释管,混合不同量的五 , 副溶血性弧菌菌株和非五副溶血性弧菌物种。例如,混合500微升五的10-5稀释管副溶血性弧菌 500微升V的过夜培养metschnikovii。
注:这种混合物模拟高菌群的背景。为了模拟低菌群的背景下,每一个10-5稀释管从两个物种的混合500微升。 - 铺在生色,TCBS和旅游业附属帐户琼脂平板100微升混合物的每个。
- 在35-37℃孵育之后长达96小时,算上五菌落parahaemolyticuS和非V.根据他们在成长和菌落形态上显色和TCBS琼脂差异溶血性弧菌物种。
注意:例如,如果非五副溶血性弧菌物种不生长在显色和TCBS琼脂,所有的殖民地会五 , 副溶血性弧菌 。如果非V.副溶血性弧菌生长的物种都介质,只能在TCBS和青色殖民地殖民地绿松石色上琼脂将是五 , 副溶血性弧菌 。非V.副溶血物种可以或可以不表现出相似的集落形态给V.副溶血性弧菌对旅游业附属帐户。- 如果非V.副溶血性弧菌物种同样增长到V.此非选择性培养基上溶血性弧菌 ,除以二的菌落数,以获得五号码副溶血性弧菌而已。与来自步骤5.3获得的预期计数比较实际的菌落数。
6. Eff为牡蛎匀浆学分
- 从称量≥12贝类≥50摹牡蛎肉包括肉类和酒类。
- PBS的等量添加到牡蛎肉和酒。混合在高速混合物90秒。这构成2 -1稀释牡蛎匀浆。
- 100克2 -1稀释牡蛎匀浆添加至400g的PBS。用刻度来测量重量,而不是体积。混合在高速混合物1分钟。高压灭菌牡蛎匀浆。
注意:这将是用于扣球牡蛎匀浆。
- 重复牡蛎匀浆的存在下恢复测定(步骤4)。
- 在500克牡蛎匀浆液冷却后,加入100微升五 。 副溶血性弧菌在临时附属机构发展到它过夜培养。 五,确定的实际金额副溶血弧菌细胞接种通过实施步骤4.2中所述的标准平板计数程序。
- 众议员吃牡蛎匀浆存在竞争法(第五步)。
- 在500克牡蛎匀浆液冷却后,加入100微升每五的过夜培养副溶血性弧菌和非V.副溶血性弧菌它。确定的细菌的实际量 细胞接种通过进行标准平板计数程序步骤4.2节
- 混合细菌细胞与牡蛎匀浆以及通过使用均化器。
注:在混合后,将含有有意添加的细胞被称为牡蛎匀浆尖刺牡蛎匀浆。 - 使加标牡蛎匀浆稀释至按照步骤4.2.2中描述的方法获得10 -1至10 -3稀释管中。传播各100μl稀释到发色,TCBS和旅游业附属帐户琼脂。在35-37°C至96小时孵育板。
- 在比较和显色培养基TCBS实际菌落数与前存在意外菌落总数从步骤6.2.1和6.3.1推断。
注意:例如,如果V的管副溶血过夜培养物包含10 8 CFU /毫升,100微升的接种物是指10 7个细胞被添加到牡蛎匀浆500克,得到5×10 4个细胞/ g以下。稀释和电镀后,具有自由度的板= 10 -2应产生500个菌落;而其自由度 = 10-3应产生50个菌落。这些是期望的菌落计数。
结果
在这项研究中,54的微生物菌株被组装,其中包括五内22株副溶血弧菌种,其他19 弧菌和13非弧菌种( 表1)。 五大部分副溶血性弧菌菌株无论是从FDA,CDC或其他国家卫生部门接收。他们代表不同的血清型和孤立的来源。这些菌株以前由监管机构标识。我们进一步确认了这些五的身份通过进行TLH-PCR 21,22
讨论
本研究着重于文化传媒开发和评估。按照惯例,TCBS是选择性和鉴别培养基用于分离和检测V.副溶血性弧菌,霍乱弧菌和V.创伤弧菌 12。然而,限制已报道这个介质,例如无法区分V.从霍乱 弧菌等品种。蔗糖和pH指示剂是TCBS的分化剂。因此,产酸由蔗糖发酵导致介质的颜色变化。介质的着色是TCBS的一个缺点,因为它可能会掩盖菌落形态的观察。新开发的显?...
披露声明
Some media were generously provided by Hardy Diagnostics, Santa Maria, CA. Thorsen conducted this study while a student at California Polytechnic State University. He is currently an employee of Hardy Diagnostics.
致谢
我们感谢M. Channey,E.洲和K.托马斯为他们的项目援助。工程物资部分被加州州立理工大学资助。
材料
| Name | Company | Catalog Number | Comments |
| Reagent/Equipment | |||
| Agar | Fisher Scientific | DF0140-15-4 | may use other brands |
| Autoclave | Any | ||
| BHI powder | Fisher Scientific | DF0418-17-7 | may use other brands |
| Blender | Any | to blend oyster meat | |
| CampyGen gas generator | Hardy Diagnostics | CN035A | to provide a microaerophilic atmosphere; may use other brands |
| Chocolate agar plates | Hardy Diagnostics | E14 | may use other brands |
| Common PCR reagents (dNTPs, MgCl2, Taq Polymerase) | Any | or use PCR beads (Fisher Sci 46-001-014) | |
| Culture tubes | Fisher Scientific | S50712 | may use other brands |
| Eppendorf tubes | Fisher Scientific | S348903 | may use other brands |
| Gel doc | Any | ||
| HardyChrom Vibrio agar plates | Hardy Diagnostics | G319 | This study evaluates this medium |
| Incubator | Any | ||
| Inoculating loops | Fisher Scientific | 22-363-606 | 10 microliter-size was used in this study |
| NaCl | Fisher Scientific | BP358-212 | may use other brands |
| Oysters | Any | ||
| PBS | Fisher Scientific | R23701 | may use other brands |
| Petri dish | Fisher Scientific | FB0875713 | may use other brands |
| Pipette and tips | Any | Sterilized tips | |
| Primers for tlh | IDT DNA | ||
| Scale | Any | ||
| Spreader | Fisher Scientific | 08-100-11 | Beads may be used instead |
| Stomacher blender | Stomacher | 400 | Samples were homogenized at 200 rpm for 30 sec. Other homogenizer can be used. |
| Sterile filter bags for blenders | Fisher Scientific | 01-812-5 | |
| TCBS powder | Hardy Diagnostics | 265020 | This study evaluates this medium |
| Thermocycler | Any | ||
| TSB powder | Fisher Scientific | DF0370-07-5 | may use other brands |
| UV viewing cabinet | Any | Emit long-wave UV light | |
| Water bath | Any | | |
| Name | Sources | Catalog Number | Comments |
| Bacterial species and strains | |||
| Aeromonas hydrophila | ATCC | ||
| Candida albicans | ATCC | ||
| Campylobacter jejuni | ATCC | ||
| Escherichia coli | ATCC | ||
| Proteus mirabilis | ATCC | ||
| Pseudomonas aeruginosa | ATCC | ||
| Staphylococcus aureus | ATCC | ||
| Salmonella Choleraesuis | ATCC | ||
| Shigella boydii | ATCC | ||
| Shigella flexneri | ATCC | ||
| Shigella sonnei | ATCC | ||
| Vibrio alginolyticus | ATCC | ||
| V. cholerae (serotypes include O139, O1, non O1, El Tor biovars) | FDA, ATCC | ||
| V. damsela | FDA | ||
| V. fisheri | Environment | ||
| V. fluvialis | CDC | ||
| V. furnissii | CDC | ||
| V. hollisae | FDA | ||
| V. metschnikovii | ATCC | ||
| V. mimicus | FDA | ||
| V. parahaemolyticus (serotypes include O3:K6, O1:K56, O4:K8, O5:K15, O8, etc.) | ATCC, FDA, CDC, Environment | ||
| V. proteolyticus | FDA | ||
| V. vulnificus | FDA |
参考文献
- Yeung, P. S., Boor, K. J. Epidemiology, pathogenesis, and prevention of foodborne Vibrio parahaemolyticus infections. Foodborne Pathog. Dis. 1 (2), 74-88 (2004).
- Yeung, P. S. M., Boor, K. J., Faruque, S. M. Epidemiology, molecular biology, and detection of foodborne Vibrio parahaemolyticus infections. Foodborne and Waterborne Bacterial pathogens: Epidemiology, Evolution and Molecular Biology. , 153-184 (2012).
- Centers for Disease Control and Prevention. Vital Signs: Incidence and Trends of Infection with Pathogens Transmitted Commonly Through Food - Foodborne Diseases Active Surveillance Network, 10 U.S. Sites, 1996-2010. Morbidity and Mortality Weekly Report. 10, 1996-2010 (2011).
- . Summary of human Vibrio cases reported to CDC, 2008 Available from: https://stacks.cdc.gov/view/cdc/21591 (2008)
- Scallan, E., et al. Foodborne illness acquired in the United States - major pathogens. Emerg. Infect. Dis. 17 (1), 7-15 (2011).
- Baross, J., Liston, J. Occurrence of Vibrio parahaemolyticus and related hemolytic vibrios in marine environments of Washington State. Appl. Microbiol. 20 (2), 179-186 (1970).
- Baross, J., Liston, J. Isolation of Vibrio parahaemolyticus from the Northwest Pacific. Nature. 217 (5135), 1263-1264 (1968).
- Kueh, C. S., Chan, K. Y. Bacteria in bivalve shellfish with special reference to the oyster. J. Appl. Bacteriol. 59 (1), 41-47 (1985).
- Food and Drug Administration. . Bad Bug Book, Foodborne Pathogenic Microorganisms and Natural Toxins. , (2012).
- Qadri, F., et al. Adaptive and inflammatory immune responses in patients infected with strains of Vibrio parahaemolyticus. J. Infect. Dis. 187 (7), 1085-1096 (2003).
- MacFaddin, J. F. . Media for isolation-cultivation-identification-maintenance of medical bacteria. 1, (1985).
- Bottone, E. J., Robin, T. Vibrio parahaemolyticus: suspicion of presence based on aberrant biochemical and morphological features. J. Clin. Microbiol. 8 (6), 760-763 (1978).
- Lotz, M. J., Tamplin, M. L., Rodrick, G. E. Thiosulfate-citrate-bile salts-sucrose agar and its selectivity for clinical and marine vibrio organisms. Ann. Clin. Lab. Sci. 13 (1), 45-48 (1983).
- Hara-Kudo, Y., Nishina, T., Nakagawa, H., Konuma, H., Hasegawa, J., Kumagai, S. Improved method for detection of Vibrio parahaemolyticus in seafood. Appl. Environ. Microbiol. 67 (12), 5819-5823 (2001).
- Eddabra, R., Piemont, Y., Scheftel, J. M. Evaluation of a new chromogenic medium, chromID Vibrio, for the isolation and presumptive identification of Vibrio choleare and Vibrio parahaemolyticus from human clinical specimens. Eur. J. Clin. Microbiol. Infect. Dis. 30 (6), 733-737 (2011).
- Kodaka, H., Teramura, H., Mizuochi, S., Saito, M., Matsuoka, H. Evaluation of the Compact Dry VP method for screening raw seafood for total Vibrio parahaemolyticus. J. Food. Prot. 72 (1), 169-173 (2009).
- Su, Y. C., Duan, J., Wu, W. H. Selectivity and specificity of a chromogenic medium for detecting Vibrio parahaemolyticus. J. Food Prot. 68 (7), 1454-1456 (2005).
- Bej, A. K., Patterson, D. P., Brasher, C. W., Vickery, M. C., Jones, D. D., Kaysner, C. A. Detection of total and hemolysin-producing Vibrio parahaemolyticus in shellfish using multiplex PCR amplification of tl, tdh and trh. J. Microbiol. Methods. 36 (3), 215-225 (1999).
- Yeung, P. S. M., DePaola, A., Kaysner, C. A., Boor, K. J. A PCR assay for specific detection of the pandemic Vibrio parahaemolyticus O3:K6 clone from shellfish. J. Food Sci. 68 (4), 1459-1466 (2003).
- Yeung, P. S. M., Hayes, M. C., DePaola, A., Kaysner, C. A., Kornstein, L., Boor, K. J. Comparative phenotypic, molecular, and virulence characterization of Vibrio parahaemolyticus O3:K6 isolates. Appl. Environ. Microbiol. 68 (6), 2901-2909 (2002).
- Duan, J., Su, Y. -. C. Comparison of a chromogenic medium with thiosulfate-citrate-bile salts-sucrose agar for detecting Vibrio parahaemolyticus. J. Food Sci. 70, M125-M128 (2005).
- Pinto, A. D., Terio, V., Novello, L., Tantillo, G. Comparison between thiosulphate-citrate-bile salt sucrose (TCBS) agar and CHROMagar Vibrio for isolating Vibrio parahaemolyticus. Food Control. 22 (1), 124-127 (2011).
- Canizalez-Roman, A., Flores-Villaseñor, H., Zazueta-Beltran, J., Muro-Amador, S., Leòn-Sicairos, N. Comparative evaluation of a chromogenic agar medium-PCR protocol with a conventional method for isolation of Vibrio parahaemolyticus strains from environmental and clinical samples. Can J Microbiol. 57 (2), 136-142 (2011).
- Kriem, M. R., et al. Prevalence of Vibrio spp. in raw shrimps (Parapenaeus longirostris) and performance of a chromogenic medium for the isolation of Vibrio strains. Lett Appl Microbiol. 61 (3), 224-230 (2015).
- Food Drug Administration. Statistical guidance on reporting results from studies evaluating diagnostic tests. http://www.fda.gov/RegulatoryInformation/Guidances/ucm071148.htm. , (2007).
- Burd, E. M. Validation of laboratory-developed molecular assays for infectious diseases. Clin Microbiol Rev. 23 (3), 550-576 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。