このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
の検出のためのより高感度で特異的な発色性寒天培地の開発
要約
Detection and isolation of clinically relevant Vibrio species require selective and differential culture media. This study evaluated the ability of a new chromogenic medium to detect and identify V. parahaemolyticus and other related species. The new medium was found to have better sensitivity and specificity than the conventional medium.
要約
ビブリオ種によって引き起こさ米国における食品媒介感染症は増加傾向を示しています。 ビブリオ属では、腸炎ビブリオは ビブリオ -関連感染症の大部分を担当しています。したがって、 ビブリオ属の中で正確な分化。そして、Vの検出腸炎は、私たちの食糧供給の安全性を確保することが非常に重要です。分子技術がますます一般的ですが、文化-によって方法はまだ日常的に行われており、それらは特定の状況において標準的な方法を考えています。したがって、新規の発色性寒天培地は、臨床的に関連するビブリオ属の単離および分化のためのより良い方法を提供することを目標に試験しました。プロトコルは、Vの検出感度、特異性および検出限界を比較しました新しい発色性の媒体と従来の媒体との間腸炎 。様々なV.ビブリオ菌株 (N = 22)を再提示多様な血清型および起源のソースを使用しました。彼らは以前に食品医薬品局(FDA)と疾病管理予防センター(CDC)によって識別され、さらにTLH -PCRによって我々の研究室で確認されました。少なくとも4つの別々の試験では、これらの株は24のために35から37℃でインキュベートし、発色性寒天と、この種を培養するための推奨される媒体であるチオ硫酸塩、クエン酸塩 - 胆汁塩 - スクロース(TCBS)寒天、上に接種しました-96時間。三V.腸炎株 (13.6%)は、成長があった場合、それにもかかわらず、緑のコロニーを示し、TCBSに最適に成長しませんでした。二つの株(9.1%)は、発色性寒天に期待シアンコロニーは得られませんでした。非V.ビブリオ菌株 (N = 32)も、発色性寒天の特異性を決定するために試験しました。これらの株のうち、31が成長または他のコロニーの形態を呈していませんでした。 V.の平均回収chromoge上の腸炎NIC寒天を2%のNaClを補充したトリプシン大豆寒天に比べて〜96.4パーセントでした。結論として、新たな発色性寒天はVを検出するための効果的な媒体であります他のビブリオ菌と区別するために腸炎と。
概要
ビブリオ属 、Vの一員として腸炎は、グラム陰性、非胞子形成、湾曲した棒状の細菌です。それは、液体および半固体の環境の両方で高い運動性を示します。ほとんどのV.ビブリオ株はヒトに非病原性である、まだ病原性サブタイプが故に、この種は多くの国1,2における重要な食品媒介病原体であると考えられ、流行やパンデミックを引き起こしました。米国のビブリオ感染症の発生率は、2000年3以降上昇傾向を示している。 ビブリオ属のうち、V.腸炎は、米国4,5に病気を引き起こす最も頻繁に報告さ種です。他の臨床的に関連する種は、Vを含みますalginolyticus、V.バルニフィカス 、V.コレラ などの病気の小さな割合は、同時に複数の種によって引き起こされます。
腸炎ビブリオは自然な私です海洋水のnhabitantので、広く河口を含む世界中の海域に分布します。種は、日本での食中毒の発生、次の1950年に発見されました。米国では、種はまず、海水、堆積物、およびピュージェットサウンド地域6,7貝で単離しました。このような二枚貝などの海洋生息地、で濾過摂食は、Vを抱くことができます彼らの自然な細菌叢8の一環として、 腸炎 。このような、Vとしてヒトにおける腸炎感染症は、多くの場合、汚染された魚介類の消費量、特に生や加熱が不十分な貝にリンクされています。開いた傷は皮膚感染につながる、海水にさらされたとき、エントリの少ない一般的な経路が発生します。ほとんどのV.ビブリオ株は、ヒトの疾患を引き起こすことはありませんが、まだそのような耐熱性溶血毒(TDH)などの病原性因子を保有する特定のサブタイプが病原性です。食品媒介Vの最も一般的な症状ビブリオ感染症であります下痢や腹痛、吐き気、嘔吐、発熱が続きます。頭痛と悪寒も報告されています。中央値潜伏期間は15時間ですが、病原性株9の十分な量を消費した後に、最大96時間にすることができます。病気は、2〜3日から続きます。 V.によって引き起こされる胃腸炎の症状腸炎は、主に自己限定的であり、したがって、特別な治療は必要ありません。胃腸炎の軽度の例は、効果的に経口補水によって治療することができます。もっと深刻な病気は、テトラサイクリンまたはシプロフロキサシン10のような抗生物質によって治療することができます。死亡率は、胃腸炎の場合の約2%であるが、血流感染または敗血症を発症する人のための29%と高くすることができます。魚介類を消費するか、開いた傷口海水にさらされた者は、Vの危険性がありますビブリオ感染症。病気のより深刻な形、生命を脅かす敗血症は、基礎疾患共同で亜集団においてより一般的ですアルコール依存症、肝臓病、糖尿病、腎疾患、悪性腫瘍、および弱まった免疫応答を引き起こす他の条件を含むnditions 11、。特に、個人のこのグループはV.によって引き起こされる深刻な病気を収縮させる高いリスクもありますV.に似た自然の生息地で見つけることができますバルニフィカス 、 腸炎 。
腸炎ビブリオは、日常的に選択し、差動媒体としてチオ硫酸塩、クエン酸塩-胆汁塩-スクロース(TCBS)寒天を用いて単離します。アルカリペプトン水に濃縮はTCBS寒天上分離に先行してもよいです。 TCBSの推定コロニーは、その後さらに、種特異的遺伝子の存在を標的生化学的試験及び/又は分子アッセイのアレイで試験します。 PCRベースの方法は、多くの場合、Vの身元を確認するために使用されています12 TLH、熱不安定性溶血素遺伝子を増幅することにより腸炎 。
関係なくCHの確認方法のOICEは、Vを分離し、区別するために効果的な媒体を有することが重要です最初の場所で他の海洋ビブリオ菌から腸炎 。 TCBSは、日常的にショ糖12を発酵する能力に応じたビブリオ属内の種を区別するために使用されています。正の発酵反応は、pH指示薬ブロモチモールブルーの色の変化を伴う。V.腸炎コロニーは緑色に青呈する、TCBSにかなり独特です。しかし、この媒体は、簡単にVを区別することはできませんalginolyticusとV.コレラ菌。ショ糖発酵プロテウス種はV.に似た黄色のコロニーを生成することができますコレラ菌やV. 13 alginolyticus。 TCBS、V.上の最初の単離に腸炎はまた、 アエロモナス細菌、プレシオモナスのshigelloides、およびシュードモナス属 14と誤認することができます。遅延スクロースFERMで株entationはVを含むビブリオ 13非発酵他のショ糖と混同することができます腸炎 。 TCBSはとりわけ、 大腸菌 、 シュードモナスputrefaciensに対して敏感ではないことが判明しました。いくつかの他の種は、潜在的にV.と混同されている灰色のコロニーに緑得腸炎またはV.バルニフィカス 15。その結果、検出およびVの単離に向けて良好な感度と特異性を有する代替培地を開発することが望ましいです。 腸炎や他の近縁種。
いくつかのメディアの選択肢が最近開発されてきました。選択剤の含有に加えて、最もその差の酵素活性に基づいて種を区別するために発色基質を組み込みます。例えば、インドキシル-βグルコシド及びインドキシル-βガラクトシドはVを区別するために発色性基質として使用されていますパラV.のものとは(青緑色表示されます)溶血性コロニーβグルコシダーゼおよびβガラクトシダーゼ16を生成するために、それらの差動能力にコレラ菌 (紫)。いくつかのグループによって開発された発色性寒天の異なる製剤が評価されたとの同等またはTCBS 17,18,19の値より実行することが報告されました。発色性媒体を使用する利点は、周囲の媒体の着色は、それによって特定のコロニーの単離を容易に最小であることです。本研究では、Vを検出し、単離するため、新たに策定発色性媒体の能力を評価しましたコレラ菌 、V.腸炎 、およびV.バルニフィカス ; V.を区別する能力に特別な焦点を当てて他の種からの腸炎 。
プロトコル
1.メディアおよび微生物株の培養
注:すべての実験において無菌技術を使用してください。滅菌材料を使用してください。使用前にすべてのコンテナ、ツールおよび試薬を滅菌します。彼らはバイオハザードと考えられているので、処分前に、すべての廃棄物をオートクレーブ。オートクレーブ温度と時間の組み合わせは、以下の手順のすべてについて≥121°Cのx≥15分です。
- 〜1-Lトリプシン大豆寒天(TSA)にするには、最初の磁気撹拌棒を含む2-L三角フラスコに、脱イオン水1 Lを追加します。最終体積よりも少なくとも2倍大きいフラスコを使用してください。トリプシン大豆ブロス粉末30gとをフラスコに顆粒寒天20グラムを追加します。
注:一部のビブリオ属の遊走を制限する代わりに、1.5%の2%寒天を使用してください。- 攪拌機をオンにすることによって完全に混合。撹拌しながら、混合物を沸騰させるために熱をオンにします。混合物が沸騰し始めるとすぐにヒーターからフラスコを取り外します。ゆるく番目をカバースズ箔付きの電子フラスコ。オートクレーブの前にフラスコにそれを確保するために箔をテープで固定します。
- トリプシン大豆ブロス(TSB)を作成するには、ステップ1.1でレシピから寒天を省略します。
注:代わりに三角フラスコのボトルを使用することができます。 - 2%の塩化ナトリウムまたは塩化ナトリウム(のTSA)を補充したトリプシン大豆寒天を作るために、前に攪拌および加熱し、混合物中のNaClの20グラムを追加します。 2%のNaCl(TSBの)を補充したトリプシン大豆ブロスを作るために、前に攪拌および加熱し、混合物中のNaClの20グラムを追加し、寒天を省略します。
- ブレインハートインフュージョン(BHI)寒天にするために、BHI粉末と純水1Lに15gの寒天顆粒37gのを中断する。粉末を溶解するために、頻繁に攪拌しながら加熱します。オートクレーブ。 BHIブロスを作るために寒天を省略します。
- TCBS寒天を作るために、精製水1LにTCBS粉末89グラムを一時停止します。 1分間、頻繁に攪拌し、沸騰と熱が完全に粉末を溶解させました。オートクレーブしないでください。
- すべての寒天培地については、45-5に熱い寒天を冷却水浴中で0℃。 5〜6プレートのスタック内の空のペトリ皿を配置します。スタックの底から出発し、約半分完全に到達するために、各ペトリ皿内に溶融寒天を注ぎます。注いだ後ペトリ皿のふたを閉じます。寒天プレートは室温で座ってできるようにすることで固化することができます。
- 翌日寒天プレートを使用するか、または12時間後。 2週間まで冷蔵庫で未使用のプレートを保管してください。使用前に、冷蔵庫からプレートを除去し、少なくとも15分間室温でそれらを平衡化。
注:1リットル寒天は〜45寒天プレートになります。寒天プレートは準備の日に十分に乾燥することができ、かつ効果的にコロニーの広がりを減らすために冷蔵した後、室温にそれらを平衡化。
- 翌日寒天プレートを使用するか、または12時間後。 2週間まで冷蔵庫で未使用のプレートを保管してください。使用前に、冷蔵庫からプレートを除去し、少なくとも15分間室温でそれらを平衡化。
- チョコレートと発色性寒天プレートを取得し、各実験の前に、室温でそれらを平衡化。
- 継代ごとに数DA を表1に示すすべての54の微生物株YS。
- このようなBHI、TSB / TSAまたはチョコレート寒天などの非選択培地に凍結保存または以前のバッチからの文化を転送するために、無菌の接種ループを使用してください。好塩性ビブリオ属菌を成長させます。 TSBの/のTSAに。
- 文化の純度を確認するには、ストリーク単離コロニーの観察を可能にするパターンですべての株。例えば、最終的に単離されたコロニーを得、少量に細菌を大量に希釈する三相ストリーキングパターンを使用します。
- 最大48時間、35-37℃でプレートを逆さまをインキュベートします。 カンピロバクター属菌の場合は、チューブまたはプレートをインキュベート ガス袋を含有する密閉蓋ジャーに微好気性環境を生成します。インキュベーション後にコロニー形態を観察します。純粋培養は、同様のコロニー形態を示すコロニーを得られるはずです。
注:COLに落ちるから蓋の裏面に形成された凝縮水滴を防ぐために、すべてのプレートをインキュベート逆さまonies。
PCRによる2種の決意
- V.の身元を確認するために、TLH -PCRを実施腸炎株 。使用したプライマーは、-F(5 'AAA GCG GAT TAT GCA GAA GCA CTG 3')およびTLH -R(5 'GCT ACT TTCタグCAT TTT CTC TGC 3')は熱不安定性溶血素遺伝子20の450bpの断片を増幅するTLH 。
- 各Vのいくつかの単離コロニーを転送するために、無菌の接種ループを使用しますTSBのの5ミリリットルへのTSAから腸炎株 。 16-24時間、35-37℃でインキュベートします。
- 1分間14,000×gで遠心分離培養。上清を除去し、リン酸緩衝生理食塩水(PBS)で2回ペレットを洗浄。細胞溶解物を得るために3分間懸濁液を沸騰させます。
注:V.腸炎を溶解しやすいです。したがって、溶解試薬が必要とされません。テンプレートとして直接コロニーのビットを使用することも可能です。 - 25μlの反応VにPCRを行ってolume。 1×PCR緩衝液の最終濃度が、1.5のMgCl 2、各dNTP100μMの、1μMの各プライマー、1 UのTaqポリメラーゼおよび細胞溶解物の1μLを含む反応混合物を準備します。 5分間94℃でプレインキュベーションした後、60秒21のために30秒間58℃、30秒間、94℃での35増幅サイクルを実行し、72°C。
- 1.5%アガロースゲルで5μlのアンプリコンのアリコートをロードします。電気泳動を開始するには、電源をオンにします。臭化エチジウム染色した後、UV照射下でアンプリコンの存在または不在を視覚化します。
選択および差分メディア3.成長
- 実験前2〜4日、コロニーを単離するためのストリーク非選択培地上の表1に示すすべての微生物株(のTSA、BHIまたはチョコレート寒天)。 48時間35-37℃で培養します。インキュベーション後にコロニーの形態を観察することによって培養液の純度を確認してください。純粋培養は、同様のコロニー形態を示すコロニーを得られるはずです。
- 培養液5mlにステップ3.1からいくつかの分離したコロニーを転送します。 16-24時間、35-37℃でチューブをインキュベートします。
注:、若いコロニーを使用してください未満4日齢である、すべての実験で一晩培養を準備します。 - ストリークコロニーを単離するための選択と差分メディア(TCBSと発色性寒天)上で一晩培養の白金耳。最大96時間、35から37℃で培養します。
- プレート上の培養密度と分離したコロニーのサイズの両方を調べることによって、すべての株の全体的な成長を記録します。周囲温度および/またはUV光の下でコロニーの色を記録します。このような標高、マージンやフォームなどの孤立したコロニーの他の特性に注意してください。
4.回復アッセイ
- Vの代表的なサブセットを選択腸炎株異なる血清型および分離の起源を包含した(n = 14)
22アップ。 TSBの5mlにプレートから若者文化を接種します。 16-24時間、35-37℃でチューブをインキュベートします。 後述のように一晩培養の標準プレートカウント法を実施します。- よく一晩培養を混合する渦。 900μlのPBSを含むチューブに一晩培養物100μlを移すことにより、10倍または10 -1希釈してください。渦は、よく混合します。
- 900μlのPBSを含む別のチューブに10 -1希釈管から100μlのを転送するために新しいピペットチップを使用してください。渦は、よく混合します。これは、10 -2希釈を構成しています。 10 -7希釈を得るためのプロセスを順次繰り返します。
- 発色性、TCBSとのTSA寒天プレート上で10 -4〜10 -7の希釈チューブ、プレートそれぞれ100μlを使用しました。
注:プレート上の希釈係数(DF)は、それぞれ、10 -8〜10 -5になります。 - トンに均一にアリコートを広げます彼は表面を寒天。
注:これは、最も希釈したアリコートを最初に広がっている限り、同じ培地上で、1株あたり同じスプレッダーを使用するの罰金です( すなわち 、10 -8〜10 -5から)。異なるメディアの同じスプレッダを使用しないでください。 - 最大96時間、35から37℃で培養します。プレート上のコロニーを数えます。 (tntc)をカウントするにはあまりにも多数でコロニーを担持するプレートを無視するか、25未満の計算CFU / mlの以下に従って:
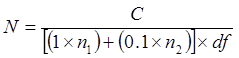
どこ
Nは、未希釈チューブ中の細胞の数= / gのCFU / mlまたはCFUとして表さ
Cは 25から300コロニーを負担プレート上で計数したコロニーの総数=
nが1をカウントコロニーが低いDFからのものであるプレートの数(秒)=
n 2はカウントコロニーは、その後の10倍希釈からのものであるプレートの数(秒)=
DF =低い希釈係数( すなわち 、より濃縮希釈)
異なるメディア間でCFU / mlの比較。 V.の%の回収率を計算し、100%としてのTSA上のCFU / mlで使用します腸炎は、発色性とTCBS寒天培地上で増殖させました。
5.競合アッセイ
発色性とTCBS寒天上の異なるコロニー形態を示す株のサブセットを選択してください。
注:この方法では、コロニーがV.から発信カウントすることが可能となります接種物中の他の種が存在するにもかかわらずのみ腸炎 、。- V.を選択します。それぞれ、TCBSと発色性寒天の期待ターコイズとシアンコロニーをもたらすビブリオ株 。
- 非V.を選択してください腸炎およびこれらの媒体のいずれかに成長する、または別のコロニーの色を示さない非ビブリオ種 。
注:たとえば、V. metschnikoviiが o非常に弱く成長しますnはTCBSと赤痢菌ソンネは TCBSに成長しない。発色性寒天培地上で増殖するが、発色性寒天上にマゼンタのコロニーが得られませんでした。
上記の株を選択した後、非選択培地上で増殖させ、単離されたコロニーを使用して、一晩ブロス培養を準備します。- V.の一晩培養を作ります腸炎とV. TSBのの5ミリリットルへのTSAからいくつかの単離コロニーを転送することによりmetschnikovii。 16-24時間、35-37℃でインキュベートします。
- BHIブロスの5ミリリットルにBHI寒天からいくつかの単離コロニーを転送することにより、 赤痢菌ソンネの一晩培養を行います。 16-24時間、35-37℃でインキュベートします。
各株について、ステップ4.2.1および4.2.2に似た希釈系列を実行します。 TSAまたはBHI上でプレートの適切な希釈液を、ステップ4.2.5に示す式を用いて、一晩培養物のCFU / mlで決定します。
注:一般的に、10 -5〜10 -7希釈から100μlをチューブは、ほとんどの文化のために働きます。次のステップで使用した細胞の正確な量を逆算するCFU / mlの値を使用してください。以下の手順は、ステップ5.3と同じ日に行われるが、計算されたCFU / mlの値は、インキュベーション後に得られます。ステップ5.2および5.3で一晩培養し、希釈管を使用して、Vの異なる量を混ぜます腸炎株と非V.ビブリオ種 。例えば、Vの10 -5希釈管の500μlのを混ぜますV.の一晩培養液500μlと腸炎 metschnikovii。
注:この混合物は、高い微生物叢の背景をシミュレートします。低叢の背景をシミュレートするために、両方の種から500μlの10 -5希釈管のそれぞれをミックス。発色性、TCBSとのTSA寒天プレート上で混合物の各100μlを広げます。最大96時間、35から37℃でインキュベートした後、Vのコロニーを数えますparahaemolyticusおよび非V.発色性とTCBS寒天上での増殖およびコロニー形態におけるそれらの差に基づいて、 腸炎種 。
注:たとえば、非V.ビブリオ種は発色性とTCBS寒天上で増殖しない、すべてのコロニーはV.になります腸炎 。非V.場合ビブリオ種は両方のメディアに成長し、発色性寒天上TCBSとシアンコロニーでのみターコイズコロニーがV.になります腸炎 。非V.ビブリオ種は、またはVに似たコロニー形態を示しても示さなくてもよいですTSA上の腸炎 。- 非V.場合ビブリオ種はV.と同様に成長しますこの非選択培地上の腸炎 、V.の数値を得るために、2つのことでコロニー数を分割のみ腸炎 。ステップ5.3由来期待カウントと実際のコロニー数を比較してください。
6.のEffオイスターホモジネートのECTS
肉と酒を含む≥12軟体動物貝類から≥50グラムの牡蠣肉を計量。- 牡蠣肉と酒に等量のPBSを追加します。 90秒間高速で混合物をブレンド。これは、2 -1希釈カキホモジネートを構成しています。
- PBSの400グラムに2 -1希釈カキホモジネートの100グラムを追加します。体重ではなく、体積を測定する尺度を使用してください。 1分間高速で混合ブレンド。カキホモジネートをオートクレーブ。
注:これはスパイクのために使用されるカキホモジネートになります。
カキホモジネートの存在下で回復アッセイ(ステップ4)を繰り返します。- 500グラムのカキホモジネートが冷却した後、Vの100μlを添加しますそれにTSBの中で一晩増殖させた培養液を腸炎 。 Vの実際の量を決定しますステップ4.2で説明した標準プレート計数手順を行うことにより、接種材料中の腸炎細胞 。
代表カキホモジネートの存在下での競争アッセイ(ステップ5)を食べます。- 500グラムのカキホモジネートが冷却した後、100μlのV.の一晩培養物の各々を追加腸炎と非V.それに腸炎 。細菌の実際の量を決定します ステップ4.2で説明した標準プレート計数手順を行うことにより、接種物中の細胞
ホモジナイザーを使用して、カキホモジネート井戸で細菌細胞を混ぜます。
注:混合した後、意図的に添加した細胞を含むカキホモジネートをスパイクされたカキホモジネートと呼ばれています。ステップ4.2.2に記載された手順に従って、10 -1〜10 -3希釈チューブを得るために、スパイクカキホモジネートの希釈液を作ります。発色性、TCBSとのTSA寒天上に各希釈液100μlを広げます。最大96時間、35から37℃で培養します。元と発色性とTCBS寒天上の実際のコロニー数を比較ステップ6.2.1および6.3.1から推定さpectedコロニー数。
注:たとえば、Vのチューブ腸炎一晩培養物は、10 8 CFU / mlの、100μlの接種が10 7細胞は、5×10 4細胞/グラムを得、カキホモジネートの500グラムに追加されていることを意味含まれています。希釈およびめっき後、プレートはDFを持つ= 10 -2は、500個のコロニーが得られるはずです。その持つDFながら= 10 -3は、50個のコロニーが得られるはずです。これらは、予想されるコロニー数です。
結果
本研究では、54の微生物株をV.内22株が含まれて、組み立てましたビブリオ種 、19他のビブリオ種 、13非ビブリオ種 ( 表1)。ほとんどのV.ビブリオ株はいずれかのFDA、CDCまたは他州の保健部門から受け取りました。彼らは、多様な血清型と分離源を表します。これらの株は、以前の規制当局によって同定しました。我々は...
ディスカッション
本研究では、培養培地の開発、評価に焦点を当てています。従来、TCBSは選択的であり、培地Vを分離し、検出するために用いられる差分腸炎、コレラ菌とV.バルニフィカス 12。しかし、制限は、このようなVを区別することができないように、この媒体について報告されています他のビブリオ種からコレラ菌 。スクロースおよびpH指示薬は、TCBの...
開示事項
Some media were generously provided by Hardy Diagnostics, Santa Maria, CA. Thorsen conducted this study while a student at California Polytechnic State University. He is currently an employee of Hardy Diagnostics.
謝辞
私たちは、プロジェクトの彼らの援助のためにM. Channey、E.チャウ、およびK.トーマスに感謝します。プロジェクト物資の一部は、カリフォルニアポリテクニック州立大学が資金を提供しました。
資料
| Name | Company | Catalog Number | Comments |
| Reagent/Equipment | |||
| Agar | Fisher Scientific | DF0140-15-4 | may use other brands |
| Autoclave | Any | ||
| BHI powder | Fisher Scientific | DF0418-17-7 | may use other brands |
| Blender | Any | to blend oyster meat | |
| CampyGen gas generator | Hardy Diagnostics | CN035A | to provide a microaerophilic atmosphere; may use other brands |
| Chocolate agar plates | Hardy Diagnostics | E14 | may use other brands |
| Common PCR reagents (dNTPs, MgCl2, Taq Polymerase) | Any | or use PCR beads (Fisher Sci 46-001-014) | |
| Culture tubes | Fisher Scientific | S50712 | may use other brands |
| Eppendorf tubes | Fisher Scientific | S348903 | may use other brands |
| Gel doc | Any | ||
| HardyChrom Vibrio agar plates | Hardy Diagnostics | G319 | This study evaluates this medium |
| Incubator | Any | ||
| Inoculating loops | Fisher Scientific | 22-363-606 | 10 microliter-size was used in this study |
| NaCl | Fisher Scientific | BP358-212 | may use other brands |
| Oysters | Any | ||
| PBS | Fisher Scientific | R23701 | may use other brands |
| Petri dish | Fisher Scientific | FB0875713 | may use other brands |
| Pipette and tips | Any | Sterilized tips | |
| Primers for tlh | IDT DNA | ||
| Scale | Any | ||
| Spreader | Fisher Scientific | 08-100-11 | Beads may be used instead |
| Stomacher blender | Stomacher | 400 | Samples were homogenized at 200 rpm for 30 sec. Other homogenizer can be used. |
| Sterile filter bags for blenders | Fisher Scientific | 01-812-5 | |
| TCBS powder | Hardy Diagnostics | 265020 | This study evaluates this medium |
| Thermocycler | Any | ||
| TSB powder | Fisher Scientific | DF0370-07-5 | may use other brands |
| UV viewing cabinet | Any | Emit long-wave UV light | |
| Water bath | Any | | |
| Name | Sources | Catalog Number | Comments |
| Bacterial species and strains | |||
| Aeromonas hydrophila | ATCC | ||
| Candida albicans | ATCC | ||
| Campylobacter jejuni | ATCC | ||
| Escherichia coli | ATCC | ||
| Proteus mirabilis | ATCC | ||
| Pseudomonas aeruginosa | ATCC | ||
| Staphylococcus aureus | ATCC | ||
| Salmonella Choleraesuis | ATCC | ||
| Shigella boydii | ATCC | ||
| Shigella flexneri | ATCC | ||
| Shigella sonnei | ATCC | ||
| Vibrio alginolyticus | ATCC | ||
| V. cholerae (serotypes include O139, O1, non O1, El Tor biovars) | FDA, ATCC | ||
| V. damsela | FDA | ||
| V. fisheri | Environment | ||
| V. fluvialis | CDC | ||
| V. furnissii | CDC | ||
| V. hollisae | FDA | ||
| V. metschnikovii | ATCC | ||
| V. mimicus | FDA | ||
| V. parahaemolyticus (serotypes include O3:K6, O1:K56, O4:K8, O5:K15, O8, etc.) | ATCC, FDA, CDC, Environment | ||
| V. proteolyticus | FDA | ||
| V. vulnificus | FDA |
参考文献
- Yeung, P. S., Boor, K. J. Epidemiology, pathogenesis, and prevention of foodborne Vibrio parahaemolyticus infections. Foodborne Pathog. Dis. 1 (2), 74-88 (2004).
- Yeung, P. S. M., Boor, K. J., Faruque, S. M. Epidemiology, molecular biology, and detection of foodborne Vibrio parahaemolyticus infections. Foodborne and Waterborne Bacterial pathogens: Epidemiology, Evolution and Molecular Biology. , 153-184 (2012).
- Centers for Disease Control and Prevention. Vital Signs: Incidence and Trends of Infection with Pathogens Transmitted Commonly Through Food - Foodborne Diseases Active Surveillance Network, 10 U.S. Sites, 1996-2010. Morbidity and Mortality Weekly Report. 10, 1996-2010 (2011).
- . Summary of human Vibrio cases reported to CDC, 2008 Available from: https://stacks.cdc.gov/view/cdc/21591 (2008)
- Scallan, E., et al. Foodborne illness acquired in the United States - major pathogens. Emerg. Infect. Dis. 17 (1), 7-15 (2011).
- Baross, J., Liston, J. Occurrence of Vibrio parahaemolyticus and related hemolytic vibrios in marine environments of Washington State. Appl. Microbiol. 20 (2), 179-186 (1970).
- Baross, J., Liston, J. Isolation of Vibrio parahaemolyticus from the Northwest Pacific. Nature. 217 (5135), 1263-1264 (1968).
- Kueh, C. S., Chan, K. Y. Bacteria in bivalve shellfish with special reference to the oyster. J. Appl. Bacteriol. 59 (1), 41-47 (1985).
- Food and Drug Administration. . Bad Bug Book, Foodborne Pathogenic Microorganisms and Natural Toxins. , (2012).
- Qadri, F., et al. Adaptive and inflammatory immune responses in patients infected with strains of Vibrio parahaemolyticus. J. Infect. Dis. 187 (7), 1085-1096 (2003).
- MacFaddin, J. F. . Media for isolation-cultivation-identification-maintenance of medical bacteria. 1, (1985).
- Bottone, E. J., Robin, T. Vibrio parahaemolyticus: suspicion of presence based on aberrant biochemical and morphological features. J. Clin. Microbiol. 8 (6), 760-763 (1978).
- Lotz, M. J., Tamplin, M. L., Rodrick, G. E. Thiosulfate-citrate-bile salts-sucrose agar and its selectivity for clinical and marine vibrio organisms. Ann. Clin. Lab. Sci. 13 (1), 45-48 (1983).
- Hara-Kudo, Y., Nishina, T., Nakagawa, H., Konuma, H., Hasegawa, J., Kumagai, S. Improved method for detection of Vibrio parahaemolyticus in seafood. Appl. Environ. Microbiol. 67 (12), 5819-5823 (2001).
- Eddabra, R., Piemont, Y., Scheftel, J. M. Evaluation of a new chromogenic medium, chromID Vibrio, for the isolation and presumptive identification of Vibrio choleare and Vibrio parahaemolyticus from human clinical specimens. Eur. J. Clin. Microbiol. Infect. Dis. 30 (6), 733-737 (2011).
- Kodaka, H., Teramura, H., Mizuochi, S., Saito, M., Matsuoka, H. Evaluation of the Compact Dry VP method for screening raw seafood for total Vibrio parahaemolyticus. J. Food. Prot. 72 (1), 169-173 (2009).
- Su, Y. C., Duan, J., Wu, W. H. Selectivity and specificity of a chromogenic medium for detecting Vibrio parahaemolyticus. J. Food Prot. 68 (7), 1454-1456 (2005).
- Bej, A. K., Patterson, D. P., Brasher, C. W., Vickery, M. C., Jones, D. D., Kaysner, C. A. Detection of total and hemolysin-producing Vibrio parahaemolyticus in shellfish using multiplex PCR amplification of tl, tdh and trh. J. Microbiol. Methods. 36 (3), 215-225 (1999).
- Yeung, P. S. M., DePaola, A., Kaysner, C. A., Boor, K. J. A PCR assay for specific detection of the pandemic Vibrio parahaemolyticus O3:K6 clone from shellfish. J. Food Sci. 68 (4), 1459-1466 (2003).
- Yeung, P. S. M., Hayes, M. C., DePaola, A., Kaysner, C. A., Kornstein, L., Boor, K. J. Comparative phenotypic, molecular, and virulence characterization of Vibrio parahaemolyticus O3:K6 isolates. Appl. Environ. Microbiol. 68 (6), 2901-2909 (2002).
- Duan, J., Su, Y. -. C. Comparison of a chromogenic medium with thiosulfate-citrate-bile salts-sucrose agar for detecting Vibrio parahaemolyticus. J. Food Sci. 70, M125-M128 (2005).
- Pinto, A. D., Terio, V., Novello, L., Tantillo, G. Comparison between thiosulphate-citrate-bile salt sucrose (TCBS) agar and CHROMagar Vibrio for isolating Vibrio parahaemolyticus. Food Control. 22 (1), 124-127 (2011).
- Canizalez-Roman, A., Flores-Villaseñor, H., Zazueta-Beltran, J., Muro-Amador, S., Leòn-Sicairos, N. Comparative evaluation of a chromogenic agar medium-PCR protocol with a conventional method for isolation of Vibrio parahaemolyticus strains from environmental and clinical samples. Can J Microbiol. 57 (2), 136-142 (2011).
- Kriem, M. R., et al. Prevalence of Vibrio spp. in raw shrimps (Parapenaeus longirostris) and performance of a chromogenic medium for the isolation of Vibrio strains. Lett Appl Microbiol. 61 (3), 224-230 (2015).
- Food Drug Administration. Statistical guidance on reporting results from studies evaluating diagnostic tests. http://www.fda.gov/RegulatoryInformation/Guidances/ucm071148.htm. , (2007).
- Burd, E. M. Validation of laboratory-developed molecular assays for infectious diseases. Clin Microbiol Rev. 23 (3), 550-576 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved