JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
의 검출을위한 더 민감하고 특정 원체 한천 배지의 개발
요약
Detection and isolation of clinically relevant Vibrio species require selective and differential culture media. This study evaluated the ability of a new chromogenic medium to detect and identify V. parahaemolyticus and other related species. The new medium was found to have better sensitivity and specificity than the conventional medium.
초록
비브리오 종에 의한 미국의 식품 매개 감염은 상승 추세를 보여 주었다. 속에서 비브리오, V. 비브리오 균은 비브리오 -associated 감염의 대부분을 담당합니다. 따라서, 비브리오 종 중 정확한 차별화. 및 V.의 검출 비브리오는 우리의 식량의 안전성을 보장하기 위해 매우 중요하다. 분자 기술이 점점 더 일반적입니다 만, 문화 따라 방법은 여전히 정기적으로 완료하고 특정 상황에서 표준 방법으로 간주됩니다. 따라서, 새로운 발색 한천 배지는 고립과 임상 적 비브리오 종의 분화를위한 더 나은 방법을 제공하는 것을 목표로 테스트했습니다. 프로토콜은 V.의 검출에 대한 민감도, 특이도 및 검출 한계 비교 새로운 발색 매체와 종래의 매체와 비브리오. 다양한 V. 비브리오 균주 (N = 22) 재다양한 혈청 형과 기원의 소스를 제시하는 사용되었다. 그들은 이전에 식품의 약국 (FDA)와 질병 통제 예방 센터 (CDC)에 의해 식별 및 추가 TLH - PCR에 의해 우리의 실험실에서 확인되었다. 적어도 네 개의 별개의 실험에서, 이들 균주를 24 35-37 ℃에서 인큐베이션 발색 한천 티오 - 구연산 담즙 염 - 자당이 종 배양 권장 매체 (TCBS) 한천에 접종 -96의 시간. 세 V. 성장이 있다면 비브리오 균주 (13.6 %)은 그럼에도 불구하고, TCBS에 최적 성장 녹색 식민지를 전시하지 않았다. 두 균주 (9.1 %)을 발색 한천 예상 시안 콜로니를 산출하지 않았다. 비 V. 비브리오 균주 (N = 32) 또한 발색 한천의 특이성을 결정하기 위해 시험 하였다. 이 균주 중 31 성장 또는 다른 식민지 형태학을 전시하지 않았다. V.의 평균 회복 chromoge에 비브리오 균NIC 한천은 1 ~ 2 % NaCl로 보충 트립신 콩 한천에 96.4 %의 상대였다. 결론적으로, 새로운 발색 한천 V.를 검출하는 효과적인 매체 비브리오 균과는 다른 vibrios 구별합니다.
서문
비브리오 속, V.의 구성원 비브리오는 그람 - 음성, 비 - 포자 형성, 곡면, 봉상 세균이다. 그것은 액체와 반고체 환경 모두에서 높은 운동성을 나타낸다. 대부분의 V. 비브리오 균주는 인간에게 비 병원성, 아직 병원성 하위 유형은 많은 나라 1, 2에 따라서이 종은 중요한 식품 매개 병원체로 간주됩니다 전염병과 전염병을 야기했다. 미국에서 비브리오 감염의 발생 빈도는 2000 3 년 이후 상승 추세를 보이고있다. 비브리오 종 중., V. 비브리오 균은 미국 4,5에서 질병을 일으키는 가장 빈번하게보고 된 종입니다. 기타 임상 관련 종 V. 포함 alginolyticus, V. 불 니피 쿠스 균, V. 콜레라 등 질병의 작은 비율은 동시에 여러 종에 의해 발생합니다.
V. 비브리오 균은 자연 전입니다해양 물 nhabitant 때문에 널리 하구를 포함하여 전 세계적으로 해양 물에 분산. 종은 일본에서 식중독의 발생 다음 1950 년에 발견되었다. 미국의 경우, 종 먼저 퓨젯 사운드 지역 6,7 해수, 퇴적물, 어패류에서 격리되었다. 같은 조개 조개 등 해양 서식지에서 필터 피더는, V. 항구 수 있습니다 자연 식물 8의 일환으로 비브리오. 같은 V.로 인간의 비브리오 균 감염은 주로 오염 된 해산물, 특히 원시 또는 덜 익힌 조개의 소비에 연결되어 있습니다. 열린 상처 피부 감염으로 이어지는, 해수에 노출되었을 때 항목의 덜 일반적인 경로가 발생합니다. 대부분의 V. 비브리오 균주는 인간의 질병을 유발하지 않는, 아직 같은 내열성 직접 용혈 (TDH)와 같은 독성 요소를 품고 특정 서브 타입은 병원성입니다. 인성 V.의 가장 일반적인 증상 비브리오 균 감염은메스꺼움, 구토, 발열 다음에 설사와 복통,. 두통과 오한도보고됩니다. 평균 잠복기는 15 시간이지만, 병원성 균주 (9) 충분한 양의 소비 후 96 시간에 할 수 있습니다. 질병은 2 ~ 3 일에서 지속됩니다. V.로 인한 위장관 증상 비브리오 균은 주로 자기 제한하고, 따라서 특별한 치료는 필요하지 않습니다. 위장염의 가벼운 경우 효과적으로 구강 수분 보충에 의해 처리 될 수있다. 더 심각한 질병은 테트라 사이클린이나 시프로플록사신 (10)과 같은 항생제로 치료 될 수있다. 사망률 위장염 케이스에 대해 2 %이지만, 혈류 감염 패혈증을 개발하는 사람들에게 29 %만큼 높을 수있다. 해수에 노출 열린 상처 해산물을 소비하거나이있는 사람은 V. 위험에 비브리오 균 감염. 질병, 생명을 위협하는 패혈증의 더 심각한 형태는, 기본 의료 협력과 하위 집단에서 더 일반적이다알콜 중독, 간 질환, 당뇨병, 신장 질환, 악성 종양, 및 약화 된 면역 반응으로 이어지는 다른 조건을 포함하는 nditions 11. 특히, 개인의이 그룹은 V.에 의한 심각한 질병을 계약에 대한 위험이 높은도 V. 유사한 자연 서식지에서 찾을 수 있습니다 불 니피 쿠스 균, 비브리오.
V. 비브리오 균은 일상적으로 선택 및 차등 매체로 티오 - 구연산 - 담즙 염 - 자당 (TCBS) 한천을 사용하여 격리됩니다. 알칼리 펩톤 물에 농축는 TCBS 한천에 격리 앞에있다. TCBS에 추정 콜로니는 상기 종 특이 유전자의 존재를 타겟팅 생화학 검사 및 / 또는 분자의 배열 분석법에서 테스트한다. PCR 기반의 방법들은 종종 V.의 신원을 확인하는 데 사용 12 TLH는 thermolabile 용혈 유전자 증폭 비브리오.
에 관계없이 채널의확인 방법 OICE, V.를 분리 및 구별 할 수있는 효과적인 매체 것이 중요 처음에 다른 해양 vibrios에서 비브리오. TCBS 일상적 수크로오스 12 발효 능력에 따른 비브리오 속에서 종을 구별하기 위해 사용되었다. 포지티브 발효 반응은 pH를 지표 브로 모티 몰 블루의 색 변화를 동반한다. V. 비브리오 균 식민지 녹색 색상에 파란색을 전시, TCBS에 상당히 독특한입니다. 그러나이 매체는 쉽게 구별 V. 없다 alginolyticus 및 V. 콜레라. 자당-발효 테우스 종 V.를 닮은 노란색 식민지를 생성 할 수있다 콜레라 나 V. alginolyticus 13. TCBS, V.에 초기 격리에 비브리오 균은 모나스의 hydrophila, Plesiomonas의 shigelloides 및 슈도모나스 종 (14)로 잘못 식별 할 수있다. 지연 자당 FERM와 균주[슬라이드 쇼]는 V.를 포함 비브리오 (13) nonfermenting 다른 크로스와 혼동 될 수있다 비브리오. TCBS는 다른 사람의 사이에서 대장균, 슈도모나스 putrefaciens 상대로하지 민감한 것으로 밝혀졌다. 다른 몇몇 종은 잠재적 V.과 혼동되어 회색 식민지 녹색 산출 비브리오 균이나 V. 불 니피 쿠스 균 15. 그 결과, 검출 V. 분리 향해 나은 민감도와 특이 대체 배지를 개발하는 것이 바람직하다 비브리오 균 및 기타 밀접하게 관련 종.
여러 대안 매체가 최근 개발되었다. 선택적 제제를 포함하는 것 외에도, 대부분이 차동 효소 활성에 기초하여 종을 구별 할 발색 기질을 통합한다. 예를 들어, indoxyl-β 글루코 시드와 indoxyl-β-갈 락토는 V. 차별화 발색 기질로 사용되어왔다 파라V.과는 (푸른 빛이 도는 녹색으로 표시) 해 몰리 식민지 그들의 차동 능력에 (보라색) 콜레라는 β - 글루코시다 제 및 β - 갈 락토시다 제 (16)를 생성한다. 여러 그룹에서 개발 한 발색 한천의 다른 제형은 평가되었으며에 상대적으로 또는 TCBS 17,18,19보다 더 나은 수행하는 것으로보고되었다. 발색 매체를 사용하는 장점은 주변 매질의 착색함으로써 특정 콜로니 분리를 용이 최소화한다는 것이다. 본 연구에서, 우리는 V.를 검출하고 분리하는 신규 제형 발색 매체의 능력을 평가 콜레라, V. 비브리오 균 및 V. 불 니피 쿠스 균; V. 차별화 할 수있는 능력에 특별한 초점을 다른 종에서 비브리오.
프로토콜
1. 미디어 및 미생물 균주의 배양
참고 : 모든 실험에서 사용 무균 기술. 멸균 재료를 사용합니다. 사용하기 전에 모든 용기, 도구 및 시약을 소독. 그들은 생물학적으로 간주되기 때문에 이전의 처분에 모든 폐기물을 압력솥. 다음 절차의 모든 압력솥 온도와 시간의 조합 ≥121 ° C X ≥15 분.
- ~ 1 L 트립신 콩 한천 (TSA)하려면, 먼저 자기 교반 막대를 함유하는 2 L 삼각 플라스크에 탈 이온수 1 L를 추가한다. 최종 부피보다 2 배 이상 큰 플라스크를 사용합니다. 트립신 간장 국물 분말 30 g을 플라스크에 과립 한천 20g을 추가합니다.
참고 : 사용 2 % 한천 대신 1.5 %가 일부 비브리오 종의 득시글 거리는을 제한합니다.- 교반기 설정하여 철저히 섞는다. 교반하면서, 혼합물을 끓여 열을 켭니다. 혼합물이 비등하기 시작하자마자 히터에서 플라스크를 제거합니다. 느슨하게 번째 커버주석 호일 전자 플라스크. 오토 클레이브를하기 전에 플라스크에 고정하는 포일 테이프입니다.
- 트립신 콩 국물 (TSB)를하려면, 단계 1.1의 조리법에서 한천을 생략합니다.
참고 : 대신 삼각 플라스크의 병을 사용할 수 있습니다. - 2 % 염화나트륨 또는 염화나트륨 (TSAS)이 보충 된 트립신 콩 한천을하기 전에 교반 및 가열 혼합물에 염화나트륨 20g을 추가한다. 2 %의 NaCl (TSBS)로 보충 트립신 간장 국물을 만들려면, 한천을 생략하기 전에 교반 및 가열 혼합물에 염화나트륨 20g을 추가합니다.
- 뇌 심장 주입 (BHI) 한천을 BHI 분말 37g 정제 물 1 L에 15g 한천 과립을 일시 중단합니다. 자주 교반 열은 분말을 용해한다. 압력솥. BHI 국물을 할 수있는 한천을 생략합니다.
- , TCBS 한천을 증류수 1 L에 TCBS 분말 89g을 중단한다. 1 분 동안 자주 교반 및 종기와 열은 완전히 분말을 용해한다. 오토 클레이브하지 마십시오.
- 모든 한천 미디어, 45-5로 뜨거운 한천을 냉각수욕 0 ° C. 5 ~ 6 판의 스택 빈 페트리 접시를 정렬합니다. 스택의 바닥에서 시작, 반 전체에 도달하는 각 페트리 접시에 용융 한천을 부어. 주입 후 페트리 접시 뚜껑을 닫습니다. 한천이 판은 실온에서 앉을 수 있도록함으로써 응고 할 수 있습니다.
- 한천 플레이트 다음날 또는 12 시간 후를 사용합니다. 최대 2 주 동안 냉장고에 사용하지 않는 접시를 저장합니다. 사용하기 전에 냉장고에서 플레이트를 제거하고 적어도 15 분 동안 실온에서 평형을.
참고 : 하나 리터 한천 ~ 45 한천 판을 만든다. 한천 플레이트를 제조 당일에 충분히 건조, 효과적으로 콜로니의 확산을 감소시키기 위해 냉장 보관 한 후, 실온으로 평형하도록 허용.
- 한천 플레이트 다음날 또는 12 시간 후를 사용합니다. 최대 2 주 동안 냉장고에 사용하지 않는 접시를 저장합니다. 사용하기 전에 냉장고에서 플레이트를 제거하고 적어도 15 분 동안 실온에서 평형을.
- 초콜릿과 발색 한천 플레이트를 구하여 각 실험 전에 실온에서 그들을 평형.
- 표 1마다 몇 다에 표시된 모든 54 미생물 균주를 배양YS.
- 냉동 재고 또는 BHI, TSB / TSA 또는 초콜릿 한천 등의 비 선택적 미디어에 이전 배치에서 문화를 전송하는 멸균 접종 루프를 사용합니다. 염성 비브리오 종을 성장. TSBS / TSAS합니다.
- 문화의 순도를 확인하려면, 연속 고립 된 식민지의 관찰을 허용 할 패턴의 모든 변종. 예를 들어, 최종적으로 절연 콜로니를 수득 작은 양의 박테리아의 대량 희석 삼상 줄무늬 패턴을 사용한다.
- 최대 48 시간 동안 35-37 ℃에서 판에 거꾸로 품어. 캄 필로 박터 종의 경우., 튜브 또는 접시를 품어 가스 주머니를 포함하는 덮개가 닫힌 병에서 호기성 환경을 생성한다. 부화 후 식민지 형태를 관찰한다. 순수 문화는 비슷한 식민지 형태를 나타내는 식민지를 산출한다.
주 : COL에 떨어지는 뚜껑의 밑면에 형성된 응축수 방울을 방지하기 위해 모든 플레이트를 거꾸로 부화onies.
PCR에 의한 2 종 결정
- V.의 신원을 확인하기 위해 TLH - PCR을 실시 비브리오 균주. 사용 프라이머는 -F (5 'AAA GCG GAT TAT GCA GAA GCA CTG 3')와 TLH의 -R (5 'GCT ACT TTC 태그 CAT TTT CTC TGC 3')이 thermolabile의 용혈 유전자 (20)의 450 bp의 단편을 증폭 TLH .
- 각 V. 몇 절연 콜로니를 전송하는 무균 접종 루프를 사용하여 TSAS에서 TSBS 5 ㎖에 비브리오 균주. 16 ~ 24 시간 동안 35-37 ° C에서 품어.
- 원심 분리기 문화 1 분 14,000 XG에. 상등액을 제거하고 인산 완충 식염수 (PBS)로 두 번 펠렛을 세척 하였다. 세포 용 해물을 수득 3 분 동안 현탁액을 끓인다.
참고 : V. 비브리오 균은 용해되기 쉽다. 따라서 용해 시약이 필요하지 않습니다. 주형으로 직접 콜로니의 비트를 사용하는 것도 가능하다. - 25 ㎕의 반응 절에서 PCR을 수행olume. 1X PCR 완충액의 최종 농도는 1.5 밀리미터의 MgCl 2, 각각의 dNTP 100 μM, 각 프라이머 1 μM, 1 U의 Taq 중합 효소 및 세포 용 해물 1 μl를 함유하는 반응 혼합물을 준비한다. 30 초, 30 초 동안 58 ° C, 60 초 21 72 ° C, 94 ° C의 증폭 35주기를 실행하여 5 분 동안 94 ℃에서 예비 인큐베이션 단계 후에.
- 1.5 % 아가 로스 젤에서 5 μL 앰플 리콘의 부하 분취. 전기 영동을 시작 전원을 켭니다. 에 티듐 브로마이드 염색 후 UV 조명 하에서 증폭의 유무를 시각화.
선택 및 차등 미디어 3. 성장
- 2 ~ 4 일 실험 전에 행진 식민지 격리를 위해 비 선택적 매체 (TSAS, BHI 또는 초콜릿 한천)에 표 1에 나타난 모든 미생물 균주. 48 시간 동안 35-37 ° C에서 번호판을 품어. 부화 후 식민지 형태를 관찰하여 문화의 순도를 확인. 순수 문화는 비슷한 식민지 형태를 나타내는 식민지를 산출한다.
- 국물 5 ㎖로 단계 3.1에서 몇 격리 식민지를 전송합니다. 16 ~ 24 시간 동안 35-37 ℃에서 튜브를 품어.
주 : 이하 사일 오래 사용 젊은 식민지은 모든 실험에서 하룻밤 문화를 준비 할 수 있습니다. - 킬 콜로니 분리를위한 선택 및 차등 미디어 (TCBS와 발색 한천)에 하룻밤 문화의 백금이. 최대 96 시간 동안 35-37 ° C에서 번호판을 품어.
- 접시에 배양 밀도와 격리 식민지의 크기를 모두 검사하여 모든 균주의 전체 성장을 기록합니다. 주변 및 / 또는 UV 조명 아래 식민지의 색상을 기록합니다. 이러한 상승, 마진과 형태로 고립 된 식민지의 다른 특성을합니다.
4. 복구 분석
- V.의 대표 하위 집합을 선택 비브리오 균주 다른 혈청 형과 분리의 기원을 포함 (N = 14)
22입니다. TSBS 5 ㎖로 판에서 젊은 문화를 접종한다. 16 ~ 24 시간 동안 35-37 ℃에서 튜브를 품어. 아래에 설명 된대로 하룻밤 문화의 표준 플레이트 카운트 방법을 실시한다.- 소용돌이 잘 하룻밤 문화를 혼합합니다. 900 ㎕의 PBS를 함유하는 튜브에 밤새 배양 100 ㎕를 전달함으로써 10 배 또는 10 -1 희석 만든다. 소용돌이는 잘 혼합한다.
- 900 ㎕의 PBS를 포함하는 다른 튜브에 10 -1 희석 튜브에서 100 μl를 전송하는 새로운 피펫 팁을 사용합니다. 소용돌이는 잘 혼합한다. 이 10-2 희석을 구성한다. 10-7 희석액을 수득하는 공정을 순차적으로 반복한다.
- 10 -4 -7 (10)에 희석 튜브를 사용하여, 발색, TCBS 및 TSAS 한천 플레이트에 100 ㎕를 각각의 접시.
참고 : 접시에 희석 계수 (DF)이 10-5 각각 -8 10이된다. - t에 균등하게 분취 확산그는 표면 한천.
참고 : 가장 희석 나누어지는 처음 확산되는만큼, 동일한 매체에 변형 당 같은 스프레더를 사용하는 것이 좋은 (즉, 10-8 -5 ~ 10에서). 다른 매체에 대해 동일한 스프레더를 사용하지 마십시오. - 최대 96 시간 동안 35-37 ° C에서 번호판을 품어. 접시에 식민지를 계산합니다. 너무 계산하는 많은 (tntc) 또는 / ㎖ 다음에 따라 25 계산 CFU보다 작은 식민지를 베어링 판을 무시 :
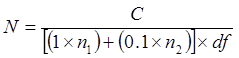
어디에
N은 희석 튜브에 세포의 수 = / g CFU / ㎖ 또는 CFU로 표현
C는 25-300 콜로니지지 플레이트에 콜로니를 계수의 총 수 =
n은 1 카운트 콜로니 하부 DF 출신 판 (들)의 개수 =
N이 카운트 콜로니 후속 10 배 희석 출신 판 (들)의 개수 =
디f는 저급 희석 계수 = (즉, 높은 농도의 희석)
다른 매체들 사이 CFU / mL로 비교합니다. 100 %로 TSAS에 CFU / ㎖를 사용 V.의 % 복구를 계산 비브리오 균은 발색과 TCBS 한천에 성장.
5. 경쟁 분석
발색과 TCBS 한천에 다른 식민지 형태학을 나타내는 균주의 하위 집합을 선택합니다.
참고 :이 방법은 식민지 V.에서 유래 계산하는 것이 가능할 것이다 접종에 다른 종의 존재에도 불구하고 만 비브리오 균,.- V. 선택 각각 TCBS와 발색 한천에 예상 터키석과 시안 식민지를 산출 비브리오 균주.
- 비 V.를 선택 비브리오 균과 이들 매체 중 하나에 성장, 또는 다른 식민지 색을 나타내지 않는 비 비브리오 종.
참고 : 예를 들어, V. 메 치니 코비는 O를 매우 약하게 성장N TCBS는합니다. 발색 한천에 성장하지 않았다 시겔 라 sonnei는 TCBS에 성장하지만 발색 한천에 마젠타 식민지를 산출하지 않습니다.
위의 균주의 선택, 비 선택적 미디어에 성장 격리 식민지를 사용하여 밤새 국물 문화를 준비합니다.- V.의 야간 문화를 만들기 비브리오 균 및 V. TSAS에서 TSBS 5 ㎖로 약간 고립 된 식민지를 전송하여 메 치니 코비. 16 ~ 24 시간 동안 35-37 ° C에서 품어.
- BHI 배지 5 ㎖에 BHI 한천에서 몇 고립 된 식민지를 전송하여 시겔의 sonnei의 야간 문화를합니다. 16 ~ 24 시간 동안 35-37 ° C에서 품어.
각 균주를 들어, 단계 4.2.1과 4.2.2 유사한 희석 시리즈를 수행합니다. TSAS 또는 BHI 플레이트에 적합한 희석 단계 4.2.5에 도시 된 수학 식을 사용하여 밤새 배양 CFU / ㎖를 결정한다.
참고 : 일반적으로 10 -5 10-7 희석 100 μL튜브는 대부분의 문화에 대해 작동합니다. 다음 단계에서 사용 된 세포의 정확한 양을 계산하기 위하여 백업 CFU / ml의 값을 사용한다. 다음 단계, 단계 5.3와 동일한 날짜에 수행 되더라도 산출 용액 CFU / 값은, 인큐베이션 후 얻어진다.단계 5.2 및 5.3에서 밤새 배양하고 희석 튜브를 사용하여, V. 상이한 양 믹스 비브리오 균주 및 비 V. 비브리오 종. 예를 들어, V.의 10-5 희석 튜브 500 μL를 혼합 V.의 하룻밤 문화의 500 μL와 비브리오 균 메 치니 코비.
참고 :이 혼합물은 높은 미생물의 배경을 재현합니다. 낮은 미생물 배경을 시뮬레이션 두 종에서 500 μL에게 10-5 희석 튜브의 각을 혼합합니다.발색, TCBS 및 TSAS 한천 플레이트의 혼합물 100 ㎕를 각각 확산.35-37 ° C에서 부화 후 96 시간까지, V.의 식민지를 계산하기위한 parahaemolyticuS 및 비 V. 발색 및 TCBS 한천 성장과 콜로니 형태에서의 차이에 기초하여 비브리오 종.
참고 : 예를 들어, 비 V. 비브리오 종은 모든 식민지 V. 될 것입니다, 발색과 TCBS 한천에 성장하지 않습니다 비브리오. 비 V. 경우 비브리오 종은 모두 미디어에 성장, 발색 한천에 TCBS 및 시안 식민지 만 청록색 식민지 V. 될 것입니다 비브리오. 비 V. 비브리오 종 또는 V. 유사한 식민지 형태를 나타내지 않을 수있다 TSAS에 비브리오.- 비 V. 경우 비브리오 종 V. 유사 성장 이 비 선택적 매체에 비브리오 균은 V.에 대한 번호를 얻기 위해 두 가지에 의해 식민지 카운트를 분할 만 비브리오. 단계 5.3로부터 유도 된 예상 된 수와 실제의 콜로니 수를 비교한다.
6.하여 Eff굴 균질 ECTS
고기와 술을 포함한에서 ≥12 연체 동물 조개 ≥50 g 굴 고기의 무게를.- 굴 고기와 술에 PBS의 동일한 금액을 추가합니다. 90 초 동안 고속 혼합 블렌드. 이것은 2-1 희석 굴 파쇄를 구성한다.
- PBS의 400g에 2 -1 희석 굴 균질의 100g을 추가합니다. 무게가 아니라 부피를 측정하기위한 스케일을 사용한다. 1 분 동안 고속 혼합 블렌드. 굴 균질를 압력솥.
참고 :이 급상승에 사용되는 굴 균질 될 것입니다.
굴 파쇄의 존재 복구 분석 (단계 4)를 반복한다.- 500 그램 굴 균질가 식은 후에, V. 100 μl를 추가 여기에 TSBS에서 재배 야간 문화를 비브리오. V.의 실제 양을 결정 단계 4.2에 설명 된 표준 플레이트 카운트 절차를 수행하여 접종에서 비브리오 균 세포.
대표굴 파쇄의 존재 경쟁 분석 (단계 5)을 먹는다.- 500 그램 굴 균질가 식은 후에, V.의 하룻밤 문화의 각 μL (100)를 추가 비브리오 균 및 비 V. 그것 비브리오. 세균의 실제 양을 결정 표준 플레이트 카운트 절차를 수행하여 접종 세포 단계 4.2에 설명
또한 호모 게 나이저를 사용해 굴 파쇄와 균체 섞는다.
참고 : 혼합 한 후, 호출되는 의도적으로 첨가 세포를 포함하는 굴 균질는 굴 균질 아군.스파이크 굴 균질 희석 단계 4.2.2에 기재된 절차에 따라서, 10-1 10-3로 희석 튜브를 얻을 수 있도록. 발색, TCBS 및 TSAS 한천에 각 희석 100 μl를 확산. 최대 96 시간 동안 35-37 ° C에서 번호판을 품어.전으로 발색 및 TCBS 한천의 실제 콜로니 수를 비교예견했던 식민지 수는 6.2.1과 6.3.1 단계에서 추론.
참고 : 예를 들어, V.의 튜브 비브리오 균 하룻밤 문화는 10 8 CFU가 / ㎖, 100 μL의 접종은 10 7 세포 5 × 104 세포 / g를 산출, 굴 균질의 500 g에 첨가하는 것을 의미가 포함되어 있습니다. 희석 및 도금 후, 플레이트는 DF를 갖는 = 10-2 500 콜로니를 수득한다; 이 갖는 안양 동안 = 10-3 (50) 식민지를 산출한다. 이러한 예상 식민지 수가 있습니다.
결과
본 연구에서는 54 균주는 V. 내에서 22 균주를 포함하는 조립했다 비브리오 종 19 개 비브리오 종 (13) 비 비브리오 종 (표 1). 대부분의 V. 비브리오 균주 중 하나를 FDA, CDC 또는 기타 국가 건강 부서 받았습니다. 그들은 다양한 혈청 형과 절연 소스를 나타냅니다. 이 균주는 이전에 규제 기관에 의해 확인되었다. 우리는 또한 이러?...
토론
이 연구는 배양 배지 개발 및 평가에 초점을 맞추고 있습니다. 종래 TCBS 인 선택적 및 매체 V. 분리 및 검출을 위해 사용되는 차동 비브리오 균, V. 콜레라 및 V. 불 니피 쿠스 균 (12). 그러나, 이러한 제한은 V. 구별 할 수 없다는,이 매체에 대해보고 된 다른 비브리오 종에서 콜레라. 자당 및 pH를 표시 TCBS의 분화 에이전트입니다. 따라서, 자당 발효기에...
공개
Some media were generously provided by Hardy Diagnostics, Santa Maria, CA. Thorsen conducted this study while a student at California Polytechnic State University. He is currently an employee of Hardy Diagnostics.
감사의 말
우리는이 프로젝트에 대한 그들의 지원 M. Channey, E. 차우 및 K. 토마스 감사합니다. 프로젝트 공급이 부분적으로 캘리포니아 폴리 테크닉 주립 대학에 의해 투자되었다.
자료
| Name | Company | Catalog Number | Comments |
| Reagent/Equipment | |||
| Agar | Fisher Scientific | DF0140-15-4 | may use other brands |
| Autoclave | Any | ||
| BHI powder | Fisher Scientific | DF0418-17-7 | may use other brands |
| Blender | Any | to blend oyster meat | |
| CampyGen gas generator | Hardy Diagnostics | CN035A | to provide a microaerophilic atmosphere; may use other brands |
| Chocolate agar plates | Hardy Diagnostics | E14 | may use other brands |
| Common PCR reagents (dNTPs, MgCl2, Taq Polymerase) | Any | or use PCR beads (Fisher Sci 46-001-014) | |
| Culture tubes | Fisher Scientific | S50712 | may use other brands |
| Eppendorf tubes | Fisher Scientific | S348903 | may use other brands |
| Gel doc | Any | ||
| HardyChrom Vibrio agar plates | Hardy Diagnostics | G319 | This study evaluates this medium |
| Incubator | Any | ||
| Inoculating loops | Fisher Scientific | 22-363-606 | 10 microliter-size was used in this study |
| NaCl | Fisher Scientific | BP358-212 | may use other brands |
| Oysters | Any | ||
| PBS | Fisher Scientific | R23701 | may use other brands |
| Petri dish | Fisher Scientific | FB0875713 | may use other brands |
| Pipette and tips | Any | Sterilized tips | |
| Primers for tlh | IDT DNA | ||
| Scale | Any | ||
| Spreader | Fisher Scientific | 08-100-11 | Beads may be used instead |
| Stomacher blender | Stomacher | 400 | Samples were homogenized at 200 rpm for 30 sec. Other homogenizer can be used. |
| Sterile filter bags for blenders | Fisher Scientific | 01-812-5 | |
| TCBS powder | Hardy Diagnostics | 265020 | This study evaluates this medium |
| Thermocycler | Any | ||
| TSB powder | Fisher Scientific | DF0370-07-5 | may use other brands |
| UV viewing cabinet | Any | Emit long-wave UV light | |
| Water bath | Any | | |
| Name | Sources | Catalog Number | Comments |
| Bacterial species and strains | |||
| Aeromonas hydrophila | ATCC | ||
| Candida albicans | ATCC | ||
| Campylobacter jejuni | ATCC | ||
| Escherichia coli | ATCC | ||
| Proteus mirabilis | ATCC | ||
| Pseudomonas aeruginosa | ATCC | ||
| Staphylococcus aureus | ATCC | ||
| Salmonella Choleraesuis | ATCC | ||
| Shigella boydii | ATCC | ||
| Shigella flexneri | ATCC | ||
| Shigella sonnei | ATCC | ||
| Vibrio alginolyticus | ATCC | ||
| V. cholerae (serotypes include O139, O1, non O1, El Tor biovars) | FDA, ATCC | ||
| V. damsela | FDA | ||
| V. fisheri | Environment | ||
| V. fluvialis | CDC | ||
| V. furnissii | CDC | ||
| V. hollisae | FDA | ||
| V. metschnikovii | ATCC | ||
| V. mimicus | FDA | ||
| V. parahaemolyticus (serotypes include O3:K6, O1:K56, O4:K8, O5:K15, O8, etc.) | ATCC, FDA, CDC, Environment | ||
| V. proteolyticus | FDA | ||
| V. vulnificus | FDA |
참고문헌
- Yeung, P. S., Boor, K. J. Epidemiology, pathogenesis, and prevention of foodborne Vibrio parahaemolyticus infections. Foodborne Pathog. Dis. 1 (2), 74-88 (2004).
- Yeung, P. S. M., Boor, K. J., Faruque, S. M. Epidemiology, molecular biology, and detection of foodborne Vibrio parahaemolyticus infections. Foodborne and Waterborne Bacterial pathogens: Epidemiology, Evolution and Molecular Biology. , 153-184 (2012).
- Centers for Disease Control and Prevention. Vital Signs: Incidence and Trends of Infection with Pathogens Transmitted Commonly Through Food - Foodborne Diseases Active Surveillance Network, 10 U.S. Sites, 1996-2010. Morbidity and Mortality Weekly Report. 10, 1996-2010 (2011).
- . Summary of human Vibrio cases reported to CDC, 2008 Available from: https://stacks.cdc.gov/view/cdc/21591 (2008)
- Scallan, E., et al. Foodborne illness acquired in the United States - major pathogens. Emerg. Infect. Dis. 17 (1), 7-15 (2011).
- Baross, J., Liston, J. Occurrence of Vibrio parahaemolyticus and related hemolytic vibrios in marine environments of Washington State. Appl. Microbiol. 20 (2), 179-186 (1970).
- Baross, J., Liston, J. Isolation of Vibrio parahaemolyticus from the Northwest Pacific. Nature. 217 (5135), 1263-1264 (1968).
- Kueh, C. S., Chan, K. Y. Bacteria in bivalve shellfish with special reference to the oyster. J. Appl. Bacteriol. 59 (1), 41-47 (1985).
- Food and Drug Administration. . Bad Bug Book, Foodborne Pathogenic Microorganisms and Natural Toxins. , (2012).
- Qadri, F., et al. Adaptive and inflammatory immune responses in patients infected with strains of Vibrio parahaemolyticus. J. Infect. Dis. 187 (7), 1085-1096 (2003).
- MacFaddin, J. F. . Media for isolation-cultivation-identification-maintenance of medical bacteria. 1, (1985).
- Bottone, E. J., Robin, T. Vibrio parahaemolyticus: suspicion of presence based on aberrant biochemical and morphological features. J. Clin. Microbiol. 8 (6), 760-763 (1978).
- Lotz, M. J., Tamplin, M. L., Rodrick, G. E. Thiosulfate-citrate-bile salts-sucrose agar and its selectivity for clinical and marine vibrio organisms. Ann. Clin. Lab. Sci. 13 (1), 45-48 (1983).
- Hara-Kudo, Y., Nishina, T., Nakagawa, H., Konuma, H., Hasegawa, J., Kumagai, S. Improved method for detection of Vibrio parahaemolyticus in seafood. Appl. Environ. Microbiol. 67 (12), 5819-5823 (2001).
- Eddabra, R., Piemont, Y., Scheftel, J. M. Evaluation of a new chromogenic medium, chromID Vibrio, for the isolation and presumptive identification of Vibrio choleare and Vibrio parahaemolyticus from human clinical specimens. Eur. J. Clin. Microbiol. Infect. Dis. 30 (6), 733-737 (2011).
- Kodaka, H., Teramura, H., Mizuochi, S., Saito, M., Matsuoka, H. Evaluation of the Compact Dry VP method for screening raw seafood for total Vibrio parahaemolyticus. J. Food. Prot. 72 (1), 169-173 (2009).
- Su, Y. C., Duan, J., Wu, W. H. Selectivity and specificity of a chromogenic medium for detecting Vibrio parahaemolyticus. J. Food Prot. 68 (7), 1454-1456 (2005).
- Bej, A. K., Patterson, D. P., Brasher, C. W., Vickery, M. C., Jones, D. D., Kaysner, C. A. Detection of total and hemolysin-producing Vibrio parahaemolyticus in shellfish using multiplex PCR amplification of tl, tdh and trh. J. Microbiol. Methods. 36 (3), 215-225 (1999).
- Yeung, P. S. M., DePaola, A., Kaysner, C. A., Boor, K. J. A PCR assay for specific detection of the pandemic Vibrio parahaemolyticus O3:K6 clone from shellfish. J. Food Sci. 68 (4), 1459-1466 (2003).
- Yeung, P. S. M., Hayes, M. C., DePaola, A., Kaysner, C. A., Kornstein, L., Boor, K. J. Comparative phenotypic, molecular, and virulence characterization of Vibrio parahaemolyticus O3:K6 isolates. Appl. Environ. Microbiol. 68 (6), 2901-2909 (2002).
- Duan, J., Su, Y. -. C. Comparison of a chromogenic medium with thiosulfate-citrate-bile salts-sucrose agar for detecting Vibrio parahaemolyticus. J. Food Sci. 70, M125-M128 (2005).
- Pinto, A. D., Terio, V., Novello, L., Tantillo, G. Comparison between thiosulphate-citrate-bile salt sucrose (TCBS) agar and CHROMagar Vibrio for isolating Vibrio parahaemolyticus. Food Control. 22 (1), 124-127 (2011).
- Canizalez-Roman, A., Flores-Villaseñor, H., Zazueta-Beltran, J., Muro-Amador, S., Leòn-Sicairos, N. Comparative evaluation of a chromogenic agar medium-PCR protocol with a conventional method for isolation of Vibrio parahaemolyticus strains from environmental and clinical samples. Can J Microbiol. 57 (2), 136-142 (2011).
- Kriem, M. R., et al. Prevalence of Vibrio spp. in raw shrimps (Parapenaeus longirostris) and performance of a chromogenic medium for the isolation of Vibrio strains. Lett Appl Microbiol. 61 (3), 224-230 (2015).
- Food Drug Administration. Statistical guidance on reporting results from studies evaluating diagnostic tests. http://www.fda.gov/RegulatoryInformation/Guidances/ucm071148.htm. , (2007).
- Burd, E. M. Validation of laboratory-developed molecular assays for infectious diseases. Clin Microbiol Rev. 23 (3), 550-576 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유