A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פיתוח בינוני אגר chromogenic רגיש וספציפי יותר לצורך זיהוי של
In This Article
Summary
Detection and isolation of clinically relevant Vibrio species require selective and differential culture media. This study evaluated the ability of a new chromogenic medium to detect and identify V. parahaemolyticus and other related species. The new medium was found to have better sensitivity and specificity than the conventional medium.
Abstract
זיהומי foodborne בארה"ב נגרמת על ידי מיני Vibrio הראו מגמת עלייה. בשנת מהמין Vibrio, parahaemolyticus V. אחראי רוב דלקות -associated Vibrio. לפיכך, בידול מדויק בין spp Vibrio. וזיהוי של V. parahaemolyticus יש חשיבות קריטית כדי להבטיח את שלומם של אספקת המזון שלנו. למרות בטכניקות מולקולריות נפוצות יותר ויותר, שיטות-תלוי תרבות עדיין נעשות באופן שיגרתי והם נחשבים שיטות סטנדרטיות בנסיבות מסוימות. לפיכך, מדיום אגר chromogenic רומן נבדק במטרה לספק שיטה טובה יותר עבור בידוד ובידול של spp Vibrio משמעות קלינית. הפרוטוקול משווה את הרגישות, סגולי וזיהוי הגבול לצורך זיהוי של V. parahaemolyticus בין מדיום chromogenic החדש מדיום קונבנציונלי. V. השונה זני parahaemolyticus (n = 22) מחדשהצגת קפסיד ומקור מגוונים של מקורות ששמשו. הם זוהו בעבר על ידי מינהל המזון והתרופות האמריקאי (FDA) המרכז לבקרת מחלות ומניעתן (CDC), ומאומת נוספת במעבדה שלנו על ידי tlh -PCR. לפחות ארבעה ניסויים נפרדים, זנים אלה היו מחוסנים על מלחי סוכרוז chromogenic אגר thiosulfate-ציטראט-מרה (TCBS) אגר, המהווה את המדיום המומלץ culturing מין זה, ואחריו דגירה על 35-37 מעלות צלזיוס למשך 24 hr -96. שלושה V. זני parahaemolyticus (13.6%) לא גדלו באופן אופטימלי על TCBS, בכל זאת הציגו מושבות ירוקות אם יש צמיחה. שני זנים (9.1%) לא הניב המושבות ציאן הצפויות על אגר chromogenic. V. אי זני parahaemolyticus (n = 32) נבדקו גם כדי לקבוע את הספציפיות של אגר chromogenic. בין זנים אלה, 31 לא גדלו ולא הפגינו שום מורפולוגיה מושבה אחרות. ההתאוששות הממוצעת של V. parahaemolyticus על chromogenic אגר היה ~ 96.4% ביחס ל אגר סויה tryptic בתוספת 2% NaCl. לסיכום, אגר chromogenic החדש הוא מדיום יעיל לגילוי V. parahaemolyticus וכדי להבחין בינו vibrios האחר.
Introduction
כחבר של סוג Vibrio, V. parahaemolyticus הוא גראם שלילי, שאינם יוצרי נבגים, מעוקל, חיידק דמוי מוט. הוא מציג תנועתיות גבוהה בשתי סביבות נוזלות חצי מוצק. רוב V. זני parahaemolyticus הם פתוגניים לבני אדם, אך תת פתוגניים גרמו מגיפות מגפות, ומכאן מין זה נחשב פתוגן foodborne חשוב במדינות רבות 1,2. השכיחות של זיהום Vibrio בארה"ב הוכיחה מגמת עלייה מאז 2000 3. בין spp Vibrio., V. parahaemolyticus הוא המין הנפוץ ביותר בגרימת מחלות בארצות הברית 4,5. מינים אחרים רלוונטיים קליני כוללים V. alginolyticus, V. vulnificus, V. cholerae ועוד אחוז קטן של המחלות נגרם על ידי מינים רבים בו זמנית.
Parahaemolyticus V. הוא i טבעיnhabitant מים ימיים ולכן התפוצה הרחבה ביותר במי אוקיינוס ברחבי העולם כולל שפכי נהרות. המין התגלה בשנת 1950 לאחר התפרצות של הרעלת מזון ביפן. בארה"ב, המין בודד לראשונה במי ים, משקעים, סרטנים וצדפות באזור Puget Sound 6,7. ניזונים מסנן בבתי גידול ימי, כגון צדפות צדפה, עשויים להכיל סוגי V. parahaemolyticus כחלק פלורה 8 הטבעית שלהם. ככזה, V. זיהומים parahaemolyticus ב האנושי לעיתים קרובות קשור לצריכה של פירות ים מזוהמים, במיוחד צדפות נא או שלא בושל. מסלול משותף פחות כניסה מתרחש כאשר פצע פתוח חשוף מי ים, מוביל לזיהום עור. רוב V. זני parahaemolyticus אינם גורם למחל אדם, אך תת מסוימים מחסה גורמים ארסיים כמו המוליזין ישיר thermostable (TDH) הם פתוגניים. התסמינים הנפוצים ביותר של V. foodborne parahaemolyticus זיהום הנושלשולים וכאבי בטן, ואחריו בחילות, הקאות וחום. כאבי ראש וצמרמורות גם מדווחות. תקופת הדגירה החציוני הוא 15 שעות, אבל יכול להיות עד 96 שעות לאחר צריכת כמות מספקת של זנים פתוגניים 9. המחלה נמשכת בין יומיים לשלושה ימים. הסימפטומים גסטרואנטריטיס הנגרמת על ידי V. parahaemolyticus הם בעיקר מעצמם ולכן טיפול מיוחד אין צורך. מקרים קלים של גסטרואנטריטיס ניתן לטפל ביעילות על ידי למקרה של התייבשות. עוד מחלות קשות ניתן לטפל על ידי אנטיביוטיקה כגון טטרציקלין או ציפרופלוקסצין 10. שיעור תמותה הוא כ -2% למקרי גסטרו, אך הוא עשוי להיות גבוה ככל 29% למי לפתח זיהום או הרעלת דם דם. כל אדם אשר צורכת פירות ים או יש פצע פתוח חשופים מי ים נמצא בסיכון של V. זיהום parahaemolyticus. הצורה חמורה יותר של מחלות, הרעלת דם מסכני חיים, נפוצה יותר בתוך תת-אוכלוסייה עם שיתוף רפואי בסיסיnditions 11, הכולל אלכוהוליזם, מחלות כבדות, סוכרת, מחלת כליות, ממאירות, ומצבים אחרים מובילים לתגובה חיסונית מוחלשת. יש לציין, קבוצה זו של אנשים היא גם בסיכון גבוה יותר לחלות במחלות קשות שנגרם על ידי V. vulnificus, אשר ניתן למצוא בבתי גידול טבעי דומה V. parahaemolyticus.
V. parahaemolyticus מבודדת באופן שגרתי באמצעות thiosulfate-ציטראט מרה מלחי סוכרוז (TCBS) אגר כמדיום סלקטיבית ההפרש. עשרה במי peptone אלקליין עלולים להקדים בידוד על אגר TCBS. מושבות משוערות על TCBS אז נבדקים נוספים מערך של בדיקות ביוכימיות / או מבחנים מולקולריים מיקוד הנוכחות של גנים ספציפי מינים. בשיטות מבוססות PCR משמשים לעתים קרובות כדי לאשר את זהותם של V. parahaemolyticus ידי הגברת גן המוליזין thermolabile, tlh 12.
לא משנה של chOICE של שיטות אישור, חשוב שיהיה מדיום יעיל לבודד ולהבחין V. parahaemolyticus מ vibrios הימי אחר מלכתחילה. TCBS נעשה שימוש בדרך כלל להבדיל מינים בתוך הסוג Vibrio לפי היכולות שלהם כדי להתסיס סוכרוז 12. תגובת תסיסה חיובית מלווה בשינוי בצבע הכחול Bromothymol אינדיקטור pH. V. מושבות parahaemolyticus הן די מובחנות TCBS, מפגין כחול לצבע ירוק. עם זאת, המדיום הזה לא יכול בקלות להבחין V. alginolyticus ו V. cholerae. תסיסת סוכרוז מינים פרוטאוס עשויים לייצר מושבות צהובות דומות V. cholerae או V. alginolyticus 13. על בידוד ראשוני על TCBS, V. parahaemolyticus יכול להיות גם בטעות כמפר Aeromonas hydrophila, shigelloides Plesiomonas, ו Pseudomonas spp 14. זנים עם Ferm סוכרוז מתעכבentation עלול להתבלבל עם סוכרוז אחר nonfermenting 13 Vibrio, הכולל V. parahaemolyticus. TCBS נמצאה להיות רגישים לא נגד Escherichia coli, putrefaciens Pseudomonas, בין היתר. מינים אחרים כמה להניב ירוק מושבות אפורות אשר מבולבלות פוטנציאלי עם V. parahaemolyticus או V. vulnificus 15. כתוצאה מכך, רצוי לפתח תקשורת תרבות האלטרנטיבית ברגישות טובה יותר וספציפי כלפי גילוי ובידוד V. parahaemolyticus ומינים אחרים קשורים זה לזה.
חלופות מדיה פותחו מספר לאחרונה. בנוסף להכללת סוכנים סלקטיבית, רוב לשלב מצעים chromogenic להבדיל מבוסס מינים על פעילות אנזימטית ההפרש שלהם. לדוגמה, indoxyl-β-glucoside ו indoxyl-β-galactoside שימשו מצעים chromogenic להבדיל V. פסקתימושבות haemolyticus (אשר מופיעים בצבע ירוק כחלחל) מאלו של V. cholerae (סגול) בשל היכולות ההפרש שלהם לייצר-glucosidase β ו β-galactosidase 16. ניסוחים שונים של אגר chromogenic שפותחו על ידי מספר קבוצות הוערכו ו דווחו לבצע דומה ל- או יותר טוב 17,18,19 TCBS. יתרון של שימוש בינוני chromogenic הוא כי והצביעה סביב המדיום היא מינימאלית ובכך מקלות על הבידוד של מושבות בפרט. במחקר זה, החוקרים העריכו את היכולת של מדיום chromogenic שעוצבה זה מקרוב כדי לזהות ולבודד V. cholerae, V. parahaemolyticus, ו V. vulnificus; עם דגש מיוחד על יכולתה להבחין V. parahaemolyticus ממינים אחרים.
Protocol
1. מדיה Culturing של זנים מיקרוביאלית
הערה: טכניקות ספטית השתמש בכל הניסויים. להשתמש בחומרים סטריליים. לעקר את כל המכולות, הכלים מגיבים לפני השימוש. חיטוי כל החומרים פסולת לפני הסילוק משום שהם נחשבים ביולוגיים מסוכנים. טמפרטורת חיטוי שילוב זמן היא ≥121 ° C x ≥15 דקות לכל מההליכים הבאים.
- כדי להפוך ~ 1-L אגר סויה tryptic (TSA), הראשון להוסיף 1 ליטר deionized מים בבקבוק 2-L Erlenmeyer המכיל בר ומערבבים מגנטי. השתמש בבקבוק כי הוא לפחות פי שתיים גדול יותר הנפח הסופי. להוסיף 30 גרם של אבקת מרק סויה tryptic ו -20 גרם אגר גרגירים לתוך הבקבוק.
הערה: השתמש 2% אגר במקום 1.5% להגביל ומסחף כמה spp Vibrio.- מערבבים היטב על ידי הפעלת בוחש. תוך ערבוב, להפעיל את החימום כדי להרתיח את התערובת. הסר את הבקבוק מן התנור ברגע שהתערובת מתחילה לרתוח. רופף לכסות הבקבוק דואר עם נייר אלומיניום. קלטת רדיד כדי לאבטח אותו אל הבקבוק לפני החיטוי.
- כדי להפוך מרק סויה tryptic (TSB), להשמיט את אגר מן המתכון בשלב 1.1.
הערה: אפשר להשתמש בקבוקים במקום בקבוק Erlenmeyer. - כדי להפוך אגר סויה tryptic בתוספת נתרן כלורי 2% או NaCl (TSAS), להוסיף 20 גרם של NaCl בתערובת לפני ערבוב וחימום. כדי להפוך מרק סויה tryptic בתוספת 2% NaCl (TSBS), להשמיט את אגר, להוסיף 20 גרם של NaCl בתערובת לפני ערבוב וחימום.
- כדי להפוך מוח לב עירוי (BHI) אגר, להשעות 37 גרם של אבקת BHI ו -15 גרגרי גרם אגר ב 1 ליטר של מים מטוהרים. חום עם תסיסה תכופה לפזר את האבקה. חיטוי. השמט אגר לעשות מרק BHI.
- כדי להפוך אגר TCBS, להשעות 89 גרם של אבקת TCBS ב 1 ליטר של מים מטוהרים. חום עם תסיסה ומרתיחים תכופים עבור 1 דקות כדי לפזר את האבקה לחלוטין. אל חיטוי.
- עבור כל מדיה אגרה, לקרר את אגר החם 45-50 ° צלזיוס באמבט מים. מסדרים צלחות פטרי ריקות בערימות של חמש עד שש צלחות. החל בתחתית הערימה, לשפוך אגר מותך לתוך כל צלחת פטרי להגיע כחצי מלא. סגור את מכסת צלחת פטרי לאחר המזיגה. אפשר אגר כדי לחזק על ידי נותן צלחות לשבת בטמפרטורת החדר.
- השתמש הצלחות אגרו למחרת או אחרי 12 שעות. אחסן צלחות בשימוש במקרר עד שבועיים. לפני השימוש, להסיר צלחות מהמקרר לאזן אותם בטמפרטורת החדר למשך 15 דקות לפחות.
הערה: אגר אחת ליטר עושה ~ 45 צלחות אגר. אפשר הצלחות אגרו להתייבש מספיק ביום הכנה, לאזן אותם לטמפרטורת חדר לאחר בקירור כדי להפחית ביעילות את התפשטות המושבות.
- השתמש הצלחות אגרו למחרת או אחרי 12 שעות. אחסן צלחות בשימוש במקרר עד שבועיים. לפני השימוש, להסיר צלחות מהמקרר לאזן אותם בטמפרטורת החדר למשך 15 דקות לפחות.
- השג צלחות אגר שוקולד chromogenic לאזן אותם בטמפרטורת החדר לפני כל ניסוי.
- תת כל 54 זני חיידקים שניתן לראות בטבלה 1 כל כמה days.
- השתמש לולאת inoculating סטרילי להעביר תרבויות ממלאי קפוא או שקבוצה קודמת למדיה nonselective כגון BHI, TSB / TSA או אגרו שוקולד. לגדול spp Vibrio halophilic. על TSBS / TSAS.
- כדי לבדוק את טוהר התרבות, פס כל הזנים בתבנית שתאפשר תצפית של מושבות מבודדות. לדוגמה, להשתמש בדפוס פסים תלת פאזיים לדלל כמות גדולה של חיידקים כמות קטנה יותר, בסופו של דבר מניב מושבות מבודדות.
- הדגירה ההפוכה הצלחות ב 35-37 מעלות צלזיוס עד 48 שעות. לקבלת spp קמפילובקטר., דגירה צינורות או צלחות בצנצנת סגורה המכסה המכיל כיס גז לייצר סביבה microaerophilic. שים מורפולוגיה מושבה לאחר דגירה. תרבויות טהורות אמורות להניב מושבות כי תערוכת מורפולוגיה מושבה דומה.
הערה: דגירה כל הצלחות הפוכות כדי למנוע טיפות מים דחוסות נוצרו על החלק התחתון של המכסה מלנפול על colonies.
2. קביעת מיני PCR
- לנהל tlh -PCR כדי לוודא את זהותו של V. זני parahaemolyticus. השתמש פריימרים tlh -f (5 'AAA מהפקולטה לרוקחות אוכלים גת TAT GCA GAA GCA CTG 3') ו -R tlh (5 'GCT ACT TTC TAG CAT TTT CTC TGC 3') כדי להגביר שבר 450 נ"ב של הגן thermolabile המוליזין 20 .
- השתמש לולאת inoculating סטרילי להעביר כמה מושבות מבודדות של כל V. זן parahaemolyticus מ TSAS עד 5 מ"ל של TSBS. לדגור על 35-37 מעלות צלזיוס במשך 16-24 שעות.
- תרבויות צנטריפוגה ב 14,000 XG דקות 1. הסר supernatant לשטוף את הכדור פעמיים עם בופר פוספט (PBS). מרתיחים את ההשעיה למשך 3 דקות להניב lysate התא.
הערה: V. parahaemolyticus קל להיות lysed. לכן מגיב תמוגה אינו נדרש. כמו כן ניתן להשתמש קצת המושבה ישירות כתבנית. - בצע PCR בתוך נ התגובה 25-μlolume. הכינו תערובת התגובה המכיל ריכוז סופי של חיץ 1x PCR, 1.5 מ"מ MgCl 2, 100 מיקרומטר של כל dNTP, 1 מיקרומטר של כל צבע יסוד, 1 U תקי פולימראז ו 1 μl של lysate התא. לאחר preincubation ב 94 מעלות צלזיוס למשך 5 דקות, לרוץ 35 מחזורי הגברה של 94 מעלות צלזיוס למשך 30 שניות, 58 ° C למשך 30 שניות, ו -72 מעלות צלזיוס למשך 60 שניות 21.
- aliquots טען של amplicon 5 μl ג'ל agarose 1.5%. הפעל אספקת החשמל להתחיל אלקטרופורזה. דמיינו את קיומו או אי קיומו של amplicons תחת תאורה UV לאחר מכתים ברומיד ethidium.
צמיחה 3. על סלקטיב דיפרנציאל מדיה
- שניים עד ארבעה ימים לפני הניסוי, פס כל זני חיידקים שניתן לראות בטבלה 1 על מדיום סלקטיבי (TSAS, BHI או אגר שוקולד) לבידוד המושבה. דגירת צלחות על 35-37 מעלות צלזיוס למשך 48 שעות. בדוק את הטוהר של התרבויות על ידי התבוננות מורפולוגיה מושבה לאחר דגירה. תרבויות טהורות אמורות להניב מושבות כי תערוכת מורפולוגיה מושבה דומה.
- העבר כמה מושבות מבודדות שלב 3.1 ל -5 מיליליטר של מרק. דגירת צינורות ב 35-37 מעלות צלזיוס במשך 16-24 שעות.
הערה: מושבות צעירות השתמש, שהן פחות מארבעה ימים ישנים, להכין תרבויות לילה בכל הניסויים. - Streak loopful של תרבויות לילה על תקשורת סלקטיבית הפרש (TCBS אגר chromogenic) לבידוד מושבה. דגירה צלחות על 35-37 מעלות צלזיוס עד 96 שעות.
- רשום את הצמיחה הכוללת של כל הזנים על ידי בדיקת צפיפות התרבות על הצלחת ואת הגודל של מושבות מבודדות. רשום את הצבע של מושבות תחת אור סביבה ו / או UV. הערת מאפיינים אחרים של מושבה המבודדת כגון הגובה, שולי וצורה.
Assay Recovery 4.
- בחר קבוצת משנה נציג V. זני parahaemolyticus (n = 14), שיכילו קפסיד ומקורותיה השונים של בידוד 22. לחסן תרבויות צעירות מהצלחות אל 5 מיליליטר של TSBS. דגירת הצינורות ב 35-37 מעלות צלזיוס במשך 16-24 שעות.
- לנהל שיטת רוזן פלייט התקן של תרבויות הלילה כמתוארת להלן.
- וורטקס לערבב את תרבויות לילה טוב. ערכו של פי 10 או 10 -1 דילול ידי העברת 100 μl של תרבות הלילה לתוך צינור המכיל 900 μl PBS. וורטקס לערבב היטב.
- השתמש טיפ pipet חדש להעביר 100 μl מהצינור 10 -1 דילול למשנהו שפופרת המכילה 900 μl PBS. וורטקס לערבב היטב. זה מהווה 10 -2 דילול. חזור על התהליך ברצף כדי לקבל 10 -7 דילול.
- באמצעות צינורות דילול 4- עד 10 -7 10, צלחת 100 μl כל על צלחות אגר chromogenic, TCBS ו TSAS.
הערה: גורם לדילול (DF) על הצלחת הופך 10 -5 עד 10 -8, בהתאמה. - מורחים את aliquots שווה על tהוא אגר משטח.
הערה: זה בסדר להשתמש באותו מפזר לכל זן על המדיום הזהה, כל עוד aliquot המדולל ביותר היא התפשטה ראשונה (כלומר, מ 10 -8 עד 10 -5). אין להשתמש באותו המפזר עבור מדיה שונה. - דגירה צלחות על 35-37 מעלות צלזיוס עד 96 שעות. רוזן מושב על הצלחות. התעלם צלחות נושאות מושבות כי הם רבים מספור (tntc) או פחות מ 25. חישוב CFU / mL לפי הפירוט הבא:
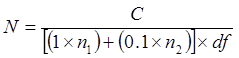
איפה
N = מספר תאים בצינור החי, כפי שבא לידי ביטוי CFU / ml או CFU / g
C = המספר הכולל של מושבות נספרות על צלחות נושאות 25-300 מושבות
n 1 = מספר לוחית (ים) שבו מושבות נספרות הם מן DF הנמוך
n 2 = מספר לוחית (ים) שבו מושבות נספרות הן מהדילול פי 10 עוקב
דf = גורם לדילול נמוך (כלומר, דילול מרוכז יותר)
- השוואת CFU / ml בקרב מדיה שונה. השתמש CFU / ml על TSAS כמו 100%, לחשב את התאוששות% של V. parahaemolyticus גדל על אגר chromogenic ו TCBS.
Assay תחרות 5.
- בחר קבוצת משנה של זנים כי תערוכת מורפולוגיה מושבה שונות על אגר chromogenic ו TCBS.
הערה: בדרך זו, ניתן יהיה לספור מושבות שמקורה V. parahaemolyticus בלבד, למרות נוכחותם של מינים אחרים הבידוד.- בחר V. זן parahaemolyticus מניב מושבות טורקיז ציאן הצפויות על TCBS ואת אגר chromogenic, בהתאמה.
- בחר V. אי parahaemolyticus וכן מיני Vibrio הלא שאינו גדלים משני של כלי התקשורת הללו, או שהם משקפים צבע מושבה שונה.
הערה: לדוגמה, V. metschnikovii גדל מאוד חלש on TCBS ולא גדל על אגר chromogenic. Shigella sonnei לא צומח על TCBS אבל מניב מושבות מגנטו על אגר chromogenic.
- לאחר הבחירה של הזנים לעיל, להכין תרבויות מרק לילה באמצעות מושבות מבודדות גדלו על תקשורת לא סלקטיבי.
- הפוך תרבויות לילה של V. parahaemolyticus ו V. metschnikovii ידי העברה כמה מושבות מבודדות מן TSAS עד 5 מיליליטר של TSBS. לדגור על 35-37 מעלות צלזיוס במשך 16-24 שעות.
- הפוך תרבויות לילה של Shigella sonnei ידי העברת כמה מושבות מבודדות מן אגר BHI עד 5 מ"ל של מרק BHI. לדגור על 35-37 מעלות צלזיוס במשך 16-24 שעות.
- עבור כל זן, לבצע שורת דילול דומה שלבי 4.2.1 ו 4.2.2. דילולי צלחת מתאימים על TSAS או BHI לקבוע CFU / מיליליטר של התרבות לילה, באמצעות המשוואה מוצגת שלב 4.2.5.
הערה: בדרך כלל, 100 μl מן 10 -5 עד 10 -7 דילולצינורות עובדים ברוב התרבויות. השתמש בערכי CFU / ml לגבות לחשב את הסכום המדויק של תאים המשמשים לשלב הבא. הערכים מחושבים CFU / ml מתקבלים לאחר דגירה, אם כי השלבים הבאים מבוצעים באותו התאריך כמו שלב 5.3. - שימוש תרבויות הלילה וצינורות דילול שלבי 5.2 ו -5.3, לערבב כמויות שונות של V. זן parahaemolyticus לבין V. אי מיני parahaemolyticus. לדוגמה, לערבב 500 μl של הצינור 10 -5 דילול של V. parahaemolyticus עם 500 μl של תרבויות לילה של V. metschnikovii.
הערה: תערובת זו מדמה רקע microflora גבוהה. כדי לדמות רקע microflora נמוך, לערבב 500 μl כל של צינור 10 -5 דילול משני המינים. - מורחים 100 μl של תערובת כל על צלחות אגר chromogenic, TCBS ו TSAS.
- לאחר הדגרה ב 35-37 מעלות צלזיוס למשך עד 96 שעות, לספור מושבות של V. parahaemolyticuים ואת V. אי מיני parahaemolyticus מבוסס על שונותם בצמיחה ומורפולוגיה מושבה על אגר chromogenic ו TCBS.
הערה: לדוגמה, אם V. אי מיני parahaemolyticus לא צומחים על אגרת chromogenic ו TCBS, כל המושבות תהיינה של V. parahaemolyticus. אם V. אי מיני parahaemolyticus גדלו משני התקשורת, רק המושבות הטורקיז על מושבות TCBS ציאן על אגרת chromogenic תהיינה של V. parahaemolyticus. הזווית הלא מיני parahaemolyticus יכולים או לא יכולים להציג מורפולוגיה מושבה דומה V. parahaemolyticus על TSAS.- אם V. אי מיני parahaemolyticus גדלו בדומה V. parahaemolyticus על מדיום סלקטיבי זה, לחלק את ספירת המושבה על ידי שני כדי להשיג מספרים על V. parahaemolyticus בלבד. השווה את ספירת המושבה בפועל עם הספירה הצפויה נגזרת שלב 5.3.
6. Effects של אויסטר homogenates
- לשקול ≥50 בשר גרם צדף מאי ≥12 רכיכות molluscan כוללים בשר ומשקאות חריפים.
- להוסיף כמות שווה של PBS על בשר הצדפה והמשקאות החריפים. טוחנים את התערובת במהירות גבוהה במשך 90 שניות. זה מהווה 2 -1 homogenate צדפה מדולל.
- להוסיף 100 גרם של homogenate צדפה 2 -1 מדולל ל 400 גרם של PBS. השתמש בקנה מידה כדי למדוד את המשקל, לא נפח. טוחנים את התערובת במהירות גבוהה במשך 1 דקות. חיטוי homogenate הצדפה.
הערה: זו תהיה homogenate צדפה המשמש spiking.
- חזור על assay Recovery (שלב 4) בנוכחות של homogenate צדפה.
- לאחר homogenate צדפה 500 גרם מתקרר, להוסיף 100 μl של V. parahaemolyticus תרבויות לילה הגדלים TSBS אליו. קבע את הסכום בפועל של V. תאי parahaemolyticus ב הבידוד על ידי ביצוע נהלי רוזן פלייט הרגילים המתואר בשלב 4.2.
- נציגלאכול את assay תחרות (שלב 5) בנוכחות של homogenate צדפה.
- לאחר homogenate צדפה 500 גרם מתקרר, להוסיף 100 μl כל תרבויות לילה של V. parahaemolyticus וו אי parahaemolyticus אליו. קבע את הסכום בפועל של חיידקים תאי הבידוד על ידי ביצוע נהלי רוזן פלייט הרגילים המתואר בשלב 4.2
- מערבבים את התאים חיידקים עם homogenate צדפה גם באמצעות homogenizer.
הערה: לאחר ערבוב, את homogenate צדפה המכיל את התאים הוסיף בכוונה נקרא ממוסמר homogenate צדפה. - הפוך את דילולים של homogenate צדפה ממוסמר להשיג 10 -1 עד 10 -3 צינורות דילול פי הנהלים המתוארים שלב 4.2.2. מורחים 100 μl של דילול כל על אגר chromogenic, TCBS ו TSAS. דגירה צלחות על 35-37 מעלות צלזיוס עד 96 שעות.
- השווה את ספירת המושבה בפועל על אגר chromogenic ו TCBS עם האקסספירת המושבה pected להסיק שלבים 6.2.1 ו 6.3.1.
הערה: לדוגמה, אם צינור של V. תרבות הלילה parahaemolyticus מכיל 10 8 CFU / ml, גידול הבידוד של 100 μl כלומר 10 7 תאים מתווספים 500 גרם של homogenate צדפה, מניב 5 x 10 4 תאים / g. לאחר דילול ציפוי, צלחת שיש df = 10 -2 אמורים להניב 500 מושבות; בעוד כי DF שיש = 10 -3 אמורים להניב 50 מושבות. אלו הם ספירת מושבה הצפויה.
תוצאות
במחקר זה, 54 זנים של חיידקים נאספו, שכלל 22 זנים בתוך V. מיני parahaemolyticus, 19 מיני Vibrio אחרים, ו -13 מיני Vibrio מייננת (טבלה 1). רוב V. זני parahaemolyticus התקבלו גם מן ה- FDA, ה- CDC או מחלקות בריאות ממלכתיות אחרות. הם מייצגים קפסיד מגוונים...
Discussion
מחקר זה מתמקד בפיתוח התקשורת והתרבות והערכה. כמקובל, TCBS היא סלקטיבית ובינוניים ההפרש המשמש לבידוד ואיתור V. parahaemolyticus, V. cholerae ו V. vulnificus 12. עם זאת, מגבלות דווחו על המדיום הזה, כגון אי היכולת להבדיל V. cholerae ממיני Vibrio אחרים. סוכרוז אינדיקטור pH הם סוכ?...
Disclosures
Some media were generously provided by Hardy Diagnostics, Santa Maria, CA. Thorsen conducted this study while a student at California Polytechnic State University. He is currently an employee of Hardy Diagnostics.
Acknowledgements
אנו מודים מ Channey, א צ'או, ו ק תומס על עזרתם על הפרויקט. אספקה הפרויקט מומנו חלקית על ידי אוניברסיטת מדינת הפוליטכני בקליפורניה.
Materials
| Name | Company | Catalog Number | Comments |
| Reagent/Equipment | |||
| Agar | Fisher Scientific | DF0140-15-4 | may use other brands |
| Autoclave | Any | ||
| BHI powder | Fisher Scientific | DF0418-17-7 | may use other brands |
| Blender | Any | to blend oyster meat | |
| CampyGen gas generator | Hardy Diagnostics | CN035A | to provide a microaerophilic atmosphere; may use other brands |
| Chocolate agar plates | Hardy Diagnostics | E14 | may use other brands |
| Common PCR reagents (dNTPs, MgCl2, Taq Polymerase) | Any | or use PCR beads (Fisher Sci 46-001-014) | |
| Culture tubes | Fisher Scientific | S50712 | may use other brands |
| Eppendorf tubes | Fisher Scientific | S348903 | may use other brands |
| Gel doc | Any | ||
| HardyChrom Vibrio agar plates | Hardy Diagnostics | G319 | This study evaluates this medium |
| Incubator | Any | ||
| Inoculating loops | Fisher Scientific | 22-363-606 | 10 microliter-size was used in this study |
| NaCl | Fisher Scientific | BP358-212 | may use other brands |
| Oysters | Any | ||
| PBS | Fisher Scientific | R23701 | may use other brands |
| Petri dish | Fisher Scientific | FB0875713 | may use other brands |
| Pipette and tips | Any | Sterilized tips | |
| Primers for tlh | IDT DNA | ||
| Scale | Any | ||
| Spreader | Fisher Scientific | 08-100-11 | Beads may be used instead |
| Stomacher blender | Stomacher | 400 | Samples were homogenized at 200 rpm for 30 sec. Other homogenizer can be used. |
| Sterile filter bags for blenders | Fisher Scientific | 01-812-5 | |
| TCBS powder | Hardy Diagnostics | 265020 | This study evaluates this medium |
| Thermocycler | Any | ||
| TSB powder | Fisher Scientific | DF0370-07-5 | may use other brands |
| UV viewing cabinet | Any | Emit long-wave UV light | |
| Water bath | Any | | |
| Name | Sources | Catalog Number | Comments |
| Bacterial species and strains | |||
| Aeromonas hydrophila | ATCC | ||
| Candida albicans | ATCC | ||
| Campylobacter jejuni | ATCC | ||
| Escherichia coli | ATCC | ||
| Proteus mirabilis | ATCC | ||
| Pseudomonas aeruginosa | ATCC | ||
| Staphylococcus aureus | ATCC | ||
| Salmonella Choleraesuis | ATCC | ||
| Shigella boydii | ATCC | ||
| Shigella flexneri | ATCC | ||
| Shigella sonnei | ATCC | ||
| Vibrio alginolyticus | ATCC | ||
| V. cholerae (serotypes include O139, O1, non O1, El Tor biovars) | FDA, ATCC | ||
| V. damsela | FDA | ||
| V. fisheri | Environment | ||
| V. fluvialis | CDC | ||
| V. furnissii | CDC | ||
| V. hollisae | FDA | ||
| V. metschnikovii | ATCC | ||
| V. mimicus | FDA | ||
| V. parahaemolyticus (serotypes include O3:K6, O1:K56, O4:K8, O5:K15, O8, etc.) | ATCC, FDA, CDC, Environment | ||
| V. proteolyticus | FDA | ||
| V. vulnificus | FDA |
References
- Yeung, P. S., Boor, K. J. Epidemiology, pathogenesis, and prevention of foodborne Vibrio parahaemolyticus infections. Foodborne Pathog. Dis. 1 (2), 74-88 (2004).
- Yeung, P. S. M., Boor, K. J., Faruque, S. M. Epidemiology, molecular biology, and detection of foodborne Vibrio parahaemolyticus infections. Foodborne and Waterborne Bacterial pathogens: Epidemiology, Evolution and Molecular Biology. , 153-184 (2012).
- Centers for Disease Control and Prevention. Vital Signs: Incidence and Trends of Infection with Pathogens Transmitted Commonly Through Food - Foodborne Diseases Active Surveillance Network, 10 U.S. Sites, 1996-2010. Morbidity and Mortality Weekly Report. 10, 1996-2010 (2011).
- . Summary of human Vibrio cases reported to CDC, 2008 Available from: https://stacks.cdc.gov/view/cdc/21591 (2008)
- Scallan, E., et al. Foodborne illness acquired in the United States - major pathogens. Emerg. Infect. Dis. 17 (1), 7-15 (2011).
- Baross, J., Liston, J. Occurrence of Vibrio parahaemolyticus and related hemolytic vibrios in marine environments of Washington State. Appl. Microbiol. 20 (2), 179-186 (1970).
- Baross, J., Liston, J. Isolation of Vibrio parahaemolyticus from the Northwest Pacific. Nature. 217 (5135), 1263-1264 (1968).
- Kueh, C. S., Chan, K. Y. Bacteria in bivalve shellfish with special reference to the oyster. J. Appl. Bacteriol. 59 (1), 41-47 (1985).
- Food and Drug Administration. . Bad Bug Book, Foodborne Pathogenic Microorganisms and Natural Toxins. , (2012).
- Qadri, F., et al. Adaptive and inflammatory immune responses in patients infected with strains of Vibrio parahaemolyticus. J. Infect. Dis. 187 (7), 1085-1096 (2003).
- MacFaddin, J. F. . Media for isolation-cultivation-identification-maintenance of medical bacteria. 1, (1985).
- Bottone, E. J., Robin, T. Vibrio parahaemolyticus: suspicion of presence based on aberrant biochemical and morphological features. J. Clin. Microbiol. 8 (6), 760-763 (1978).
- Lotz, M. J., Tamplin, M. L., Rodrick, G. E. Thiosulfate-citrate-bile salts-sucrose agar and its selectivity for clinical and marine vibrio organisms. Ann. Clin. Lab. Sci. 13 (1), 45-48 (1983).
- Hara-Kudo, Y., Nishina, T., Nakagawa, H., Konuma, H., Hasegawa, J., Kumagai, S. Improved method for detection of Vibrio parahaemolyticus in seafood. Appl. Environ. Microbiol. 67 (12), 5819-5823 (2001).
- Eddabra, R., Piemont, Y., Scheftel, J. M. Evaluation of a new chromogenic medium, chromID Vibrio, for the isolation and presumptive identification of Vibrio choleare and Vibrio parahaemolyticus from human clinical specimens. Eur. J. Clin. Microbiol. Infect. Dis. 30 (6), 733-737 (2011).
- Kodaka, H., Teramura, H., Mizuochi, S., Saito, M., Matsuoka, H. Evaluation of the Compact Dry VP method for screening raw seafood for total Vibrio parahaemolyticus. J. Food. Prot. 72 (1), 169-173 (2009).
- Su, Y. C., Duan, J., Wu, W. H. Selectivity and specificity of a chromogenic medium for detecting Vibrio parahaemolyticus. J. Food Prot. 68 (7), 1454-1456 (2005).
- Bej, A. K., Patterson, D. P., Brasher, C. W., Vickery, M. C., Jones, D. D., Kaysner, C. A. Detection of total and hemolysin-producing Vibrio parahaemolyticus in shellfish using multiplex PCR amplification of tl, tdh and trh. J. Microbiol. Methods. 36 (3), 215-225 (1999).
- Yeung, P. S. M., DePaola, A., Kaysner, C. A., Boor, K. J. A PCR assay for specific detection of the pandemic Vibrio parahaemolyticus O3:K6 clone from shellfish. J. Food Sci. 68 (4), 1459-1466 (2003).
- Yeung, P. S. M., Hayes, M. C., DePaola, A., Kaysner, C. A., Kornstein, L., Boor, K. J. Comparative phenotypic, molecular, and virulence characterization of Vibrio parahaemolyticus O3:K6 isolates. Appl. Environ. Microbiol. 68 (6), 2901-2909 (2002).
- Duan, J., Su, Y. -. C. Comparison of a chromogenic medium with thiosulfate-citrate-bile salts-sucrose agar for detecting Vibrio parahaemolyticus. J. Food Sci. 70, M125-M128 (2005).
- Pinto, A. D., Terio, V., Novello, L., Tantillo, G. Comparison between thiosulphate-citrate-bile salt sucrose (TCBS) agar and CHROMagar Vibrio for isolating Vibrio parahaemolyticus. Food Control. 22 (1), 124-127 (2011).
- Canizalez-Roman, A., Flores-Villaseñor, H., Zazueta-Beltran, J., Muro-Amador, S., Leòn-Sicairos, N. Comparative evaluation of a chromogenic agar medium-PCR protocol with a conventional method for isolation of Vibrio parahaemolyticus strains from environmental and clinical samples. Can J Microbiol. 57 (2), 136-142 (2011).
- Kriem, M. R., et al. Prevalence of Vibrio spp. in raw shrimps (Parapenaeus longirostris) and performance of a chromogenic medium for the isolation of Vibrio strains. Lett Appl Microbiol. 61 (3), 224-230 (2015).
- Food Drug Administration. Statistical guidance on reporting results from studies evaluating diagnostic tests. http://www.fda.gov/RegulatoryInformation/Guidances/ucm071148.htm. , (2007).
- Burd, E. M. Validation of laboratory-developed molecular assays for infectious diseases. Clin Microbiol Rev. 23 (3), 550-576 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved