Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Desarrollo de una más sensible y específica cromogénico medio de agar para la detección de
En este artículo
Resumen
Detection and isolation of clinically relevant Vibrio species require selective and differential culture media. This study evaluated the ability of a new chromogenic medium to detect and identify V. parahaemolyticus and other related species. The new medium was found to have better sensitivity and specificity than the conventional medium.
Resumen
Infecciones transmitidas por los alimentos en los EE.UU. causada por especies de Vibrio han mostrado una tendencia al alza. En el género Vibrio, V. parahaemolyticus es responsable de la mayoría de las infecciones -asociado Vibrio. Por lo tanto, la diferenciación precisa entre Vibrio spp. y la detección de V. parahaemolyticus es de vital importancia para garantizar la seguridad de nuestro suministro de alimentos. Aunque las técnicas moleculares son cada vez más comunes, métodos de cultivo a dependiendo todavía de forma rutinaria hecho y que se consideran métodos estándar en determinadas circunstancias. Por lo tanto, un nuevo medio de agar cromogénico fue probado con el objetivo de proporcionar un mejor método para el aislamiento y la diferenciación de Vibrio spp clínicamente relevante. El protocolo compara el límite de sensibilidad, especificidad y de detección para la detección de V. parahaemolyticus entre el nuevo medio cromogénico y un medio convencional. Varios V. parahaemolyticus cepas (n = 22) de reSe han usado presentar diversos serotipos y de la fuente de origen. Ellos fueron identificados previamente por la Administración de Alimentos y Medicamentos (FDA) y los Centros para el Control y la Prevención de Enfermedades (CDC), y verificado aún más en nuestro laboratorio por TLH-PCR. En por lo menos cuatro ensayos separados, estas cepas se inocularon en el agar y tiosulfato-citrato-sales biliares-sacarosa cromogénicos (TCBS) de agar, que es el medio recomendado para el cultivo de esta especie, seguido de incubación a 35-37 ° C durante 24 h -96. Tres V. parahaemolyticus cepas (13,6%) no crecieron de manera óptima en TCBS, no obstante, exhibieron colonias de color verde si había crecimiento. Dos cepas (9,1%) no dieron los esperados cian colonias en el agar cromogénico. V. no cepas parahaemolyticus (n = 32) también se probaron para determinar la especificidad de la agar cromogénico. Entre estas cepas, 31 no crecieron o exhibieron otras morfologías de colonias. La recuperación media de V. parahaemolyticus en el chromogenic agar fue de ~ 96,4% en relación con agar de soja tríptico suplementado con 2% de NaCl. En conclusión, el nuevo agar cromogénico es un medio eficaz para detectar V. parahaemolyticus y para diferenciarlo de otros vibrios.
Introducción
Como miembro del género Vibrio, V. parahaemolyticus es una bacteria Gram-negativas, no formadoras de esporas, curvada, en forma de barra. Se presenta una alta movilidad en ambos ambientes líquidos y semisólidos. La mayoría V. parahaemolyticus cepas no son patógenos para los seres humanos, sin embargo, los subtipos patógenos han causado epidemias y pandemias, por lo tanto, esta especie se considera que es un importante patógeno de transmisión alimentaria en muchos países 1,2. La incidencia de la infección por Vibrio en los EE.UU. ha mostrado una tendencia al alza desde el año 2000 3. Entre Vibrio spp., V. parahaemolyticus es la especie más frecuentemente reportado que causan enfermedades en los EE.UU. 4,5. Otras especies clínicamente relevantes incluyen V. Alginolyticus, V. vulnificus, V. cholerae, etc. Un pequeño porcentaje de las enfermedades es causada por múltiples especies simultáneamente.
V. parahaemolyticus es una i naturalesnhabitant de agua marina y, por tanto, ampliamente distribuido en aguas marinas en todo el mundo, incluyendo los estuarios. La especie fue descubierta en 1950 después de un brote de intoxicación alimentaria en Japón. En los EE.UU., la especie fue aislada por primera vez en el agua de mar, sedimentos y moluscos en la región de Puget Sound 6,7. Filtradores en los hábitats marinos, como los moluscos bivalvos, pueden albergar V. parahaemolyticus como parte de su flora natural 8. Como tal, V. infecciones parahaemolyticus en humanos a menudo están relacionados con el consumo de mariscos contaminados, especialmente los mariscos crudos o poco cocidos. Una ruta menos común de entrada se produce cuando herida abierta se expone al agua del mar, lo que lleva a una infección cutánea. La mayoría V. cepas parahaemolyticus no causan enfermedad en humanos, sin embargo, ciertos subtipos que albergan los factores de virulencia como hemolisina directa termoestable (TDH) son patógenas. Los síntomas más frecuentes de transmisión alimentaria V. infección son parahaemolyticusdiarrea y dolor abdominal, seguido de náuseas, vómitos y fiebre. También se informa de dolor de cabeza y escalofríos. El período de incubación promedio es de 15 horas, pero puede ser de hasta 96 horas después del consumo de una cantidad suficiente de cepas patógenas 9. La enfermedad dura de dos a tres días. Los síntomas de la gastroenteritis causada por V. parahaemolyticus son en gran medida auto-limitante y, por tanto, un tratamiento especial no es necesario. Los casos leves de gastroenteritis pueden ser tratados eficazmente mediante rehidratación oral. Más enfermedades graves se pueden tratar con antibióticos tales como la tetraciclina o la ciprofloxacina 10. La tasa de mortalidad es de alrededor del 2% de los casos de gastroenteritis, pero puede ser tan alta como 29% para aquellos que desarrollan infección del torrente sanguíneo o septicemia. Cualquier persona que consume mariscos o tiene una herida abierta expuesta al agua de mar está en riesgo de V. infección parahaemolyticus. La forma más grave de enfermedades, septicemia que amenaza la vida, es más común en una subpoblación con co médico subyacentenditions 11, que incluyen el alcoholismo, enfermedad hepática, diabetes, enfermedad renal, enfermedad maligna, y otras condiciones que conducen a una respuesta inmune debilitado. Cabe destacar que este grupo de personas es también un riesgo mayor de contraer enfermedades graves causadas por V. vulnificus, que se puede encontrar en los hábitats naturales similares a V. parahaemolyticus.
V. parahaemolyticus se aísla de forma rutinaria usando agar sales de sacarosa tiosulfato-citrato-biliares (TCBS) como un medio selectivo y diferencial. El enriquecimiento en agua de peptona alcalina puede preceder el aislamiento en agar TCBS. presuntas colonias en TCBS se prueban aún más en una serie de pruebas bioquímicas y / o ensayos moleculares dirigidas a la presencia de genes específicos de cada especie. Métodos basados en PCR se utilizan a menudo para confirmar la identidad de V. parahaemolyticus mediante la amplificación del gen de la hemolisina termolábil, tlh 12.
Independientemente de la choice de los métodos de confirmación, es importante tener un medio eficaz para aislar y diferenciar V. parahaemolyticus de otros vibrios marinos en el primer lugar. TCBS rutinariamente se ha utilizado para diferenciar las especies dentro del género Vibrio, según su capacidad para fermentar la sacarosa 12. Reacción de fermentación positiva se acompaña de un cambio de color del indicador de pH de bromotimol azul. V. colonias parahaemolyticus son bastante distintiva en TCBS, exhibiendo color de azul a verde. Sin embargo, este medio no puede diferenciar fácilmente V. alginolyticus y V. cholerae. especies de Proteus sacarosa-fermentación pueden producir colonias de color amarillo que se asemejan V. V. cholerae o Alginolyticus 13. El aislamiento inicial en TCBS, V. parahaemolyticus también se han identificado erróneamente como Aeromonas hydrophila, Plesiomonas shigelloides, y Pseudomonas spp 14. Las cepas con ferm sacarosa retardadaentación puede ser confundida con otra sacarosa no fermentadores Vibrio 13, que incluye V. parahaemolyticus. TCBS se encontró que no es sensible frente a Escherichia coli, Pseudomonas putrefaciens, entre otros. Varias otras especies producen colonias verdes a grises que son potencialmente confundirse con V. V. parahaemolyticus o 15 vulnificus. Como resultado de ello, es deseable desarrollar medios de cultivo alternativa con mejor sensibilidad y especificidad hacia la detección y el aislamiento de V. parahaemolyticus y otras especies estrechamente relacionadas.
Varias alternativas de medios de comunicación se han desarrollado recientemente. Además de la inclusión de agentes selectivos, la mayoría incorporan sustratos cromogénicos para diferenciar especies en base a sus actividades enzimáticas diferenciales. Por ejemplo, indoxilo-β-glucósido y de indoxilo-β-galactósido se han utilizado como los sustratos cromogénicos para diferenciar V. paracahaemolyticus colonias (que aparecen de color verde azulado) de las de V. cholerae (púrpura) debido a sus capacidades diferenciales para producir β-glucosidasa y β-galactosidasa 16. Diferentes formulaciones de agar cromogénico desarrolladas por varios grupos han sido evaluados y se informó para llevar a cabo de forma comparable a o mejor que TCBS 17,18,19. Una ventaja de usar un medio cromogénico es que la coloración del medio circundante es mínimo lo que facilita el aislamiento de colonias particulares. En este estudio, se evaluó la capacidad de un medio cromogénico de nueva formulación para detectar y aislar V. cholerae, V. parahaemolyticus y V. vulnificus; con un enfoque especial en su capacidad para diferenciar V. parahaemolyticus de otras especies.
Protocolo
1. Medios y cultivo de cepas microbianas
NOTA: Use técnicas asépticas en todos los experimentos. Utilizar materiales estériles. Esterilizar todos los recipientes, herramientas y reactivos antes de su uso. Autoclave todos los materiales de desecho antes de su eliminación, ya que se consideran de riesgo biológico. temperatura del autoclave y el tiempo de combinación es ≥121 ° C x ≥15 min para todos los procedimientos siguientes.
- Para hacer ~ 1 l de agar tríptico de soja (TSA), primero agregar 1 L de agua desionizada en un matraz de 2 litros Erlenmeyer que contiene una barra de agitación magnética. Utilice un matraz que es al menos dos veces mayor que el volumen final. Añadir 30 g de polvo de caldo de soja tríptico y 20 g de agar gránulos en el matraz.
NOTA: El uso agar al 2% en lugar del 1,5% para limitar el enjambre de algunas especies de Vibrio.- Mezclar bien activando el agitador. Mientras se agita, encender la calefacción a hervir la mezcla. Retirar el matraz de la estufa tan pronto como la mezcla comience a hervir. Cubra THe matraz con un papel de aluminio. Tape el papel de aluminio para fijarlo al matraz antes de autoclave.
- Para hacer caldo de soja tríptico (TSB), omita el agar de la receta en el paso 1.1.
NOTA: Puede utilizar botellas en lugar de un matraz Erlenmeyer. - Para hacer agar de soja tríptico suplementado con cloruro de sodio 2% o NaCl (TSAS), añadir 20 g de NaCl en la mezcla antes de la agitación y el calentamiento. Para hacer caldo de soja tríptico suplementado con 2% de NaCl (OSP), omitir el agar, añadir 20 g de NaCl en la mezcla antes de la agitación y el calentamiento.
- Para hacer agar de infusión de cerebro y corazón (BHI), suspender 37 g de polvo BHI y 15 g de gránulos de agar en 1 L de agua purificada. Calentar con agitación para disolver el polvo. Autoclave. Omitir el agar para hacer caldo BHI.
- Para hacer agar TCBS, suspender 89 g del polvo TCBS en 1 L de agua purificada. Calentar con agitación y se deja hervir durante 1 minuto para disolver completamente el polvo. No esterilizar en autoclave.
- Para todos los medios de agar, enfriar el agar caliente a 45-50 ° C en un baño de agua. Organizar placas de Petri vacías en pilas de cinco a seis placas. A partir de la parte inferior de la pila, se vierte el agar fundido en cada placa de Petri para llegar hasta la mitad. Cierre la tapa de la placa de Petri después de verter. Dejar que el agar se solidifique al permitir que las placas reposar a temperatura ambiente.
- Utilice las placas de agar al día siguiente o después de 12 horas. Almacenar las placas utilizadas en un refrigerador hasta por dos semanas. Antes de usar, eliminar los platos de la nevera y se equilibre a temperatura ambiente durante al menos 15 min.
NOTA: agar de un litro hace ~ 45 placas de agar. Permitir a las placas de agar se seque lo suficiente en el día de la preparación, y se equilibran a temperatura ambiente después de almacenamiento en frío para reducir eficazmente la propagación de las colonias.
- Utilice las placas de agar al día siguiente o después de 12 horas. Almacenar las placas utilizadas en un refrigerador hasta por dos semanas. Antes de usar, eliminar los platos de la nevera y se equilibre a temperatura ambiente durante al menos 15 min.
- Obtener placas de agar chocolate y cromogénico y equilibrar a temperatura ambiente antes de cada experimento.
- Subcultura de los 54 cepas microbianas que se muestran en la Tabla 1 da cada pocosys.
- Use un asa de siembra estéril para transferir las culturas a partir de una solución madre congelada o un lote anterior a los medios no selectivos como el BHI, TSB / TSA o agar chocolate. Crecer halófilas Vibrio spp. en los OSP / TSAS.
- Para comprobar la pureza de la cultura, racha todas las cepas en un patrón que permita la observación de colonias aisladas. Por ejemplo, utilizar un patrón de rayas de tres fases para diluir una gran cantidad de bacterias a menor cantidad, con el tiempo produciendo colonias aisladas.
- Incubar las placas al revés a 35-37 ° C durante un máximo de 48 horas. Para Campylobacter spp., Incubar los tubos o placas en un frasco de tapa cerrado que contiene una bolsa de gas para producir un ambiente microaerofílico. Observe morfología de las colonias después de la incubación. Los cultivos puros deben producir colonias que exhiben morfología de la colonia similar.
NOTA: Incubar todas las placas al revés para evitar que las gotas de agua condensadas formadas en la parte inferior de la tapa caiga sobre la colOnies.
2. Las especies Determinación por PCR
- Llevar a cabo TLH-PCR para confirmar la identidad de V. cepas parahaemolyticus. Use cebadores TLH -F (5 'AAA GCG GAT TAT GCA GCA GAA CTG 3') y -R tlh (5 'TCG ACT TTC TAG CAT TTT CTC TGC 3') para amplificar un fragmento de 450 pb del gen de la hemolisina termolábil 20 .
- Use un asa de siembra estéril para transferir algunas colonias aisladas de cada V. parahaemolyticus cepa de TSAS a 5 ml de TSB. Incubar a 35-37 ° C durante 16-24 horas.
- culturas centrifugar a 14.000 xg durante 1 min. Eliminar el sobrenadante y lavar el precipitado dos veces con solución salina tamponada con fosfato (PBS). Hervir la suspensión durante 3 min para dar lisado celular.
NOTA: V. parahaemolyticus es fácil de ser lisadas. Por lo tanto no se requiere reactivo de lisis. También es posible utilizar un poco de colonia directamente como la plantilla. - Realizar PCR en una reacción de 25 l-volumen. Preparar una mezcla de reacción que contiene una concentración final de 1 x tampón de PCR, 1.5 mM MgCl2, 100 mM de cada dNTP, 1 mM de cada cebador, 1 U de Taq polimerasa y 1 l de lisado celular. Después de la preincubación a 94 ° C durante 5 min, ejecute 35 ciclos de amplificación de 94 ° C durante 30 seg, 58 ° C durante 30 seg, y 72 ° C durante 60 seg 21.
- alícuotas de carga de amplicón 5-l en 1,5% geles de agarosa. Encienda la fuente de alimentación para iniciar la electroforesis. Visualizar la presencia o ausencia de amplicones bajo iluminación UV después de la tinción con bromuro de etidio.
3. Crecimiento en medios selectivos y diferenciales
- Dos a cuatro días antes del experimento, racha todas las cepas microbianas que se muestran en la Tabla 1 en medio no selectivo (TSAS, BHI o agar chocolate) para el aislamiento de colonias. Incubar las placas a 35-37 ° C durante 48 horas. Comprobar la pureza de los cultivos mediante la observación de morfología de las colonias después de la incubación. Los cultivos puros deben producir colonias que exhiben morfología de la colonia similar.
- Transferir algunas colonias aisladas a partir del paso 3.1 en 5 ml de caldo. Incubar los tubos a 35-37 ° C durante 16-24 horas.
Nota: El uso colonias jóvenes, que son menos de cuatro días de edad, para preparar cultivos de una noche en todos los experimentos. - Racha de un asa de siembra de cultivos de una noche en medios selectivos y diferenciales (TCBS y agar cromogénico) para el aislamiento de colonias. Incubar las placas a 35-37 ° C durante un máximo de 96 horas.
- Registrar el crecimiento global de todas las cepas mediante el examen tanto de la densidad de cultivo en el plato y el tamaño de las colonias aisladas. Registre el color de las colonias bajo la luz ambiental y / o UV. Tenga en cuenta otras características de la colonia aislada, como la elevación, el margen y la forma.
4. Ensayo de recuperación
- Seleccionar un subconjunto representativo de V. cepas parahaemolyticus (n = 14) que abarcan diferentes serotipos y orígenes de aislamiento 22. Inocular cultivos jóvenes de las placas en 5 ml de TSB. Incubar los tubos a 35-37 ° C durante 16-24 horas.
- Llevar a cabo un método de recuento en placa estándar de los cultivos de una noche como se describe a continuación.
- Vórtice para mezclar bien los cultivos de la noche. Hacer una 10 veces o dilución 10 -1 mediante la transferencia de 100 l de cultivo de una noche en un tubo que contiene 900 l de PBS. Vórtice para mezclar bien.
- Utilizar una punta de pipeta para transferir 100 l del tubo de dilución 10 -1 a otro tubo que contiene 900 l de PBS. Vórtice para mezclar bien. Esto constituye dilución 10 -2. Repita el proceso de forma secuencial para obtener una dilución 10 -7.
- El uso de los 10 -4 a 10 -7 tubos de dilución, la placa de 100 l cada uno de los TCBS y TSAS placas de agar cromogénicos,.
NOTA: El factor de dilución (df) de la placa se convierte en 10 -5-10 -8, respectivamente. - Difundir las alícuotas de manera uniforme en tél agar superficie.
NOTA: Es muy bien utilizar el mismo esparcidor por cepa en el mismo medio, siempre que la alícuota más diluida se extiende primero (es decir, de 10 -8-10 -5). No utilice el mismo esparcidor para diferentes medios. - Incubar las placas a 35-37 ° C durante un máximo de 96 horas. Recuento de las colonias en las placas. Ignorar placas de apoyo colonias que son demasiado numerosos para contar (TNTC) o menor que 25. Calcular CFU / ml de acuerdo con lo siguiente:
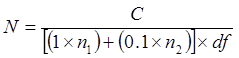
Dónde
N = el número de células en el tubo sin diluir, expresado como UFC / ml o CFU / g
C = el número total de colonias contadas en las placas que dan 25-300 colonias
1 = el número de placa (s) donde las colonias contadas son de la más baja df
n2 = número de placa (s) donde son colonias contadas a partir de la dilución de 10 veces subsecuente
ref = factor de dilución más baja (es decir, la dilución más concentrada)
- Comparar CFU / ml entre los diferentes medios de comunicación. Utilice UFC / ml en TSAS como el 100%, se calcula el% de recuperación de V. parahaemolyticus cultiva en el agar cromogénico y TCBS.
Ensayo 5. Competencia
- Elegir un subconjunto de cepas que muestran diferentes morfologías de colonias en el agar cromogénico y TCBS.
NOTA: De esta manera, será posible contar las colonias se originaron de V. Sólo parahaemolyticus, a pesar de la presencia de otras especies en el inóculo.- Elija una V. parahaemolyticus cepa que produce las colonias de color turquesa y cian esperados en TCBS y el agar cromogénico, respectivamente.
- Elija un no V. parahaemolyticus y Vibrio una especie no que no crecen en cualquiera de estos medios, o tienen diferentes color de la colonia.
NOTA: Por ejemplo, V. metschnikovii crece muy débilmente on TCBS y no creció en el agar cromogénico. Shigella sonnei no crece en TCBS pero produce colonias de color magenta en el agar cromogénico.
- Después de la selección de las cepas anteriores, preparar caldos de cultivo durante la noche utilizando colonias aisladas cultivadas en medios no selectivos.
- Hacer cultivos de una noche de V. parahaemolyticus y V. metschnikovii mediante la transferencia de algunas colonias aisladas de TSAS a 5 ml de TSB. Incubar a 35-37 ° C durante 16-24 horas.
- Hacer cultivos de una noche de Shigella sonnei mediante la transferencia de unas pocas colonias aisladas de agar BHI a 5 ml de caldo BHI. Incubar a 35-37 ° C durante 16-24 horas.
- Para cada cepa, lleve a cabo una serie de dilución similar a los pasos 4.2.1 y 4.2.2. Placa de diluciones apropiadas sobre TSAS o BHI para determinar CFU / ml de cultivo de una noche, utilizando la ecuación de muestra en el paso 4.2.5.
NOTA: Por lo general, 100 l de la dilución 10 -5 a la 10 -7tubos de obras para la mayoría de las culturas. Utilice los valores de UFC / ml para respaldar calcular la cantidad exacta de las células utilizadas en el siguiente paso. Los valores de UFC / ml calculados se obtienen después de la incubación, aunque los pasos siguientes se llevan a cabo en la misma fecha que la Etapa 5.3. - El uso de los cultivos de la noche y los tubos de dilución en los pasos 5.2 y 5.3, mezclar diferentes cantidades de una V. cepa parahaemolyticus y un no V. especies parahaemolyticus. Por ejemplo, la mezcla de 500 l de la tubo de dilución 10 -5 de V. parahaemolyticus con 500 l de los cultivos de una noche de V. metschnikovii.
NOTA: Esta mezcla simula alto fondo microflora. Para simular un fondo bajo microflora, mezclar 500 l cada uno del tubo de dilución 10 -5 de ambas especies. - Spread 100 l de la mezcla de cada uno de los TCBS y TSAS placas de agar cromogénicos,.
- Después de la incubación a 35-37 ° C durante un máximo de 96 horas, contar las colonias de V. parahaemolyticus y la no V. especies parahaemolyticus con base en su diferencia en el crecimiento y la morfología de las colonias en el agar cromogénico y TCBS.
NOTA: Por ejemplo, si la no V. parahaemolyticus especies no crecen en el agar cromogénico y TCBS, todas las colonias serán de V. parahaemolyticus. Si la no V. parahaemolyticus especie crece en ambos medios, sólo las colonias de color turquesa en colonias TCBS y cian en agar cromogénico serán de V. parahaemolyticus. La no V. especies parahaemolyticus pueden o no pueden exhibir la morfología de colonia similar a V. parahaemolyticus en TSAS.- Si la no V. especies parahaemolyticus crece de manera similar a V. parahaemolyticus en este medio no selectivo, divida el recuento de colonias por dos para obtener el número de V. parahaemolyticus solamente. Comparar el recuento de colonias real con la frecuencia esperada derivada del Paso 5.3.
6. EFFECTS de Oyster Los homogeneizados
- Pesar ≥50 g de carne de molusco ≥12 moluscos incluida la carne y el licor.
- Añadir la misma cantidad de PBS a la carne de la ostra y el licor. Mezclar la mezcla a alta velocidad durante 90 seg. Esto constituye el 2 -1 diluida homogeneizado de ostras.
- Añadir 100 g de 2 -1 homogeneizado ostra diluido a 400 g de PBS. Utilice una escala para medir el peso, no por volumen. Mezclar la mezcla a alta velocidad durante 1 min. Autoclave el homogeneizado de ostras.
NOTA: Este será el homogeneizado de ostras utilizado para clavar.
- Repetir el ensayo de recuperación (Paso 4) en presencia de homogeneizado de ostras.
- Después de los 500 g de ostras homogeneizado se enfría, se añaden 100 l de V. parahaemolyticus cultivos de una noche cultivados en TSB a ella. Determinar la cantidad real de V. parahaemolyticus células en el inóculo mediante la realización de los procedimientos de recuento en placa estándar descrito en el paso 4.2.
- Repscomer el ensayo de la competencia (Paso 5) en presencia de homogeneizado de ostras.
- Después de los 500 g de ostras homogeneizado se enfría, se añaden 100 l cada uno de los cultivos de una noche de V. parahaemolyticus y V. no parahaemolyticus a ella. Determinar la cantidad real de bacterias Las células en el inóculo mediante la realización de los procedimientos de recuento en placa estándar descrito en el paso 4.2
- Mezclar las células bacterianas con homogeneizado de ostras bien mediante el uso de un homogeneizador.
NOTA: Después de mezclar, el homogeneizado de ostra que contiene las células añadidas intencionadamente se llama claveteado homogeneizado de ostras. - Hacer diluciones del homogeneizado de ostras de púas para obtener 10 -1 a 10 -3 tubos de dilución de acuerdo con los procedimientos descritos en la etapa 4.2.2. Spread 100 l de cada dilución en el cromogénico TCBS y TSAS agar,. Incubar las placas a 35-37 ° C durante un máximo de 96 horas.
- Comparar el recuento de colonias en agar cromogénico real y TCBS con el exse sospecha vienen del recuento de colonias deduce de Pasos 6.2.1 y 6.3.1.
NOTA: Por ejemplo, si un tubo de V. parahaemolyticus cultivo durante la noche contiene 10 8 CFU / ml, un inóculo de 100 l significa que 10 7 células se añaden a la 500-g de homogeneizado de ostras, produciendo 5 x 10 4 células / g. Después de la dilución y de las planchas, teniendo la placa df = 10 -2 debería producir 500 colonias; mientras que el tener df = 10 -3 debería producir 50 colonias. Estos son los recuentos de colonias esperados.
Resultados
En este estudio, 54 cepas microbianas fueron ensamblados, que incluyó 22 cepas dentro de la V. especies parahaemolyticus, Vibrio otras 19 especies, y 13 especies de Vibrio no (Tabla 1). La mayoría V. cepas parahaemolyticus se recibieron ya sea de la FDA, CDC u otros departamentos de salud estatales. Representan diversos serotipos y fuentes de aislamiento. Estas cepas fueron identificadas previamente por los organism...
Discusión
Este estudio se centra en el desarrollo de medios de cultivo y evaluación. Convencionalmente, el TCBS es selectivo y diferencial medio utilizado para el aislamiento y la detección de V. parahaemolyticus, V. cholerae y V. 12 vulnificus. Sin embargo, se ha informado de limitaciones para este medio, tales como la incapacidad para diferenciar V. cholerae de otras especies de Vibrio. La sacarosa y el indicador de pH son los agentes de diferenciación de TCBS. Por lo t...
Divulgaciones
Some media were generously provided by Hardy Diagnostics, Santa Maria, CA. Thorsen conducted this study while a student at California Polytechnic State University. He is currently an employee of Hardy Diagnostics.
Agradecimientos
Damos las gracias a M. Channey, E. Chau, y K. Tomas por su colaboración en el proyecto. El Proyecto de abastecimiento fueron financiados parcialmente por California Polytechnic State University.
Materiales
| Name | Company | Catalog Number | Comments |
| Reagent/Equipment | |||
| Agar | Fisher Scientific | DF0140-15-4 | may use other brands |
| Autoclave | Any | ||
| BHI powder | Fisher Scientific | DF0418-17-7 | may use other brands |
| Blender | Any | to blend oyster meat | |
| CampyGen gas generator | Hardy Diagnostics | CN035A | to provide a microaerophilic atmosphere; may use other brands |
| Chocolate agar plates | Hardy Diagnostics | E14 | may use other brands |
| Common PCR reagents (dNTPs, MgCl2, Taq Polymerase) | Any | or use PCR beads (Fisher Sci 46-001-014) | |
| Culture tubes | Fisher Scientific | S50712 | may use other brands |
| Eppendorf tubes | Fisher Scientific | S348903 | may use other brands |
| Gel doc | Any | ||
| HardyChrom Vibrio agar plates | Hardy Diagnostics | G319 | This study evaluates this medium |
| Incubator | Any | ||
| Inoculating loops | Fisher Scientific | 22-363-606 | 10 microliter-size was used in this study |
| NaCl | Fisher Scientific | BP358-212 | may use other brands |
| Oysters | Any | ||
| PBS | Fisher Scientific | R23701 | may use other brands |
| Petri dish | Fisher Scientific | FB0875713 | may use other brands |
| Pipette and tips | Any | Sterilized tips | |
| Primers for tlh | IDT DNA | ||
| Scale | Any | ||
| Spreader | Fisher Scientific | 08-100-11 | Beads may be used instead |
| Stomacher blender | Stomacher | 400 | Samples were homogenized at 200 rpm for 30 sec. Other homogenizer can be used. |
| Sterile filter bags for blenders | Fisher Scientific | 01-812-5 | |
| TCBS powder | Hardy Diagnostics | 265020 | This study evaluates this medium |
| Thermocycler | Any | ||
| TSB powder | Fisher Scientific | DF0370-07-5 | may use other brands |
| UV viewing cabinet | Any | Emit long-wave UV light | |
| Water bath | Any | | |
| Name | Sources | Catalog Number | Comments |
| Bacterial species and strains | |||
| Aeromonas hydrophila | ATCC | ||
| Candida albicans | ATCC | ||
| Campylobacter jejuni | ATCC | ||
| Escherichia coli | ATCC | ||
| Proteus mirabilis | ATCC | ||
| Pseudomonas aeruginosa | ATCC | ||
| Staphylococcus aureus | ATCC | ||
| Salmonella Choleraesuis | ATCC | ||
| Shigella boydii | ATCC | ||
| Shigella flexneri | ATCC | ||
| Shigella sonnei | ATCC | ||
| Vibrio alginolyticus | ATCC | ||
| V. cholerae (serotypes include O139, O1, non O1, El Tor biovars) | FDA, ATCC | ||
| V. damsela | FDA | ||
| V. fisheri | Environment | ||
| V. fluvialis | CDC | ||
| V. furnissii | CDC | ||
| V. hollisae | FDA | ||
| V. metschnikovii | ATCC | ||
| V. mimicus | FDA | ||
| V. parahaemolyticus (serotypes include O3:K6, O1:K56, O4:K8, O5:K15, O8, etc.) | ATCC, FDA, CDC, Environment | ||
| V. proteolyticus | FDA | ||
| V. vulnificus | FDA |
Referencias
- Yeung, P. S., Boor, K. J. Epidemiology, pathogenesis, and prevention of foodborne Vibrio parahaemolyticus infections. Foodborne Pathog. Dis. 1 (2), 74-88 (2004).
- Yeung, P. S. M., Boor, K. J., Faruque, S. M. Epidemiology, molecular biology, and detection of foodborne Vibrio parahaemolyticus infections. Foodborne and Waterborne Bacterial pathogens: Epidemiology, Evolution and Molecular Biology. , 153-184 (2012).
- Centers for Disease Control and Prevention. Vital Signs: Incidence and Trends of Infection with Pathogens Transmitted Commonly Through Food - Foodborne Diseases Active Surveillance Network, 10 U.S. Sites, 1996-2010. Morbidity and Mortality Weekly Report. 10, 1996-2010 (2011).
- . Summary of human Vibrio cases reported to CDC, 2008 Available from: https://stacks.cdc.gov/view/cdc/21591 (2008)
- Scallan, E., et al. Foodborne illness acquired in the United States - major pathogens. Emerg. Infect. Dis. 17 (1), 7-15 (2011).
- Baross, J., Liston, J. Occurrence of Vibrio parahaemolyticus and related hemolytic vibrios in marine environments of Washington State. Appl. Microbiol. 20 (2), 179-186 (1970).
- Baross, J., Liston, J. Isolation of Vibrio parahaemolyticus from the Northwest Pacific. Nature. 217 (5135), 1263-1264 (1968).
- Kueh, C. S., Chan, K. Y. Bacteria in bivalve shellfish with special reference to the oyster. J. Appl. Bacteriol. 59 (1), 41-47 (1985).
- Food and Drug Administration. . Bad Bug Book, Foodborne Pathogenic Microorganisms and Natural Toxins. , (2012).
- Qadri, F., et al. Adaptive and inflammatory immune responses in patients infected with strains of Vibrio parahaemolyticus. J. Infect. Dis. 187 (7), 1085-1096 (2003).
- MacFaddin, J. F. . Media for isolation-cultivation-identification-maintenance of medical bacteria. 1, (1985).
- Bottone, E. J., Robin, T. Vibrio parahaemolyticus: suspicion of presence based on aberrant biochemical and morphological features. J. Clin. Microbiol. 8 (6), 760-763 (1978).
- Lotz, M. J., Tamplin, M. L., Rodrick, G. E. Thiosulfate-citrate-bile salts-sucrose agar and its selectivity for clinical and marine vibrio organisms. Ann. Clin. Lab. Sci. 13 (1), 45-48 (1983).
- Hara-Kudo, Y., Nishina, T., Nakagawa, H., Konuma, H., Hasegawa, J., Kumagai, S. Improved method for detection of Vibrio parahaemolyticus in seafood. Appl. Environ. Microbiol. 67 (12), 5819-5823 (2001).
- Eddabra, R., Piemont, Y., Scheftel, J. M. Evaluation of a new chromogenic medium, chromID Vibrio, for the isolation and presumptive identification of Vibrio choleare and Vibrio parahaemolyticus from human clinical specimens. Eur. J. Clin. Microbiol. Infect. Dis. 30 (6), 733-737 (2011).
- Kodaka, H., Teramura, H., Mizuochi, S., Saito, M., Matsuoka, H. Evaluation of the Compact Dry VP method for screening raw seafood for total Vibrio parahaemolyticus. J. Food. Prot. 72 (1), 169-173 (2009).
- Su, Y. C., Duan, J., Wu, W. H. Selectivity and specificity of a chromogenic medium for detecting Vibrio parahaemolyticus. J. Food Prot. 68 (7), 1454-1456 (2005).
- Bej, A. K., Patterson, D. P., Brasher, C. W., Vickery, M. C., Jones, D. D., Kaysner, C. A. Detection of total and hemolysin-producing Vibrio parahaemolyticus in shellfish using multiplex PCR amplification of tl, tdh and trh. J. Microbiol. Methods. 36 (3), 215-225 (1999).
- Yeung, P. S. M., DePaola, A., Kaysner, C. A., Boor, K. J. A PCR assay for specific detection of the pandemic Vibrio parahaemolyticus O3:K6 clone from shellfish. J. Food Sci. 68 (4), 1459-1466 (2003).
- Yeung, P. S. M., Hayes, M. C., DePaola, A., Kaysner, C. A., Kornstein, L., Boor, K. J. Comparative phenotypic, molecular, and virulence characterization of Vibrio parahaemolyticus O3:K6 isolates. Appl. Environ. Microbiol. 68 (6), 2901-2909 (2002).
- Duan, J., Su, Y. -. C. Comparison of a chromogenic medium with thiosulfate-citrate-bile salts-sucrose agar for detecting Vibrio parahaemolyticus. J. Food Sci. 70, M125-M128 (2005).
- Pinto, A. D., Terio, V., Novello, L., Tantillo, G. Comparison between thiosulphate-citrate-bile salt sucrose (TCBS) agar and CHROMagar Vibrio for isolating Vibrio parahaemolyticus. Food Control. 22 (1), 124-127 (2011).
- Canizalez-Roman, A., Flores-Villaseñor, H., Zazueta-Beltran, J., Muro-Amador, S., Leòn-Sicairos, N. Comparative evaluation of a chromogenic agar medium-PCR protocol with a conventional method for isolation of Vibrio parahaemolyticus strains from environmental and clinical samples. Can J Microbiol. 57 (2), 136-142 (2011).
- Kriem, M. R., et al. Prevalence of Vibrio spp. in raw shrimps (Parapenaeus longirostris) and performance of a chromogenic medium for the isolation of Vibrio strains. Lett Appl Microbiol. 61 (3), 224-230 (2015).
- Food Drug Administration. Statistical guidance on reporting results from studies evaluating diagnostic tests. http://www.fda.gov/RegulatoryInformation/Guidances/ucm071148.htm. , (2007).
- Burd, E. M. Validation of laboratory-developed molecular assays for infectious diseases. Clin Microbiol Rev. 23 (3), 550-576 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados