A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الماوس معزولة تقنية الكلى Perfused
In This Article
Summary
الماوس معزولة الكلى perfused (MIPK) هي تقنية للحفاظ على الكلى الماوس تحت المجراة سابقا الظروف perfused وظيفية لمدة 1 ساعة. ويرد في مخازن وتقنية جراحية في التفاصيل.
Abstract
الماوس معزولة الكلى perfused (MIPK) هي تقنية للحفاظ على الكلى الماوس تحت المجراة سابقا الظروف perfused وظيفية لمدة 1 ساعة. وهذا شرط أساسي لدراسة علم وظائف الأعضاء من الجهاز معزولة وللعديد من التطبيقات المبتكرة التي قد يكون من الممكن في المستقبل، بما في ذلك decellularization نضح عن الهندسة الحيوية الكلى أو إدارة مكافحة الرفض أو المخدرات تحرير الجينوم في جرعات عالية لرئيس الكلية للزرع. خلال ذلك الوقت من نضح، والكلى يمكن التلاعب بها، ويمكن تقييم وظائف الكلى، ومختلف المواد الصيدلانية تدار. بعد العملية، والكلى يمكن زرعها أو تجهز لعلم الأحياء الجزيئي، وتحليل الكيمياء الحيوية، أو المجهري.
وتصف هذه الورقة الإرواء والتقنية الجراحية اللازمة لنضح خارج الجسم الحي الكلى الماوس. وترد تفاصيل جهاز نضح وقدمت بيانات تظهر الخامسiability من إعداد والكلى: تدفق الدم الكلوي، ومقاومة الأوعية الدموية، والبول بيانات وظيفية، الميكروسكوب الإلكتروني النافذ من شرائح كليون المختلفة وقراءات المورفولوجية، والبقع الغربية من البروتينات نقل شرائح كليون المختلفة وقراءات الجزيئية.
Introduction
وقد نضح معزولة من الأجهزة موضوع جهد مستمر بين فسيولوجي لعقود عديدة 1. هذه التقنية تتيح وظيفة الجهاز، دون التأثيرات الجهازية مثل ارتفاع ضغط الدم، والهرمونات، أو الأعصاب، لدراستها. يعتبر كارل إدوارد Loebell أن يكون أول من وصف نضح الناجح لالكلى معزولة، في عام 1849 2. ومنذ ذلك الحين، شهدت جهاز نضح صقل كبير. قدم فراي وغروبر رئة اصطناعية لالأوكسجين ونابض مضخات نضح المستمر 2. في حين الباحثين في وقت مبكر درس أساسا الكلى من الثدييات وهي كبيرة والخنازير والكلاب 2 3 -The التقرير الأول للاستخدام الكلى الفئران، التي فايس وآخرون. ، كان علامة فارقة في دراسة صغيرة الثدييات جهاز نضح (4). Schurek وآخرون. ذكرت ضرورة إضافة الكريات الحمراء الثدييات إلى الإرواء إذا أنبوبي كلوي كافيةكان الأوكسجين إلى أن يتحقق 5. حاسمة لتجارب طويلة الأمد كانت مقدمة من غسيل الكلى المستمر من المخزن المؤقت من قبل نفس المجموعة البحثية 6. في عام 2003، Schweda وآخرون. كانوا أول من الإبلاغ عن الكلى الماوس وظيفية معزولة perfused (MIPK) 7، والمكرر في وقت لاحق من قبل Rahgozar وآخرون. 18 ويندل وآخرون. 14.
بينما من الناحية الفنية أكثر تحديا من الفئران المعزولة الكلى perfused، واستخدام MIPK يحمل ميزة تمكن من استخدام مجموعة واسعة من الفئران المعدلة وراثيا. تعرض هذه الورقة على تفاصيل طريقة المؤلفين من أجل perfusing الكلى الماوس معزولة لمدة 1 ساعة. يسمح أسلوب التقييم المستمر لمعدل الكلوي تدفق، ومقاومة الأوعية الدموية، والإفراج عن هرمون، تحليل غازات الدم وتحليل البول، وتطبيق المخدرات. وبعد هذا الإجراء، يمكن معالجتها الكلى للتحليل الجزيئي والكيمياء الحيوية، وتكون ثابتة للفحص المجهري، أوزرعه في الماوس المتلقي (الشكل 1).

الشكل 1: نظرة عامة على احتمال الإدخال / الإخراج إلى الكلى Perfused المعزولة. بغا: تحليل الدم الغاز. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
هذه التقنية من المرجح أن تلقي اهتماما متزايدا في السنوات القادمة، كما يتم مناقشة العديد من التطبيقات المبتكرة مع فجر لفترات طويلة نضح الكلى سوي الحرارة قبل الزرع (مع أو من دون تطبيق المضادة للرفض أو عقاقير تحرير الجينوم) 8، 9، 10 ، 11، والهندسة الحيوية الكلى كلها من السقالات decellularized 12، وتطبيق جرعات عالية من الأصباغ الفلورية لmultiphoton التصوير 13 . بل هو أيضا نموذج مثالي مع الذي لدراسة دور الجينات المحددة خلال قصور كلوي حاد 14.
ويرد بروتوكول خطوة بخطوة للسماح غيرها من المختبرات لأداء معزولة الماوس نضح الكلى بنجاح. أولا، يتم تحديد تكوين وإعداد المخزن المؤقت. ثم، يتم وصف عملية جراحية في التفاصيل وتعرض الخطوات الحاسمة. ويرد الثالث، البيانات التي تمثل من الإعداد الناجح: تدفق الدم الكلوي، ومقاومة الأوعية الدموية، معدل الترشيح الكبيبي، والكهارل كسور إفراز للجميع القياسات وظيفية من الميكروسكوب الجدوى والإلكترون انتقال مورفولوجية قطاعات كليون مختلفة من الكلى perfused ثابت بعد 1 ساعة من نضح.
Protocol
أجريت جميع الإجراءات التي تنطوي على الحيوانات وصفها في هذه المخطوطة وفقا للقانون السويسري والموافقة عليها من قبل الإدارة البيطرية للكانتون زيورخ، سويسرا.
1. إعداد العازلة
- إعداد حلول 1-4 والحل الهرمون المضاد لإدرار البول (ADH) (الجدول 1).
- إعداد العازلة غسيل الكلى (الجدول 1).
ملاحظة: هذا هو عازلة تستخدم المخزن المؤقت لغسيل الكلى خلال نضح. وفي وقت لاحق، سوف تضعف كريات الدم الحمراء في هذا المخزن المؤقت لتشكيل الإرواء النهائي. - إعداد كرات الدم الحمراء.
- تمييع 250 مل من تركيز كريات الدم الحمراء البشرية (مادة اختبار تم الحصول عليها من بنك الدم المحلي) إلى 500 مل مع العازلة غسيل الكلى. أجهزة الطرد المركزي في 2000 x ج لمدة 8 دقائق. إزالة المنطقة العازلة، والحرص على عدم إزالة أي خلايا الدم الحمراء. تكرار 3X.
- إعداد (ألبومين المصل البقري، BSA) الزلال العازلة.
- في 200 مل من dialysiالصورة العازلة، حل 44 غرام من جيش صرب البوسنة باستخدام بقضيب. تصفية حل مع ورقة الترشيح.
- إعداد الإرواء.
- تصفية كريات الدم الحمراء من الخطوة 1.3.1 من خلال ورق الترشيح في المخزن المؤقت BSA. ملء تصل إلى الحجم الكلي 800 مل مع العازلة غسيل الكلى.
ملاحظة: هذا هو الإرواء النهائي. يجب أن يكون الهيماتوكريت الآن بين 8 و 12٪. سائل الإرواء يمكن تخزينها لمدة تصل إلى 12 ساعة عند 4 درجات مئوية.
- تصفية كريات الدم الحمراء من الخطوة 1.3.1 من خلال ورق الترشيح في المخزن المؤقت BSA. ملء تصل إلى الحجم الكلي 800 مل مع العازلة غسيل الكلى.
2. المبادرة للغسيل والأوكسجين
- بدوره على حمام ماء المحيطة الخزان أكبر العازلة، أصغر خزان العازلة، وغرفة رطبة (جلب، غرفة صغيرة مزدوجة الجدران إلى 37 درجة مئوية، و 100٪ الرطوبة عقد في وقت لاحق الكلى) إلى 37 درجة مئوية (الشكل 2) .
- ملء خزان مؤقت أكبر مع العازلة غسيل الكلى وخزان أصغر مع الإرواء.
- تشغيل 5٪ CO 2/95٪ O 2 تدفق الغاز إلى المخزن المؤقت لغسيل الكلى.
- التبديل على غسيل الكلى المستمر للسائل الإرواء ضد المخزن المؤقت لغسيل الكلى. احرص على استخدام أنابيب غسيل الكلى المنخفضة للتدفق. انتقل إلى الخطوة 3.

الشكل 2: رسم تخطيطي للحلبة الإرواء. يظهر مخطط المكونات الرئيسية لدائرة نضح واتجاه تدفق العازلة. وتحفظ كل مكونات محاطة الأزرق الداكن عند 37 درجة مئوية مع حمام ماء / الحرارة. 1: فقاعات غسيل الكلى عازلة لا يقل عن 3 أضعاف حجم المخزن المؤقت نضح مستمر مع 95٪ O 2/5٪ CO 2. 2: يتم مدال غسيل الكلى العازلة والعازلة نضح باستمرار ضد بعضها البعض في أنبوب غسيل الكلى عن طريق مضخة الأسطوانة. 3: ونتيجة لهذا غسيل الكلى، وإثراء المخزن المؤقت نضح مع 9٪ O يتم الاحتفاظ 05/02٪ CO 2 والكهارل مستويات througho المستمرالتحرير الارواء. 4: مضخة بكرة يفجر المنطقة العازلة نضح نحو الكلى. 5: windkessel يزيل موجات تحوي وبمثابة فخ فقاعة. 6: الضغط على (متصلة إلى 4. (مضخة بكرة) للحفاظ على الضغط المستمر مع السماح للتدفق بالتناوب بحرية). 7: طوال التروية، يبقى الكلى في غرفة رطبة للرطوبة الهواء 100٪ و 37 درجة مئوية درجة حرارة الكلى. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
3. الجراحي إجراء الجزء 1 (رسم تخطيطي لجميع الأربطة، انظر الشكل 3)
ملاحظة: إجراء جميع الحروف المركبة باستخدام 5-0 موضوع الجراحي.
- تخدير الماوس عن طريق الحقن داخل الصفاق (10 ميكرولتر / غرام من وزن الجسم، و 20 ملغ / مل الكيتامين و 1 ملغ / مل زيلازين يذوب في 0.9٪ كلوريد الصوديوم). تأكيد عمق كاف من anesthتقييم الأثر البيئي من خلال اختبار لغياب ردود الفعل الخلفي القدم.
- إصلاح الماوس في موقف ضعيف في غرفة رطبة. حماية العينين مع مرهم التعليم والتدريب المهني. وضع حقنة 1 مل تحت العمود الفقري لرفع السفن قطني.
- إجراء عملية فتح البطن وسيطة من قمة العانة لافتتاح القص أولا الجلد، ثم عضلات البطن، مع مقص.
- إزالة الأمعاء ووضعه على الجانب الأيسر من جانبي الماوس من البطن.
- تحرير المثانة من النسيج الضام، واستكشاف كل من الحالب ومجرى البول.
- وضع رباط حول الحالب الأيسر (ضمد الأول). أغلقه.
- وضع رباط حول مجرى البول (ضمد الثاني). أغلقه.
- وضع "اسو" رباط حول المثانة كاملة (ضمد الثالث).
- شق المثانة 1 مم.
- يقني؛ يدخل القنية فتح مع 2 سم PE 50 الأنابيب.
- انهيار ضمد الثالث حول الأنبوب.
- قطع الحالب الأيسر والقاصي مجرى البول من الأربطة. هؤلاء الاشخاصالآن تعلق دير إلى الحالب الأيمن فقط وتتحرك بحرية.
- مسح الشريان الأورطي البطني من النسيج الضام والدهون.
- وضع البطن ضمد منتصف الشريان الأورطي (IV رباط).
- وضع رباط حول الشريان الأبهر أسفل الحجاب الحاجز بين الشريان المساريقي العلوي والجذع الاضطرابات الهضمية (V رباط).
- وضع رباط حول الشريان المساريقي العلوي (السادس رباط).
- وضع رباط الأبهر دون الحق مباشرة وفوق الشريان الكلوي الأيسر (رباط السابع).
- وضع رباط حول حزمة الذيلية الوريد (الوريد) (الثامن رباط). انتقل إلى الخطوة 4.
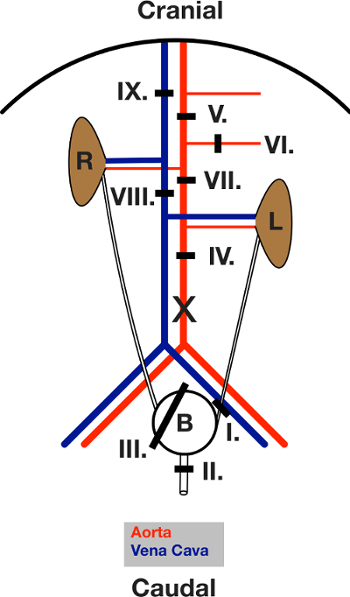
الشكل 3: رسم تخطيطي للالحروف المركبة وضعها خلال جراحة. عرض من البطن مفتوحة بعد فتح البطن. تم نقل الأمعاء إلى اليسار. L و R يشير إلى الكلى اليسار واليمين. التظهر خطوط سوداء مجال ربطة منها. توضع الأربطة أولا ثم أغلقت، في تسلسل معين في النص. يصادف العاشر موقع شق لإقناء؛ إدخال القنية الشريان الأورطي. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
4. الاشعال من حلبة الإرواء
- بدء تشغيل المضخة الدوارة وملء الأنبوب مع الإرواء. الحرص على تفريغ جميع فقاعات الهواء منه.
- شغل الجهاز windkessel إلى حوالي منتصف مستوى مع الإرواء.
- معايرة محول الضغط على 0 ملم زئبق عندما يتم تعبئة جميع الأنابيب وتدفق هو 0. الحفاظ على إبرة نضح على مستوى الكلى خلال هذا الوقت.
- إبقاء تدفق على مستوى الحد الأدنى ثابت (0.6 مل / دقيقة) وانتقل إلى الخطوة 5.
5. الجراحي إجراء الجزء 2
- وضع المشبك بين ضمد الرابع والمتفرعة من رينا اليسارل الشريان.
- إجراء شق صغير في الذيلية الأبهر من ضمد الرابع، مع الحرص على عدم قطع الجدار الظهري.
- تمدد فتح في الشريان الأورطي مع الموسع السفينة.
- يقني؛ يدخل القنية الشريان الأورطي مع إبرة (2 سم، وسحبت PE 50)، ودفع الطرف فقط إلى المشبك.
- فتح المشبك.
- دفع غيض من cranially الإبرة حتى يصل تقاطع الصحيح الشريان الكلوي والشريان الأورطي.
- انهيار ضمد السابع.
- انهيار ضمد الرابع.
- فتح الصدر مع مقص من قبل تشريح الحجاب الحاجز. مع خفض واحد، فصل الشريان الأبهر، الوريد الأجوف والقلب والأعصاب الخضري. مع هذه الخطوة، هو التضحية الحيوانية عن طريق استنزاف السريع تحت التخدير العميق المستمر.
- بدء السيطرة على ضغط مضخة نضح. الحفاظ على الضغط المتوسط بين 80 و 100 مم زئبق.
- انهيار خامسا رباط
- انهيار ضمد السادس.
- انهيار ضمد الثامن.
- الحرة الكلية اليمنى من TISSU الضامه وتضمينها في داخل كبسولة الدهنية مع مقص.
- قطع الشريان الأورطي قريب إلى ضمد V.
- قطع الشريان المساريقي العلوي إلى أقصى حد لضمد السادس.
- قطع حزمة السفينة الداعمة الكلى بها، مع الحرص على عدم قطع في الأوعية أنفسهم.
- قطع الكبد في اتصال الكلى. رعاية لتحرير الكلى، ولكن ترك جزء صغير من تمسكا الكبد لذلك، بحيث يتم الحفاظ على الوريد الأجوف مفتوحة بها.
- اتخاذ حزمة الكلى من الماوس. إزالة الماوس من غرفة رطبة.
- وضع "اسو" رباط حول ربط الكبد والكلى (التاسع رباط).
- يقني؛ يدخل القنية الوريد الأجوف مع خط وريدي (2 سم PE 50).
- انهيار ضمد التاسع. تدفق الوريدي من خلال خط وريدي يجب أن تبدأ على الفور.
- إغلاق غرفة رطبة.
6. تحليل المصب
- خلال ساعة التالية، تراقب باستمرار تدفق الدم وintravasculضغط ع 15. جمع تدفق الوريدي، والتي يمكن استخدامها لتحليل، على سبيل المثال، الكلوي الإفراج الرينين 7. جمع البول لتحليل تركيز بالكهرباء والكبيبي معدل الترشيح 14. بعد 1 ساعة من نضح والكلى يمكن المفاجئة المجمدة لالنشاف الغربية أو أن تكون ثابتة للتصوير النهج 16.
النتائج
مع طريقة وصفها، يمكن أن الكلى الماوس معزولة لا تزال قابلة للحياة لا يقل عن 1 ساعة. نحن اختبار قابلية الأنسجة بعد 1 ساعة من نضح مستمر مع وظيفية (تدفق الكلوي الدم ومقاومة الأوعية الدموية، وتحليل غازات الدم من التدفق الوريدي، معدل الترشيح الكبيبي، البول...
Discussion
الماوس معزولة الكلى perfused هو أداة لدراسة وظائف الكلى في بيئة تسيطر عليها خارج الجسم لمدة 1 ساعة، سد الفجوة بين التجارب المجراة على الحيوانات سليمة، والتي قد تكون معيبة بسبب تأثير العوامل النظامية عديدة، وفي التجارب المختبرية في شرائح كليون معزولة ...
Disclosures
The authors have no competing financial interests and nothing else to disclose.
Acknowledgements
The authors would like to thank Hans-Joachim Schurek for invaluable scientific advice. The authors would like to thank Monique Carrel and Michèle Heidemeyer for excellent technical assistance, David Penton Ribas and Nourdine Faresse for a critical reading of the manuscript and Carsten Wagner and Jürg Biber for the NaPi-2a antibody. This work was supported by the Swiss National Centre for Competence in Research "Kidney.CH" and by a project grant (310030_143929/1) from the Swiss National Science Foundation.
Materials
| Name | Company | Catalog Number | Comments |
| Perfusion Circuit: | |||
| Moist chamber 834/8 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2901 | |
| Cannular with basket and side port | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2947 | |
| Thermostat TC120-ST5 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-4544 | |
| ISM 827/230V Roller Pump Reglo Analogue | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-0114 | |
| Reservoir jacketed for buffer solution 1 L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3438 | |
| Reservoir jacketed for buffer solution 0.5 L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3436 | |
| Pressure Transducer APT300 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3862 | |
| TAM-D Plugsys Transducer | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-1793 | |
| SCP Plugsys servo controller | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2806 | |
| Windkessel | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3717 | |
| HSE-USB data acquisition | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3330 | |
| Low-Flux Dialysator Diacap Polysulfone | B.Braun | 7203525 | |
| PE-Tubing for aorta cannulation 1.19 mm I.D. x 1.70 mm O.D. | Scientific Commodities Inc. | BB31695-PE/8 | |
| Name | Company | Catalog Number | Comments |
| Buffer reagents: | |||
| Aminoplasmal 10% | B.Braun | 134518064 | |
| Sodium pyruvate | Sigma-Aldrich | P2256-25G | |
| L-Glutamic acid monosodium salt hydrate | Sigma-Aldrich | G1626-100G | |
| L-(-)-Malic acid sodium salt | Sigma-Aldrich | M1125-25G | |
| Sodium-L-Lactate | Sigma-Aldrich | L7022-10G | |
| alpha-Ketoglutaric acid sodium salt | Sigma-Aldrich | K1875-25G | |
| NaCl | Sigma-Aldrich | 31434-1KG-R | |
| NaHCO3 | Sigma-Aldrich | S5761-5KG | |
| KCl | Sigma-Aldrich | 60130-1KG | |
| Urea | Sigma-Aldrich | U5378-500G | |
| Creatinine | Sigma-Aldrich | C4255-10G | |
| Ampicillin | Roche | 10835242001 | |
| MgCl2 * 6H2O | Sigma-Aldrich | M2393-500G | |
| D-Glucose | Sigma-Aldrich | G8270-1KG | |
| CaCl2 * 6H2O | Riedel-de-Haën | 12074 | |
| NaH2PO4 | Sigma-Aldrich | S9638-500G | |
| Na2HPO4 | Sigma-Aldrich | S0876-500G | |
| Antidiuretic Hormone dDAVP | Sigma-Aldrich | V2013-1MG | |
| FITC-Inulin | Sigma-Aldrich | ||
| Filter used for erythrocyte filtration | Macherey-Nagel | MN 615 | |
| BGA Analysis: | |||
| ABL 80 flex | Radiometer Medical ApS | ||
| Electron Microscope: | |||
| Philips CM100 TEM | FEI |
References
- Carrel, A., Lindbergh, C. A. The culture of whole organs. Science (New York, N.Y.). 81 (2112), 621-623 (1935).
- Skutul, K. . Über Durchströmungsapparate Pflüger's Archiv. 123 (4-6), 249-273 (1908).
- Nizet, A. The isolated perfused kidney: possibilities, limitations and results. Kidney Int. 7 (1), 1-11 (1975).
- Weiss, C., Passow, H., Rothstein, A. Autoregulation of flow in isolated rat kidney in the absence of red cells. Am J Physiol. 196 (5), 1115-1118 (1959).
- Schurek, H. J., Kriz, W. Morphologic and functional evidence for oxygen deficiency in the isolated perfused rat kidney. Lab Invest. 53 (2), 145-155 (1985).
- Stolte, H., Schurek, H. J., Alt, J. M. Glomerular albumin filtration: a comparison of micropuncture studies in the isolated perfused rat kidney with in vivo experimental conditions. Kidney Int. 16 (3), 377-384 (1979).
- Schweda, F., Wagner, C., Krämer, B. K., Schnermann, J., Kurtz, A. Preserved macula densa-dependent renin secretion in A1 adenosine receptor knockout mice. AJP Renal Physiol. 284 (4), F770-F777 (2003).
- Moers, C., Smits, J. M., et al. Machine perfusion or cold storage in deceased-donor kidney transplantation. N Engl J Med. 360 (1), 7-19 (2009).
- Nicholson, M. L., Hosgood, S. A. Renal transplantation after ex vivo normothermic perfusion: the first clinical study. Am J Transplant. 13 (5), 1246-1252 (2013).
- Worner, M., Poore, S., Tilkorn, D., Lokmic, Z., Penington, A. J. A low-cost, small volume circuit for autologous blood normothermic perfusion of rabbit organs. Art Org. 38 (4), 352-361 (2014).
- Kaths, J. M., Spetzler, V. N., et al. Normothermic Ex Vivo Kidney Perfusion for the Preservation of Kidney Grafts prior to Transplantation. J Vis Exp. (101), e52909 (2015).
- Song, J. J., Guyette, J. P., Gilpin, S. E., Gonzalez, G., Vacanti, J. P., Ott, H. C. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Med. 19 (5), 646-651 (2013).
- Hall, A. M., Crawford, C., Unwin, R. J., Duchen, M. R., Peppiatt-Wildman, C. M. Multiphoton imaging of the functioning kidney. JASN. 22 (7), 1297-1304 (2011).
- Lindell, S. L., Williams, N., Brusilovsky, I., Mangino, M. J. Mouse IPK: A Powerful Tool to Partially Characterize Renal Reperfusion and Preservation Injury. Open Transplant J. 5, 15-22 (2011).
- Wagner, C., De Wit, C., Kurtz, L., Grünberger, C., Kurtz, A., Schweda, F. Connexin40 is essential for the pressure control of renin synthesis and secretion. Circ Res. 100 (4), 556-563 (2007).
- Czogalla, J., Vohra, T., Penton, D., Kirschmann, M., Craigie, E., Loffing, J. The mineralocorticoid receptor (MR) regulates ENaC but not NCC in mice with random MR deletion. Pflüger's Archiv. , (2016).
- Poosti, F., et al. Precision-cut kidney slices (PCKS) to study development of renal fibrosis and efficacy of drug targeting ex vivo. Dis Model Mech. 8 (10), 1227-1236 (2015).
- Rahgozar, M., Guan, Z., Matthias, A., Gobé, G. C., Endre, Z. H. Angiotensin II facilitates autoregulation in the perfused mouse kidney: An optimized in vitro model for assessment of renal vascular and tubular function. Nephrology. 9 (5), 288-296 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved