Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die Maus isoliert perfundierten Nieren-Technik
In diesem Artikel
Zusammenfassung
Die Maus isoliert perfundierten Nieren (MIPK) ist eine Technik zum Halten einer Mausniere unter ex vivo - Bedingungen durchbluteten und funktionell für 1 Std. Die Puffer und die chirurgische Technik werden ausführlich beschrieben.
Zusammenfassung
Die Maus isoliert perfundierten Nieren (MIPK) ist eine Technik zum Halten einer Mausniere unter ex vivo - Bedingungen durchbluteten und funktionell für 1 Std. Dies ist eine Voraussetzung für die Physiologie des isolierten Organs zu studieren und für viele innovative Anwendungen, die in der Zukunft möglich sein, einschließlich Perfusion Dezellularisierung für Nieren Biotechnik oder die Verabreichung von anti-Ablehnung oder Genom-Bearbeitung Medikamente in hohen Dosen zu grundieren der Niere für die Transplantation. Während der Zeit der Perfusion kann die Niere manipuliert werden, kann die Nierenfunktion bewertet werden, und verschiedene Arzneimittel verabreicht. Nach dem Verfahren kann die Niere für die Molekularbiologie, biochemische Analyse oder Mikroskopie transplantierten oder verarbeitet werden.
Dieses Papier beschreibt die Perfusat und die chirurgische Technik für die ex vivo Perfusion von Mausnieren benötigt. Einzelheiten der Perfusionsgerät gegeben und Daten vorgestellt, die v zeigtAFTUNG der Zubereitung der Niere: Nierendurchblutung, Gefäßwiderstand und Urin Daten als funktionelle, Transmissionselektronenmikrographien verschiedener nephron Segmente als morphologische Ablesungen und Western-Blots von Transportproteinen verschiedener nephron Segmente als molekulare Anzeige.
Einleitung
Die isolierte Perfusion von Organen hat unter Physiologen seit vielen Jahrzehnten ein Gegenstand einer laufenden Bemühungen gewesen. Die Technik ermöglicht es, die Funktion des Organs, ohne systemische Einflüsse wie Blutdruck, Hormone oder Nerven, untersucht werden. Carl Eduard Loebell gilt als der erste sein , um die erfolgreiche Perfusion eines isolierten Niere beschrieben haben, im Jahr 1849 2. Seitdem hat sich die Perfusionsgerät erhebliche Verfeinerung erfahren. Frey und Gruber führte eine künstliche Lunge für die Sauerstoffversorgung und pulsatile Pumpen für kontinuierliche Perfusion 2. Während frühe Forscher vor allem die Nieren von großen Säugetieren nämlich sucht, Schweine und Hunde 2 3 -der erste Bericht über die Verwendung von Rattennieren, die von Weiss et al. , War in der Studie der kleinen Säuger-Organperfusion 4 ein Meilenstein. Schurek et al. die Notwendigkeit der Zugabe von Säugetieren Erythrozyten zu dem Perfusat, wenn eine ausreichende renale tubuläre berichtetOxygenierung wurde auf 5 erreicht werden. Kritisch für Langzeitversuchen war die Einführung der kontinuierlichen Dialyse des Puffers von der gleichen Arbeitsgruppe 6. Im Jahr 2003 Schweda et al. waren die ersten , eine funktionelle Maus isoliert perfundierten Niere (MIPK) 7, verfeinert später von Rahgozar et al berichten. 18 und Lindell et al. 14.
Während technisch schwieriger als die Ratte perfundierten Nieren isoliert, trägt die Verwendung des MIPK den Vorteil, die Verwendung einer Vielzahl von genetisch veränderten Mäusen ermöglichen. Dieses Papier stellt die Einzelheiten des Verfahrens der Autoren für die Perfusion von isolierten Maus-Nieren für 1 Stunde. Das Verfahren ermöglicht die kontinuierliche Messung der Nierendurchflussrate, Gefäßwiderstand, Hormonfreisetzung, Blutgasanalyse, Urinanalyse und die Anwendung von Medikamenten. Nach dem Verfahren könnte Nieren für molekulare und biochemische Analyse verarbeitet werden, für die Mikroskopie festgelegt werden, odertransplantierten in eine Empfängermaus (Abbildung 1).

Abbildung 1: Übersicht über die möglichen Input / Output an den isolierten perfundierten Nieren. BGA: Blutgasanalyse. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diese Technik wird wahrscheinlich erhalten Aufmerksamkeit in den kommenden Jahren zu erhöhen, da viele innovative Anwendungen sind mit dem Beginn der verlängerten normothermic Nierenperfusion vor der Transplantation diskutiert (mit oder ohne die Anwendung von Anti-Ablehnung oder Genom-Bearbeitung Drogen) 8, 9, 10 , 11, die Bioengineering von ganzen Nieren von dezellularisierten Gerüste 12 und die Anwendung von hohen Dosen von fluoreszierenden Farbstoffen für Mehrphotonenabbildungs 13 . Es ist auch ein ideales Modell , mit dem 14 die Rolle spezifischer Gene während der akuten Nierenschädigung zu untersuchen.
Ein Schritt-für-Schritt-Protokoll gegeben anderen Labors zu ermöglichen isolierten Maus Nierenperfusion erfolgreich durchzuführen. Zuerst wird die Zusammensetzung und die Herstellung des Puffers spezifiziert. Dann wird die Operation im Detail beschrieben und die kritischen Schritte gezeigt. Drittens werden Daten vorgestellt, die repräsentativ für eine erfolgreiche Vorbereitung: Nierendurchblutung, Gefäßwiderstand, glomeruläre Filtrationsrate und fraktionierte Elektrolytausscheidung-alle als funktionelle Messungen der Lebensfähigkeit-und transmissionselektronenmikroskopischen Aufnahmen der Morphologie verschiedener nephron Segmente perfundiert Nieren nach 1 Stunde der Perfusion fixiert.
Protokoll
Alle Verfahren mit Tieren in diesem Manuskript beschrieben, wurden auf Schweizer Recht durchgeführt nach und von der Veterinärverwaltung des Kantons Zürich, Schweiz genehmigt.
1. Puffer Vorbereitung
- Herstellung von Lösungen von 1 bis 4 und der ADH (ADH) -Lösung (Tabelle 1).
- Bereiten Sie die Dialysepuffer (Tabelle 1).
Hinweis: Dies ist der Puffer als Dialysepuffer während der Perfusion verwendet. Später werden die Erythrozyten in diesem Puffer verdünnt, um die endgültige Perfusat zu bilden. - Erythrozyt Vorbereitung.
- Verdünnte 250 ml menschlicher Erythrozyten-Konzentrat (geprüfte Material aus der lokalen Blutbank erhalten wird) auf 500 ml mit Dialysepuffer. Zentrifuge bei 2000 × g für 8 min. Entfernen Sie den Puffer, wobei keine Erythrozyten zu entfernen. 3x wiederholen.
- Bereiten Sie das Albumin (Rinderserumalbumin, BSA) Puffer.
- In 200 ml dialysis Puffer, lösen sich 44 g BSA einen Rührstab verwenden. Filtern Sie die Lösung mit Filterpapier.
- Bereiten Sie die Perfusat.
- Filtern Sie die Erythrozyten aus Schritt 1.3.1 durch Filterpapier in den BSA-Puffer. Füllen Sie auf ein Gesamtvolumen von 800 ml mit Dialysepuffer auf.
HINWEIS: Dies ist die letzte Perfusat. Der Hämatokrit sollten nun zwischen 8 und 12% liegen. Das Perfusat kann bei 4 ° C bis zu 12 Stunden gelagert werden.
- Filtern Sie die Erythrozyten aus Schritt 1.3.1 durch Filterpapier in den BSA-Puffer. Füllen Sie auf ein Gesamtvolumen von 800 ml mit Dialysepuffer auf.
2. Initiieren Dialyse und Oxygenation
- Schalten Sie das Wasserbad rund um den größeren Pufferbehälter, kleiner Pufferspeicher, und die feuchte Kammer (eine kleine, doppelwandige Kammer gebracht auf 37 ° C und 100% Luftfeuchtigkeit später die Nieren halten) bis 37 ° C (Abbildung 2) .
- Füllen Sie den größeren Pufferspeicher mit dem Dialysepuffer und den kleineren Behälter mit dem Perfusat.
- Schalten Sie die 5% CO 2/95% O 2 Gaszufluss zu dem Dialysepuffer.
- Schalten Sie kontinuierliche Dialyse des Perfusat gegen den Dialysepuffer. Achten Sie darauf, Low-Flux-Dialyseschlauch zu verwenden. Gehen Sie zu Schritt 3.

Abbildung 2: Schematische Darstellung des Perfusionskreislaufes. Schema zeigt die Hauptkomponenten des Perfusionskreislaufs und die Richtung des Pufferflusses. Alle Komponenten von dunkelblau umgeben sind bei 37 ° C mit einem Wasserbad / Thermostat gehalten. 1: Dialysepuffer von mindestens 3 - fache des Volumens des Puffers Perfusion mit 95% O 2/5% CO 2 kontinuierlich geperlt. 2: Dialysepuffer und Perfusionspuffer werden gegeneinander in einen Dialyseschlauch mit einer Rollenpumpe kontinuierlich dialysiert. 3: Durch diese Dialyse, die Perfusionspuffer mit 9% O 2/5% CO 2 und der Elektrolytspiegel konstant gehalten werden througho angereichertut Perfusion. 4: Eine Rollenpumpe treibt den Perfusionspuffer in Richtung auf die Niere. 5: Ein Windkessel entfernt peristaltischen Wellen und wirkt als Blasenfalle. 6: Druckwandler (verbunden mit 4. (Rollenpumpe) Dauerdruck zu halten , während frei abwechselnd Strömung erlaubt). 7: Während der Perfusion, bleibt die Niere in einer feuchten Kammer für 100% Luftfeuchtigkeit und 37 ° C Nierentemperatur. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
3. Chirurgische Verfahren Teil 1 (für ein Diagramm aller Ligaturen, siehe Abbildung 3)
Hinweis: Führen Sie alle Ligatur mit 5-0 chirurgischen Faden.
- Anästhesieren einer Maus durch intraperitoneale Injektion (10 ul / g Körpergewicht, 20 mg / ml Ketamin und 1 mg / ml Xylazin in 0,9% NaCl gelöst). Bestätigen Sie eine ausreichende Tiefe von AnesthESIA durch die Prüfung für das Fehlen von hinteren Fuß Reflexe.
- Befestigen Sie die Maus in Rückenlage in der feuchten Kammer. Schützen Sie die Augen mit vet Salbe. Legen Sie eine 1-ml-Spritze unterhalb der Wirbelsäule, die Lendengefäße zu erhöhen.
- Führen Sie eine mittlere Laparotomie vom Schamkamm bis zum Brustbein Öffnung zuerst die Haut, dann die Bauchmuskeln, mit einer Schere.
- Entfernen Sie den Darm und legen Sie sie auf der linken Seite der Maus seitlich aus dem Bauch.
- Befreien Sie die Blase aus Bindegewebe und erforschen beide Harnleiter und die Harnröhre.
- Legen Sie eine Ligatur um die linke Harnleiter (Ligatur I). Schließen Sie es.
- Legen Sie eine Ligatur um die Harnröhre (Ligatur II). Schließen Sie es.
- Setzen Sie ein "Lasso" Ligatur um die ganze Blase (Ligatur III).
- Inzision der Blase 1 mm.
- Kanülieren die Öffnung mit 2 cm PE 50 Schläuchen.
- Schließen Ligatur III um das Rohr.
- Schneiden Sie die linke Harnleiter und Harnröhre entfernt von der Ligatur. Die bladder wird jetzt nur auf der rechten Seite Harnleiter befestigt und frei bewegen.
- Deaktivieren Sie die Bauchaorta von Bindegewebe und Fett.
- Legen Sie eine Bauch Mitte Aorta Ligatur (Ligatur IV).
- Legen Sie eine Ligatur um die Aorta unterhalb der Membran zwischen der A. mesenterica superior und der Zöliakie-Stamm (Ligatur V).
- Legen Sie eine Ligatur um die A. mesenterica superior (Ligatur VI).
- Legen Sie eine Aorten-Ligatur direkt unter dem rechten und über dem linken Nierenarterie (Ligatur VII).
- Legen Sie eine Ligatur um die Schwanzvene Paket (Cava) (Ligatur VIII). Gehen Sie zu Schritt 4.
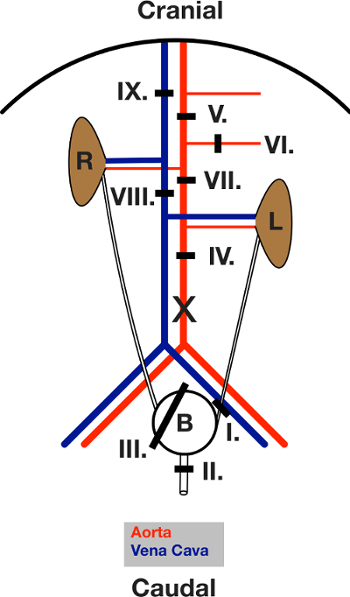
Abbildung 3: Schematische Darstellung der Ligatures während der Operation gegeben. Mit Blick auf das offene Bauch nach der Laparotomie. Der Darm wird nach links ausgezogen. L und R zeigen die linke und die rechte Niere. Dasschwarze Linien zeigen den Bereich der jeweiligen Ligatur. Ligatures werden immer zuerst gesetzt und dann geschlossen, in der im Text angegebenen Reihenfolge. X markiert die Lage des Einschnitts für Aorta Kanülierung. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
4. Priming des Perfusionskreislaufes
- Starten Sie die Kreiselpumpe und füllen Sie den Schlauch mit Perfusat. Achten Sie darauf, alle Luftblasen aus sie zu leeren.
- Füllen Sie das Windkessel Gerät etwa der mittleren Ebene mit Perfusat.
- Kalibrieren Sie den Druckwandler auf 0 mm Hg, wenn alle Rohre gefüllt und Strömung ist 0. während dieser Zeit die Perfusion Nadel bei Nieren Niveau zu halten.
- Halten Sie Fluss auf einem konstanten minimalen Niveau (0,6 ml / min) und gehen Sie zu Schritt 5.
5. Chirurgisches Verfahren Teil 2
- Legen Sie eine Klammer zwischen Ligatur IV und der Verzweigung des linken renal Arterie.
- Machen Sie einen kleinen Schnitt in der Aorta Schwanz- der Ligatur IV, dabei nicht die Rückwand zu schneiden.
- Dilatieren die Öffnung in der Aorta mit einem Gefäß Dilatator.
- nur an der Klemme kanülieren die Aorta mit einer Nadel (2 cm lang, zog 50 PE), die Spitze schieben.
- Öffnen Sie die Klemme.
- Schieben Sie die Spitze der Nadel kranial, bis sie die Kreuzung der rechten Nierenarterie und der Aorta erreicht.
- Schließen Ligatur VII.
- Schließen Ligatur IV.
- Öffnen Sie die Brust mit einer Schere durch die Membran zu sezieren. Mit einem einzigen Schnitt, trennen Sie die Aorta, Hohlvene, Herz und vegetative Nerven. Mit diesem Schritt wird das Tier über eine schnelle Ausbluten unter kontinuierlicher tiefer Narkose getötet.
- Starten Drucksteuerung der Perfusionspumpe. Pflegen Sie den mittleren Druck zwischen 80 und 100 mmHg.
- Schließen Ligatur V.
- Schließen Ligatur VI.
- Schließen Ligatur VIII.
- Freie die rechte Niere von Binde- tissue und seine Einbettung in die adipösen Kapsel mit einer Schere.
- Schneiden proximal die Aorta V. Ligatur
- Schneiden Sie die A. mesenterica superior distal VI Ligatur.
- Schneiden Sie die Niere tragende Gefäßbündel aus, dabei nicht in die Gefäße selbst zu schneiden.
- Schneiden die Leber an der Verbindung mit der Niere. Achten Sie darauf, die Niere zu befreien, aber ein kleiner Teil der Leber verwachsen sie verlassen, so dass die Hohlvene wird durch sie offen gehalten.
- Nehmen Sie die Niere Bündel aus der Maus. Entfernen Sie die Maus aus der feuchten Kammer.
- Setzen Sie ein "Lasso" Ligatur um die Verbindung von Leber und Niere (Ligatur IX).
- Kanülieren die Hohlvene mit einer venösen Leitung (2 cm PE 50).
- Schließen Ligatur IX. Venöse Abfluss durch die venöse Leitung sollte sofort beginnen.
- Schließen Sie die feuchte Kammer.
6. Downstream-Analysen
- Während der folgenden Stunde, überwachen kontinuierlich den Blutfluss und intravascular Druck 15. Sammeln Sie venösen Abfluss, die 7 für die Analyse von zum Beispiel Nierenreninfreisetzung verwendet werden kann. Sammeln Sie Urin für die Analyse der Elektrolytkonzentration und der glomerulären Filtrationsrate 14. Nach 1 Stunde Perfusion kann Nieren für Western - Blot werden schockgefroren oder für die Bildgebung Ansätze 16 festgelegt werden.
Ergebnisse
Mit dem Verfahren isolierten Maus-Nieren beschrieben, kann für mindestens 1 h lebensfähig bleiben. Wir testeten die Gewebelebensfähigkeit nach 1 Stunde der kontinuierlichen Perfusion mit funktionellen (Nierendurchblutung und Gefäßwiderstand, Blutgasanalyse von venösen Abflusses, der glomerulären Filtrationsrate, Harn- fraktionierte Na + und K + -Ausscheidung und Urinosmolalität) und morphologischen (Transmissionselektronenmikroskop Mikroskopie TEM) Methods i...
Diskussion
Die Maus perfundierte Niere isoliert ist ein Werkzeug für die Untersuchung der Nierenfunktion in einer kontrollierten Umgebung ex vivo für 1 h, die Lücke zwischen den in vivo Experimenten in intakten Tieren, die durch die Wirkung zahlreicher systemischer Faktoren fehlerhaft sein kann, und in vitro - Experimenten in isoliert nephron Segmente oder kultivierten Zellen, die notwendigerweise die Auswirkungen der intakten Organstruktur auf Funktion vernachlässigen. Es ist, nach Kenntnis der Auto...
Offenlegungen
The authors have no competing financial interests and nothing else to disclose.
Danksagungen
The authors would like to thank Hans-Joachim Schurek for invaluable scientific advice. The authors would like to thank Monique Carrel and Michèle Heidemeyer for excellent technical assistance, David Penton Ribas and Nourdine Faresse for a critical reading of the manuscript and Carsten Wagner and Jürg Biber for the NaPi-2a antibody. This work was supported by the Swiss National Centre for Competence in Research "Kidney.CH" and by a project grant (310030_143929/1) from the Swiss National Science Foundation.
Materialien
| Name | Company | Catalog Number | Comments |
| Perfusion Circuit: | |||
| Moist chamber 834/8 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2901 | |
| Cannular with basket and side port | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2947 | |
| Thermostat TC120-ST5 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-4544 | |
| ISM 827/230V Roller Pump Reglo Analogue | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-0114 | |
| Reservoir jacketed for buffer solution 1L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3438 | |
| Reservoir jacketed for buffer solution 0.5L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3436 | |
| Pressure Transducer APT300 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3862 | |
| TAM-D Plugsys Transducer | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-1793 | |
| SCP Plugsys servo controller | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2806 | |
| Windkessel | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3717 | |
| HSE-USB data acquisition | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3330 | |
| Low-Flux Dialysator Diacap Polysulfone | B.Braun | 7203525 | |
| PE-Tubing for aorta cannulation 1.19mm I.D. x 1.70mm O.D. | Scientific Commodities Inc. | BB31695-PE/8 | |
| Name | Company | Catalog Number | Comments |
| Buffer reagents: | |||
| Aminoplasmal 10% | B.Braun | 134518064 | |
| Sodium pyruvate | Sigma-Aldrich | P2256-25G | |
| L-Glutamic acid monosodium salt hydrate | Sigma-Aldrich | G1626-100G | |
| L-(-)-Malic acid sodium salt | Sigma-Aldrich | M1125-25G | |
| Sodium-L-Lactate | Sigma-Aldrich | L7022-10G | |
| alpha-Ketoglutaric acid sodium salt | Sigma-Aldrich | K1875-25G | |
| NaCl | Sigma-Aldrich | 31434-1KG-R | |
| NaHCO3 | Sigma-Aldrich | S5761-5KG | |
| KCl | Sigma-Aldrich | 60130-1KG | |
| Urea | Sigma-Aldrich | U5378-500G | |
| Creatinine | Sigma-Aldrich | C4255-10G | |
| Ampicillin | Roche | 10835242001 | |
| MgCl2 * 6H2O | Sigma-Aldrich | M2393-500G | |
| D-Glucose | Sigma-Aldrich | G8270-1KG | |
| CaCl2 * 6H2O | Riedel-de-Haën | 12074 | |
| NaH2PO4 | Sigma-Aldrich | S9638-500G | |
| Na2HPO4 | Sigma-Aldrich | S0876-500G | |
| Antidiuretic Hormone dDAVP | Sigma-Aldrich | V2013-1MG | |
| FITC-Inulin | Sigma-Aldrich | ||
| Filter used for erythrocyte filtration | Macherey-Nagel | MN 615 | |
| BGA Analysis: | |||
| ABL 80 flex | Radiometer Medical ApS | ||
| Electron Microscope: | |||
| Philips CM100 TEM | FEI |
Referenzen
- Carrel, A., Lindbergh, C. A. The culture of whole organs. Science (New York, N.Y.). 81 (2112), 621-623 (1935).
- Skutul, K. . Über Durchströmungsapparate Pflüger's Archiv. 123 (4-6), 249-273 (1908).
- Nizet, A. The isolated perfused kidney: possibilities, limitations and results. Kidney Int. 7 (1), 1-11 (1975).
- Weiss, C., Passow, H., Rothstein, A. Autoregulation of flow in isolated rat kidney in the absence of red cells. Am J Physiol. 196 (5), 1115-1118 (1959).
- Schurek, H. J., Kriz, W. Morphologic and functional evidence for oxygen deficiency in the isolated perfused rat kidney. Lab Invest. 53 (2), 145-155 (1985).
- Stolte, H., Schurek, H. J., Alt, J. M. Glomerular albumin filtration: a comparison of micropuncture studies in the isolated perfused rat kidney with in vivo experimental conditions. Kidney Int. 16 (3), 377-384 (1979).
- Schweda, F., Wagner, C., Krämer, B. K., Schnermann, J., Kurtz, A. Preserved macula densa-dependent renin secretion in A1 adenosine receptor knockout mice. AJP Renal Physiol. 284 (4), F770-F777 (2003).
- Moers, C., Smits, J. M., et al. Machine perfusion or cold storage in deceased-donor kidney transplantation. N Engl J Med. 360 (1), 7-19 (2009).
- Nicholson, M. L., Hosgood, S. A. Renal transplantation after ex vivo normothermic perfusion: the first clinical study. Am J Transplant. 13 (5), 1246-1252 (2013).
- Worner, M., Poore, S., Tilkorn, D., Lokmic, Z., Penington, A. J. A low-cost, small volume circuit for autologous blood normothermic perfusion of rabbit organs. Art Org. 38 (4), 352-361 (2014).
- Kaths, J. M., Spetzler, V. N., et al. Normothermic Ex Vivo Kidney Perfusion for the Preservation of Kidney Grafts prior to Transplantation. J Vis Exp. (101), e52909 (2015).
- Song, J. J., Guyette, J. P., Gilpin, S. E., Gonzalez, G., Vacanti, J. P., Ott, H. C. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Med. 19 (5), 646-651 (2013).
- Hall, A. M., Crawford, C., Unwin, R. J., Duchen, M. R., Peppiatt-Wildman, C. M. Multiphoton imaging of the functioning kidney. JASN. 22 (7), 1297-1304 (2011).
- Lindell, S. L., Williams, N., Brusilovsky, I., Mangino, M. J. Mouse IPK: A Powerful Tool to Partially Characterize Renal Reperfusion and Preservation Injury. Open Transplant J. 5, 15-22 (2011).
- Wagner, C., De Wit, C., Kurtz, L., Grünberger, C., Kurtz, A., Schweda, F. Connexin40 is essential for the pressure control of renin synthesis and secretion. Circ Res. 100 (4), 556-563 (2007).
- Czogalla, J., Vohra, T., Penton, D., Kirschmann, M., Craigie, E., Loffing, J. The mineralocorticoid receptor (MR) regulates ENaC but not NCC in mice with random MR deletion. Pflüger's Archiv. , (2016).
- Poosti, F., et al. Precision-cut kidney slices (PCKS) to study development of renal fibrosis and efficacy of drug targeting ex vivo. Dis Model Mech. 8 (10), 1227-1236 (2015).
- Rahgozar, M., Guan, Z., Matthias, A., Gobé, G. C., Endre, Z. H. Angiotensin II facilitates autoregulation in the perfused mouse kidney: An optimized in vitro model for assessment of renal vascular and tubular function. Nephrology. 9 (5), 288-296 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten