É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A técnica de rim perfundidos rato isolado
Neste Artigo
Resumo
O mouse rim isolado perfundido (MIPK) é uma técnica para manter um rim do rato em condições ex vivo perfundidos e funcionais durante 1 h. Os tampões e técnica cirúrgica encontram-se descritos em pormenor.
Resumo
O mouse rim isolado perfundido (MIPK) é uma técnica para manter um rim do rato em condições ex vivo perfundidos e funcionais durante 1 h. Este é um pré-requisito para o estudo da fisiologia do órgão isolado e para muitas aplicações inovadoras que possam ser possíveis no futuro, incluindo decellularization perfusão de bioengenharia nos rins ou a administração de anti-rejeição ou drogas edição do genoma em altas doses para preparar o rim para transplante. Durante o tempo da perfusão, o rim pode ser manipulada, a função renal pode ser avaliada, e vários produtos farmacêuticos administrados. Após o procedimento, o rim transplantado ou pode ser processado para a biologia molecular, bioquímica, ou microscopia.
Este artigo descreve o perfusado e da técnica cirúrgica necessária para a perfusão ex-vivo de rins de rato. Os detalhes do aparelho de perfusão são dados e os dados são apresentados mostrando o vESPONSABILIDADE da preparação do rim: fluxo sangüíneo renal, resistência vascular, e urina dados como funcionais, micrografias eletrônicas de transmissão de diferentes segmentos dos néfrons como leituras morfológicas e Western blot de proteínas de transporte de diferentes segmentos dos néfrons como leitura molecular.
Introdução
A perfusão isolada de órgãos tem sido objecto de um esforço contínuo entre os fisiologistas por muitas décadas 1. A técnica permite que a função do órgão, sem influências sistêmicas, tais como pressão arterial, hormônios ou nervos, a ser estudado. Carl Eduard Loebell é considerado para ser o primeiro a ter descrito a perfusão bem sucedida de um rim isolado, em 1849 2. Desde então, o aparelho de perfusão foi submetido refinamento significativa. Frey e Gruber introduzido um pulmão artificial para bombas de oxigenação e pulsátil para perfusão contínua 2. Enquanto os primeiros pesquisadores estudaram principalmente os rins de mamíferos de grande porte, ou seja, porcos e cães 2 3 -o primeiro relatório do uso de rins de ratos, por Weiss et al. , Foi um marco no estudo da perfusão-mamífero-órgão pequeno 4. Schurek et ai. relataram a necessidade de adição de eritrócitos de mamífero para o perfusato se tubular renal suficienteoxigenação deveria ser alcançado 5. Crítico para experiências a longo prazo foi a introdução de diálise contínua do tampão pelo mesmo grupo de pesquisa 6. Em 2003, Schweda et al. foram os primeiros a relatar um rim do rato funcional isolado perfundido (MIPK) 7, posteriormente refinado por Rahgozar et al. 18 e Lindell et ai. 14.
Embora tecnicamente mais exigente do que o de rato perfundido isolado de rim, o uso do MIPK carrega a vantagem de permitir o uso de uma grande variedade de ratinhos geneticamente alterados. Este artigo apresenta os dados sobre o método dos autores para perfusão isolados de rato rins durante 1 h. O método permite a avaliação contínua da taxa renal fluxo, resistência vascular, liberação de hormônio, gasometria, análise de urina, bem como a aplicação de medicamentos. Seguindo o procedimento, rins podem ser processadas para análise molecular e bioquímica, ser fixo por microscopia, outransplantado para um rato receptor (Figura 1).

Figura 1: Visão geral do Possível entrada / saída para o rim isolado perfundido. BGA: Hemogasometria. Por favor clique aqui para ver uma versão maior desta figura.
Esta técnica provavelmente vai receber uma atenção crescente nos próximos anos, como muitas aplicações inovadoras estão sendo discutidas com o alvorecer da perfusão renal normotérmica prolongado antes do transplante (com ou sem a aplicação de anti-rejeição ou drogas edição do genoma) 8, 9, 10 , 11, a bioengenharia dos rins inteiros de andaimes descelularizados 12, bem como a aplicação de doses elevadas de corantes fluorescentes para a imagem latente multiphoton 13 . Também é um modelo ideal com o qual se estudar o papel de genes específicos durante a lesão renal aguda 14.
Um protocolo de passo-a-passo é dado para permitir que outros laboratórios para realizar isolado rato perfusão renal com sucesso. Em primeiro lugar, a composição e preparação do buffer é especificado. Em seguida, a cirurgia é descrito em pormenor e os passos críticos são mostrados. Em terceiro lugar, os dados são apresentados que são representativos de uma preparação bem sucedida: o fluxo sanguíneo renal, resistência vascular, taxa de filtração glomerular, e eletrólitos fraccionada medições funcionais de viabilidade e eletrônica de transmissão micrografias da morfologia dos diferentes segmentos dos néfrons de Rins todos excreção- fixado após 1 hora de perfusão.
Protocolo
Todos os procedimentos que envolvem animais descritos neste manuscrito foram conduzidos de acordo com a lei suíça e aprovado pela administração veterinária do Cantão de Zurique, Suíça.
1. Preparação Tampão
- Preparar soluções 1 - 4 e a solução de hormônio antidiurético (ADH) (Tabela 1).
- Prepara-se o tampão de diálise (Tabela 1).
NOTA: Este é o tampão utilizado como o tampão de diálise durante a perfusão. Mais tarde, os eritrócitos serão diluídas neste tampão para formar o perfusato final. - preparação de eritrócitos.
- Dilui-se 250 ml de concentrado de eritrócitos humana (material testado obtido a partir do banco de sangue local) para 500 ml com tampão de diálise. Centrifugar a 2000 xg durante 8 minutos. Remover o tampão, tomando cuidado para não remover quaisquer eritrócitos. 3x.
- Prepara-se o (albumina de soro de bovino; BSA) de albumina de tampão.
- Em 200 ml de dialysitampão s, dissolver 44 g de BSA usando uma barra de agitação. Filtra-se a solução com papel de filtro.
- Prepara-se o perfusado.
- Filtrar os eritrócitos a partir do passo 1.3.1 através de papel de filtro para o tampão de BSA. Encha até um volume total de 800 ml com tampão de diálise.
NOTA: Este é o perfusato final. O hematócrito agora deve situar-se entre 8 e 12%. O perfusato pode ser armazenado durante até 12 h a 4 ° C.
- Filtrar os eritrócitos a partir do passo 1.3.1 através de papel de filtro para o tampão de BSA. Encha até um volume total de 800 ml com tampão de diálise.
2. Início de Diálise e Oxigenação
- Ligar o banho de água em torno do reservatório maior tampão, menor do reservatório tampão, e a câmara de humidade (uma pequena câmara, de parede dupla trazida a 37 ° C e 100% de humidade para realizar mais tarde, o rim) a 37 ° C (Figura 2) .
- Encher o reservatório de tampão de maior com o tampão de diálise e o reservatório menor com o perfusato.
- Ligue a 5% de CO 2/95% O 2 afluxo de gás para o tampão de diálise.
- Ligar diálise contínua do perfusado contra o tampão de diálise. Tome o cuidado de usar tubos de diálise baixo fluxo. Vá para a Etapa 3.

Figura 2: Desenho esquemático do circuito de perfusão. Esquema mostra os principais componentes do circuito de perfusão e a direcção do fluxo tampão. Todos os componentes rodeados por azul escuro são mantidos a 37 ° C com um banho de água / termostato. 1: tampão de diálise de pelo menos 3 vezes o volume de tampão de perfusão é continuamente borbulhada com 95% de O2 / 5% de CO 2. 2: tampão de diálise e tampão de perfusão são continuamente dialisada contra o outro num tubo de diálise por uma bomba de rolos. 3: througho constante Devido a esta diálise, o tampão de perfusão é enriquecida com 9% de O2 / 5% de CO 2 e de electrólitos são mantidos níveisperfusão ut. 4: Uma bomba de cilindro impele o tampão de perfusão para o rim. 5: Uma Windkessel remove as ondas peristálticas e funciona como uma armadilha de bolhas. 6: transdutor de pressão (ligados a 4. (bomba de roletes) para manter a pressão contínua, permitindo o fluxo alternando livremente). 7: Durante a perfusão, o rim permanece numa câmara húmida para 100% de humidade atmosférica e 37 ° C Temperatura de rim. Por favor clique aqui para ver uma versão maior desta figura.
3. Cirúrgica Procedimento Parte 1 (para um diagrama de todas as ligaduras, consulte a Figura 3)
Nota: Executar todas as ligaduras usando 5-0 fio cirúrgico.
- Anestesiar um rato por injecção intraperitoneal (10 mL / g de peso corporal, de 20 mg / ml de cetamina e 1 mg / ml de xilazina dissolvido em 0,9% de NaCl). Confirmar profundidade suficiente de AnesthAIAS por testar a ausência de reflexos traseira pés.
- Corrigir o rato em decúbito dorsal na câmara húmida. Proteger os olhos com pomada veterinário. Coloque uma seringa de 1 ml abaixo da coluna vertebral para elevar os vasos lombares.
- Realizar uma laparotomia mediana da crista púbica para a abertura do esterno primeira a pele, em seguida, os músculos abdominais, com uma tesoura.
- Remover o intestino e colocá-lo no lado esquerdo da lateral do mouse a partir do abdômen.
- Libertar a bexiga de tecido conjuntivo e explorar ambos os ureteres e uretra.
- Coloque uma ligadura em torno do ureter esquerdo (ligadura I). Fecha-o.
- Colocar uma ligadura em torno da uretra (ligadura II). Fecha-o.
- Coloque um "laço" ligadura em torno de toda a bexiga (ligadura III).
- Faça uma incisão na bexiga 1 mm.
- Canular a abertura com dois centímetros PE 50 tubos.
- Fechar ligadura III em torno do tubo.
- Cortar o uréter esquerdo e uretra distai das ligaduras. o bladder agora está ligado ao ureter direito apenas e movimentando-se livremente.
- Desmarque a aorta abdominal de tecido conjuntivo e gordura.
- Coloque uma ligadura meados de aorta abdominal (ligadura IV).
- Colocar uma ligadura em torno da aorta abaixo do diafragma entre a artéria mesentérica superior e o tronco celíaca (V ligadura).
- Colocar uma ligadura à volta da artéria mesentérica superior (VI ligadura).
- Coloque uma ligadura da aorta imediatamente abaixo do direito e acima da artéria renal esquerda (VII ligadura).
- Coloque uma ligadura em torno do pacote de caudal veia (veia) (VIII ligadura). Vá para a Etapa 4.
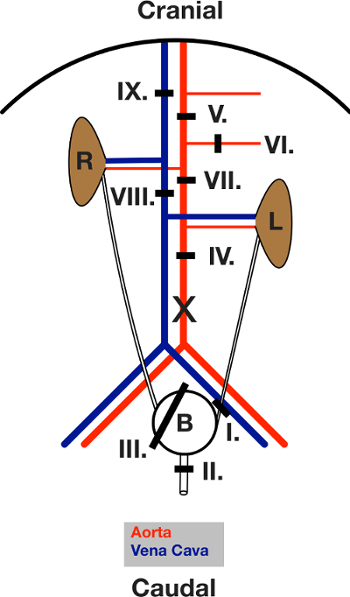
Figura 3: Desenho esquemático das ligaduras colocadas durante a cirurgia. Vista do abdómen aberto após a laparotomia. O intestino é movido para fora para a esquerda. L e R indicam o rim esquerdo eo direito. olinhas pretas mostram a área da respectiva laqueação. Ligaduras primeira colocação e depois fechada, na sequência indicada no texto. X marca a localização da incisão para canulação da aorta. Por favor clique aqui para ver uma versão maior desta figura.
4. Priming do circuito de perfusão
- Inicie a bomba rotativa e encher o tubo com perfusato. Tome cuidado para esvaziar todas as bolhas de ar.
- Encha o dispositivo Windkessel a cerca de nível médio com perfusato.
- Calibra-se o transdutor de pressão até 0 mm de Hg quando toda a tubagem é cheio e o fluxo é 0. Manter a agulha de perfusão, a nível renal durante este tempo.
- Manter o fluxo em um nível mínimo constante (0,6 ml / min) e vá para a Etapa 5.
5. Surgical Procedimento Parte 2
- Coloque um grampo entre ligadura IV ea ramificação da rena esquerdal artéria.
- Faça uma pequena incisão no caudal aorta de ligadura IV, tomando cuidado para não cortar a parede dorsal.
- Dilatar a abertura da aorta com um vaso dilatador.
- Canular a aorta, com uma agulha (2 cm de comprimento, puxado PE 50), empurrando a ponta apenas para o grampo.
- Abra o grampo.
- Empurrar a ponta da agulha cranialmente até atingir a junção da artéria renal direita e da aorta.
- Fechar ligadura VII.
- Fechar ligadura IV.
- Abra o peito com uma tesoura dissecando o diafragma. Com um único corte, separe a aorta, a veia cava, coração e nervos vegetativos. Com este passo, o animal foi sacrificado através de exsanguinação sob anestesia profunda rápida contínua.
- Iniciar o controle da pressão da bomba de perfusão. Manter a pressão média entre 80 e 100 mmHg.
- Fechar V. ligadura
- Fechar ligadura VI.
- Fechar ligadura VIII.
- Livre do rim direito de tissu conjuntivoe e sua incorporação na cápsula adiposo com uma tesoura.
- Corte a aorta proximal à ligadura V.
- Corte da artéria mesentérica superior distalmente à ligadura VI.
- Cortar o feixe vascular-sustentável rim para fora, tomando cuidado para não cortar os próprios vasos.
- Cortar o fígado na ligação para o rim. Cuidar para libertar o rim, mas deixa uma pequena parte do aderente fígado a ele, de modo que a veia cava é mantida aberta por ela.
- Pegue o pacote de rim para fora do mouse. Remover o rato da câmara úmida.
- Coloque um "laço" ligadura à volta da ligação de fígado e rim (IX ligadura).
- Canular a veia cava com uma linha venosa (dois centímetros PE 50).
- Fechar ligadura IX. fluxo venoso através do cateter venoso deve começar imediatamente.
- Feche a câmara úmida.
6. As análises a jusante
- Durante a hora seguinte, monitorar continuamente o fluxo sanguíneo e intravasculpressão de ar 15. Recolhe fluxo venoso, que pode ser utilizado para análise de, por exemplo, a libertação de renina renal 7. Coleta de urina para análise da concentração de eletrólitos e taxa de filtração glomerular 14. Após 1 hora de perfusão, os rins podem ser snap-congelados por western blot ou ser fixado para a imagem latente aproxima 16.
Resultados
Com o método descrito, rins isolados do rato podem permanecer viáveis durante pelo menos 1 h. Foi testada a viabilidade dos tecidos depois de 1 hora de perfusão contínua com funcional (fluxo sanguíneo renal e resistência vascular, gasometria do fluxo venoso, taxa de filtração glomerular, urinário fraccionada Na + e K + excreção, e osmolaridade urinária) e morfológico (eletrônica de transmissão microscopia, TEM) em quatro métodos rins de tipo se...
Discussão
O mouse rim isolado perfundido é uma ferramenta para o estudo da função renal em um ambiente controlado ex vivo, durante 1 hora, fazendo a ponte entre experiências in vivo em animais intactos, o que pode ser falho pelo impacto de vários fatores sistêmicos e experimentos in vitro em segmentos dos néfrons isolados ou células cultivadas, o que necessariamente negligenciam o impacto da estrutura de órgãos intactos na função. Há, ao conhecimento dos autores, nenhuma técnica alternativ...
Divulgações
The authors have no competing financial interests and nothing else to disclose.
Agradecimentos
The authors would like to thank Hans-Joachim Schurek for invaluable scientific advice. The authors would like to thank Monique Carrel and Michèle Heidemeyer for excellent technical assistance, David Penton Ribas and Nourdine Faresse for a critical reading of the manuscript and Carsten Wagner and Jürg Biber for the NaPi-2a antibody. This work was supported by the Swiss National Centre for Competence in Research "Kidney.CH" and by a project grant (310030_143929/1) from the Swiss National Science Foundation.
Materiais
| Name | Company | Catalog Number | Comments |
| Perfusion Circuit: | |||
| Moist chamber 834/8 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2901 | |
| Cannular with basket and side port | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2947 | |
| Thermostat TC120-ST5 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-4544 | |
| ISM 827/230V Roller Pump Reglo Analogue | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-0114 | |
| Reservoir jacketed for buffer solution 1 L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3438 | |
| Reservoir jacketed for buffer solution 0.5 L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3436 | |
| Pressure Transducer APT300 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3862 | |
| TAM-D Plugsys Transducer | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-1793 | |
| SCP Plugsys servo controller | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2806 | |
| Windkessel | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3717 | |
| HSE-USB data acquisition | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3330 | |
| Low-Flux Dialysator Diacap Polysulfone | B.Braun | 7203525 | |
| PE-Tubing for aorta cannulation 1.19 mm I.D. x 1.70 mm O.D. | Scientific Commodities Inc. | BB31695-PE/8 | |
| Name | Company | Catalog Number | Comments |
| Buffer reagents: | |||
| Aminoplasmal 10% | B.Braun | 134518064 | |
| Sodium pyruvate | Sigma-Aldrich | P2256-25G | |
| L-Glutamic acid monosodium salt hydrate | Sigma-Aldrich | G1626-100G | |
| L-(-)-Malic acid sodium salt | Sigma-Aldrich | M1125-25G | |
| Sodium-L-Lactate | Sigma-Aldrich | L7022-10G | |
| alpha-Ketoglutaric acid sodium salt | Sigma-Aldrich | K1875-25G | |
| NaCl | Sigma-Aldrich | 31434-1KG-R | |
| NaHCO3 | Sigma-Aldrich | S5761-5KG | |
| KCl | Sigma-Aldrich | 60130-1KG | |
| Urea | Sigma-Aldrich | U5378-500G | |
| Creatinine | Sigma-Aldrich | C4255-10G | |
| Ampicillin | Roche | 10835242001 | |
| MgCl2 * 6H2O | Sigma-Aldrich | M2393-500G | |
| D-Glucose | Sigma-Aldrich | G8270-1KG | |
| CaCl2 * 6H2O | Riedel-de-Haën | 12074 | |
| NaH2PO4 | Sigma-Aldrich | S9638-500G | |
| Na2HPO4 | Sigma-Aldrich | S0876-500G | |
| Antidiuretic Hormone dDAVP | Sigma-Aldrich | V2013-1MG | |
| FITC-Inulin | Sigma-Aldrich | ||
| Filter used for erythrocyte filtration | Macherey-Nagel | MN 615 | |
| BGA Analysis: | |||
| ABL 80 flex | Radiometer Medical ApS | ||
| Electron Microscope: | |||
| Philips CM100 TEM | FEI |
Referências
- Carrel, A., Lindbergh, C. A. The culture of whole organs. Science (New York, N.Y.). 81 (2112), 621-623 (1935).
- Skutul, K. . Über Durchströmungsapparate Pflüger's Archiv. 123 (4-6), 249-273 (1908).
- Nizet, A. The isolated perfused kidney: possibilities, limitations and results. Kidney Int. 7 (1), 1-11 (1975).
- Weiss, C., Passow, H., Rothstein, A. Autoregulation of flow in isolated rat kidney in the absence of red cells. Am J Physiol. 196 (5), 1115-1118 (1959).
- Schurek, H. J., Kriz, W. Morphologic and functional evidence for oxygen deficiency in the isolated perfused rat kidney. Lab Invest. 53 (2), 145-155 (1985).
- Stolte, H., Schurek, H. J., Alt, J. M. Glomerular albumin filtration: a comparison of micropuncture studies in the isolated perfused rat kidney with in vivo experimental conditions. Kidney Int. 16 (3), 377-384 (1979).
- Schweda, F., Wagner, C., Krämer, B. K., Schnermann, J., Kurtz, A. Preserved macula densa-dependent renin secretion in A1 adenosine receptor knockout mice. AJP Renal Physiol. 284 (4), F770-F777 (2003).
- Moers, C., Smits, J. M., et al. Machine perfusion or cold storage in deceased-donor kidney transplantation. N Engl J Med. 360 (1), 7-19 (2009).
- Nicholson, M. L., Hosgood, S. A. Renal transplantation after ex vivo normothermic perfusion: the first clinical study. Am J Transplant. 13 (5), 1246-1252 (2013).
- Worner, M., Poore, S., Tilkorn, D., Lokmic, Z., Penington, A. J. A low-cost, small volume circuit for autologous blood normothermic perfusion of rabbit organs. Art Org. 38 (4), 352-361 (2014).
- Kaths, J. M., Spetzler, V. N., et al. Normothermic Ex Vivo Kidney Perfusion for the Preservation of Kidney Grafts prior to Transplantation. J Vis Exp. (101), e52909 (2015).
- Song, J. J., Guyette, J. P., Gilpin, S. E., Gonzalez, G., Vacanti, J. P., Ott, H. C. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Med. 19 (5), 646-651 (2013).
- Hall, A. M., Crawford, C., Unwin, R. J., Duchen, M. R., Peppiatt-Wildman, C. M. Multiphoton imaging of the functioning kidney. JASN. 22 (7), 1297-1304 (2011).
- Lindell, S. L., Williams, N., Brusilovsky, I., Mangino, M. J. Mouse IPK: A Powerful Tool to Partially Characterize Renal Reperfusion and Preservation Injury. Open Transplant J. 5, 15-22 (2011).
- Wagner, C., De Wit, C., Kurtz, L., Grünberger, C., Kurtz, A., Schweda, F. Connexin40 is essential for the pressure control of renin synthesis and secretion. Circ Res. 100 (4), 556-563 (2007).
- Czogalla, J., Vohra, T., Penton, D., Kirschmann, M., Craigie, E., Loffing, J. The mineralocorticoid receptor (MR) regulates ENaC but not NCC in mice with random MR deletion. Pflüger's Archiv. , (2016).
- Poosti, F., et al. Precision-cut kidney slices (PCKS) to study development of renal fibrosis and efficacy of drug targeting ex vivo. Dis Model Mech. 8 (10), 1227-1236 (2015).
- Rahgozar, M., Guan, Z., Matthias, A., Gobé, G. C., Endre, Z. H. Angiotensin II facilitates autoregulation in the perfused mouse kidney: An optimized in vitro model for assessment of renal vascular and tubular function. Nephrology. 9 (5), 288-296 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados