È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
La tecnica del rene perfusi mouse isolato
In questo articolo
Riepilogo
L'isolato rene perfuso mouse (MIPK) è una tecnica per mantenere un rene mouse sotto ex vivo condizioni perfusi e funzionali per 1 ora. I buffer e tecnica chirurgica sono descritte in dettaglio.
Abstract
L'isolato rene perfuso mouse (MIPK) è una tecnica per mantenere un rene mouse sotto ex vivo condizioni perfusi e funzionali per 1 ora. Questo è un prerequisito per lo studio della fisiologia dell'organo isolata e per molte applicazioni innovative che possono essere possibile in futuro, tra perfusione decellularization per la bioingegneria reni o la somministrazione di anti-rigetto o droghe genoma-editing in dosi elevate per innescare il rene per il trapianto. Durante il tempo della perfusione, il rene può essere manipolato, funzione renale può essere valutata, e vari farmaci somministrati. Dopo la procedura, il rene può essere trapiantato o trasformati per la biologia molecolare, l'analisi biochimica, o al microscopio.
Questo articolo descrive il perfusato e la tecnica chirurgica necessaria per la perfusione ex vivo di reni mouse. Dettagli dell'apparato perfusione sono date e dati sono presentati mostra la vESPONSABILITÀ di preparazione del rene: il flusso ematico renale, la resistenza vascolare, e delle urine dati come, microscopio elettronico di trasmissione funzionali dei diversi segmenti del nefrone come letture morfologiche, e le macchie occidentali di proteine di trasporto dei diversi segmenti del nefrone come lettura molecolare.
Introduzione
La perfusione isolata di organi è stato oggetto di uno sforzo continuo tra fisiologi per molti decenni 1. La tecnica consente la funzione dell'organo, senza influenze sistemiche come la pressione sanguigna, ormoni, o nervi, da studiare. Carl Eduard Loebell è considerato il primo ad aver descritto la perfusione successo di un rene isolato, nel 1849 2. Da allora, l'apparato perfusione ha subito notevole raffinatezza. Frey e Gruber ha introdotto un polmone artificiale per le pompe di ossigenazione e pulsatile per continua perfusione 2. Mentre i primi ricercatori hanno studiato principalmente i reni di grandi mammiferi, cioè, maiali e cani 2 3 -la prima relazione l'uso di reni di ratto, di Weiss et al. , È stata una pietra miliare nello studio della perfusione piccolo-mammifero-organo 4. Schurek et al. riferito la necessità di aggiungere eritrociti di mammifero al perfusato se tubulare renale sufficienteossigenazione doveva essere raggiunto 5. Critico per esperimenti di lunga durata è stata l'introduzione della dialisi continua del buffer dallo stesso gruppo di ricerca 6. Nel 2003, Schweda et al. sono stati i primi a segnalare un rene del mouse funzionale isolato perfuso (MIPK) 7, in seguito perfezionato da Rahgozar et al. 18 e Lindell et al. 14.
Mentre tecnicamente più impegnativo rispetto al ratto isolato rene perfuso, l'uso del MIPK porta il vantaggio di permettere l'uso di una vasta gamma di topi geneticamente modificati. Questo documento presenta i dettagli del metodo degli autori per la perfusione isolata reni del mouse per 1 ora. Il metodo consente la valutazione continua della velocità di flusso renale, resistenza vascolare, rilascio di ormone, emogasanalisi, analisi delle urine, e l'applicazione di farmaci. Seguendo la procedura, reni potrebbero essere trattati per analisi molecolari e biochimiche, fissati per la microscopia, otrapiantato in un topo ricevente (Figura 1).

Figura 1: panoramica dei possibili Input / Output al rene isolato e perfuso. BGA: analisi dei gas del sangue. Clicca qui per vedere una versione più grande di questa figura.
Questa tecnica probabile che riceverà maggiore attenzione nei prossimi anni, come molte applicazioni innovative sono in discussione con l'alba di una prolungata perfusione del rene normotermico prima del trapianto (con o senza l'applicazione di anti-rigetto o droghe genoma-editing) 8, 9, 10 , 11, la bioingegneria di interi reni da impalcature decellularized 12, e l'applicazione di elevate dosi di coloranti fluorescenti per l'imaging multiphoton 13 . E 'anche un modello ideale con cui studiare il ruolo di specifici geni durante il danno renale acuto 14.
Un protocollo step-by-step è dato per consentire ad altri laboratori di eseguire isolato mouse perfusione del rene con successo. Innanzitutto, è specificato la composizione e preparazione del buffer. Quindi, l'intervento è descritto in dettaglio e sono presenti i punti critici. In terzo luogo, i dati vengono presentati che sono rappresentativi di una preparazione di successo: il flusso ematico renale, la resistenza vascolare, velocità di filtrazione glomerulare, e degli elettroliti frazionaria misurazioni funzionali di vitalità e di elettroni trasmissione micrografie della morfologia dei diversi segmenti nefrone di reni perfusi tutti escrezione- fisso dopo 1 ora di perfusione.
Protocollo
Tutte le procedure che coinvolgono gli animali descritti in questo manoscritto sono stati condotti secondo il diritto svizzero e approvati dall'amministrazione veterinario del Cantone di Zurigo, Svizzera.
1. Preparazione Buffer
- Preparare soluzioni 1 - 4 e la soluzione ormone antidiuretico (ADH) (Tabella 1).
- Preparare il tampone di dialisi (Tabella 1).
NOTA: Questo è il buffer utilizzato come tampone di dialisi durante la perfusione. Successivamente, gli eritrociti vengono diluiti in questo tampone per formare il perfusato finale. - preparazione degli eritrociti.
- Diluire 250 ml di concentrato di eritrociti umani (materiale testato ottenuto dalla banca locale del sangue) a 500 ml con tampone di dialisi. Centrifugare a 2.000 g per 8 minuti. Rimuovere il tampone, facendo attenzione a non rimuovere eventuali eritrociti. Ripetere 3x.
- Preparare la (albumina sierica bovina; BSA) l'albumina del buffer.
- In 200 ml di dialysibuffer di s, sciogliere 44 g di BSA con un ancoretta. Filtrare la soluzione con carta da filtro.
- Preparare il perfusato.
- Filtrare le eritrociti dal punto 1.3.1 attraverso carta da filtro nel buffer BSA. Riempire fino ad un volume totale di 800 ml con tampone di dialisi.
NOTA: Questo è il perfusato finale. L'ematocrito dovrebbe essere compresa tra 8 e 12%. Il perfusato può essere conservato per un massimo di 12 ore a 4 ° C.
- Filtrare le eritrociti dal punto 1.3.1 attraverso carta da filtro nel buffer BSA. Riempire fino ad un volume totale di 800 ml con tampone di dialisi.
2. Avvio Dialisi e l'ossigenazione
- Accendere bagnomaria circonda il serbatoio più grande del buffer, più piccolo serbatoio tampone, e la camera umida (una piccola camera doppia parete portata a 37 ° C e 100% di umidità per mantenere entro il rene) a 37 ° C (figura 2) .
- Riempire il serbatoio buffer maggiore con il tampone di dialisi e il serbatoio più piccolo con perfusato.
- Accendere il 5% di CO 2/95% O 2 afflusso di gas al tampone di dialisi.
- Accendere dialisi continua del perfusato contro il tampone di dialisi. Fate attenzione ad usare a basso flusso tubo di dialisi. Passare al punto 3.

Figura 2: Schema del circuito di perfusione. Schema mostra i principali componenti del circuito di perfusione e la direzione del flusso buffer. Tutti i componenti circondato da blu scuro vengono mantenute a 37 ° C con un bagno di acqua / termostato. 1: Dialisi tampone di almeno 3 volte il volume del buffer di perfusione è continuamente gorgogliare con 95% O 2/5% di CO 2. 2: Dialisi buffer e buffer di perfusione sono continuamente dializzati contro l'altro in un tubo di dialisi da una pompa a rulli. 3: througho costante Per questo la dialisi, il buffer di perfusione è arricchito con 9% O 2/5% di CO 2 ed elettroliti livelli sono mantenutiut perfusione. 4: Una pompa rullo spinge il buffer di perfusione verso il rene. 5: Un windkessel rimuove onde peristaltiche e agisce come una trappola bolla. 6: trasduttore di pressione (collegato a 4. (pompa roller) per mantenere una pressione continua pur consentendo flusso liberamente alternata). 7: Durante la perfusione, il rene rimane in una camera umida per 100% di umidità e temperatura di 37 ° C renale. Clicca qui per vedere una versione più grande di questa figura.
3. Procedura chirurgica Part 1 (per un diagramma di tutte le legature, vedi Figura 3)
Nota: Eseguire tutte le legature utilizzando 5-0 filo chirurgico.
- Anestetizzare un topo mediante iniezione intraperitoneale (10 ml / g di peso corporeo, 20 mg / ml di ketamina e 1 mg / ml xilazina disciolto in 0,9% NaCl). Confermare la sufficiente profondità di AnesthESIA testando per l'assenza di riflessi retro-piede.
- Fissare il mouse in posizione supina nella camera umida. Proteggere gli occhi con vet unguento. Inserire una siringa da 1 ml di sotto della colonna vertebrale per elevare i vasi lombari.
- Eseguire una laparotomia mediana dalla cresta pubica per l'apertura dello sterno prima la pelle, poi i muscoli addominali, con le forbici.
- Rimuovere l'intestino e posizionarlo sul lato sinistro del laterali del mouse dall'addome.
- Liberare la vescica da tessuto connettivo e di esplorare entrambi gli ureteri e l'uretra.
- Mettere una legatura intorno dell'uretere sinistro (I legature). Chiudilo.
- Inserire una legatura intorno all'uretra (legature II). Chiudilo.
- Posizionare un "laccio" legatura in giro per tutta la vescica (legature III).
- Incidere la vescica 1 mm.
- Incannulare l'apertura cm 2 PE 50 tubi.
- Chiudi legatura III attorno al tubo.
- Tagliare l'uretere sinistro e dell'uretra distale dalle legature. il bladder è ora attaccato al dell'uretere solo a destra e liberi di muoversi.
- Cancellare l'aorta addominale del tessuto connettivo e il grasso.
- Inserire un addominale legatura metà dell'aorta (legature IV).
- Inserire una legatura intorno all'aorta sotto il diaframma tra l'arteria mesenterica superiore e il tronco celiaco (legature V).
- Mettere una legatura intorno all'arteria mesenterica superiore (legature VI).
- Inserire un legatura aortica direttamente sotto destra e sopra l'arteria renale sinistra (VII legatura).
- Mettere una legatura attorno al pacchetto caudale vena (cava) (VIII legature). Passare al punto 4.
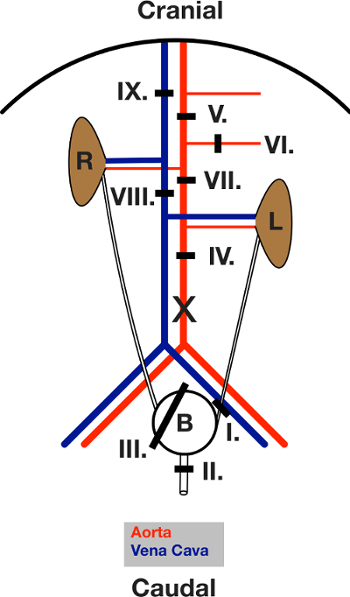
Figura 3: Schema del Legature poste durante l'intervento chirurgico. Vista dell'addome aperto dopo la laparotomia. L'intestino viene spostato verso sinistra. L e R indicano il rene sinistro e destro. Illinee nere mostrano l'area della rispettiva legatura. Legature prima immissione e poi chiusi, nella sequenza indicata nel testo. X indica la posizione di incisione per dell'aorta cannulazione. Clicca qui per vedere una versione più grande di questa figura.
4. Adescamento del circuito di perfusione
- Avviare la pompa rotativa e riempire il tubo con perfusato. Fare attenzione a svuotare tutte le bolle d'aria da esso.
- Riempire il dispositivo windkessel a circa la metà del livello con perfusato.
- Calibrare il trasduttore di pressione a 0 mm Hg quando tutti i tubi è riempita e il flusso è 0. Tenere l'ago perfusione a livello renale durante questo periodo.
- Mantenere il flusso ad un livello minimo costante (0,6 ml / min) e passare al punto 5.
5. Procedura chirurgica Parte 2
- Posizionare un morsetto tra la legatura IV e la ramificazione della rena sinistral arteria.
- Fai una piccola incisione nella caudale dell'aorta di legatura IV, avendo cura di non tagliare la parete dorsale.
- Dilata l'apertura in aorta con un dilatatore vascolare.
- Incannulare l'aorta con un ago (2 cm di lunghezza, tirato PE 50), spingendo la punta solo al morsetto.
- Aprire il morsetto.
- Inserire la punta di un ago cranialmente fino a raggiungere il bivio dell'arteria rene destro e l'aorta.
- Chiudere la legatura VII.
- Chiudere la legatura IV.
- Aprite la cassa con le forbici dalla dissezione del diaframma. Con un unico taglio, separare l'aorta, vena cava, cuore e nervi vegetativi. Con questo passo, l'animale viene sacrificato via rapida dissanguamento in anestesia profonda continua.
- Avviare il controllo della pressione della pompa di perfusione. Mantenere la pressione media tra 80 e 100 mmHg.
- Chiudi V. legatura
- Chiudere la legatura VI.
- Chiudere la legatura VIII.
- Libero il diritto rene da tissu connettivoe e la sua incorporazione nella capsula adiposa con le forbici.
- Tagliare l'aorta prossimale di legatura V.
- Tagliare l'arteria mesenterica superiore distale di legatura VI.
- Tagliare il fascio nave rene-out di supporto, avendo cura di non tagliare in vasi stessi.
- Tagliare il fegato al collegamento al rene. Fare attenzione per liberare il rene, ma lasciare una piccola parte del aderenti fegato ad esso, in modo che la vena cava viene mantenuto aperto da esso.
- Prendere il fascio di rene di topo. Rimuovere il mouse dalla camera umida.
- Posizionare un "laccio" legatura attorno al collegamento di fegato e rene (legature IX).
- Incannulare la vena cava con una linea venosa (2 centimetri PE 50).
- Chiudere la legatura IX. deflusso venoso attraverso la linea venosa dovrebbe iniziare immediatamente.
- Chiudere la camera umida.
6. Le analisi a valle
- Durante l'ora successiva, monitorare continuamente il flusso di sangue e intravasculpressione ar 15. Raccogliere deflusso venoso, che può essere utilizzato per l'analisi, ad esempio, renale rilascio di renina 7. Raccogliere le urine per l'analisi della concentrazione di elettroliti e velocità di filtrazione glomerulare 14. Dopo 1 ora di perfusione, i reni possono essere snap-congelati per blotting occidentale o essere fissati per l'imaging approcci 16.
Risultati
Con il metodo descritto, isolati reni mouse possono rimanere vitali per almeno 1 ora. Abbiamo testato la vitalità del tessuto dopo 1 ora di perfusione continua con funzionale (flusso ematico renale e la resistenza vascolare, analisi dei gas del sangue del deflusso venoso, velocità di filtrazione glomerulare, urinario frazionata Na + e K + escrezione, e nelle urine osmolalità) e morfologica (elettronico a trasmissione microscopia, TEM) metodi in quattro reni di ti...
Discussione
Il mouse isolato rene perfuso è uno strumento per lo studio della funzione renale in un ambiente controllato ex-vivo per 1 ora, colmando il divario tra esperimenti in vivo su animali intatti, che può essere viziata da l'impatto di numerosi fattori sistemici, e in esperimenti in vitro in nefrone isolati o cellule in coltura, che necessariamente trascurare l'impatto della struttura dell'organo intatta sulla funzione. C'è, alla conoscenza degli autori, non tecnica alte...
Divulgazioni
The authors have no competing financial interests and nothing else to disclose.
Riconoscimenti
The authors would like to thank Hans-Joachim Schurek for invaluable scientific advice. The authors would like to thank Monique Carrel and Michèle Heidemeyer for excellent technical assistance, David Penton Ribas and Nourdine Faresse for a critical reading of the manuscript and Carsten Wagner and Jürg Biber for the NaPi-2a antibody. This work was supported by the Swiss National Centre for Competence in Research "Kidney.CH" and by a project grant (310030_143929/1) from the Swiss National Science Foundation.
Materiali
| Name | Company | Catalog Number | Comments |
| Perfusion Circuit: | |||
| Moist chamber 834/8 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2901 | |
| Cannular with basket and side port | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2947 | |
| Thermostat TC120-ST5 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-4544 | |
| ISM 827/230V Roller Pump Reglo Analogue | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-0114 | |
| Reservoir jacketed for buffer solution 1 L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3438 | |
| Reservoir jacketed for buffer solution 0.5 L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3436 | |
| Pressure Transducer APT300 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3862 | |
| TAM-D Plugsys Transducer | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-1793 | |
| SCP Plugsys servo controller | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2806 | |
| Windkessel | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3717 | |
| HSE-USB data acquisition | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3330 | |
| Low-Flux Dialysator Diacap Polysulfone | B.Braun | 7203525 | |
| PE-Tubing for aorta cannulation 1.19 mm I.D. x 1.70 mm O.D. | Scientific Commodities Inc. | BB31695-PE/8 | |
| Name | Company | Catalog Number | Comments |
| Buffer reagents: | |||
| Aminoplasmal 10% | B.Braun | 134518064 | |
| Sodium pyruvate | Sigma-Aldrich | P2256-25G | |
| L-Glutamic acid monosodium salt hydrate | Sigma-Aldrich | G1626-100G | |
| L-(-)-Malic acid sodium salt | Sigma-Aldrich | M1125-25G | |
| Sodium-L-Lactate | Sigma-Aldrich | L7022-10G | |
| alpha-Ketoglutaric acid sodium salt | Sigma-Aldrich | K1875-25G | |
| NaCl | Sigma-Aldrich | 31434-1KG-R | |
| NaHCO3 | Sigma-Aldrich | S5761-5KG | |
| KCl | Sigma-Aldrich | 60130-1KG | |
| Urea | Sigma-Aldrich | U5378-500G | |
| Creatinine | Sigma-Aldrich | C4255-10G | |
| Ampicillin | Roche | 10835242001 | |
| MgCl2 * 6H2O | Sigma-Aldrich | M2393-500G | |
| D-Glucose | Sigma-Aldrich | G8270-1KG | |
| CaCl2 * 6H2O | Riedel-de-Haën | 12074 | |
| NaH2PO4 | Sigma-Aldrich | S9638-500G | |
| Na2HPO4 | Sigma-Aldrich | S0876-500G | |
| Antidiuretic Hormone dDAVP | Sigma-Aldrich | V2013-1MG | |
| FITC-Inulin | Sigma-Aldrich | ||
| Filter used for erythrocyte filtration | Macherey-Nagel | MN 615 | |
| BGA Analysis: | |||
| ABL 80 flex | Radiometer Medical ApS | ||
| Electron Microscope: | |||
| Philips CM100 TEM | FEI |
Riferimenti
- Carrel, A., Lindbergh, C. A. The culture of whole organs. Science (New York, N.Y.). 81 (2112), 621-623 (1935).
- Skutul, K. . Über Durchströmungsapparate Pflüger's Archiv. 123 (4-6), 249-273 (1908).
- Nizet, A. The isolated perfused kidney: possibilities, limitations and results. Kidney Int. 7 (1), 1-11 (1975).
- Weiss, C., Passow, H., Rothstein, A. Autoregulation of flow in isolated rat kidney in the absence of red cells. Am J Physiol. 196 (5), 1115-1118 (1959).
- Schurek, H. J., Kriz, W. Morphologic and functional evidence for oxygen deficiency in the isolated perfused rat kidney. Lab Invest. 53 (2), 145-155 (1985).
- Stolte, H., Schurek, H. J., Alt, J. M. Glomerular albumin filtration: a comparison of micropuncture studies in the isolated perfused rat kidney with in vivo experimental conditions. Kidney Int. 16 (3), 377-384 (1979).
- Schweda, F., Wagner, C., Krämer, B. K., Schnermann, J., Kurtz, A. Preserved macula densa-dependent renin secretion in A1 adenosine receptor knockout mice. AJP Renal Physiol. 284 (4), F770-F777 (2003).
- Moers, C., Smits, J. M., et al. Machine perfusion or cold storage in deceased-donor kidney transplantation. N Engl J Med. 360 (1), 7-19 (2009).
- Nicholson, M. L., Hosgood, S. A. Renal transplantation after ex vivo normothermic perfusion: the first clinical study. Am J Transplant. 13 (5), 1246-1252 (2013).
- Worner, M., Poore, S., Tilkorn, D., Lokmic, Z., Penington, A. J. A low-cost, small volume circuit for autologous blood normothermic perfusion of rabbit organs. Art Org. 38 (4), 352-361 (2014).
- Kaths, J. M., Spetzler, V. N., et al. Normothermic Ex Vivo Kidney Perfusion for the Preservation of Kidney Grafts prior to Transplantation. J Vis Exp. (101), e52909 (2015).
- Song, J. J., Guyette, J. P., Gilpin, S. E., Gonzalez, G., Vacanti, J. P., Ott, H. C. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Med. 19 (5), 646-651 (2013).
- Hall, A. M., Crawford, C., Unwin, R. J., Duchen, M. R., Peppiatt-Wildman, C. M. Multiphoton imaging of the functioning kidney. JASN. 22 (7), 1297-1304 (2011).
- Lindell, S. L., Williams, N., Brusilovsky, I., Mangino, M. J. Mouse IPK: A Powerful Tool to Partially Characterize Renal Reperfusion and Preservation Injury. Open Transplant J. 5, 15-22 (2011).
- Wagner, C., De Wit, C., Kurtz, L., Grünberger, C., Kurtz, A., Schweda, F. Connexin40 is essential for the pressure control of renin synthesis and secretion. Circ Res. 100 (4), 556-563 (2007).
- Czogalla, J., Vohra, T., Penton, D., Kirschmann, M., Craigie, E., Loffing, J. The mineralocorticoid receptor (MR) regulates ENaC but not NCC in mice with random MR deletion. Pflüger's Archiv. , (2016).
- Poosti, F., et al. Precision-cut kidney slices (PCKS) to study development of renal fibrosis and efficacy of drug targeting ex vivo. Dis Model Mech. 8 (10), 1227-1236 (2015).
- Rahgozar, M., Guan, Z., Matthias, A., Gobé, G. C., Endre, Z. H. Angiotensin II facilitates autoregulation in the perfused mouse kidney: An optimized in vitro model for assessment of renal vascular and tubular function. Nephrology. 9 (5), 288-296 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon