このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウス単離された灌流腎臓テクニック
要約
マウス単離された灌流腎臓(MIPK)が1時間灌流し、機能的なex vivoでの条件の下でのマウスの腎臓を維持するための技術です。緩衝液および外科技術を詳細に説明します。
要約
マウス単離された灌流腎臓(MIPK)が1時間灌流し、機能的なex vivoでの条件の下でのマウスの腎臓を維持するための技術です。これは、摘出された臓器の灌流腎生物工学のための脱細胞化または抗拒絶またはプライム腎臓に高用量におけるゲノム編集する薬剤の投与を含む、将来的には可能かもしれない多くの革新的なアプリケーションのための生理学を研究するための前提条件であります移植のため。灌流の時間の間、腎臓の腎機能を評価することができる、操作、および種々の医薬品を投与することができます。処置後、腎臓を移植することができ、または分子生物学、生化学分析、または顕微鏡検査のために処理しました。
本論文では、灌流液およびマウスの腎臓のex vivo灌流のために必要な外科的技術が記載されています。灌流装置の詳細が与えられ、データは、Vを示して提示されています形態学的読み出しとして異なるネフロンセグメントの機能、透過型電子顕微鏡写真、及び分子の読み出しなどの異なるネフロンセグメントの輸送タンパク質のウェスタンブロットのような腎臓の血流、血管抵抗、及び尿データ:腎臓の調製のiability。
概要
臓器の孤立した灌流は、何十年もの間1のための生理学者の間で継続的な努力の対象となっています。技術は、血圧、ホルモン、又は神経のような全身的影響を受けず、臓器の機能を可能にし、検討することができます。カール・エドゥアルドLoebellは、1849年2に、孤立した腎臓の正常灌流を記載した最初であると考えられています。それ以来、灌流装置は、かなりの洗練を受けました。フレイとグルーバーは、連続灌流2のために酸素や拍動ポンプの人工肺を導入しました。初期の研究者は、主に大型哺乳動物、すなわち、豚2と犬3ワイスらによるラット腎臓の使用の-the最初の報告、の腎臓を研究している間。小哺乳類臓器灌流4の研究において画期的な出来事でした。 Schurek ら。十分な尿細管場合は灌流液に、哺乳動物の赤血球を追加することの必要性を報告酸素は5を達成されることになっていました。長期的な実験のためのクリティカルは、同じ研究グループ6によるバッファの連続透析を導入しました。 2003年には、Schweda ら。後でRahgozar らによって洗練機能マウス単離された灌流腎臓(MIPK)7を 、初めて報告しました。 18とリンデルら。 14。
ラット単離された灌流腎臓よりも技術的にはより困難ながら、MIPKの使用は、遺伝的に改変したマウスの広い配列の使用を可能にするという利点を有します。本論文では、1時間単離したマウスの腎臓を灌流するための本手法の詳細を提示しています。この方法は、腎臓の流量、血管抵抗、ホルモン放出、血液ガス分析、尿分析、および薬物の適用の継続的な評価を可能にします。手順の後、腎臓は、分子および生化学的解析のために処理することができる顕微鏡用に固定され、またはレシピエントマウスに移植した ( 図1)。

図1:単離された灌流腎臓に対する可能な入力/出力の概要。 BGA:血液ガス分析。 この図の拡大版をご覧になるにはこちらをクリックしてください。
この技術は、おそらく多くの革新的なアプリケーションは、移植前に長期の正常体温腎臓灌流の夜明けで議論されているように10、9、8(抗拒絶またはゲノム編集薬の適用の有無にかかわらず)、今後数年間で関心が高まっ受け取ります、11、脱細胞化スカフォールド12から全体腎臓の生体工学、および多光子イメージング13のための蛍光色素の高用量の適用。また、急性腎障害14中に特定の遺伝子の役割を研究するための理想的なモデルです。
ステップバイステップのプロトコルは、他の研究室が正常に単離したマウス腎臓灌流を行うことができるように与えられています。まず、緩衝液の組成および調製は、指定されています。そして、手術は、詳細に記載されており、重要なステップが示されています。第三に、データが成功した準備を代表するものであり、その提示されている:腎臓の血流量、血管抵抗、糸球体濾過率、およびフラクショナル電解質排泄-すべて灌流腎臓の異なるネフロンセグメントの形態の生存能および透過型電子顕微鏡写真のような官能測定灌流の1時間後に固定。
プロトコル
この原稿に記載された動物に関わるすべての手順は、スイスの法律に基づいて行われ、チューリッヒ、スイスのカントンの動物への投与によって承認されました。
1.バッファの準備
- 4および抗利尿ホルモン(ADH)溶液( 表1) -ソリューション1を準備します。
- 透析緩衝液( 表1)を準備します。
注:これは、灌流中に透析緩衝液として使用されるバッファです。その後、赤血球は、最終的な灌流液を形成するために、この緩衝液で希釈されます。 - 赤血球製剤。
- 透析緩衝液で500ミリリットルにヒト赤血球濃厚液(ローカル血液バンクから得られた試験した材料)の250ミリリットルを希釈します。 8分間、2000×gで遠心分離します。任意の赤血球を除去しないように注意して、バッファを削除してください。 3回繰り返します。
- バッファ;アルブミン(BSAウシ血清アルブミン)を準備します。
- dialysiの200ミリリットルでバッファ、攪拌棒を用いてBSA 44gのを溶かします。ろ紙を用いて溶液をフィルタリングします。
- 灌流液を準備します。
- BSA緩衝液に濾紙ステップ1.3.1から赤血球をフィルタリングします。透析緩衝液で800ミリリットルの全容量まで記入してください。
注:これは、最終的な灌流液です。ヘマトクリットは現在8と12%の間であるべきです。灌流液は4℃で最大12時間保存することができます。
- BSA緩衝液に濾紙ステップ1.3.1から赤血球をフィルタリングします。透析緩衝液で800ミリリットルの全容量まで記入してください。
2.開始透析と酸素化
- より大きなバッファ容器、小さいバッファ容器、及び湿室を37℃に(小、二重壁チャンバは後で腎臓を保持するために37℃、湿度100%にした)周囲の水浴をオンにします( 図2) 。
- 透析緩衝液と灌流液と小さい容器と、より大きなバッファ容器を埋めます。
- 透析緩衝液に5%CO 2/95%O 2ガス流入をオンにします。
- 透析緩衝液に対して灌流液の連続透析に切り替えます。低フラックス透析チューブを使用するように注意してください。ステップ3に進みます。

図2:灌流回路の模式図。スキームは、灌流回路の主要な構成要素とバッファフローの方向を示しています。濃い青で囲まれたすべてのコンポーネントは、水浴/サーモスタットで37℃に維持されています。 1:灌流バッファーの少なくとも3倍容量の透析バッファーを連続的に95%O 2/5%CO 2でバブリングします。 2:透析緩衝液および灌流緩衝液を連続的にローラーポンプにより透析チューブに互いに対して透析します。 3:これにより透析に、灌流バッファはO 2/5%CO 2および電解質のレベルを一定にthroughoを維持している9%に濃縮されていますutの灌流。 4:ローラーポンプは、腎臓に向かって灌流バッファを推進します。 5:ウインドケッセルは蠕動波を除去し、気泡トラップとして機能します。 6:(自由に交互の流れを可能にしながら、連続的な圧力を維持するために4(ローラーポンプ)に接続された)圧力トランスデューサ。 7:灌流を通して、腎臓は100%の空気湿度および37℃の腎臓温度のために湿ったチャンバ内に残っています。 この図の拡大版をご覧になるにはこちらをクリックしてください。
3.外科的手順パート1(すべての合字の図については、図3を参照してください)
注:5-0手術用糸を使用して、すべての合字を実行します。
- 腹腔内注射によってマウス(0.9%のNaClに溶解した体重の20mg / mlのケタミンおよび1mg / mlのキシラジンの10μL/ g)を麻酔。 anesthの十分な深さを確認リア足の反射の欠如のためにテストすることによりESIA。
- 湿室中仰臥位でマウスを修正しました。獣医軟膏で目を保護します。腰椎血管を上昇させるために背骨の下に1ミリリットル注射器を置きます。
- はさみで、その後、腹部の筋肉、胸骨開口最初の皮膚に恥骨稜から正中開腹術を行います。
- 腸を削除し、腹部からのマウスの横方向の左側に配置します。
- 結合組織から膀胱を解放し、尿管及び尿道の両方を探ります。
- 左尿管(リガチャーI)の周りの合字を置きます。それを閉じます。
- 尿道(リガチャーII)の周りの合字を置きます。それを閉じます。
- 全膀胱(リガチャーIII)の周りに「投げ縄」リガチャーを置きます。
- 膀胱に1ミリメートルを切開。
- 2cmのPE 50チューブを開口部にカニューレを挿入。
- チューブの周りに閉じるリガチャーIII。
- 合字から左尿管及び尿道の先端をカットします。宣伝ちらしデルは、今だけ、自由に移動し、右尿管に取り付けられています。
- 結合組織および脂肪の腹部大動脈をクリアします。
- 腹半ば大動脈結紮(リガチャーIV)を配置します。
- 上腸間膜動脈および腹腔動脈(リガチャーV)との間に横隔膜下の大動脈の周りに結紮糸を配置します。
- 上腸間膜動脈(リガチャーVI)の周りの合字を置きます。
- 直接右下のと左腎動脈(リガチャーVII)上記の大動脈結紮糸を配置します。
- 尾静脈パッケージ(カヴァ)(リガチャーVIII)の周りの合字を置きます。ステップ4に進みます。
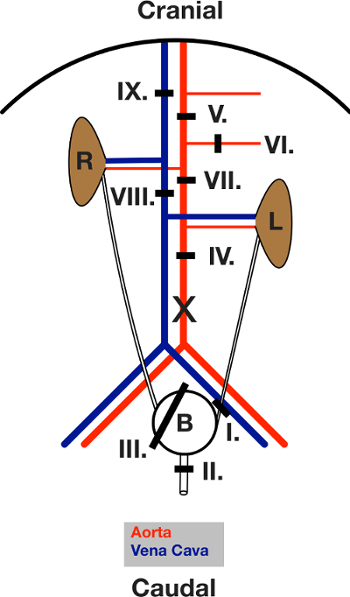
図3:手術中に配置された合字の模式図。開腹手術後の開いた腹部のビュー。腸を左に出て移動されます。 L及びRは 、左右の腎臓を示します。ザ黒い線は、それぞれの合字の区域を示します。合字は、最初に配置し、テキストに与えられた順序で、閉じています。 Xは、大動脈カニューレ挿入のための切開の位置をマークします。 この図の拡大版をご覧になるにはこちらをクリックしてください。
灌流回路の4プライミング
- ロータリーポンプを起動し、灌流液でチューブを埋めます。それから、すべての気泡を空にするように注意してください。
- 灌流液とのほぼ中間のレベルにウインドケッセルデバイスを記入してください。
- すべてのチューブは充填され、フローがこの時間の間に腎臓レベルで灌流針を保管してください0であるときに0ミリメートルHgまで圧力変換器を校正。
- 一定の最低レベル(0.6ミリリットル/分)で流れを維持し、ステップ5に進んでください。
5.外科的手順パート2
- リガチャーIVおよび左レナの分岐の間にクランプを置きリットル動脈。
- 背壁を切らないように注意しながら、リガチャーIVの大動脈尾側に小さな切開を行います。
- 血管拡張器と大動脈の開口部を拡張。
- 針で大動脈にカニューレを挿入(長さ2cm、PE 50を引っ張って)、ちょうどクランプに先端をプッシュ。
- クランプを開きます。
- それは右腎動脈と大動脈の接合部に到達するまで頭側針の先端を押してください。
- 閉じる結紮VII。
- 合字IVを閉じます。
- ダイアフラムを解剖することによりハサミで胸を開きます。シングルカットでは、大動脈、大静脈、心臓や栄養神経を分離します。このステップでは、動物は、連続深麻酔下での急速な失血を経て犠牲になります。
- 灌流ポンプの圧力制御を開始します。 80と100 mmHgの間の平均圧力を維持します。
- 閉じるリガチャーV.
- 閉じるリガチャーVI。
- 閉じるリガチャーVIII。
- 結合TISSUから無料右の腎臓eとはさみで脂肪カプセル内への埋め込み。
- リガチャーVに近位大動脈をカット
- VIを結紮糸遠位に上腸間膜動脈をカット。
- 容器に身を切らないように注意しながら、腎臓支持維管束を切り出します。
- 腎臓への接続時に肝臓をカットします。腎臓を解放するように注意してください、しかし、大静脈は、それによって開いたままにされるように、それに肝付着の小さな部分を残します。
- マウスのうち、腎臓バンドルしてください。湿ったチャンバーからマウスを外します。
- 肝臓と腎臓(リガチャーIX)の接続の周りに「投げ縄」リガチャーを置きます。
- 静脈ライン(2cmのPE 50)との大静脈にカニューレを挿入。
- 閉じるリガチャーのIX。静脈ラインを通る静脈流出はすぐに開始する必要があります。
- モイストチャンバーを閉じます。
6.ダウンストリーム分析
- 以下の時間の間、継続的に血流とintravasculを監視Ar圧力15。分析のために使用することができる静脈流出、例えば、腎臓のレニン放出7を集めます。電解質濃度と糸球体濾過率14の分析のための尿を収集します。灌流の1時間後、腎臓をウェスタンブロッティングのためにスナップ凍結させることができるか、イメージングのために固定することが16に近づきます。
結果
方法について説明すると、単離したマウスの腎臓は、少なくとも1時間生存したまますることができます。我々は、機能(腎血流及び血管抵抗、静脈流出の血液ガス分析、糸球体濾過率、尿中分別のNa +及びK +排泄、および尿浸透圧)で連続灌流の1時間後の組織の生存率をテストし、形態学(透過電子野生型C57BL / 6マウスの4腎臓における顕微鏡、TEM)?...
ディスカッション
灌流腎臓単離されたマウスは、多数の全身要因の影響により欠陥があることがあり、無傷の動物におけるin vivo実験、の間のギャップを埋める、1時間にわたって制御された環境のex vivoで腎機能を研究するためのツールであり、in vitroの実験で必ずしも機能上の無傷の臓器構造の影響を無視孤立ネフロンセグメントまたは培養細胞、。この特定のタスクを実行すると?...
開示事項
The authors have no competing financial interests and nothing else to disclose.
謝辞
The authors would like to thank Hans-Joachim Schurek for invaluable scientific advice. The authors would like to thank Monique Carrel and Michèle Heidemeyer for excellent technical assistance, David Penton Ribas and Nourdine Faresse for a critical reading of the manuscript and Carsten Wagner and Jürg Biber for the NaPi-2a antibody. This work was supported by the Swiss National Centre for Competence in Research "Kidney.CH" and by a project grant (310030_143929/1) from the Swiss National Science Foundation.
資料
| Name | Company | Catalog Number | Comments |
| Perfusion Circuit: | |||
| Moist chamber 834/8 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2901 | |
| Cannular with basket and side port | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2947 | |
| Thermostat TC120-ST5 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-4544 | |
| ISM 827/230V Roller Pump Reglo Analogue | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-0114 | |
| Reservoir jacketed for buffer solution 1 L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3438 | |
| Reservoir jacketed for buffer solution 0.5 L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3436 | |
| Pressure Transducer APT300 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3862 | |
| TAM-D Plugsys Transducer | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-1793 | |
| SCP Plugsys servo controller | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2806 | |
| Windkessel | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3717 | |
| HSE-USB data acquisition | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3330 | |
| Low-Flux Dialysator Diacap Polysulfone | B.Braun | 7203525 | |
| PE-Tubing for aorta cannulation 1.19 mm I.D. x 1.70 mm O.D. | Scientific Commodities Inc. | BB31695-PE/8 | |
| Name | Company | Catalog Number | Comments |
| Buffer reagents: | |||
| Aminoplasmal 10% | B.Braun | 134518064 | |
| Sodium pyruvate | Sigma-Aldrich | P2256-25G | |
| L-Glutamic acid monosodium salt hydrate | Sigma-Aldrich | G1626-100G | |
| L-(-)-Malic acid sodium salt | Sigma-Aldrich | M1125-25G | |
| Sodium-L-Lactate | Sigma-Aldrich | L7022-10G | |
| alpha-Ketoglutaric acid sodium salt | Sigma-Aldrich | K1875-25G | |
| NaCl | Sigma-Aldrich | 31434-1KG-R | |
| NaHCO3 | Sigma-Aldrich | S5761-5KG | |
| KCl | Sigma-Aldrich | 60130-1KG | |
| Urea | Sigma-Aldrich | U5378-500G | |
| Creatinine | Sigma-Aldrich | C4255-10G | |
| Ampicillin | Roche | 10835242001 | |
| MgCl2 * 6H2O | Sigma-Aldrich | M2393-500G | |
| D-Glucose | Sigma-Aldrich | G8270-1KG | |
| CaCl2 * 6H2O | Riedel-de-Haën | 12074 | |
| NaH2PO4 | Sigma-Aldrich | S9638-500G | |
| Na2HPO4 | Sigma-Aldrich | S0876-500G | |
| Antidiuretic Hormone dDAVP | Sigma-Aldrich | V2013-1MG | |
| FITC-Inulin | Sigma-Aldrich | ||
| Filter used for erythrocyte filtration | Macherey-Nagel | MN 615 | |
| BGA Analysis: | |||
| ABL 80 flex | Radiometer Medical ApS | ||
| Electron Microscope: | |||
| Philips CM100 TEM | FEI |
参考文献
- Carrel, A., Lindbergh, C. A. The culture of whole organs. Science (New York, N.Y.). 81 (2112), 621-623 (1935).
- Skutul, K. . Über Durchströmungsapparate Pflüger's Archiv. 123 (4-6), 249-273 (1908).
- Nizet, A. The isolated perfused kidney: possibilities, limitations and results. Kidney Int. 7 (1), 1-11 (1975).
- Weiss, C., Passow, H., Rothstein, A. Autoregulation of flow in isolated rat kidney in the absence of red cells. Am J Physiol. 196 (5), 1115-1118 (1959).
- Schurek, H. J., Kriz, W. Morphologic and functional evidence for oxygen deficiency in the isolated perfused rat kidney. Lab Invest. 53 (2), 145-155 (1985).
- Stolte, H., Schurek, H. J., Alt, J. M. Glomerular albumin filtration: a comparison of micropuncture studies in the isolated perfused rat kidney with in vivo experimental conditions. Kidney Int. 16 (3), 377-384 (1979).
- Schweda, F., Wagner, C., Krämer, B. K., Schnermann, J., Kurtz, A. Preserved macula densa-dependent renin secretion in A1 adenosine receptor knockout mice. AJP Renal Physiol. 284 (4), F770-F777 (2003).
- Moers, C., Smits, J. M., et al. Machine perfusion or cold storage in deceased-donor kidney transplantation. N Engl J Med. 360 (1), 7-19 (2009).
- Nicholson, M. L., Hosgood, S. A. Renal transplantation after ex vivo normothermic perfusion: the first clinical study. Am J Transplant. 13 (5), 1246-1252 (2013).
- Worner, M., Poore, S., Tilkorn, D., Lokmic, Z., Penington, A. J. A low-cost, small volume circuit for autologous blood normothermic perfusion of rabbit organs. Art Org. 38 (4), 352-361 (2014).
- Kaths, J. M., Spetzler, V. N., et al. Normothermic Ex Vivo Kidney Perfusion for the Preservation of Kidney Grafts prior to Transplantation. J Vis Exp. (101), e52909 (2015).
- Song, J. J., Guyette, J. P., Gilpin, S. E., Gonzalez, G., Vacanti, J. P., Ott, H. C. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Med. 19 (5), 646-651 (2013).
- Hall, A. M., Crawford, C., Unwin, R. J., Duchen, M. R., Peppiatt-Wildman, C. M. Multiphoton imaging of the functioning kidney. JASN. 22 (7), 1297-1304 (2011).
- Lindell, S. L., Williams, N., Brusilovsky, I., Mangino, M. J. Mouse IPK: A Powerful Tool to Partially Characterize Renal Reperfusion and Preservation Injury. Open Transplant J. 5, 15-22 (2011).
- Wagner, C., De Wit, C., Kurtz, L., Grünberger, C., Kurtz, A., Schweda, F. Connexin40 is essential for the pressure control of renin synthesis and secretion. Circ Res. 100 (4), 556-563 (2007).
- Czogalla, J., Vohra, T., Penton, D., Kirschmann, M., Craigie, E., Loffing, J. The mineralocorticoid receptor (MR) regulates ENaC but not NCC in mice with random MR deletion. Pflüger's Archiv. , (2016).
- Poosti, F., et al. Precision-cut kidney slices (PCKS) to study development of renal fibrosis and efficacy of drug targeting ex vivo. Dis Model Mech. 8 (10), 1227-1236 (2015).
- Rahgozar, M., Guan, Z., Matthias, A., Gobé, G. C., Endre, Z. H. Angiotensin II facilitates autoregulation in the perfused mouse kidney: An optimized in vitro model for assessment of renal vascular and tubular function. Nephrology. 9 (5), 288-296 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved