需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
鼠标离体肾技术
摘要
鼠标离体灌注肾(MIPK)是用于灌注和1小时官能体外条件下保持一个小鼠肾脏的技术。的缓冲液和外科技术进行详细说明。
摘要
鼠标离体灌注肾(MIPK)是用于灌注和1小时官能体外条件下保持一个小鼠肾脏的技术。这是研究分离的器官,并为许多创新的应用程序,可能会在未来成为可能,包括灌注脱细胞肾生物工程或抗排斥或基因组编辑药物在高剂量黄金肾脏的管理生理学的一个先决条件用于移植。在灌注时,肾脏可以被操纵,肾功能可以评估,和给药的各种药物。手术后,肾脏可以移植或用于分子生物学,生物化学分析,或显微处理。
本文介绍了灌流,需要鼠标肾脏的体外灌注的手术技术。灌注装置的细节给出并且呈现表示V数据肾脏的制剂iability:肾血流量,血管阻力,和尿的数据作为不同肾段作为形态学读数,和不同肾段作为分子读出的转运蛋白的蛋白质印迹的官能,透射电子显微镜照片。
引言
器官的隔离灌注一直生理学家中不断努力的主题几十年1。该技术使器官的功能,而没有全身的影响,如血压,激素,或神经,进行研究。卡尔·爱德华Loebell被认为是第一个所描述的一个孤立肾灌注成功,于1849年2。此后,灌注设备发生了显著细化。弗雷和格鲁伯引入了氧合搏动泵人工肺的连续灌流2。虽然早期的研究人员重点研究大型哺乳动物-即,猪2和狗3使用大鼠肾脏的-the第一份报告,魏斯等人的肾脏。 ,是小型哺乳动物器官灌注4研究的一个里程碑。 Schurek 等。报道添加哺乳动物红细胞到灌流如果有足够的肾小管的必要性氧合要达到5。临界长期实验是由相同的研究组6引进缓冲器的连续透析。在2003年,Schweda 等。是第一个报告功能的鼠标离体灌注肾(MIPK)7,后来被Rahgozar 等精制而成。 18和林德尔等。 14。
虽然在技术上不是孤立肾灌注大鼠更具挑战性,使用MIPK负有能够使用各种各样基因改造的小鼠中的优势。本文介绍了作者的方法的详细信息隔离灌注小鼠肾1小时。该方法允许对肾流量,血管阻力,激素释放,血气分析,尿液分析,以及药物的应用程序的连续评估。以下的方法,肾脏可以用于分子和生化分析进行处理,是固定的显微镜,或移植到受体小鼠( 图1)。

图1:可能的输入/输出到离体肾的概述。 BGA:血气分析。 请点击此处查看该图的放大版本。
这种技术可能会得到更多的关注,未来数年,多创新应用正在与长期常温肾脏血流灌注的曙光移植前的讨论(含或不含抗排斥或基因组编辑药物的应用)8,9,10 11,从脱细胞支架12整个肾脏的生物工程,剂量和高剂量荧光染料对多光子成像13应用。这也是与研究急性肾损伤14中特定基因的作用的理想模型。
一个一步一步的协议,是考虑到让其他实验室成功地执行孤立的小鼠肾脏灌注。首先,组合物和制剂的缓冲液中被指定。然后,手术中详细描述和示出的关键步骤。第三,数据呈现的是,用于展示成功制备的:肾血流量,血管阻力,肾小球滤过率和分数电解质排泄-所有灌注肾脏的不同肾段的形态的生存能力和透射电子显微照片的功能性测量灌注后的1小时固定。
研究方案
所有涉及这个手稿中描述动物的程序进行了根据瑞士法律和瑞士苏黎世州的兽医行政管理部门批准。
1.缓冲液配制
- 制备溶液1 - 4和抗利尿激素(ADH)溶液( 表1)。
- 制备透析缓冲液( 表1)。
注意:这是用作灌注在透析缓冲的缓冲器。以后,红细胞将在这个缓冲液稀释以形成最终灌洗液。 - 红细胞制剂。
- 稀释250毫升人红细胞浓缩至500毫升透析缓冲液(从当地血库获得测试材料)。离心在2000 xg离心8分钟。删除缓冲区,注意不要删除任何红细胞。重复3倍。
- 制备白蛋白(牛血清白蛋白; BSA)的缓冲液中。
- 在200毫升dialysi的的缓冲器中,用搅拌棒溶解44克BSA的。过滤用滤纸将溶液。
- 准备灌注液。
- 从步骤1.3.1通过滤纸进入BSA缓冲过滤红细胞。填充到800毫升的透析缓冲液的总体积。
注意:这是最后的灌注液。血细胞比容现在应该在8和12%之间。灌注液可以储存于4℃多达12小时下进行。
- 从步骤1.3.1通过滤纸进入BSA缓冲过滤红细胞。填充到800毫升的透析缓冲液的总体积。
2.起爆透析和氧合
- 打开周围较大缓冲储水,较小的缓冲液贮存和湿室(一个小的,双壁腔带到37℃和100%湿度稍后握住肾)至37℃的水浴( 图2) 。
- 填充透析缓冲液的较大的缓冲区贮存器和与灌注液较小贮存器。
- 2/95%O 2的气体流入转动5%CO到透析缓冲液。
- 打开对透析缓冲灌注液的连续透析。小心使用低通量透析管。继续执行步骤3。

图2:灌注回路的示意图。方案示出了灌注回路的主要组成部分和缓冲液流的方向。由深蓝色包围所有部件都保持在37℃的水浴/恒温器。 1:灌注缓冲液中的至少3倍体积的透析缓冲液连续地用95%O 2/5%CO 2鼓泡。 2:透析缓冲液和灌注缓冲液被连续地对在透析管彼此通过一个滚子泵透析。 3:由于这种透析,在灌注缓冲液用9%氧气富集2/5%CO 2和电解质水平保持恒定throughoUT灌注。 4:滚子泵推动朝肾脏灌注缓冲区。 5:删除的Windkessel蠕动波,并作为一个泡沫陷阱。 6:压力传感器(连接到4(滚子泵),以保持连续的压力,同时允许自由交替流)。 7:在整个灌注,肾保持在100%的空气湿度和37℃肾温度的潮湿室中。 请点击此处查看该图的放大版本。
3.手术过程第1部分(适用于所有结扎的示意图,见图3)
注意:请用5-0外科缝线结扎所有。
- 麻醉通过腹膜内注射的小鼠(体重20毫克/毫升氯胺酮和1毫克/毫升甲苯噻嗪溶解在0.9%NaCl中的10微升/克)。确认anesth足够的深度ESIA通过测试后无足反射的。
- 固定鼠标在湿室仰卧位置。保护眼睛与兽医药膏。放置脊柱低于1ml注射器来升高腰椎血管。
- 从耻骨嵴到胸骨开幕先将患处,然后腹肌,用剪刀执行中位数剖腹探查术。
- 除去肠并将其放置在从腹部鼠标侧的左侧。
- 无结缔组织,膀胱,探索两侧输尿管和尿道。
- 周围放置左侧输尿管(结扎I)的结扎。关闭它。
- 将尿道周围(结扎II)连字。关闭它。
- 将围绕整个膀胱(结扎III)一个"套索"连字。
- 切开膀胱1毫米。
- 导管插入与2厘米PE管材50开。
- 关闭结扎III管道周围。
- 剪切从结扎左侧输尿管和尿道远端。该BLAD德现在连接到右输尿管仅自由移动。
- 清除结缔组织和脂肪的腹主动脉。
- 将腹部中期主动脉结扎(结扎IV)。
- 周围放置肠系膜上动脉和腹腔干(结扎Ⅴ)之间的隔膜下方的主动脉结扎。
- 周围放置肠系膜动脉(结扎VI)的结扎。
- 放置一个主动脉结扎正下方的右侧和左侧肾动脉(结扎Ⅶ)以上。
- 周围放置尾静脉包(静脉)(结扎Ⅷ)结扎。继续执行步骤4。
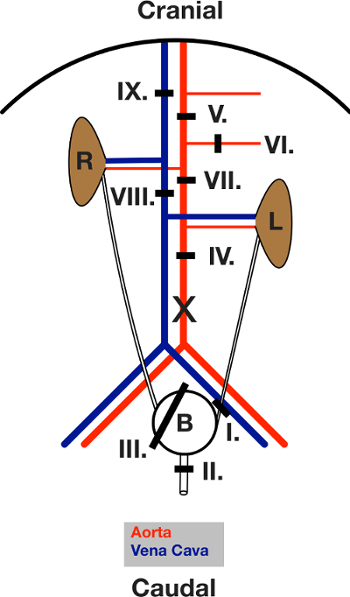
图3:手术时放置在连字的示意图。查看剖腹手术后开腹部。肠道移出到左侧。 L和R指示的左右肾。该黑线显示各个结扎的面积。连字放在前面,然后关闭,在文中给出的顺序排列。 X标记为主动脉插管切口的位置。 请点击此处查看该图的放大版本。
4.灌注回路的引发
- 启动回转泵和填充灌注液管路。小心从它清空所有气泡。
- 该设备的Windkessel填写大约级中旬灌流。
- 校准压力传感器为0毫米汞柱时所有管路被填充和流量为0保持在肾脏水平灌注针在这段时间。
- 保持流动在一个恒定的最低水平(0.6ml /分钟),并继续执行步骤5。
5.手术过程第2部分
- 放置结扎IV和左RENA的分支之间的夹紧升动脉。
- 使结扎IV的主动脉尾一小切口,注意不要切背墙。
- 用扩张血管扩张主动脉开幕。
- 导管插入用针主动脉(2厘米长,拉PE 50),推尖端正好夹。
- 打开夹子。
- 推针颅的前端,直到它到达右肾动脉和主动脉的连接处。
- 关闭结扎七。
- 关闭结扎IV。
- 通过解剖隔膜打开用剪刀胸部。通过单一切口,分离主动脉,腔静脉,心脏和植物神经。与此步骤中,该动物是通过在连续深度麻醉迅速放血处死。
- 启动灌注泵的压力控制。保持80至100毫米汞柱之间的平均压力。
- 关闭结扎V.
- 关闭结扎VI。
- 关闭结扎八。
- 从结缔组织Tissu酒店免费右肾e和它嵌入到用剪刀脂肪囊。
- 切主动脉近端至结扎线V.
- 切肠系膜上动脉远端,以结扎线VI。
- 切肾血管配套捆绑了,小心不要切入血管自己。
- 割肝在连接到肾脏。照顾到释放肾,但将肝粘附的一小部分到它,因此,腔静脉通过它保持打开。
- 取肾捆绑了鼠标。从湿室中取出鼠标。
- 周围放置肝脏和肾脏(结扎IX)的连接的"套索"连字。
- 导管插入与静脉线路(2毫升的PE 50)的下腔静脉。
- 关闭结扎九。通过静脉行静脉流出应立即启动。
- 关闭湿室。
6.下游分析
- 在以下小时,连续监测血流量和intravasculAR压力15。收集静脉流出,它可以被用于分析,例如,肾肾素释放7。收集尿液的电解质浓度及肾小球滤过率14分析。灌注1小时后,肾脏可以管理单元冷冻western印迹或固定成像方法16。
结果
与所描述的方法,分离小鼠肾可为至少1小时保持存活。我们后官能(肾血流量和血管阻力,静脉流出,肾小球滤过率,尿分数Na +和K +排泄血气分析和尿液摩尔渗透压浓度)和形态(透射电子连续灌注的1小时测试的组织活力显微镜,TEM)的方法,在野生型C57BL / 6小鼠四个肾脏。此外,进行了不同的小管的根尖标记蛋白的蛋白质印迹,隔离灌注肾脏比较同一...
讨论
离体灌注肾脏鼠标是用于在受控环境中的体外研究肾功能1小时,架桥在完整的动物体内实验,这可以通过许多全身性因素的影响,是有缺陷的之间的间隙的一个工具,并在体外实验中分离的肾段或培养细胞,这必然忽视完整器官结构对功能的影响。还有就是,以作者的知识,没有替代技术,用以执行这一特定的任务。对肾组织的生化研究,然而,可以在使用肾脏切片17
披露声明
The authors have no competing financial interests and nothing else to disclose.
致谢
The authors would like to thank Hans-Joachim Schurek for invaluable scientific advice. The authors would like to thank Monique Carrel and Michèle Heidemeyer for excellent technical assistance, David Penton Ribas and Nourdine Faresse for a critical reading of the manuscript and Carsten Wagner and Jürg Biber for the NaPi-2a antibody. This work was supported by the Swiss National Centre for Competence in Research "Kidney.CH" and by a project grant (310030_143929/1) from the Swiss National Science Foundation.
材料
| Name | Company | Catalog Number | Comments |
| Perfusion Circuit: | |||
| Moist chamber 834/8 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2901 | |
| Cannular with basket and side port | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2947 | |
| Thermostat TC120-ST5 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-4544 | |
| ISM 827/230V Roller Pump Reglo Analogue | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-0114 | |
| Reservoir jacketed for buffer solution 1 L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3438 | |
| Reservoir jacketed for buffer solution 0.5 L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3436 | |
| Pressure Transducer APT300 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3862 | |
| TAM-D Plugsys Transducer | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-1793 | |
| SCP Plugsys servo controller | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2806 | |
| Windkessel | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3717 | |
| HSE-USB data acquisition | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3330 | |
| Low-Flux Dialysator Diacap Polysulfone | B.Braun | 7203525 | |
| PE-Tubing for aorta cannulation 1.19 mm I.D. x 1.70 mm O.D. | Scientific Commodities Inc. | BB31695-PE/8 | |
| Name | Company | Catalog Number | Comments |
| Buffer reagents: | |||
| Aminoplasmal 10% | B.Braun | 134518064 | |
| Sodium pyruvate | Sigma-Aldrich | P2256-25G | |
| L-Glutamic acid monosodium salt hydrate | Sigma-Aldrich | G1626-100G | |
| L-(-)-Malic acid sodium salt | Sigma-Aldrich | M1125-25G | |
| Sodium-L-Lactate | Sigma-Aldrich | L7022-10G | |
| alpha-Ketoglutaric acid sodium salt | Sigma-Aldrich | K1875-25G | |
| NaCl | Sigma-Aldrich | 31434-1KG-R | |
| NaHCO3 | Sigma-Aldrich | S5761-5KG | |
| KCl | Sigma-Aldrich | 60130-1KG | |
| Urea | Sigma-Aldrich | U5378-500G | |
| Creatinine | Sigma-Aldrich | C4255-10G | |
| Ampicillin | Roche | 10835242001 | |
| MgCl2 * 6H2O | Sigma-Aldrich | M2393-500G | |
| D-Glucose | Sigma-Aldrich | G8270-1KG | |
| CaCl2 * 6H2O | Riedel-de-Haën | 12074 | |
| NaH2PO4 | Sigma-Aldrich | S9638-500G | |
| Na2HPO4 | Sigma-Aldrich | S0876-500G | |
| Antidiuretic Hormone dDAVP | Sigma-Aldrich | V2013-1MG | |
| FITC-Inulin | Sigma-Aldrich | ||
| Filter used for erythrocyte filtration | Macherey-Nagel | MN 615 | |
| BGA Analysis: | |||
| ABL 80 flex | Radiometer Medical ApS | ||
| Electron Microscope: | |||
| Philips CM100 TEM | FEI |
参考文献
- Carrel, A., Lindbergh, C. A. The culture of whole organs. Science (New York, N.Y.). 81 (2112), 621-623 (1935).
- Skutul, K. . Über Durchströmungsapparate Pflüger's Archiv. 123 (4-6), 249-273 (1908).
- Nizet, A. The isolated perfused kidney: possibilities, limitations and results. Kidney Int. 7 (1), 1-11 (1975).
- Weiss, C., Passow, H., Rothstein, A. Autoregulation of flow in isolated rat kidney in the absence of red cells. Am J Physiol. 196 (5), 1115-1118 (1959).
- Schurek, H. J., Kriz, W. Morphologic and functional evidence for oxygen deficiency in the isolated perfused rat kidney. Lab Invest. 53 (2), 145-155 (1985).
- Stolte, H., Schurek, H. J., Alt, J. M. Glomerular albumin filtration: a comparison of micropuncture studies in the isolated perfused rat kidney with in vivo experimental conditions. Kidney Int. 16 (3), 377-384 (1979).
- Schweda, F., Wagner, C., Krämer, B. K., Schnermann, J., Kurtz, A. Preserved macula densa-dependent renin secretion in A1 adenosine receptor knockout mice. AJP Renal Physiol. 284 (4), F770-F777 (2003).
- Moers, C., Smits, J. M., et al. Machine perfusion or cold storage in deceased-donor kidney transplantation. N Engl J Med. 360 (1), 7-19 (2009).
- Nicholson, M. L., Hosgood, S. A. Renal transplantation after ex vivo normothermic perfusion: the first clinical study. Am J Transplant. 13 (5), 1246-1252 (2013).
- Worner, M., Poore, S., Tilkorn, D., Lokmic, Z., Penington, A. J. A low-cost, small volume circuit for autologous blood normothermic perfusion of rabbit organs. Art Org. 38 (4), 352-361 (2014).
- Kaths, J. M., Spetzler, V. N., et al. Normothermic Ex Vivo Kidney Perfusion for the Preservation of Kidney Grafts prior to Transplantation. J Vis Exp. (101), e52909 (2015).
- Song, J. J., Guyette, J. P., Gilpin, S. E., Gonzalez, G., Vacanti, J. P., Ott, H. C. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Med. 19 (5), 646-651 (2013).
- Hall, A. M., Crawford, C., Unwin, R. J., Duchen, M. R., Peppiatt-Wildman, C. M. Multiphoton imaging of the functioning kidney. JASN. 22 (7), 1297-1304 (2011).
- Lindell, S. L., Williams, N., Brusilovsky, I., Mangino, M. J. Mouse IPK: A Powerful Tool to Partially Characterize Renal Reperfusion and Preservation Injury. Open Transplant J. 5, 15-22 (2011).
- Wagner, C., De Wit, C., Kurtz, L., Grünberger, C., Kurtz, A., Schweda, F. Connexin40 is essential for the pressure control of renin synthesis and secretion. Circ Res. 100 (4), 556-563 (2007).
- Czogalla, J., Vohra, T., Penton, D., Kirschmann, M., Craigie, E., Loffing, J. The mineralocorticoid receptor (MR) regulates ENaC but not NCC in mice with random MR deletion. Pflüger's Archiv. , (2016).
- Poosti, F., et al. Precision-cut kidney slices (PCKS) to study development of renal fibrosis and efficacy of drug targeting ex vivo. Dis Model Mech. 8 (10), 1227-1236 (2015).
- Rahgozar, M., Guan, Z., Matthias, A., Gobé, G. C., Endre, Z. H. Angiotensin II facilitates autoregulation in the perfused mouse kidney: An optimized in vitro model for assessment of renal vascular and tubular function. Nephrology. 9 (5), 288-296 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。