Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Мышь Изолированные перфузировались почки Техника
В этой статье
Резюме
Мышь , изолированных перфузию почек (МИПК) представляет собой метод для поддержания почки мыши в условиях бывших естественных условиях перфузии и функциональных в течение 1 часа. Буферы и хирургическая техника подробно описаны.
Аннотация
Мышь , изолированных перфузию почек (МИПК) представляет собой метод для поддержания почки мыши в условиях бывших естественных условиях перфузии и функциональных в течение 1 часа. Это является предпосылкой для изучения физиологии изолированного органа, а также для многих инновационных приложений, которые могут быть возможно в будущем, в том числе перфузионной decellularization для почек биоинженерии или введения анти-отторжения или генома редактирования препаратов в высоких дозах премьер почки для трансплантации. Во время перфузии почек можно манипулировать, функция почек может быть оценена, и различные фармацевтические препараты вводят. После процедуры, почки могут быть пересажены или обработаны для молекулярной биологии, биохимического анализа, или микроскопии.
В данной статье описывается перфузат и хирургической техники , необходимой для экс естественных условиях перфузии почек мыши. Подробная информация о перфузионного устройства приведены данные, показывающие клиновойiability подготовки Почки в: почечный кровоток, сосудистое сопротивление, и мочи данных как функциональных, просвечивающей электронной микрофотографии различных сегментов нефрона как морфологическими считываниями и вестерн-блоттинга транспортных белков различных сегментов нефрона как молекулярного считывания.
Введение
Изолированная перфузия органов была предметом постоянных усилий между физиологи в течение многих десятилетий 1. Методика позволяет функцию органа, без системных воздействий, таких как кровяное давление, гормоны, или нервов, чтобы быть изучены. Карл Эдуард Loebell считается первым описал успешное перфузия изолированной почки, в 1849 году 2. С тех пор перфузия аппарат претерпел значительные доработки. Фрей и Грубер представил искусственное легкое для оксигенации и пульсирующих насосов для непрерывной перфузии 2. В то время как ранние исследователи изучали в основном почки крупных млекопитающих, а именно, свиней и собак 2 3 -Первый отчет об использовании почек крыс, Вейсса и др. , Стала важной вехой в изучении перфузии небольшого млекопитающего-органа 4. Schurek и др. сообщили о необходимости добавления к эритроцитам млекопитающих перфузату при наличии достаточных почечных канальцевоксигенации было быть достигнуто 5. Критические для долгосрочных экспериментов было введение непрерывного диализа буфера с помощью той же исследовательской группой 6. В 2003 году Schweda и др. были первыми , чтобы сообщить о функциональной мыши изолированных перфузии почек (МИПК) 7, позже уточнена Rahgozar и др. 18 и Lindell и др. 14.
В то время как технически более сложной, чем крысы, изолированных перфузии почек, использование МИПК имеет то преимущество, что позволяет использовать широкий спектр генетически измененных мышей. В данной статье представлены подробности метода авторов для перфузии изолированных почек мыши в течение 1 часа. Метод позволяет для непрерывной оценки скорости почечного кровотока, сосудистого сопротивления, высвобождение гормонов, анализ газового состава крови, анализ мочи, а также применение лекарственных средств. После процедуры, почки могут быть обработаны для молекулярного и биохимического анализа, должны быть установлены для микроскопии, илипересаживают в мышь - реципиента (рис 1).

Рисунок 1: Обзор возможных ввода / вывода к изолированному перфузировались почки. BGA: анализ газов крови. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Этот метод , вероятно , будет получать все большее внимание в предстоящие годы, так как многие инновационные приложения обсуждаются с рассветом длительной нормотермической перфузии почек до трансплантации (с или без применения анти-отторжения или генома редактирования наркотиков) 8, 9, 10 , 11, биоинженерии целых почек от decellularized каркасах 12, и применение высоких доз флуоресцентных красителей для многофотонной томографии 13 . Он также является идеальной моделью , с которой для изучения роли специфических генов во время острого повреждения почек 14.
Протокол шаг за шагом дается, чтобы другие лаборатории проводить изолированную мыши почки перфузию успешно. Во-первых, состав и приготовление буфера задается. Затем, операция подробно описана и показаны критические шаги. В-третьих, данные представлены, которые являются репрезентативными для успешной подготовки: почечного кровотока, сосудистого сопротивления, скорости клубочковой фильтрации, а дробная электролит экскреции-все, как функциональные измерения жизнеспособности-и просвечивающей электронной микроскопии морфологии различных сегментов нефрона перфузией почек фиксированной после 1 часа перфузии.
протокол
Все процедуры, связанные с животными, описанные в этой рукописи были проведены в соответствии со швейцарским законодательством и утверждается ветеринарии кантона Цюрих, Швейцария.
1. Буфер Получение
- Готовят растворы 1 - 4 , и раствор антидиуретического гормона (АДГ) (таблица 1).
- Подготовка буфера для диализа (таблица 1).
Примечание: Это буфер, используемый в качестве буфера для диализа во время перфузии. Позже Эритроциты будет разбавлен в этом буфере с образованием конечного перфузата. - подготовка Erythrocyte.
- Разбавляют 250 мл концентрата эритроцита человека (тестировалась материала, полученного из местного банка крови) до 500 мл буфера для диализа. Центрифуга при 2000 мкг в течение 8 мин. Удалите буфер, соблюдая осторожность, чтобы не удалить эритроциты. Повторите 3 раза.
- Приготовьте альбумин (альбумин бычьей сыворотки БСА) буфера.
- В 200 мл dialysis буфера, растворите 44 г БСА с использованием мешалку. Фильтр решение с фильтровальной бумагой.
- Подготовить перфузата.
- Фильтр эритроцитов, начиная с шага 1.3.1 через фильтровальную бумагу в буфер БСА. Наполните до общего объема 800 мл с помощью буфера для диализа.
Примечание: Это последний Перфузат. Теперь гематокрита должно быть от 8 до 12%. Перфузат можно хранить в течение до 12 ч при температуре 4 ° С.
- Фильтр эритроцитов, начиная с шага 1.3.1 через фильтровальную бумагу в буфер БСА. Наполните до общего объема 800 мл с помощью буфера для диализа.
2. Инициирование Диализ и оксигенации
- Включите водяной бане , окружающей буфер большего размера резервуара, меньший буферный резервуар и влажную камеру (небольшая, с двойными стенками камера доводят до 37 ° С и относительной влажности 100% , чтобы позже провести почка) до 37 ° С (рисунок 2) ,
- Заполните буфер большего размера резервуар с буфером диализ и меньший резервуар с перфузату.
- Включите 5% CO 2/95% O 2 подачу газа в буфер диализом.
- Включение непрерывного диализа перфузату против буфера для диализа. Будьте осторожны, чтобы использовать низкого потока диализной трубки. Перейдите к шагу 3.

Рисунок 2: Схематическое изображение Perfusion Circuit. Схема показывает основные компоненты схемы перфузионной и направление потока буфера. Все компоненты, окруженные темно-синего цвета выдерживают при 37 ° С с водяной бани / термостатом. 1: диализ буфером по крайней мере в 3 раза объем буфера перфузионного непрерывно продувают 95% O 2/5% CO 2. 2: Диализ буфер и буфер перфузию непрерывно диализу против друг друга в диализной трубке с помощью роликового насоса. 3: Из - за этого диализом, буфер перфузия обогащен 9% O 2/5% CO 2 и электролитные уровни поддерживаются постоянными throughoут перфузия. 4: Роликовый насос разгоняет перфузионного буфер к почке. 5: Уиндкессел удаляет перистальтических волн и действует как пузырь ловушку. 6: Датчик давления (подключен к 4 (роликового насоса) , чтобы сохранить постоянное давление, позволяя свободно переменный поток). 7: На протяжении перфузии почек остается во влажной камере в течение 100% влажности воздуха и температуре 37 ° C Температура почек. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
3. Хирургические процедуры Часть 1 (на диаграмме всех лигатур, смотри рисунок 3)
Примечание: Выполните все лигатуры с помощью 5-0 хирургической нити.
- Обезболить мышь интраперитонеально (10 мкл / г массы тела, 20 мг / мл кетамина и 1 мг / мл ксилазина, растворенного в 0,9% NaCl). Подтвердить достаточную глубину AnesthОВОСС путем проверки на отсутствие задних ног рефлексов.
- Закрепите мышь в положении лежа на спине во влажной камере. Защитите глаза с ветеринаром мазь. Поместите 1 мл шприц ниже позвоночника, чтобы поднять поясничных сосудов.
- Выполнить средний лапаротомии от лобковой гребень к грудине открытия первой кожи, то мышцы живота, с помощью ножниц.
- Удалить кишечник и поместите его на левой стороне боковой мыши из брюшной полости.
- Освободите мочевой пузырь из соединительной ткани и исследовать оба мочеточника и мочеиспускательного канала.
- Поместите лигатуры вокруг левого мочеточника (лигатуры I). Закрой его.
- Поместите лигатуры вокруг мочеиспускательного канала (лигатуры II). Закрой его.
- Поместите "Лассо" лигатуры вокруг всего мочевого пузыря (лигатуры III).
- Надрезать мочевого пузыря 1 мм.
- Иглу отверстие с 2 см РЕ 50 труб.
- Закрыть лигатура III вокруг трубки.
- Обрежьте левого мочеточника и мочеиспускательного канала удалена от лигатуры. Bladдер теперь прикреплен к правой мочеточника только и свободно двигаться.
- Очистите брюшной аорты соединительной ткани и жира.
- Поместите брюшной аорты в середине лигатуры (лигатуры IV).
- Поместите лигатуры вокруг аорты ниже диафрагмы между верхней брыжеечной артерии и чревного ствола (лигатура V).
- Поместите лигатуры вокруг верхней брыжеечной артерии (лигатуры VI).
- Поместите аортального лигатуры непосредственно ниже справа и над левой почечной артерии (лигатура VII).
- Поместите лигатуры вокруг хвостового пакета вены (кава) (лигатуры VIII). Перейдите к шагу 4.
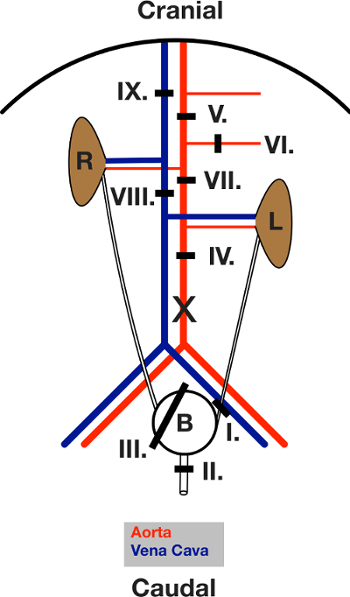
Рисунок 3: Схематическое изображение лигатур , помещенных во время хирургического вмешательства. Вид на открытой брюшной полости после лапаротомии. Кишечник съехал влево. L и R указывают на левую и правую почку.черные линии показывают площадь соответствующего лигатуры. Лигатуры сначала помещаются, а затем закрыты, в последовательности, указанной в тексте. X обозначает расположение разреза для пункции аорты. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
4. Грунтовка перфузионной Circuit
- Запустите роторный насос и заполнить трубку с перфузату. Позаботьтесь, чтобы очистить все пузырьки воздуха из него.
- Заполните устройство Уиндкессел примерно среднего уровня с перфузату.
- Выполните калибровку датчика давления до 0 мм ртутного столба, когда все трубки заполняют и поток 0. Держите перфузионного иглу на уровне почек в течение этого времени.
- Держите поток на постоянном минимальном уровне (0,6 мл / мин) и перейти к шагу 5.
5. Хирургическая процедура Часть 2
- Поместите зажим между лигатуры IV и разветвлению левого Ренал артерии.
- Сделайте небольшой надрез в аорте хвостового лигатуры IV, следя за тем, чтобы не перерезать спинной стенки.
- Разбавить отверстие в аорту с расширитель сосуда.
- Аорту иглу с иглой (2 см длиной, вытащил PE 50), толкая наконечник только к зажиму.
- Откройте зажим.
- Вставьте кончик иглы краниально, пока не достигнет стык правой артерии почек и аорты.
- Закрыть лигатуры VII.
- Закрыть лигатуры IV.
- Откройте сундук с ножницами рассечением диафрагмы. С помощью одного разреза, отделяют аорту, полую вену, сердце и вегетативных нервов. С помощью этого шага, животное умерщвляют посредством быстрого обескровливания при непрерывном глубокой анестезии.
- Начало регулирования давления перфузионной насоса. Поддерживать среднее давление от 80 до 100 мм ртутного столба.
- Закрыть лигатуры В.
- Закрыть лигатуры VI.
- Закрыть лигатуры VIII.
- Свободная правая почка от соединительной Tissuе и его вложение в жировую капсулу с ножницами.
- Обрежьте аорту проксимальнее лигатуры В.
- Обрежьте брыжеечной артерии дистальнее лигатуры VI.
- Разрежьте узелок почки поддерживающие судно из, следя за тем, чтобы не врезаться в самих судах.
- Порежьте печень в связи с почками. Позаботьтесь, чтобы освободить почки, но оставить небольшую часть приверженца печени к нему, так что полая остается открытым ею.
- Возьмите пучок из почки мыши. Отключив мышь от влажной камере.
- Поместите "Лассо" лигатуры вокруг соединения печени и почек (лигатуры IX).
- Вводить иглу в полую вену с венозной линии (2 см PE 50).
- Закрыть лигатуры IX. Венозный отток через венозную линию следует немедленно начать.
- Закройте влажную камеру.
6. Downstream Анализы
- В течение следующего часа, непрерывно контролировать поток крови и intravasculдавление 15 соток. Собирают венозного оттока, который может быть использован для анализа, например, почечную высвобождение ренина 7. Сбор мочи для анализа концентрации электролита и клубочковой фильтрации 14. Через 1 час перфузии, почки могут быть быстро замораживают для вестерн - блоттинга или быть установлены для работы с изображениями приближается к 16.
Результаты
С помощью описанной метод, изолированные почки мыши могут оставаться жизнеспособными в течение, по крайней мере 1 часа. Мы протестировали жизнеспособности тканей после 1 ч непрерывной перфузии с функциональной (почечного кровотока и сосудистого сопротивления, анализ...
Обсуждение
Мышь , изолированных перфузию почек является инструментом для изучения функции почек в контролируемой среде экс естественных условиях в течение 1 ч, преодоление разрыва между экспериментами в естественных условиях у интактных животных, которые могут быть испорчено под возд?...
Раскрытие информации
The authors have no competing financial interests and nothing else to disclose.
Благодарности
The authors would like to thank Hans-Joachim Schurek for invaluable scientific advice. The authors would like to thank Monique Carrel and Michèle Heidemeyer for excellent technical assistance, David Penton Ribas and Nourdine Faresse for a critical reading of the manuscript and Carsten Wagner and Jürg Biber for the NaPi-2a antibody. This work was supported by the Swiss National Centre for Competence in Research "Kidney.CH" and by a project grant (310030_143929/1) from the Swiss National Science Foundation.
Материалы
| Name | Company | Catalog Number | Comments |
| Perfusion Circuit: | |||
| Moist chamber 834/8 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2901 | |
| Cannular with basket and side port | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2947 | |
| Thermostat TC120-ST5 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-4544 | |
| ISM 827/230V Roller Pump Reglo Analogue | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-0114 | |
| Reservoir jacketed for buffer solution 1 L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3438 | |
| Reservoir jacketed for buffer solution 0.5 L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3436 | |
| Pressure Transducer APT300 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3862 | |
| TAM-D Plugsys Transducer | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-1793 | |
| SCP Plugsys servo controller | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2806 | |
| Windkessel | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3717 | |
| HSE-USB data acquisition | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3330 | |
| Low-Flux Dialysator Diacap Polysulfone | B.Braun | 7203525 | |
| PE-Tubing for aorta cannulation 1.19 mm I.D. x 1.70 mm O.D. | Scientific Commodities Inc. | BB31695-PE/8 | |
| Name | Company | Catalog Number | Comments |
| Buffer reagents: | |||
| Aminoplasmal 10% | B.Braun | 134518064 | |
| Sodium pyruvate | Sigma-Aldrich | P2256-25G | |
| L-Glutamic acid monosodium salt hydrate | Sigma-Aldrich | G1626-100G | |
| L-(-)-Malic acid sodium salt | Sigma-Aldrich | M1125-25G | |
| Sodium-L-Lactate | Sigma-Aldrich | L7022-10G | |
| alpha-Ketoglutaric acid sodium salt | Sigma-Aldrich | K1875-25G | |
| NaCl | Sigma-Aldrich | 31434-1KG-R | |
| NaHCO3 | Sigma-Aldrich | S5761-5KG | |
| KCl | Sigma-Aldrich | 60130-1KG | |
| Urea | Sigma-Aldrich | U5378-500G | |
| Creatinine | Sigma-Aldrich | C4255-10G | |
| Ampicillin | Roche | 10835242001 | |
| MgCl2 * 6H2O | Sigma-Aldrich | M2393-500G | |
| D-Glucose | Sigma-Aldrich | G8270-1KG | |
| CaCl2 * 6H2O | Riedel-de-Haën | 12074 | |
| NaH2PO4 | Sigma-Aldrich | S9638-500G | |
| Na2HPO4 | Sigma-Aldrich | S0876-500G | |
| Antidiuretic Hormone dDAVP | Sigma-Aldrich | V2013-1MG | |
| FITC-Inulin | Sigma-Aldrich | ||
| Filter used for erythrocyte filtration | Macherey-Nagel | MN 615 | |
| BGA Analysis: | |||
| ABL 80 flex | Radiometer Medical ApS | ||
| Electron Microscope: | |||
| Philips CM100 TEM | FEI |
Ссылки
- Carrel, A., Lindbergh, C. A. The culture of whole organs. Science (New York, N.Y.). 81 (2112), 621-623 (1935).
- Skutul, K. . Über Durchströmungsapparate Pflüger's Archiv. 123 (4-6), 249-273 (1908).
- Nizet, A. The isolated perfused kidney: possibilities, limitations and results. Kidney Int. 7 (1), 1-11 (1975).
- Weiss, C., Passow, H., Rothstein, A. Autoregulation of flow in isolated rat kidney in the absence of red cells. Am J Physiol. 196 (5), 1115-1118 (1959).
- Schurek, H. J., Kriz, W. Morphologic and functional evidence for oxygen deficiency in the isolated perfused rat kidney. Lab Invest. 53 (2), 145-155 (1985).
- Stolte, H., Schurek, H. J., Alt, J. M. Glomerular albumin filtration: a comparison of micropuncture studies in the isolated perfused rat kidney with in vivo experimental conditions. Kidney Int. 16 (3), 377-384 (1979).
- Schweda, F., Wagner, C., Krämer, B. K., Schnermann, J., Kurtz, A. Preserved macula densa-dependent renin secretion in A1 adenosine receptor knockout mice. AJP Renal Physiol. 284 (4), F770-F777 (2003).
- Moers, C., Smits, J. M., et al. Machine perfusion or cold storage in deceased-donor kidney transplantation. N Engl J Med. 360 (1), 7-19 (2009).
- Nicholson, M. L., Hosgood, S. A. Renal transplantation after ex vivo normothermic perfusion: the first clinical study. Am J Transplant. 13 (5), 1246-1252 (2013).
- Worner, M., Poore, S., Tilkorn, D., Lokmic, Z., Penington, A. J. A low-cost, small volume circuit for autologous blood normothermic perfusion of rabbit organs. Art Org. 38 (4), 352-361 (2014).
- Kaths, J. M., Spetzler, V. N., et al. Normothermic Ex Vivo Kidney Perfusion for the Preservation of Kidney Grafts prior to Transplantation. J Vis Exp. (101), e52909 (2015).
- Song, J. J., Guyette, J. P., Gilpin, S. E., Gonzalez, G., Vacanti, J. P., Ott, H. C. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Med. 19 (5), 646-651 (2013).
- Hall, A. M., Crawford, C., Unwin, R. J., Duchen, M. R., Peppiatt-Wildman, C. M. Multiphoton imaging of the functioning kidney. JASN. 22 (7), 1297-1304 (2011).
- Lindell, S. L., Williams, N., Brusilovsky, I., Mangino, M. J. Mouse IPK: A Powerful Tool to Partially Characterize Renal Reperfusion and Preservation Injury. Open Transplant J. 5, 15-22 (2011).
- Wagner, C., De Wit, C., Kurtz, L., Grünberger, C., Kurtz, A., Schweda, F. Connexin40 is essential for the pressure control of renin synthesis and secretion. Circ Res. 100 (4), 556-563 (2007).
- Czogalla, J., Vohra, T., Penton, D., Kirschmann, M., Craigie, E., Loffing, J. The mineralocorticoid receptor (MR) regulates ENaC but not NCC in mice with random MR deletion. Pflüger's Archiv. , (2016).
- Poosti, F., et al. Precision-cut kidney slices (PCKS) to study development of renal fibrosis and efficacy of drug targeting ex vivo. Dis Model Mech. 8 (10), 1227-1236 (2015).
- Rahgozar, M., Guan, Z., Matthias, A., Gobé, G. C., Endre, Z. H. Angiotensin II facilitates autoregulation in the perfused mouse kidney: An optimized in vitro model for assessment of renal vascular and tubular function. Nephrology. 9 (5), 288-296 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены