Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
La perfusé Technique du rein de souris isolé
Dans cet article
Résumé
Le rein de souris isolé perfusé (MIPK) est une technique pour la tenue d' un rein de souris ex vivo sous conditions perfusés et fonctionnelles pendant 1 h. Les tampons et les techniques chirurgicales sont décrits en détail.
Résumé
Le rein de souris isolé perfusé (MIPK) est une technique pour la tenue d' un rein de souris ex vivo sous conditions perfusés et fonctionnelles pendant 1 h. Ceci est une condition préalable à l'étude de la physiologie de l'organe isolé et pour de nombreuses applications innovantes qui peuvent être possible à l'avenir, y compris perfusion décellularisation pour les reins bioingénierie ou l'administration d'anti-rejet ou de la drogue du génome édition à des doses élevées pour amorcer le rein pour la transplantation. Pendant le temps de la perfusion, le rein peut être manipulée, la fonction rénale peut être évaluée, ainsi que divers produits pharmaceutiques administrés. Après la procédure, le rein peut être transplanté ou traitées pour la biologie moléculaire, l'analyse biochimique ou examen microscopique.
Ce document décrit le perfusat et la technique chirurgicale nécessaire pour l'ex vivo perfusion des reins de souris. Détails de l'appareil de perfusion sont données et les données sont présentées montrant la vdonnées flux sanguin rénal, la résistance vasculaire, et d'urine comme micrographies fonctionnels électroniques de transmission des différents segments de néphron comme des lectures morphologiques et western blots de protéines de transport des différents segments de néphron comme lecture moléculaire: ESPONSABILITE de la préparation du rein.
Introduction
La perfusion isolée des organes a fait l'objet d'un effort continu entre les physiologistes depuis de nombreuses décennies 1. La technique permet à la fonction de l'organe, sans influences systémiques tels que la pression artérielle, les hormones, ou les nerfs, à étudier. Carl Eduard Loebell est considéré comme le premier à avoir décrit la perfusion réussie d'un rein isolé, en 1849 2. Depuis lors, le dispositif de perfusion a subi de raffinement significative. Frey et Gruber introduit un poumon artificiel pour l' oxygénation et pulsatiles pompes pour perfusion continue 2. Alors que les premiers chercheurs principalement étudié les reins de grands mammifères , à savoir, les porcs et les chiens 2 3 -le premier rapport de l'utilisation de reins de rats, par Weiss et al. , Était une étape importante dans l'étude de la perfusion de petit mammifère organe 4. Schurek et al. signalé la nécessité d'ajouter des érythrocytes de mammifère au perfusat si tubulaire rénale suffisanteoxygénation devait être atteint 5. Critical pour les expériences à long terme a été l'introduction de la dialyse continue de la mémoire tampon par le même groupe de recherche 6. En 2003, Schweda et al. ont été les premiers à signaler un rein de souris fonctionnelle isolé perfusé (MIPK) 7, puis affiné par Rahgozar et al. 18 et Lindell et al. 14.
Bien que techniquement plus difficile que le rat isolé rein perfusé, l'utilisation du MIPK porte l'avantage de permettre l'utilisation d'une large gamme de souris génétiquement modifiées. Cet article présente les détails de la méthode des auteurs pour perfuser les reins de souris isolées pendant 1 h. La méthode permet l'évaluation continue des taux d'écoulement rénale, la résistance vasculaire, la libération d'hormones, l'analyse des gaz du sang, analyse d'urine, et l'application de la drogue. Après la procédure, les reins peuvent être traitées pour l'analyse moléculaire et biochimique, fixés pour la microscopie, outransplantées dans une souris réceptrice (figure 1).

Figure 1: Vue d'ensemble de possibles entrées / sorties du rein isolé perfusé. BGA: analyse des gaz du sang. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Cette technique sera probablement recevoir une attention croissante au cours des prochaines années, car de nombreuses applications innovantes sont en cours de discussion à l'aube de longue normothermique perfusion rénale avant la transplantation (avec ou sans l'application d'anti-rejet ou de la drogue du génome édition) 8, 9, 10 , 11, la bioingénierie des reins entiers de échafauds décellularisés 12, et l'application de doses élevées de colorants fluorescents pour multiphotonique imagerie 13 . Il est également un modèle idéal avec lequel pour étudier le rôle des gènes spécifiques lors de lésions rénales aiguës 14.
Un protocole étape par étape est donnée pour permettre à d'autres laboratoires pour effectuer isolé souris perfusion rénale avec succès. Tout d'abord, la composition et la préparation de la mémoire tampon est spécifiée. Ensuite, l'opération est décrite en détail, et les étapes essentielles sont représentées. En troisième lieu, les données sont présentées qui sont représentatives d'une préparation réussie: le flux sanguin rénal, la résistance vasculaire, le taux de filtration glomérulaire, et l'électrolyte fractionnée d'excrétion toutes les mesures que fonctionnelles des micrographies de viabilité et électronique à transmission de la morphologie des différents segments de néphron des reins perfusés fixée après 1 h de perfusion.
Protocole
Toutes les procédures impliquant des animaux décrits dans ce manuscrit ont été menées conformément au droit suisse et approuvés par l'administration vétérinaire du canton de Zurich, en Suisse.
1. Préparation du tampon
- Préparer des solutions 1 - 4 et la solution d' hormone antidiurétique (ADH) (tableau 1).
- Préparer le tampon de dialyse (tableau 1).
NOTE: Ceci est le tampon utilisé comme tampon de dialyse au cours de la perfusion. Plus tard, les érythrocytes sont dilués dans ce tampon pour former la solution de perfusion finale. - préparation des érythrocytes.
- Diluer 250 ml de concentré érythrocytaire humaine (matériau testé obtenu à partir de la banque de sang locale) à 500 ml avec le tampon de dialyse. Centrifuger à 2000 xg pendant 8 min. Retirez le tampon, en faisant attention de ne pas supprimer tous les érythrocytes. Répétez 3x.
- Préparer la (albumine de sérum bovin, BSA) à l'albumine tampon.
- Dans 200 ml de dialysis tampon, dissoudre 44 g de BSA en utilisant une barre d'agitation. On filtre la solution avec du papier filtre.
- Préparer le perfusat.
- Filtrer les globules rouges de l'étape 1.3.1 à travers un papier filtre dans la mémoire tampon de BSA. Remplir jusqu'à un volume total de 800 ml avec le tampon de dialyse.
NOTE: Ceci est le perfusat final. L'hématocrite devrait maintenant se situer entre 8 et 12%. Le perfusat peut être stocké pendant jusqu'à 12 heures à 4 ° C.
- Filtrer les globules rouges de l'étape 1.3.1 à travers un papier filtre dans la mémoire tampon de BSA. Remplir jusqu'à un volume total de 800 ml avec le tampon de dialyse.
2. Initier Dialyse et Oxygénation
- Mettre en marche le bain d'eau entourant le grand réservoir tampon, le réservoir tampon inférieur et la chambre humide (une petite chambre à double paroi portée à 37 ° C et 100% d' humidité pour maintenir ensuite le rein) à 37 ° C (figure 2) .
- Remplir le réservoir-tampon plus grand avec le tampon de dialyse et le plus petit réservoir avec le liquide de perfusion.
- Allumer la 5% de CO 2 / O 2 à 95% entrée de gaz dans le tampon de dialyse.
- Allumez la dialyse continue du perfusat contre le tampon de dialyse. Prenez soin d'utiliser des tubes de dialyse à faible flux. Passez à l'étape 3.

Figure 2: Dessin schématique du circuit Perfusion. Le schéma représente les composants principaux du circuit de perfusion et la direction d'écoulement du tampon. Tous les composants entourés de bleu foncé sont maintenus à 37 ° C avec un bain d'eau / thermostat. 1: Dialyse tampon d'au moins 3 fois le volume du tampon de perfusion est continuellement barboter avec 95% O 2/5% CO 2. 2: Dialyse tampon et un tampon de perfusion continue sont dialysées contre l'autre dans un tube de dialyse par une pompe à rouleaux. 3: constante througho En raison de cette dialyse, le tampon de perfusion est enrichi avec 9% O 2/5% de CO 2 et d' électrolytes niveaux sont maintenusperfusion ut. 4: une pompe à rouleaux propulse le tampon de perfusion vers le rein. 5: Windkessel supprime les ondes péristaltiques et agit comme un piège à bulles. 6: Capteur de pression (relié à 4. (pompe à rouleaux) pour maintenir une pression constante tout en permettant un écoulement libre en alternance). 7: Tout au long de la perfusion, le rein reste dans une chambre humide à 100% d' humidité de l' air et 37 ° C Température du rein. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
3. Surgical Procédure Partie 1 (pour un diagramme de tous les ligatures, voir la figure 3)
Remarque: Effectuer toutes les ligatures en utilisant 5-0 fil chirurgical.
- Anesthésier une souris par injection intrapéritonéale (10 ul / g de poids corporel, 20 mg / ml de kétamine et 1 mg / ml de xylazine dissous dans du NaCl à 0,9%). Confirmer la profondeur suffisante de anesthEIES en testant absence de réflexes arrière-pied.
- Fixer la souris dans une position couchée dans la chambre humide. Protéger les yeux avec vétérinaire pommade. Placer une seringue de 1 ml en dessous de la colonne vertébrale afin d'élever les vaisseaux lombaires.
- Effectuer une laparotomie médiane de la crête du pubis à l'ouverture du sternum d'abord la peau, puis les muscles abdominaux, avec des ciseaux.
- Enlever l'intestin et le placer sur le côté gauche de la partie latérale de la souris de l'abdomen.
- Libérez la vessie du tissu conjonctif et explorer les deux uretères et l'urètre.
- Placer une ligature autour de l'uretère gauche (ligatures I). Ferme le.
- Placez une ligature autour de l'urètre (ligature II). Ferme le.
- Placer un "lasso" ligature autour de l'ensemble de la vessie (ligatures III).
- Inciser la vessie de 1 mm.
- Cathétériser l'ouverture avec 2 cm PE 50 tubes.
- Fermer III Ligature autour du tube.
- Couper l'uretère gauche et de l'urètre distal des ligatures. Le bladder est maintenant attaché à l'uretère droit seulement et se déplacer librement.
- Décochez l'aorte abdominale du tissu connectif et la graisse.
- Placer une ligature milieu de l'aorte abdominale (IV Ligature).
- Placer une ligature autour de l'aorte au-dessous du diaphragme entre l'artère mésentérique supérieure et le tronc coeliaque (V Ligature).
- Placer une ligature autour de l'artère mésentérique supérieure (VI Ligature).
- Placer une ligature aortique directement en dessous de la droite et au-dessus de l'artère rénale gauche (VII ligatures).
- Placez une ligature autour du paquet caudale de veine (cava) (VIII ligatures). Passez à l'étape 4.
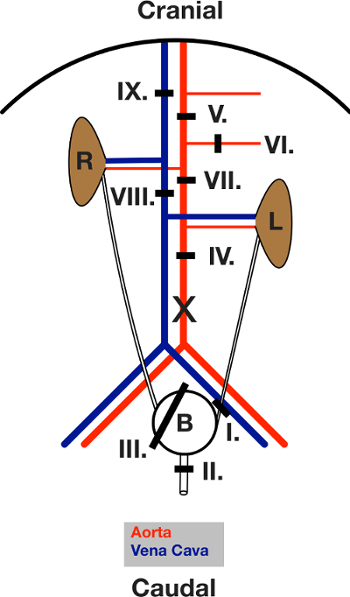
Figure 3: Dessin schématique des ligatures placées pendant la chirurgie. Vue de l'abdomen ouvert après la laparotomie. L'intestin est déplacé vers la gauche. L et R indiquent le rein gauche et à droite. ledes lignes noires indiquent la zone de la ligature respective. Les ligatures sont d'abord placés, puis fermés, dans l'ordre indiqué dans le texte. X marque l'emplacement de l'incision de l' aorte pour la canulation. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
4. Amorçage du circuit Perfusion
- Démarrer la pompe rotative et remplir le tube avec perfusat. Prenez soin de vider toutes les bulles d'air de celui-ci.
- Remplissez le dispositif de Windkessel à environ mi-niveau avec perfusat.
- Calibrer le capteur de pression à 0 mm Hg lorsque tous les tubes est rempli et le débit est 0. Gardez l'aiguille de perfusion au niveau du rein pendant ce temps.
- Gardez l'écoulement à un niveau minimal constant (0,6 ml / min) et passez à l'étape 5.
5. Surgical Procédure Partie 2
- Placez une pince entre ligatures IV et la ramification du rena gauchel 'artère.
- Faire une petite incision dans la caudale aorte de ligatures IV, en prenant soin de ne pas couper la paroi dorsale.
- Dilater l'ouverture dans l'aorte avec un dilatateur de vaisseau.
- Cathétériser l'aorte avec une aiguille (2 cm de long, tiré PE 50), poussant la pointe juste à la pince.
- Ouvrez la pince.
- Poussez la pointe de la céphalique de l'aiguille jusqu'à ce qu'il atteigne la jonction de l'artère rénale droite et l'aorte.
- Fermer ligatures VII.
- Fermer ligatures IV.
- Ouvrez le coffre avec des ciseaux en disséquant le diaphragme. Avec une seule coupe, séparer l'aorte, la veine cave, le cœur et les nerfs végétatifs. Avec cette étape, l'animal est sacrifié par exsanguination rapide sous anesthésie profonde continue.
- Commencer le contrôle de la pression de la pompe de perfusion. Maintenir la pression moyenne entre 80 et 100 mmHg.
- Fermer V. ligatures
- Fermer ligatures VI.
- Fermer ligatures VIII.
- Gratuit le rein droit du tissu conjonctife et son incorporation dans la capsule adipeuse avec des ciseaux.
- Couper l'aorte proximale pour ligaturer V.
- Couper l'artère mésentérique supérieure distalement à ligaturer VI.
- Couper le navire faisceau de rein de soutien, en prenant soin de ne pas couper dans les navires eux-mêmes.
- Couper le foie à la connexion au rein. Prendre soin de libérer le rein, tout en laissant une petite partie de l'adhésif du foie, de sorte que la veine cave est maintenue ouverte par celui-ci.
- Prendre le faisceau de rein de la souris. Retirez la souris à partir de la chambre humide.
- Placer un "lasso" ligature autour de la connexion du foie et les reins (IX ligatures).
- Cathétériser la veine cave avec une ligne veineuse (2 cm de PE 50).
- Fermer ligatures IX. écoulement veineux à travers la ligne veineuse devrait immédiatement commencer.
- Fermez la chambre humide.
6. Les analyses en aval
- Pendant l'heure qui suit, surveiller en permanence le flux sanguin et intravasculpression ar 15. Recueillir l' écoulement veineux, qui peut être utilisé pour l' analyse, par exemple, la libération de rénine rénale 7. Recueillir l' urine pour l' analyse de la concentration d'électrolyte et le taux de filtration glomérulaire 14. Après 1 heure de perfusion, les reins peuvent être snap-congelés pour western blot ou être fixés pour l' imagerie des approches 16.
Résultats
Avec le procédé décrit, les reins de souris isolées peuvent rester viables pendant au moins 1 h. Nous avons testé la viabilité du tissu après 1 h de perfusion continue avec fonctionnelle (flux sanguin rénal et la résistance vasculaire, l' analyse des gaz du sang d'écoulement veineux, le taux de filtration glomérulaire, excrétion fractionnelle Na + et K +, et l'osmolalité urinaire) et morphologique électronique (transmission microscopie, TEM...
Discussion
La souris isolé rein perfusé est un outil pour l' étude de la fonction rénale dans un environnement contrôlé ex vivo pendant 1 heure, combler le fossé entre les expériences in vivo chez les animaux intacts, ce qui peut être faussée par l'impact de nombreux facteurs systémiques, et des expériences in vitro en segments de néphron isolés ou des cellules en culture, qui négligent nécessairement l'impact de la structure des organes intacts sur la fonction. Il es...
Déclarations de divulgation
The authors have no competing financial interests and nothing else to disclose.
Remerciements
The authors would like to thank Hans-Joachim Schurek for invaluable scientific advice. The authors would like to thank Monique Carrel and Michèle Heidemeyer for excellent technical assistance, David Penton Ribas and Nourdine Faresse for a critical reading of the manuscript and Carsten Wagner and Jürg Biber for the NaPi-2a antibody. This work was supported by the Swiss National Centre for Competence in Research "Kidney.CH" and by a project grant (310030_143929/1) from the Swiss National Science Foundation.
matériels
| Name | Company | Catalog Number | Comments |
| Perfusion Circuit: | |||
| Moist chamber 834/8 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2901 | |
| Cannular with basket and side port | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2947 | |
| Thermostat TC120-ST5 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-4544 | |
| ISM 827/230V Roller Pump Reglo Analogue | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-0114 | |
| Reservoir jacketed for buffer solution 1 L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3438 | |
| Reservoir jacketed for buffer solution 0.5 L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3436 | |
| Pressure Transducer APT300 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3862 | |
| TAM-D Plugsys Transducer | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-1793 | |
| SCP Plugsys servo controller | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2806 | |
| Windkessel | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3717 | |
| HSE-USB data acquisition | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3330 | |
| Low-Flux Dialysator Diacap Polysulfone | B.Braun | 7203525 | |
| PE-Tubing for aorta cannulation 1.19 mm I.D. x 1.70 mm O.D. | Scientific Commodities Inc. | BB31695-PE/8 | |
| Name | Company | Catalog Number | Comments |
| Buffer reagents: | |||
| Aminoplasmal 10% | B.Braun | 134518064 | |
| Sodium pyruvate | Sigma-Aldrich | P2256-25G | |
| L-Glutamic acid monosodium salt hydrate | Sigma-Aldrich | G1626-100G | |
| L-(-)-Malic acid sodium salt | Sigma-Aldrich | M1125-25G | |
| Sodium-L-Lactate | Sigma-Aldrich | L7022-10G | |
| alpha-Ketoglutaric acid sodium salt | Sigma-Aldrich | K1875-25G | |
| NaCl | Sigma-Aldrich | 31434-1KG-R | |
| NaHCO3 | Sigma-Aldrich | S5761-5KG | |
| KCl | Sigma-Aldrich | 60130-1KG | |
| Urea | Sigma-Aldrich | U5378-500G | |
| Creatinine | Sigma-Aldrich | C4255-10G | |
| Ampicillin | Roche | 10835242001 | |
| MgCl2 * 6H2O | Sigma-Aldrich | M2393-500G | |
| D-Glucose | Sigma-Aldrich | G8270-1KG | |
| CaCl2 * 6H2O | Riedel-de-Haën | 12074 | |
| NaH2PO4 | Sigma-Aldrich | S9638-500G | |
| Na2HPO4 | Sigma-Aldrich | S0876-500G | |
| Antidiuretic Hormone dDAVP | Sigma-Aldrich | V2013-1MG | |
| FITC-Inulin | Sigma-Aldrich | ||
| Filter used for erythrocyte filtration | Macherey-Nagel | MN 615 | |
| BGA Analysis: | |||
| ABL 80 flex | Radiometer Medical ApS | ||
| Electron Microscope: | |||
| Philips CM100 TEM | FEI |
Références
- Carrel, A., Lindbergh, C. A. The culture of whole organs. Science (New York, N.Y.). 81 (2112), 621-623 (1935).
- Skutul, K. . Über Durchströmungsapparate Pflüger's Archiv. 123 (4-6), 249-273 (1908).
- Nizet, A. The isolated perfused kidney: possibilities, limitations and results. Kidney Int. 7 (1), 1-11 (1975).
- Weiss, C., Passow, H., Rothstein, A. Autoregulation of flow in isolated rat kidney in the absence of red cells. Am J Physiol. 196 (5), 1115-1118 (1959).
- Schurek, H. J., Kriz, W. Morphologic and functional evidence for oxygen deficiency in the isolated perfused rat kidney. Lab Invest. 53 (2), 145-155 (1985).
- Stolte, H., Schurek, H. J., Alt, J. M. Glomerular albumin filtration: a comparison of micropuncture studies in the isolated perfused rat kidney with in vivo experimental conditions. Kidney Int. 16 (3), 377-384 (1979).
- Schweda, F., Wagner, C., Krämer, B. K., Schnermann, J., Kurtz, A. Preserved macula densa-dependent renin secretion in A1 adenosine receptor knockout mice. AJP Renal Physiol. 284 (4), F770-F777 (2003).
- Moers, C., Smits, J. M., et al. Machine perfusion or cold storage in deceased-donor kidney transplantation. N Engl J Med. 360 (1), 7-19 (2009).
- Nicholson, M. L., Hosgood, S. A. Renal transplantation after ex vivo normothermic perfusion: the first clinical study. Am J Transplant. 13 (5), 1246-1252 (2013).
- Worner, M., Poore, S., Tilkorn, D., Lokmic, Z., Penington, A. J. A low-cost, small volume circuit for autologous blood normothermic perfusion of rabbit organs. Art Org. 38 (4), 352-361 (2014).
- Kaths, J. M., Spetzler, V. N., et al. Normothermic Ex Vivo Kidney Perfusion for the Preservation of Kidney Grafts prior to Transplantation. J Vis Exp. (101), e52909 (2015).
- Song, J. J., Guyette, J. P., Gilpin, S. E., Gonzalez, G., Vacanti, J. P., Ott, H. C. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Med. 19 (5), 646-651 (2013).
- Hall, A. M., Crawford, C., Unwin, R. J., Duchen, M. R., Peppiatt-Wildman, C. M. Multiphoton imaging of the functioning kidney. JASN. 22 (7), 1297-1304 (2011).
- Lindell, S. L., Williams, N., Brusilovsky, I., Mangino, M. J. Mouse IPK: A Powerful Tool to Partially Characterize Renal Reperfusion and Preservation Injury. Open Transplant J. 5, 15-22 (2011).
- Wagner, C., De Wit, C., Kurtz, L., Grünberger, C., Kurtz, A., Schweda, F. Connexin40 is essential for the pressure control of renin synthesis and secretion. Circ Res. 100 (4), 556-563 (2007).
- Czogalla, J., Vohra, T., Penton, D., Kirschmann, M., Craigie, E., Loffing, J. The mineralocorticoid receptor (MR) regulates ENaC but not NCC in mice with random MR deletion. Pflüger's Archiv. , (2016).
- Poosti, F., et al. Precision-cut kidney slices (PCKS) to study development of renal fibrosis and efficacy of drug targeting ex vivo. Dis Model Mech. 8 (10), 1227-1236 (2015).
- Rahgozar, M., Guan, Z., Matthias, A., Gobé, G. C., Endre, Z. H. Angiotensin II facilitates autoregulation in the perfused mouse kidney: An optimized in vitro model for assessment of renal vascular and tubular function. Nephrology. 9 (5), 288-296 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon