A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
جراحة التحويلة، الحق القلب قسطرة، والأوعية الدموية القياس الشكلي في الفأر نموذج لالناجم عن تدفق-الرئوي الشرياني ارتفاع ضغط الدم
In This Article
Summary
This protocol describes a surgical procedure to create a model for flow-induced pulmonary arterial hypertension (PAH) in rats and the procedures to analyze the principle hemodynamic and histological end-points in this model.
Abstract
In this protocol, PAH is induced by combining a 60 mg/kg monocrotalin (MCT) injection with increased pulmonary blood flow through an aorto-caval shunt (MCT+Flow). The shunt is created by inserting an 18-G needle from the abdominal aorta into the adjacent caval vein. Increased pulmonary flow has been demonstrated as an essential trigger for a severe form of PAH with distinct phases of disease progression, characterized by early medial hypertrophy followed by neointimal lesions and the progressive occlusion of the small pulmonary vessels. To measure the right heart and pulmonary hemodynamics in this model, right heart catheterization is performed by inserting a rigid cannula containing a flexible ball-tip catheter via the right jugular vein into the right ventricle. The catheter is then advanced into the main and the more distal pulmonary arteries. The histopathology of the pulmonary vasculature is assessed qualitatively, by scoring the pre- and intra-acinar vessels on the degree of muscularization and the presence of a neointima, and quantitatively, by measuring the wall thickness, the wall-lumen ratios, and the occlusion score.
Introduction
والهدف من هذه الطريقة هو خلق نموذج يمكن استنساخه لالشديد، الناجم عن التدفق الشرياني الرئوي وارتفاع ضغط الدم في الفئران وقياس في الدورة الدموية حيث المبدأ ونقطة نهاية النسيجية المرضية.
الرئوي ارتفاع ضغط الدم الشرياني (الهيئة العامة للإسكان) هو متلازمة سريرية أن تشمل الزيادة التدريجية في المقاومة الوعائية الرئوية مما يؤدي إلى فشل البطين الأيمن والموت. ضمن الطيف مرض superordinate من أمراض ارتفاع ضغط الدم الرئوي (PH)، الهيئة العامة للإسكان هو الشكل الأكثر حدة واحدة أن يبقى دون علاج 1. يتميز اعتلال الشرايين الأساسية في الهيئة العامة للإسكان من الشكل التقليدي لإعادة الأوعية الدموية التي تسبب انسداد لمعة السفينة. وتعتبر Muscularization من السفن غير muscularized العادية وتضخم طبقة سفينة سطي كظواهر المرض في وقت مبكر من الهيئة العامة للإسكان، وينظر أيضا في أشكال أخرى من PH 2، ويعتقد أن يكون عكسها 3. كما الهيئة العامة للإسكان لdvances، وتبدأ طبقة باطنة لإعادة، تشكل في نهاية المطاف الآفات neointimal مميزة 2. Neointimal من نوع الأوعية الدموية الرئوية إعادة عرض حصري لالهيئة العامة للإسكان ويعتبر حاليا أن يكون لا رجعة فيه (4).
كما الهيئة العامة للإسكان هو مرض نادر، والتقدم في الفهم لها pathobiological وتطوير علاجات جديدة اعتمدت بشكل كبير على نماذج حيوانية. و(MCT) نموذج monocrotalin في الفئران هو نموذج ضربة واحدة بسيطة التي كانت، ولا تزال، وتستخدم في كثير من الأحيان. MCT هو السم الذي يسبب إصابة الشرايين الرئوية والتهاب الإقليمي 5. 60 ملغ / كغ MCT يؤدي إلى زيادة في ضغط متوسط الشريان الرئوي (mPAP)، الرئوي المقاومة الوعائية (PVR)، وتضخم البطين الأيمن (RVH) بعد 3-4 أسابيع 6. يتميز histomorphology من تضخم وسطي معزولة بدون آفات neointimal 5. وMCTوبالتالي يمثل نموذج الفئران شكل معتدل من PH، وليس الهيئة العامة للإسكان، على الرغم من أنه يرد عادة باسم هذا الأخير.
في الأطفال الذين يعانون من الهيئة العامة للإسكان المرتبطة تحويلة الخلقية اليسار إلى اليمين (الهيئة العامة للإسكان-CHD)، وزيادة يعتبر تدفق الدم الرئوي كما الزناد أساسي لتطوير الآفات neointimal 7، 8، 9. في الفئران، وزيادة تدفق الدم الرئوي يمكن أن يتسبب من خلال إنشاء تحويلة بين الشريان الأورطي البطني والوريد الأجوف، وهي تقنية صفت لأول مرة في عام 1990 10. بدائل لخلق زيادة تدفق الرئوي هي من الرئة من جانب واحد أو تحت الترقوة إلى مفاغرة الشريان الرئوي 11. تتكون عيوب المفاهيمية من هذه النماذج من النمو التعويضي المحتملين من الرئة المتبقية وتفعيل مسار التكيف الناجمة عن استئصال الرئة، أو الإصابة علاجي المنشأ من الأوعية الدموية الرئوية المقررلمفاغرة الشريان الرئوي، سواء يفند تأثيرات زيادة تدفق الدم الرئوي.
عندما يتم إنشاء تحويلة الأورطيه- الأجوف وزيادة تدفق الدم الرئوي هو فعل بمثابة الضربة الثانية في الفئران المعالجة MCT، تحدث الآفات neointimal مميزة، وشكل حاد من الهيئة العامة للإسكان وما يرتبط بها من فشل البطين الأيمن (حمى الوادي المتصدع) تطوير 3 أسابيع بعد زيادة تدفق 12. وتقدم الدورة الدموية من الهيئة العامة للإسكان في هذا النموذج يمكن تقييم في الحي بواسطة تخطيط صدى القلب وقسطرة القلب الأيمن. وhistomorphology الأوعية الدموية، وسمك جدار الوعاء الدموي، ودرجة الانسداد الشرياني، والمعلمات للفشل البطين الأيمن تشكل الدعائم التي تقوم عليها توصيف المجراة سابقا من الهيئة العامة للإسكان.
يصف هذا الأسلوب بروتوكولات وإجراءات تفصيلية لعملية جراحية الأورطيه- الأجوف تحويلة (AC-تحويلة)، والحق قسطرة القلب، وتقييم النوعي والكمي للhistomorphology الأوعية الدموية.
Protocol
وقد تمت الموافقة على الإجراءات التي تجرى على الحيوانات من قبل اللجنة المركزية الهولندية للتجارب على الحيوانات واللجنة رعاية الحيوان في جامعة المركز الطبي جرونينجن (NL). استخدمت كل من ويستار ولويس الفئران مع الأوزان ما بين 180 و 300 غرام.
1. السكن والتأقلم
- بعد وصوله إلى المرفق الحيوان المركزي والجرذان منزل في مجموعات من 5 في قفص. خلال فترة تأقلم لمدة 7 أيام، تعويد الفئران لمعالجة البشر، ولكن لا يتم تنفيذ أي إجراءات تجريبية.
2. إعداد وحقن معقمة Monocrotalin
- ل1 مل من 60 ملغ / مل monocrotalin (MCT) حل، تزن 60 ملغ من monocrotalin في أنبوب 2 مل. إضافة 700 ميكرولتر من كلوريد الصوديوم 0.9٪. إضافة 200 ميكرولتر من 1 M حمض الهيدروكلوريك. تدفئة الحل في أنبوب تحت ماء الحنفية الساخن ودوامة عليه. استخدام 6 N هيدروكسيد الصوديوم لجلب الرقم الهيدروجيني نحو 7.0. استخدام تقنية معقمة لإعداد MCT للحقن في القوارض.
- حقن 1 مل من معقم 60 ملغ / مل حل MCT للكيلوغرام الواحد تحت الجلد في الرقبة (0.3 مل من 60 ملغ / مل MCT ل300 غرام الفئران). ملاحظة: نحن نفضل عدم استخدام كميات أصغر بسبب فرصة أكبر أن جرعة حقن لن يكون مناسبا.
جراحة التحويلة 3. الأورطي-الأجوف
- تخدير.
- ملء غرفة الاستقراء مع 5٪ الأيزوفلورين / 100٪ O 2 (تدفق: 1 لتر / دقيقة) ووضع الفئران في الغرفة. تحقق من عمق كاف من التخدير عن طريق إجراء قرصة أخمص القدمين الخلفيتين. وزن الفئران.
- حلاقة وتنظيف البطن على مساحة أن ما يقرب من 8 سم و 3 سم. وضع فأر على ظهرها على حصيرة الحرارة (37 درجة مئوية) من قبل حصيرة معقمة تغطيتها.
- ضع خطم في التهوية قناع / غطاء محرك السيارة مع 2-3٪ الأيزوفلورين / 100٪ O 2 (تدفق: 1 لتر / دقيقة). تحقق من عمق التخدير عن طريق إجراء قرصة أخمص القدمين الخلفيتين. تطبيق مرهم العين لمنع جفاف بينما تحت التخدير.
- تحويلة سورجيري.
- فرك الجلد مع كلوريد hexidine للتطهير. حقن 0.01 ملغم / كغم البوبرينورفين تحت الجلد لتسكين الألم بعد العمليات الجراحية.
- استخدام أدوات معقمة لإجراء عملية جراحية. إجراء شق بشفرة مشرط رقم 10 في البطن في خط الوسط، اعتبارا من 1 سم تحت الحجاب الحاجز وتمتد إلى أسفل إلى ما فوق الأعضاء التناسلية.
- وترفع من الأمعاء مع مسحة القطن، وتغطي الأمعاء في والشاش الرطب معقم (0.9٪ كلوريد الصوديوم)، ووضعها على الجانب الأيسر من الحيوان.
- استخدام قطعة قطن لفصل الأغشية التي تربط الشريان الأورطي البطني والوريد الأجوف السفلي إلى الأنسجة المحيطة بها.
ملاحظة: لا تشريح الأغشية بين الشريان الأبهر والوريد الأجوف. - باستخدام ملقط المنشقة، وإزالة الدهون الأبهر ماحول الأوعية فقط فوق التشعب، فقط على الجانب الأيمن من الشريان الأورطي وفقط على موقع حيث سيتم إدخال الإبرة.
- استخدام قطعة قطن لفصل الشريان الأبهر والوريد الأجوف من 2 مم سوبrior إلى الموقع حيث سيتم إدخال الإبرة من أجل خلق مساحة للالمشبك Biemer.
- في هذا المجال، أولا وضع رباط فضفاضة (5-0 خياطة) حول الشريان الأورطي. خلق التوتر على ربطة طريق وضع المشبك كوشر على ذلك، ومن ثم وضع كوشر متفوقة على شق (الشكل 1A). وضع Biemer المشبك فقط متفوقة على ضمد (شملت رقم البريد 1A).
- باستخدام قطعة من القطن، ضغط الوريد الأجوف كما بشكل أقصى وقت ممكن لعرقلة تدفق (الشكل 1A). ينحني إبرة (18 G في هذا البروتوكول) في زاوية 45 درجة، حيث يشير فتحة نحو الخارج (الشكل 1A).
- في زاوية من 90 درجة، أدخل الإبرة في الشريان الأورطي، فقط فوق التشعب، مع فتحة لافتا الإبرة إلى اليسار (الشكل 1A). التلاعب في رأس الإبرة إلى اليسار وأدخله في الوريد الأجوف.
ملاحظة: الآن يجب أن يكون طرف الإبرة فيزيبلي في الوريد الأجوف (الشكل 1B). - استخدام قطعة من القطن الثانية لدفع الدم المتبقية في الشريان الأورطي من موقع الإدراج لمنع تجلط الدم. تجفيف المنطقة المحيطة ناور مع شاش معقم من أجل الغراء التمسك بشكل كاف.
- سحب الإبرة بأكملها من الشريان الأورطي وتطبيقه على الفور قطرة من الغراء الأنسجة على الموقع ثقب في الشريان الأورطي. تأكد من عدم الغراء مسحة القطن إلى الأنسجة. Unclamp الشريان الأورطي.
- التحقق من تحويلة يدويا عن طريق سحب على والافراج عن رباط على الداني الأبهر إلى تحويلة. تخفيف يجب تلوين القاصي الوريد الأجوف لتحويلة في أحمر وخلق الاضطراب في موقع تحويلة.
ملاحظة: سوف تشديد يتحول الدم في الوريد الأجوف إلى الأحمر الداكن. - وضع الأمعاء مرة أخرى في الحيوان. إغلاق طبقة العضلات والجلد مع resorbable 4-0 الغرز. تهوية الحيوان مع 100٪ O 2 للتعافي من التخدير.
ملاحظة: لا تترك العاني غير المراقب سوء حتى استعاد وعيه كافية للحفاظ على الاستلقاء القصية.
- جراحة صورية.
- تنفيذ كافة الإجراءات المذكورة أعلاه باستثناء إدخال الإبرة في الشريان الأورطي.
- الرعاية بعد الجراحة.
- وضع الفئران في قفص واحد وفي حاضنة عند 37 درجة مئوية حتى صباح اليوم التالي.
- حوالي 6 ساعات بعد الجراحة، وضخ 0.01 ملغم / كغم البوبرينورفين تحت الجلد لتسكين الألم بعد العمليات الجراحية. كرر في صباح اليوم التالي إذا تبين الفئران علامات الانزعاج.
ملاحظة: أول 3 أيام بعد الجراحة، والفئران تميل إلى أكل وشرب أقل (وهذا مهم بشكل خاص عند طعام أو مياه الشرب تختلط مع الأدوية). وتشير معظم الفئران السلوك العادي بعد 3 أيام من الجراحة. إذا لم يكن كذلك، ترصد عن كثب. يعتبر فقدان الوزن تزيد عن 15٪ في 1 أسبوع غير طبيعي، ويجب أن يتم التخلص من هذا القبيل الفئران عن طريق استخراج وتعميم حجم الدم في حين تحت التخدير.
"jove_title"> 4. تطوير الهيئة العامة للإسكان
ملاحظة: في هذا البروتوكول، والموت الرحيم للحيوان قبل استخراج تعميم حجم الدم في حين تحت التخدير.
- تضحية 1 يوم بعد الجراحة (MF8) لالاستجابات الخلوية والوظيفية في وقت مبكر لزيادة تدفق الدم الرئوي (على سبيل المثال، من الجين بنسبة التنظيم أو عوامل النسخ في وقت مبكر).
- تضحية 1 أسبوع بعد الجراحة (MF14) للمرحلة مبكرة، النمط الظاهري الهيئة العامة للإسكان الأوعية الدموية (تضخم وسطي بدون آفات neointimal).
- تضحية 2 أسابيع بعد الجراحة (MF21) لمراحل متقدمة من الهيئة العامة للإسكان الأوعية الدموية النمط الظاهري (ملحوظ تضخم وسطي وتشكيل neointimal) مع ارتفاع معتدل في RVP وmPAP.
- تضحية 3 أسابيع بعد الجراحة (MF28) لنهاية مرحلة الهيئة العامة للإسكان الأوعية الدموية النمط الظاهري (ملحوظ انسداد neointimal) والارتفاع القوي في RVP وmPAP. علامات سريرية للفشل البطين الأيمن شائعة في هذه المرحلة.
- التضحية بعد يوم 28 (MF-حمى الوادي المتصدع) عن فشل البطين الأيمن المصاحب الهيئة العامة للإسكان (حمى الوادي المتصدع)، الذي يعرف طبيا باسم ضيق التنفس والخمول الشديد، وفقدان الوزن (<10٪ في 1 أسبوع). إنهاء الفئران عند واحد من هذه العلامات موجودا. في كثير من الأحيان، الفئران تتطور هذه الأعراض بين أيام 28 و 35، وإذا تركت بدون حراسة، ويموت من تلقاء أنفسهم خلال هذه الفترة الزمنية.
5. حق القلب قسطرة
- تخدير.
- ملء غرفة الاستقراء مع 5٪ الأيزوفلورين / 100٪ O 2 (تدفق: 1 لتر / دقيقة) ووضع الفئران في المربع. تحقق من عمق كاف من التخدير عن طريق إجراء قرصة أخمص القدمين الخلفيتين. وزن الفئران.
- حلاقة وتنظيف الرقبة في الجانب الأيمن بطني من الفئران، وبالنسبة لبروتوكول تخطيط صدى القلب، والصدر والجزء العلوي من البطن.
- وضع فأر على ظهرها على حصيرة الحرارة (37 درجة مئوية) ووضع خطم في التهوية قناع / غطاء محرك السيارة مع 2-3٪ الأيزوفلورين / 100٪ O 2 (تدفق: 1 لتر / دقيقة). يجب أن تواجه الخطم نحو الباحثة.
- تحقق عمق التخدير. كن حذرا مع الفئران مع PH شديد. إذا يقلل من معدل ضربات القلب، والحد من عمق التخدير. الأفضل، أداء جميع القياسات في غضون 20 دقيقة. تطبيق مرهم العين لمنع جفاف بينما تحت التخدير.
- بروتوكول ضربات القلب.
- إجراء تخطيط صدى القلب وفقا لبروتوكول صفها بريتين وآخرون. في إن الرب 13.
- بروتوكول القسطرة.
ملاحظة: يستخدم هذا البروتوكول قنية جامدة مع طرف متشكلة عازمة 20 درجة لتوجيه 15 سم السيليكون القسطرة مع مم الكرة 2 من غيض. يتم استخدام إبرة 20 G مع فتحتها تميل قليلا إلى الداخل لإدراج قنية في الوريد الوداجي الأيمن (انظر قائمة المواد). الفئران في أي مرحلة من الهيئة العامة للإسكان التقدم والسيطرة يمكن أن تستخدم في هذا البروتوكول.- تطهير الرقبة مع كلوريد hexidine. جعل شق 1.5 سم بشفرة مشرط رقم 10 في الجانب الأيمن بطنيمن الرقبة، من الحق في عظمة الترقوة حتى العظم الفك السفلي.
- نشر النسيج باستخدام المقص. باستخدام الملقط، وسحب بلطف الأنسجة بعيدا حتى يظهر حبل الوريد. تشريح الأغشية حول حبل الوريد الوريد باستخدام الملقط منشقة.
- وضع التوتر على حبل الوريد عن طريق وضع رباط فضفاضة (5-0 خياطة) حول السفينة. زيادة التوتر والشريط ربطة على قناع التهوية (الشكل 2A).
- المصب من موقع الإدراج، ووضع رباط فضفاضة حول السفينة لتشديد بعد قنية هي في الموقع من أجل منع تسرب وفقدان الضغط.
- باستخدام مقابض ملقط، ينحني قليلا غيض من إبرة 20 G مع فتحة إلى الداخل لإجراء قنية مع القسطرة.
- إدخال رأس الإبرة 20-G في الوريد، وسرعان ما وضع قنية تحتوي على القسطرة داخل السفينة. سحب إبرة، ثم قم بإغلاق ضمدالتي أعدت في الخطوة 5.3.4.
- إجراء قنية تحتوي قسطرة في الوريد الوداجي. غيض من قنية هو في منحنى 20 درجة (راجع الخطوة 5.3.5). مناورة قنية تحت عظمة الترقوة وتقدم قليلا لدخول الأيمن الأذين (الشكل 2C).
- للدخول إلى البطين الأيمن، تشير غيض من قنية إلى اليسار، نحو القلب (الشكل 2D). على الشاشة السرير، يجب أن يظهر منحنى الضغط RV، مطابقة الشكل 2D.
- عندما منحنى الضغط RV هو ثابت، كتابة البطين الأيمن الانقباضي والانبساطي ضغط 1 (sRVP1 / dRVP1).
- التلاعب غيض من قنية إلى اليسار وإلى الأعلى. دفع القسطرة داخل قنية (الشكل 2E).
- دفع القسطرة في الشريان الرئوي الرئيسي (PA). يجب أن يشعر أي مقاومة عند تمرير الصمام الرئوي.
ملاحظة: عندما تدخل القسطرة في الشريان الرئوي الرئيسي، دوضغط iastolic يرتفع. على الشاشة السرير، يجب أن يظهر منحنى ضغط السلطة الفلسطينية، مطابقة الشكل 2E. - عندما منحنى الضغط السلطة الفلسطينية هو ثابت، كتابة الانقباضي، ضغط الدم الانبساطي، ويعني السلطة الفلسطينية ضغط 1 (sPAP1، dPAP1، mPAP1).
- مزيد من التقدم القسطرة داخل قنية حتى يحصل مثبتة على الكرة في طرف القسطرة في الشريان الرئوي. مراقبة منحنى الضغط على رصد انخفاض السرير وتتناسب مع منحنى الضغط إسفين في الشكل 2F.
- عندما منحنى الضغط إسفين هو ثابت، كتابة الانقباضي، ضغط الدم الانبساطي، ويعني الضغط إسفين.
- سحب القسطرة ببطء، وبعد ذلك قياس وكتابة القيم sPAP2، dPAP2، mPAP2، sRVP2، وdRVP2، كما هو معروض على الشاشة السرير.
- عندما تكون في RV، وسحب قليلا إلى الوراء قنية والقسطرة لقياس يعني الضغط الأذيني الأيمن (RAP). منحنى يجب أن يتطابق مع منحنى RAP في الشكل 2A.
لاالشركة المصرية للاتصالات: في هذا البروتوكول، والموت الرحيم الفئران بعد بروتوكول القسطرة عن طريق استخراج حجم الدورة الدموية في حين تحت التخدير.
6. تقييم الصرف وقياس الأشكال
ملاحظة: في هذا البروتوكول، والموت الرحيم للحيوان قبل استخراج تعميم حجم الدم في حين تحت التخدير. الفئران في أي مرحلة من الهيئة العامة للإسكان التقدم والسيطرة يمكن أن تستخدم في هذا البروتوكول.
- بعد التضحية، واخراج الرئتين عن طريق قطع القصبة الهوائية حوالي 5 مم فوق التشعب الشعب الهوائية والسفن التي تربط الرئتين إلى القلب. وضع الرئتين في المياه المالحة الباردة. تشريح الرئة اليسرى. قطع القصبة الرئيسية اليسار في التشعب.
- ملء حقنة 50 مل مع 4٪ لامتصاص العرق، ونعلق أنبوب مع قنية إلى الحقنة، وشنق الحقنة حوالي متر فوق طاولة العمل. تناسب قنية في القصبة الرئيسية اليسرى لملء سلبي الرئة مع امتصاص العرق.التعامل مع امتصاص العرق بحذر.
- احتضان الرئة اليسرى في امتصاص العرق لمدة 48 ساعة.
- يذوى الرئة اليسرى التي يحتضنها ذلك على التوالي في 70٪ من الإيثانول (1 ح)، و 80٪ من الإيثانول (1 ح)، و 90٪ من الإيثانول (ح 1)، و 100٪ من الإيثانول (3 ساعات)، زايلول (2 ح)، والبارافين ( 2 ساعة).
- تضمين الرئة اليسرى في البارافين، مع نقير الرئة التي تواجه كاسيت.
- وصمة عار على 4 ميكرومتر أقسام الرئة جزءا لا يتجزأ من البارافين باستخدام تلطيخ فيرهوف أو المرنة، فان Gieson، وفقا لتعليمات الشركة الصانعة 29. تأكد من أن صفيحة مرنة وتختلف أيضا (كما في الشكل 3). مسح أقسام الملون في 40X التكبير.
- تقسيم الرئة إلى 4 أجزاء. في كل رباعي، والعثور على 10 سفن التي يبلغ قطرها الخارجي <50 ميكرون (داخل عنيبية) و 10 السفن التي يبلغ قطرها الخارجي> 50 ميكرون (قبل عنيبية). التقاط صورة (2 × 40 صور في الرئة). تكبير عشوائيا حتى 20x التكبير وصورة كل سفينةفي هذا المجال من أجل الحد من التحيز في الاختيار.
- استبعاد السفن التي لديها أطول / أقصر نسبة قطر> 2، شكل دائري غير مكتمل، أو انهيار أكثر من ربع من جدار الوعاء الدموي.
ويرد مثال من سفينة مستبعدة في الشكل 3B جعل كل صورة على نفس التكبير (40X)، وتشمل شريط النطاق: ملاحظة. - فتح يماغيج والصورة الأولى. رسم خط مستقيم على شريط الحجم في الصورة لوضع جدول عبر "تحليل" و"تعيين نطاق واسع." ل"المسافة المعروفة"، استخدم القيمة على شريط نطاق والصورة. استخدام ميكرومتر (ميكرون) كوحدة للطول. تعيين المقياس إلى العالمية.
- باستخدام "التحديدات مرفوعة" رسم خط على الحدود الداخلية للمنطقة اللمعية (الشكل 3)، واستخدام "قياس" (CRTL م) لقياس هذا المجال. ثم، رسم خط حول ELAST الخارجيجيم الصفيحة (الشكل 3) لقياس منطقة السفينة الإجمالية.
- حساب اللمعية وقطرها الخارجي (
 ) باستخدام
) باستخدام  .
. - حساب سمك الجدار باستخدام
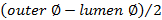 .
. - حساب نسبة الجدار / التجويف باستخدام
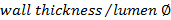 .
. - حساب درجة الانسداد باستخدام
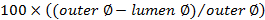 .
. - تسجيل السفينة على muscularization (لا، muscularization الجزئية أو الكلية) (الشكل 3B).
يتم تعريف سفن مع الصفيحة المرنة مزدوجة لأكثر من نصف محيط الدائرة كما muscularized تماما: ملاحظة. يتم تعريف السفن مع الصفيحة المرنة مزدوجة أقل من نصف محيط الدائرة كما muscularized جزئيا. - تسجيل السفينة على وجود neointima (نعم أو لا) (الشكل 3C).
يتم تعريف سفن بدون رقيقة داخلية محددة بوضوح جنبا إلى جنب مع (وغالبا ما غريب الأطوار) اللمعية انسداد كما الآفات neointimal: ملاحظة.
النتائج
يتم عرض نتائج ممثلة في الشكل (4). تظهر النتائج المقدمة خصائص MCT + FLOW في الفئران لويس في المجموعات التالية: التحكم (ن = 3)، MF8 (ن = 5)، MF14 (ن = 5)، MF28 (ن = 5)، وMF-حمى الوادي المتصدع ( ن = 10). وأجريت التحليلات الإحصائية باستخدام في اتجاه واحد أنوفا مع تصحيح بو?...
Discussion
ويصف هذه الطريقة العملية الجراحية لتحويلة الأورطيه- الأجوف في الفئران قبل المعاملة مع MCT إلى إنشاء الهيئة العامة للإسكان التي يسببها تدفق والتقنيات لتقييم الدورة الدموية مبدأ ونقطة نهاية النسيجية المرضية التي تميز الهيئة العامة للإسكان وهذا النموذج.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This study was supported by the Netherlands Cardiovascular Research Initiative, the Dutch Heart Foundation, the Dutch Federation of University Medical Centers, the Netherlands Organization for Health Research and Development, and the Royal Netherlands Academy of Sciences (CVON nr. 2012-08, PHAEDRA, The Sebald fund, Stichting Hartekind).
Materials
| Name | Company | Catalog Number | Comments |
| Shunt Surgery | |||
| Sterile surgical gloves | |||
| Duratears Eye ointment | Alcon | 10380 | |
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Histoacryllic tissue glue | B. Braun Medical | 1050052 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Safil 4-0 sutures violet resorbable | B. Braun Medical | ||
| 18 G needle | Luer | NN1838R BD | tip bent in 45 degrees orifice to the outside |
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Temgesic Buprenorphine | RB Pharmaceuticals | 5429 | subcutaneous injection |
| Sodium Chloride 0.9% | |||
| Ventilation mask Rat | |||
| Scalple blade | |||
| Biemer clamp 18 mm, 5 mm opening | AgnTho | 64-562 | |
| Heat mat | |||
| Kocher Clamp | |||
| Shaving machine | |||
| Microscope | Leica | ||
| Right Heart Catheterization | |||
| Sterile surgical gloves | |||
| Eye ointment | Duratears | ||
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Needle 20 G | Luer | Tip slightly bent to the inside | |
| Cannula 20 G | Luer | to introduce catheter, tip pre-formed in 20 degrees | |
| Silastic Catheter 15 cm long | 0.5 mm ball 2 mm from tip | ||
| Pressure transducer | Ailtech | ||
| Bedside monitor Cardiocap/5 | Datex-Ohmeda | ||
| Shaving machine | |||
| 10 mL Syringe | |||
| Sodium Chloride 0.9% | for flushing | ||
| Vascular Morphology | |||
| 50 mL Syringe | |||
| 4% Formaldehyde | |||
| 18 G cannula with tube | |||
| Verhoef staining kit | Sigma-Aldrich | HT254 | http://www.sigmaaldrich.com/catalog/product/sigma/ht254?lang=en®ion=US |
| Digital slide scanner | Hamamatsu | C9600 | |
| ImageJ | |||
| Elastic (Connective Tissue Stain) | Abcam | ab150667 | http://www.abcam.com/elastic-connective-tissue-stain-ab150667.html http://www.abcam.com/ps/products/150/ab150667/documents/ab150667-Elastic%20Stain%20Kit%20(website).pdf |
References
- Hoeper, M. M., Bogaard, H. J., Condliffe, R., et al. Definitions and diagnosis of pulmonary hypertension. J Am Coll Cardiol. 62, D42-D50 (2013).
- Stacher, E., Graham, B. B., Hunt, J. M., et al. Modern age pathology of pulmonary arterial hypertension. Am J Respir Crit Care Med. 186 (3), 261-272 (2012).
- Levy, M., Maurey, C., Celermajer, D. S., et al. Impaired apoptosis of pulmonary endothelial cells is associated with intimal proliferation and irreversibility of pulmonary hypertension in congenital heart disease. J Am Coll Cardiol. 49 (7), 803-810 (2007).
- Sakao, S., Tatsumi, K., Voelkel, N. F. Reversible or irreversible remodeling in pulmonary arterial hypertension. Am J Respir Cell Mol Biol. 43 (6), 629-634 (2010).
- Gomez-Arroyo, J. G., Farkas, L., Alhussaini, A. A., et al. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 302 (4), L363-L369 (2012).
- Jones, J. E. Serial noninvasive assessment of progressive pulmonary hypertension in a rat model. Am J Physiol - Heart Circ Physiol. 283 (1), 364-371 (2002).
- Hoffman, J. I., Rudolph, A. M., Heymann, M. A. Pulmonary vascular disease with congenital heart lesions: Pathologic features and causes. Circulation. 64 (5), 873-877 (1981).
- van Albada, M. E., Berger, R. M. Pulmonary arterial hypertension in congenital cardiac disease--the need for refinement of the evian-venice classification. Cardiol Young. 18 (1), 10-17 (2008).
- Dickinson, M. G., Bartelds, B., Borgdorff, M. A., Berger, R. M. The role of disturbed blood flow in the development of pulmonary arterial hypertension: Lessons from preclinical animal models. Am J Physiol Lung Cell Mol Physiol. 305 (1), L1-L14 (2013).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovasc Res. 24 (5), 430-432 (1990).
- Okada, K., Tanaka, Y., Bernstein, M., Zhang, W., Patterson, G. A., Botney, M. D. Pulmonary hemodynamics modify the rat pulmonary artery response to injury. A neointimal model of pulmonary hypertension. Am J Pathol. 151 (4), 1019-1025 (1997).
- van Albada, M. E., Schoemaker, R. G., Kemna, M. S., Cromme-Dijkhuis, A. H., van Veghel, R., Berger, R. M. The role of increased pulmonary blood flow in pulmonary arterial hypertension. Eur Respir J. 26 (3), 487-493 (2005).
- Brittain, E. Echocardiographic assessment of the right heart in mice. JVis Exp. (e81), (2013).
- Dickinson, M. G., Bartelds, B., Molema, G., et al. Egr-1 expression during neointimal development in flow-associated pulmonary hypertension. Am J Pathol. 179 (5), 2199-2209 (2011).
- Borgdorff, M. A., Bartelds, B., Dickinson, M. G., Steendijk, P., de Vroomen, M., Berger, R. M. Distinct loading conditions reveal various patterns of right ventricular adaptation. Am J Physiol Heart Circ Physiol. 305 (3), H354-H364 (2013).
- Ruiter, G., de Man, F. S., Schalij, I., et al. Reversibility of the monocrotaline pulmonary hypertension rat model. Eur Respir J. 42 (2), 553-556 (2013).
- van Albada, M. E., Bartelds, B., Wijnberg, H., et al. Gene expression profile in flow-associated pulmonary arterial hypertension with neointimal lesions. Am J Physiol Lung Cell Mol Physiol. 298 (4), L483-L491 (2010).
- Dickinson, M. G., Kowalski, P. S., Bartelds, B., et al. A critical role for egr-1 during vascular remodelling in pulmonary arterial hypertension. Cardiovasc Res. 103 (4), 573-584 (2014).
- van der Feen, D. E., Dickinson, M. G., Bartelds, M. G., et al. Egr-1 identifies neointimal remodeling and relates to progression in human pulmonary arterial hypertension. Jheart lung transplant. 35 (4), 481-490 (2016).
- Rungatscher, A. Chronic overcirculation-induced pulmonary arterial hypertension in aorto-caval shunt. Microvasc Res. 94, 73-79 (2014).
- O'Blenes, S. B., Fischer, S., McIntyre, B., Keshavjee, S., Rabinovitch, M. Hemodynamic unloading leads to regression of pulmonary vascular disease in rats. J Thorac Cardiovasc Surg. 121 (2), 279-289 (2001).
- Sakao, S., Taraseviciene-Stewart, L., Lee, J. D., Wood, K., Cool, C. D., Voelkel, N. F. Initial apoptosis is followed by increased proliferation of apoptosis-resistant endothelial cells. FASEB J. 19 (9), 1178-1180 (2005).
- Spiekerkoetter, E. FK506 activates BMPR2, rescues endothelial dysfunction, and reverses pulmonary hypertension. J Clin Invest. 123 (8), 3600-3613 (2013).
- Nickel, N. P., Spiekerkoetter, E., Gu, M., et al. Elafin reverses pulmonary hypertension via caveolin-1-dependent bone morphogenetic protein signaling. Am J Respir Crit Care Med. 191 (11), 1273-1286 (2015).
- Meloche, J., Potus, F., Vaillancourt, M., et al. Bromodomain-containing protein 4: The epigenetic origin of pulmonary arterial hypertension. Circ Res. 117 (6), 525-535 (2015).
- Happé, C. M. Pneumonectomy combined with SU5416 induces severe pulmonary hypertension in rats. Am J Physiol Lung Cell Mol Physiol. 310 (11), L1088-L1097 (2016).
- Ranchoux, B., Antigny, F., Rucker-Martin, C., et al. Endothelial-to-mesenchymal transition in pulmonary hypertension. Circulation. 131 (11), 1006-1018 (2015).
- de Raaf, M. A. SuHx rat model: Partly reversible pulmonary hypertension and progressive intima obstruction. Eur Respy J. 44 (1), 160-168 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved