Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La cirugía de derivación, un cateterismo derecho, y Vascular Morfometría en un modelo de rata de flujo inducido por la hipertensión arterial pulmonar
En este artículo
Resumen
This protocol describes a surgical procedure to create a model for flow-induced pulmonary arterial hypertension (PAH) in rats and the procedures to analyze the principle hemodynamic and histological end-points in this model.
Resumen
In this protocol, PAH is induced by combining a 60 mg/kg monocrotalin (MCT) injection with increased pulmonary blood flow through an aorto-caval shunt (MCT+Flow). The shunt is created by inserting an 18-G needle from the abdominal aorta into the adjacent caval vein. Increased pulmonary flow has been demonstrated as an essential trigger for a severe form of PAH with distinct phases of disease progression, characterized by early medial hypertrophy followed by neointimal lesions and the progressive occlusion of the small pulmonary vessels. To measure the right heart and pulmonary hemodynamics in this model, right heart catheterization is performed by inserting a rigid cannula containing a flexible ball-tip catheter via the right jugular vein into the right ventricle. The catheter is then advanced into the main and the more distal pulmonary arteries. The histopathology of the pulmonary vasculature is assessed qualitatively, by scoring the pre- and intra-acinar vessels on the degree of muscularization and the presence of a neointima, and quantitatively, by measuring the wall thickness, the wall-lumen ratios, and the occlusion score.
Introducción
El objetivo de este método es para crear un modelo reproducible para la hipertensión arterial pulmonar grave, inducida por el flujo en ratas y para medir su principio hemodinámica y puntos finales histopatológicos.
La hipertensión arterial pulmonar (HAP) es un síndrome clínico que abarca un aumento progresivo de la resistencia vascular pulmonar que lleva a insuficiencia ventricular derecha y la muerte. Dentro del espectro de la enfermedad de orden superior de las enfermedades hipertensivas pulmonar (HP), HAP es la forma más grave y uno que se queda sin una cura 1. La arteriopatía subyacente en la HAP se caracteriza por una forma típica de la remodelación vascular que ocluye la luz del vaso. Muscularization de buques no muscularized normales y la hipertrofia de la capa de vasos medial son considerados como fenómenos iniciales de la enfermedad en la HAP, se observan también en otras formas de HP 2, y se cree que son reversibles 3. Como un HAPVANCES, la capa íntima comienza a remodelar, formando lesiones característicos de la neoíntima 2. De tipo neointimal remodelación vascular pulmonar es exclusivo de HAP y en la actualidad es considerado como irreversible 4.
Dado que los HAP es una enfermedad rara, los avances en su comprensión patobiológico y el desarrollo de nuevas terapias se han basado en gran medida en modelos animales. El modelo monocrotalin (MCT) en ratas es un modelo simple golpe solo que ha sido, y todavía es, utiliza con frecuencia. MCT es una toxina que causa daño a las arteriolas pulmonares y la inflamación regional 5. 60 mg / kg MCT conduce a un aumento en la presión arterial pulmonar media (PAPm), resistencia vascular pulmonar (PVR) y la hipertrofia ventricular derecha (RVH) después de 3 - 4 semanas 6. La histomorfología se caracteriza por hipertrofia de la media aislada y sin lesiones neoíntima 5. El MCTpor lo tanto modelo de rata representa una forma moderada de PH, y no PAH, aunque se presenta comúnmente como el último.
En los niños con HAP asociada a una derivación congénita de izquierda a derecha (HAP-CPC), el aumento del flujo sanguíneo pulmonar es considerado como el desencadenante esencial para el desarrollo de lesiones de la neoíntima 7, 8, 9. En ratas, el aumento de flujo sanguíneo pulmonar puede ser inducida por la creación de una derivación entre la aorta abdominal y la vena cava, una técnica descrita por primera vez en 1990 10. Alternativas para crear un aumento del flujo pulmonar son por neumonectomía unilateral o por subclavia para anastomosis de la arteria pulmonar 11. desventajas conceptuales de estos modelos consisten en el potencial de crecimiento compensatorio del pulmón restante y activación de la vía de adaptación inducida por la neumonectomía, o de lesión iatrogénica de la vasculatura pulmonar debidapara la anastomosis de la arteria pulmonar, tanto confundiendo a los efectos del aumento del flujo sanguíneo pulmonar.
Cuando se crea una derivación aorto-cava y un aumento del flujo sanguíneo pulmonar es inducida como un segundo golpe en ratas MCT-tratada, se producen lesiones de la neoíntima característicos, y una forma grave de la HAP y la insuficiencia ventricular derecha asociada (FVR) se desarrollan entre 3 semanas después de que el aumento flujo 12. La progresión hemodinámica de HAP en este modelo se puede evaluar in vivo mediante ecocardiografía y cateterismo cardíaco derecho. La histomorfología vascular, grosor de la pared del vaso, grado de oclusión de las arteriolas, y los parámetros para el fallo del ventrículo derecho forman los pilares de la caracterización ex vivo de la HAP.
Este método describe protocolos detallados para la cirugía de derivación aorto-cava (AC-shunt), el cateterismo derecho, y la evaluación cualitativa y cuantitativa de histomorfología vascular.
Protocolo
Los procedimientos que implican sujetos animales han sido aprobados por el Comité Central de Holanda para la Experimentación Animal y el Comité de Cuidado de Animales de la Universidad del Centro Médico de Groningen (Países Bajos). Se utilizaron ratas Wistar y ambos Lewis con pesos entre 180 y 300 g.
1. Vivienda y aclimatación
- Después de la llegada a la instalación central de los animales, las ratas de las casas en grupos de 5 por jaula. Durante un período de aclimatación de 7 días, las ratas acostumbrar a la manipulación humana, pero no realice ningún procedimiento experimental.
2. Preparación y la inyección de estéril Monocrotalin
- Para 1 ml de 60 mg / mL monocrotalin (MCT) solución, pesar 60 mg de monocrotalin en un tubo de 2 ml. Añadir 700 l de 0,9% de NaCl. Añadir 200 l de HCl 1M. Calentar la solución en el tubo bajo agua del grifo corriente caliente y agitar él. Usar NaOH 6 N para llevar el pH hacia 7,0. Utilice una técnica estéril para la preparación de la PCM para su inyección en los roedores.
- Inyectar 1 ml de solución estéril ml 60 mg / MCT por kg por vía subcutánea en el cuello (0,3 ml de 60 mg / ml para un MCT 300-g rata). NOTA: No prefiero usar volúmenes más pequeños debido a la mayor probabilidad de que la dosis inyectada, no será apropiado.
La cirugía de derivación 3. aorta-vena cava
- Anestesia.
- Llenar la cámara de inducción con isoflurano 5% / 100% de O2 (caudal: 1 L / min) y colocar la rata en la cámara. Compruebe si hay una adecuada profundidad de la anestesia mediante la realización de una pizca dedo del pie trasero. Pesar la rata.
- Afeitarse y limpiar el abdomen sobre un área que es de aproximadamente 8 cm de largo y 3 cm de ancho. Coloque la rata en su espalda sobre una estera de calor (37 ° C) cubierto por una estera estéril.
- Coloque el hocico en una ventilación de la máscara / capucha con 2 - 3% de isoflurano / O2 al 100% (flujo: 1 L / min). Comprobar la profundidad de la anestesia mediante la realización de una pizca dedo del pie trasero. Aplicar ungüento para los ojos para evitar la sequedad, mientras que bajo anestesia.
- shunt SurGery.
- Frote la piel con cloruro-hexidine para la desinfección. Inyectar 0,01 mg / kg de buprenorfina por vía subcutánea para la analgesia postoperatoria.
- Utilizar instrumentos estériles para la cirugía. Hacer una incisión con una hoja de bisturí # 10 en el abdomen en la línea media, a partir de 1 cm por debajo del diafragma una se extiende hasta justo por encima de los genitales.
- Levante el intestino grueso con un hisopo de algodón, cubrir los intestinos en una gasa estéril y húmedo (0,9% NaCl), y colocarlos en el lado izquierdo del animal.
- Use hisopos de algodón para separar las membranas que unen la aorta abdominal y la vena cava inferior a los tejidos circundantes.
NOTA: No diseccionar las membranas entre la aorta y la vena cava. - El uso de pinzas en astilla, eliminar la grasa perivascular aorta justo por encima de la bifurcación, sólo en el lado derecho de la aorta y sólo en el sitio donde se insertará la aguja.
- Use hisopos de algodón para separar la aorta y la vena cava de 2 mm superior al lugar donde se insertará la aguja con el fin de crear espacio para una abrazadera Biemer.
- En esta área, colocar primero una ligadura floja (5-0 sutura) alrededor de la aorta. Crear tensión en la ligadura mediante la colocación de una pinza de Kocher en él, y luego colocar el Kocher superior a la incisión (Figura 1A). Coloque la abrazadera Biemer justo por encima de la ligadura (Figur e 1A).
- El uso de un hisopo de algodón, comprimir la vena cava lo más distante posible para obstruir el flujo (Figura 1A). Curva una aguja (18 G en este protocolo) en un ángulo de 45 grados, con el señalador orificio hacia el exterior (Figura 1A).
- En un ángulo de 90 grados, insertar la aguja en la aorta, justo por encima de la bifurcación, con el orificio de la aguja apuntando hacia la izquierda (Figura 1 A). Manipular la punta de la aguja hacia la izquierda y la inserta en la vena cava.
NOTA: La punta de la aguja debe ser ahora visible en la vena cava (Figura 1B). - Use un segundo hisopo de algodón para empujar la sangre que queda en la aorta de la zona de inserción para prevenir la trombosis. Se seca el área alrededor de la derivación con una gasa estéril para que el pegamento se adhiera adecuadamente.
- Tire toda la aguja de la aorta y aplicar inmediatamente una gota de pegamento de tejidos en el sitio de punción en la aorta. Asegúrese de no pegar el hisopo de algodón para el tejido. Desembridar la aorta.
- Verificar la derivación manualmente tirando y soltando la ligadura en la aorta proximal a la derivación. Aflojamiento debe de color y la parte distal de la vena cava a la derivación en rojo brillante y crear una turbulencia en el lugar de la derivación.
NOTA: El apriete a su vez, la sangre en la vena cava de nuevo a rojo oscuro. - Coloque los intestinos de nuevo en el animal. Cierre la capa muscular y la piel con suturas reabsorbibles 4-0. Ventilar el animal con 100% de O 2 para recuperarse de la anestesia.
NOTA: No deje un aniMal desatendida hasta que se haya recuperado el conocimiento suficiente para mantener decúbito esternal.
- La cirugía simulada.
- Realizar todos los procedimientos anteriores a excepción de la inserción de la aguja en la aorta.
- El cuidado post-quirúrgico.
- Coloque la rata en una jaula individual y en una incubadora a 37 ° C hasta la mañana siguiente.
- Alrededor de las 6 h después de la cirugía, se inyectan 0,01 mg / kg de buprenorfina por vía subcutánea para la analgesia postoperatoria. Repetir la mañana siguiente si la rata muestra signos de malestar.
NOTA: Los primeros 3 días después de la cirugía, las ratas tienden a comer y beber menos (esto es particularmente importante cuando pienso o agua potable se mezclan con las drogas). La mayoría de las ratas muestran un comportamiento normal de 3 días después de la cirugía. Si no es así, seguir de cerca. La pérdida de peso superior al 15% en 1 semana se considera anormal, y tales ratas debe ser sacrificado por la extracción del volumen de sangre circulante, mientras que bajo anestesia.
4. Desarrollo de HAP
NOTA: En este protocolo, el animal es sacrificado por la extracción del volumen de sangre circulante, mientras que bajo anestesia.
- Sacrificio 1 día después de la cirugía (MF8) para las primeras respuestas celulares y funcionales a un aumento del flujo sanguíneo pulmonar (por ejemplo, el gen de la regulación o de factores de transcripción temprana).
- Sacrificio de 1 semana después de la cirugía (MF14) para un fenotipo vascular HAP en estadio temprano (hipertrofia de la media de la neoíntima sin lesiones).
- Sacrificar a 2 semanas después de la cirugía (MF21) para un fenotipo vascular HAP en estadio avanzado (marcada hipertrofia de la media y la formación neointimal) con elevación leve de la RVP y la PAP media.
- Sacrificar a 3 semanas después de la cirugía (MF28) para un fenotipo vascular HAP en etapa terminal (marcado oclusión neointimal) y elevación fuerte en la RVP y la PAP media. Los signos clínicos de insuficiencia ventricular derecha son comunes en esta etapa.
- Sacrificio a día 28 (MF-FVR) Para la insuficiencia ventricular derecha HAP asociada (FVR), clínicamente definida como la disnea, letargo grave, y la pérdida de peso (<10% en 1 semana). Terminar ratas cuando está presente una de estas señales. Con frecuencia, las ratas desarrollan estos síntomas entre los días 28 y 35 y, si se deja sin vigilancia, mueren de forma espontánea durante este intervalo de tiempo.
5. La cateterización cardiaca derecha
- Anestesia.
- Llenar la cámara de inducción con isoflurano 5% / 100% de O2 (caudal: 1 L / min) y colocar la rata en la caja. Compruebe si hay una adecuada profundidad de la anestesia mediante la realización de una pizca dedo del pie trasero. Pesar la rata.
- Afeitado y limpiar el cuello en el lado derecho-ventral de la rata y, para el protocolo de la ecocardiografía, el tórax y el abdomen superior.
- Coloque la rata en su espalda sobre una estera de calor (37 ° C) y coloque el hocico en una ventilación de la máscara / capucha con 2 - 3% de isoflurano / O2 al 100% (flujo: 1 L / min). El hocico debe ser enfrentado hacia el investigador.
- Comprobar la profundidad de la anestesia. Tenga cuidado con las ratas con HP severa. Si la frecuencia cardíaca disminuye, reducir la profundidad de la anestesia. Preferible, realizar todas las mediciones dentro de los 20 min. Aplicar ungüento para los ojos para evitar la sequedad, mientras que bajo anestesia.
- protocolo de Ecocardiografía.
- Realizar la ecocardiografía de acuerdo con el protocolo descrito por Brittain et al. en JoVe 13.
- protocolo de cateterismo.
NOTA: Este protocolo utiliza una cánula rígida con una punta preformada inclinó 20 grados para guiar el catéter de silicio 15-cm con una bola de 2 mm de la punta. Una aguja de 20 G con su orificio ligeramente doblada hacia el interior se utiliza para insertar la cánula en la vena yugular derecha (ver la lista de materiales). Ratas en cualquier fase de la progresión y control PAH pueden ser utilizados en este protocolo.- Desinfectar el cuello con cloruro-hexidine. Se practica una incisión de 1,5 cm con una hoja de bisturí # 10 en el lado derecho ventraldel cuello, desde la clavícula hasta el hueso mandibular.
- Difundir el tejido usando tijeras. Con unas pinzas, tire suavemente el tejido aparte hasta que aparezca la vena yugular. Diseccionar las membranas que rodean el uso de fórceps vena yugular en astilla.
- Ponga la tensión en la vena yugular mediante la colocación de una ligadura floja (5-0 sutura) alrededor del vaso. Aumentar la tensión y la cinta de la ligadura en la máscara de ventilación (Figura 2A).
- Aguas abajo del sitio de inserción, coloque una ligadura floja alrededor del recipiente para apretar después de la cánula está en situ con el fin de evitar las fugas y la pérdida de presión.
- El uso de las asas de un fórceps, doblar ligeramente la punta de una aguja 20-G con el orificio en el interior para llevar a cabo la cánula con el catéter.
- Introducir la punta de la aguja 20-G en la vena y colocar rápidamente la cánula que contiene el catéter dentro del vaso. Retirar la aguja, y luego cierre la ligaduraque se preparó en el paso 5.3.4.
- Llevar a cabo la cánula que contiene el catéter en la vena yugular. La punta de la cánula se encuentra en una curva de 20 grados (véase la etapa 5.3.5). Maniobra de la cánula debajo de la clavícula y avanzar un poco para entrar en la aurícula derecha (Figura 2C).
- Para entrar en el ventrículo derecho, apunte la punta de la cánula hacia la izquierda, hacia el corazón (Figura 2D). En el monitor de cabecera, una curva de presión del VD debería aparecer, haciendo coincidir la figura 2D.
- Cuando la curva de presión del VD es constante, anote la presión ventricular derecha sistólica y diastólica 1 (sRVP1 / dRVP1).
- Manipular la punta de la cánula hacia la izquierda y hacia arriba. Avanzar el catéter dentro de la cánula (Figura 2E).
- Avanzar el catéter en la arteria pulmonar principal (PA). No hay resistencia se debe sentir cuando se pasa de la válvula pulmonar.
NOTA: Cuando el catéter entra en la arteria pulmonar principal, el diastolic presión aumentará. En el monitor de cabecera, una curva de presión de la AP debería aparecer, haciendo coincidir la figura 2E. - Cuando la curva de presión de la AP es constante, anote la presión sistólica, diastólica y media presión de la AP 1 (sPAP1, dPAP1, mPAP1).
- seguir avanzando en el catéter dentro de la cánula hasta que la bola en la punta del catéter queda atrapado en una arteria pulmonar. Observar la evolución de la presión en la caída de monitor de cabecera y que coincida con la curva de la presión de enclavamiento en la Figura 2F.
- Cuando la curva de presión de enclavamiento es constante, anote la presión sistólica, diastólica y la presión de enclavamiento significar.
- Tire hacia atrás del catéter lentamente y, posteriormente, medir y anotar los valores de sPAP2, dPAP2, mPAP2, sRVP2, y dRVP2, como se muestra en el monitor de cabecera.
- Cuando en el RV, ligeramente tirar de la cánula y el catéter para medir la presión auricular derecha (RAP) significa. La curva debe coincidir con la curva de RAP en la figura 2A.
NOTE: En este protocolo, las ratas son sacrificados después de que el protocolo de cateterismo por la extracción del volumen de sangre circulante, mientras que bajo anestesia.
6. Evaluación de la morfología y morfometría
NOTA: En este protocolo, el animal es sacrificado por la extracción del volumen de sangre circulante, mientras que bajo anestesia. Ratas en cualquier fase de la progresión y control PAH pueden ser utilizados en este protocolo.
- Después del sacrificio, sacar a los pulmones mediante la reducción de la tráquea de unos 5 mm por encima de la bifurcación bronquial y los vasos que conectan los pulmones al corazón. Ponga los pulmones en solución salina fría. Diseccionar el pulmón izquierdo. Cortar el bronquio principal izquierdo en la bifurcación.
- Llene una jeringa de 50 ml con paraformaldehído al 4%, colocar un tubo con una cánula de la jeringa, y colgar la jeringa cerca de un metro por encima de la mesa de trabajo. Montar la cánula en el bronquio principal izquierdo para llenar los pulmones de forma pasiva con paraformaldehído.Paraformaldehído manejar con precaución.
- Incubar el pulmón izquierdo en paraformaldehído durante 48 h.
- Deshidratar el pulmón izquierdo incubándola consecutivamente en 70% de etanol (1 h), 80% de etanol (1 h), 90% de etanol (1 h), 100% de etanol (3 h), xilol (2 h), y la parafina ( 2 h).
- Incrustar el pulmón izquierdo en parafina, con el hilio del pulmón frente a la casete.
- Manchar las secciones de pulmón, de 4 micras incluidos en parafina utilizando una tinción de Verhoeff o Elastica-van Gieson, según las instrucciones del fabricante 29. Asegúrese de que la láminas elásticas son bien diferenciado (como en la figura 3). Analiza las secciones teñidas con un aumento de 40X.
- Divida el pulmón en 4 cuadrantes. En cada cuadrante, encontrar 10 buques con un diámetro exterior <50 micras (intra-acinares) y 10 buques con un diámetro exterior> 50 micras (pre-acinares). Tome una fotografía (2 x 40 cuadros por pulmón). Acercar al azar hasta 20 aumentos y fotografiar todos los buquesen este campo de visión para minimizar el sesgo de selección.
- Excluir vasos que tienen una relación de más largo / más corto de diámetro> 2, una forma circular incompleta, o un colapso de más de un cuarto de la pared del vaso.
NOTA: Un ejemplo de un recipiente de excluidos se muestra en la Figura 3b Haga que cada imagen en el mismo aumento (40X) e incluyen una barra de escala. - ImageJ abierta y la primera imagen. Dibujar una línea recta en la barra de escala en la imagen para establecer la escala a través de "Analyse" y "escala establecida." Por "distancia conocida," utilizar el valor de la barra de escala de la imagen. Utilice micrómetros (micras) como la unidad de longitud. Establecer la escala a lo global.
- El uso de "selecciones a mano alzada" dibujar una línea en el borde interior del área luminal (Figura 3), y el uso de "medir" (Ctrl m) para medir esta área. A continuación, dibuje una línea alrededor del exterior elastic lámina (Figura 3) para medir el área total del vaso.
- Calcular el luminal y el diámetro exterior (
 ) utilizando
) utilizando  .
. - Calcular el espesor de pared usando
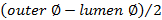 .
. - Se calcula la relación pared / luz usando
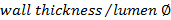 .
. - Se calcula la puntuación de la oclusión utilizando
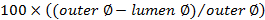 .
. - Puntuación del buque en muscularization (no, muscularization parcial o total) (Figura 3B).
NOTA: Los buques con una lámina elástica doble para más de la mitad de la circunferencia se definen como totalmente muscularized. Los buques con una lámina elástica doble menos de la mitad de la circunferencia se definen como parte muscularized. - Puntuación del buque en la presencia de un NeoiNtima (sí o no) (Figura 3C).
NOTA: Embarcaciones sin una lámina elástica interna claramente definida combinado con oclusión (a menudo excéntrica) luminal se definen como lesiones de la neoíntima.
Resultados
Los resultados representativos se presentan en la Figura 4. Los resultados presentados muestran características de MCT + FLOW en ratas Lewis en los siguientes grupos: control (n = 3), mf8 (n = 5), MF14 (n = 5), MF28 (n = 5), y MF-RVF ( n = 10). Los análisis estadísticos se realizaron utilizando el ANOVA de una vía con corrección de Bonferroni.
60 mg / kg MCT y aumentó la ventaja del flujo sanguíneo pulm...
Discusión
Este método describe el procedimiento quirúrgico de una derivación aorto-cava en ratas pre-tratados con MCT para crear PAH inducida por el flujo y las técnicas para evaluar el principio hemodinámica y puntos finales histopatológicos que caracterizan PAH y este modelo.
Los pasos críticos dentro del Protocolo y solución de problemas
La cirugía y posterior a la cirugía. Durante la cirugía de derivación aorto-cava, el paso más crítico es la disección de l...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This study was supported by the Netherlands Cardiovascular Research Initiative, the Dutch Heart Foundation, the Dutch Federation of University Medical Centers, the Netherlands Organization for Health Research and Development, and the Royal Netherlands Academy of Sciences (CVON nr. 2012-08, PHAEDRA, The Sebald fund, Stichting Hartekind).
Materiales
| Name | Company | Catalog Number | Comments |
| Shunt Surgery | |||
| Sterile surgical gloves | |||
| Duratears Eye ointment | Alcon | 10380 | |
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Histoacryllic tissue glue | B. Braun Medical | 1050052 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Safil 4-0 sutures violet resorbable | B. Braun Medical | ||
| 18 G needle | Luer | NN1838R BD | tip bent in 45 degrees orifice to the outside |
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Temgesic Buprenorphine | RB Pharmaceuticals | 5429 | subcutaneous injection |
| Sodium Chloride 0.9% | |||
| Ventilation mask Rat | |||
| Scalple blade | |||
| Biemer clamp 18 mm, 5 mm opening | AgnTho | 64-562 | |
| Heat mat | |||
| Kocher Clamp | |||
| Shaving machine | |||
| Microscope | Leica | ||
| Right Heart Catheterization | |||
| Sterile surgical gloves | |||
| Eye ointment | Duratears | ||
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Needle 20 G | Luer | Tip slightly bent to the inside | |
| Cannula 20 G | Luer | to introduce catheter, tip pre-formed in 20 degrees | |
| Silastic Catheter 15 cm long | 0.5 mm ball 2 mm from tip | ||
| Pressure transducer | Ailtech | ||
| Bedside monitor Cardiocap/5 | Datex-Ohmeda | ||
| Shaving machine | |||
| 10 mL Syringe | |||
| Sodium Chloride 0.9% | for flushing | ||
| Vascular Morphology | |||
| 50 mL Syringe | |||
| 4% Formaldehyde | |||
| 18 G cannula with tube | |||
| Verhoef staining kit | Sigma-Aldrich | HT254 | http://www.sigmaaldrich.com/catalog/product/sigma/ht254?lang=en®ion=US |
| Digital slide scanner | Hamamatsu | C9600 | |
| ImageJ | |||
| Elastic (Connective Tissue Stain) | Abcam | ab150667 | http://www.abcam.com/elastic-connective-tissue-stain-ab150667.html http://www.abcam.com/ps/products/150/ab150667/documents/ab150667-Elastic%20Stain%20Kit%20(website).pdf |
Referencias
- Hoeper, M. M., Bogaard, H. J., Condliffe, R., et al. Definitions and diagnosis of pulmonary hypertension. J Am Coll Cardiol. 62, D42-D50 (2013).
- Stacher, E., Graham, B. B., Hunt, J. M., et al. Modern age pathology of pulmonary arterial hypertension. Am J Respir Crit Care Med. 186 (3), 261-272 (2012).
- Levy, M., Maurey, C., Celermajer, D. S., et al. Impaired apoptosis of pulmonary endothelial cells is associated with intimal proliferation and irreversibility of pulmonary hypertension in congenital heart disease. J Am Coll Cardiol. 49 (7), 803-810 (2007).
- Sakao, S., Tatsumi, K., Voelkel, N. F. Reversible or irreversible remodeling in pulmonary arterial hypertension. Am J Respir Cell Mol Biol. 43 (6), 629-634 (2010).
- Gomez-Arroyo, J. G., Farkas, L., Alhussaini, A. A., et al. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 302 (4), L363-L369 (2012).
- Jones, J. E. Serial noninvasive assessment of progressive pulmonary hypertension in a rat model. Am J Physiol - Heart Circ Physiol. 283 (1), 364-371 (2002).
- Hoffman, J. I., Rudolph, A. M., Heymann, M. A. Pulmonary vascular disease with congenital heart lesions: Pathologic features and causes. Circulation. 64 (5), 873-877 (1981).
- van Albada, M. E., Berger, R. M. Pulmonary arterial hypertension in congenital cardiac disease--the need for refinement of the evian-venice classification. Cardiol Young. 18 (1), 10-17 (2008).
- Dickinson, M. G., Bartelds, B., Borgdorff, M. A., Berger, R. M. The role of disturbed blood flow in the development of pulmonary arterial hypertension: Lessons from preclinical animal models. Am J Physiol Lung Cell Mol Physiol. 305 (1), L1-L14 (2013).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovasc Res. 24 (5), 430-432 (1990).
- Okada, K., Tanaka, Y., Bernstein, M., Zhang, W., Patterson, G. A., Botney, M. D. Pulmonary hemodynamics modify the rat pulmonary artery response to injury. A neointimal model of pulmonary hypertension. Am J Pathol. 151 (4), 1019-1025 (1997).
- van Albada, M. E., Schoemaker, R. G., Kemna, M. S., Cromme-Dijkhuis, A. H., van Veghel, R., Berger, R. M. The role of increased pulmonary blood flow in pulmonary arterial hypertension. Eur Respir J. 26 (3), 487-493 (2005).
- Brittain, E. Echocardiographic assessment of the right heart in mice. JVis Exp. (e81), (2013).
- Dickinson, M. G., Bartelds, B., Molema, G., et al. Egr-1 expression during neointimal development in flow-associated pulmonary hypertension. Am J Pathol. 179 (5), 2199-2209 (2011).
- Borgdorff, M. A., Bartelds, B., Dickinson, M. G., Steendijk, P., de Vroomen, M., Berger, R. M. Distinct loading conditions reveal various patterns of right ventricular adaptation. Am J Physiol Heart Circ Physiol. 305 (3), H354-H364 (2013).
- Ruiter, G., de Man, F. S., Schalij, I., et al. Reversibility of the monocrotaline pulmonary hypertension rat model. Eur Respir J. 42 (2), 553-556 (2013).
- van Albada, M. E., Bartelds, B., Wijnberg, H., et al. Gene expression profile in flow-associated pulmonary arterial hypertension with neointimal lesions. Am J Physiol Lung Cell Mol Physiol. 298 (4), L483-L491 (2010).
- Dickinson, M. G., Kowalski, P. S., Bartelds, B., et al. A critical role for egr-1 during vascular remodelling in pulmonary arterial hypertension. Cardiovasc Res. 103 (4), 573-584 (2014).
- van der Feen, D. E., Dickinson, M. G., Bartelds, M. G., et al. Egr-1 identifies neointimal remodeling and relates to progression in human pulmonary arterial hypertension. Jheart lung transplant. 35 (4), 481-490 (2016).
- Rungatscher, A. Chronic overcirculation-induced pulmonary arterial hypertension in aorto-caval shunt. Microvasc Res. 94, 73-79 (2014).
- O'Blenes, S. B., Fischer, S., McIntyre, B., Keshavjee, S., Rabinovitch, M. Hemodynamic unloading leads to regression of pulmonary vascular disease in rats. J Thorac Cardiovasc Surg. 121 (2), 279-289 (2001).
- Sakao, S., Taraseviciene-Stewart, L., Lee, J. D., Wood, K., Cool, C. D., Voelkel, N. F. Initial apoptosis is followed by increased proliferation of apoptosis-resistant endothelial cells. FASEB J. 19 (9), 1178-1180 (2005).
- Spiekerkoetter, E. FK506 activates BMPR2, rescues endothelial dysfunction, and reverses pulmonary hypertension. J Clin Invest. 123 (8), 3600-3613 (2013).
- Nickel, N. P., Spiekerkoetter, E., Gu, M., et al. Elafin reverses pulmonary hypertension via caveolin-1-dependent bone morphogenetic protein signaling. Am J Respir Crit Care Med. 191 (11), 1273-1286 (2015).
- Meloche, J., Potus, F., Vaillancourt, M., et al. Bromodomain-containing protein 4: The epigenetic origin of pulmonary arterial hypertension. Circ Res. 117 (6), 525-535 (2015).
- Happé, C. M. Pneumonectomy combined with SU5416 induces severe pulmonary hypertension in rats. Am J Physiol Lung Cell Mol Physiol. 310 (11), L1088-L1097 (2016).
- Ranchoux, B., Antigny, F., Rucker-Martin, C., et al. Endothelial-to-mesenchymal transition in pulmonary hypertension. Circulation. 131 (11), 1006-1018 (2015).
- de Raaf, M. A. SuHx rat model: Partly reversible pulmonary hypertension and progressive intima obstruction. Eur Respy J. 44 (1), 160-168 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados