A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
כירורגיה שאנט, צנתור לב ימני, וכלי הדם Morphometry במודל חולדה עבור נגרמת זרימה ריאתי עורקי יתר לחץ דם
In This Article
Summary
This protocol describes a surgical procedure to create a model for flow-induced pulmonary arterial hypertension (PAH) in rats and the procedures to analyze the principle hemodynamic and histological end-points in this model.
Abstract
In this protocol, PAH is induced by combining a 60 mg/kg monocrotalin (MCT) injection with increased pulmonary blood flow through an aorto-caval shunt (MCT+Flow). The shunt is created by inserting an 18-G needle from the abdominal aorta into the adjacent caval vein. Increased pulmonary flow has been demonstrated as an essential trigger for a severe form of PAH with distinct phases of disease progression, characterized by early medial hypertrophy followed by neointimal lesions and the progressive occlusion of the small pulmonary vessels. To measure the right heart and pulmonary hemodynamics in this model, right heart catheterization is performed by inserting a rigid cannula containing a flexible ball-tip catheter via the right jugular vein into the right ventricle. The catheter is then advanced into the main and the more distal pulmonary arteries. The histopathology of the pulmonary vasculature is assessed qualitatively, by scoring the pre- and intra-acinar vessels on the degree of muscularization and the presence of a neointima, and quantitatively, by measuring the wall thickness, the wall-lumen ratios, and the occlusion score.
Introduction
המטרה של שיטה זו היא ליצור מודל לשחזור עבור חמורה, יתר לחץ דם ריאתי עורקים-induced זרימה אצל חולדות למדוד המודינמי שלה עיקרון ונקודות קצה histopathological.
יתר לחץ דם עורקי ריאתי (PAH) היא תסמונת קלינית שמקיף עלייה הדרגתית התנגדות בכלי הדם הריאתיים מובילה לכישלון ומוות החדר הימני. בתוך ספקטרום המחלה המוסמך של מחלות יתר לחץ דם ריאתי (PH), PAH היא הצורה החמורה ביותר ואחד שנשארה ללא תרופה 1. Arteriopathy הבסיסית PAH מאופיינת צורה טיפוסית של שיפוץ כלי דם כי עלול לחסום כאן את לומן הכלי. Muscularization של הלא muscularized שיט היפרטרופיה נורמלי של השכבה כלי המדיאלי נחשבים תופעות המחלה מוקדם PAH, נראים גם בצורות אחרות של PH 2, והם חשבו להיות הפיך 3. כפי PAHdvances, שכבת intimal מתחילה לשפץ, בסופו של דבר להרכיב נגעי מאפיין neointimal 2. שיפוץ Neointimal מסוג בכלי הדם הריאתיים היא בלעדית PAH ונחשב כיום להיות 4 בלתי הפיך.
כפי PAH היא מחלה נדירה, התקדמות בהבנה שלה pathobiological ופיתוח של טיפולים חדשניים הסתמך במידה רבה על מודלים של בעלי חיים. Monocrotalin (MCT) מודל בחולדות הוא מודל להיט אחד פשוט כי כבר, והוא עדיין, שימוש תכוף. MCT הוא רעלן שגורם לפגיעה arterioles ריאתי ו -5 דלקת האזורי. 60 מ"ג / ק"ג MCT מוביל לעלייה בלחץ בעורק הריאה הממוצע (mPAP), התנגדות בכלי הדם הריאתיים (PVR), וכן היפרטרופיה החדר הימני (RVH) לאחר 3 - 4 שבועות 6. Histomorphology מאופיין היפרטרופיה המדיאלי מבודד ללא נגעים neointimal 5. MCTמודל עכברוש ובכך מייצג צורה מתונה של PH, ולא PAH, למרות שהוא מוצג בכינויו האחרון.
אצל ילדים עם PAH הקשורים שנט מולד שמאל לימין (PAH-CHD), זרימת דם מוגבר ריאתי נחשבת על ההדק החיוני לפיתוח נגעי neointimal 7, 8, 9. בחולדות, זרימת הדם הריאתי מוגבר יכול להיגרם על ידי יצירת שנט בין אבי העורקים בבטן ואת הווריד הנבוב, טכניקה תוארה לראשונה בשנת 1990 10. חלופות כדי ליצור זרימת ריאתי מוגבר הן על ידי pneumonectomy חד-צדדית או על ידי subclavian כדי השקה עורק הריאה 11. חסרונות רעיוניים של מודלים אלה כוללים צמיחת מפצת פוטנציאל של הריאה הנותרת הפעלת מסלול אדפטיבית המושרה על ידי pneumonectomy, או של פגיעת iatrogenic של כלי הדם הריאתי עקבכדי השקת עורק ריאה, הן הכובל את ההשפעות של זרימת דם הריאתי מוגברת.
כאשר מחלף aorto-caval נוצר מוגבר זרימת דם הריאתי מושרה כמו להיט שני בחולדות MCT שטופלה, נגעי neointimal מאפיינים להתרחש, צורה חמורה של PAH וכישלון חדר ממני משויך (RVF) לפתח 3 שבועות לאחר מוגבר לזרום 12. ההתקדמות המודינמי של PAH במודל זה ניתן להעריכם vivo על ידי אקו ו צנתור לב נכון. Histomorphology וסקולרית, עובי בדפנות כלי הדם, מידת ספיגה arteriolar, ופרמטרים לכישלון החדר הימני מהווים את עמודי התווך של אפיון vivo לשעבר של PAH.
שיטה זו מתארת פרוטוקולים מפורטים שנט-caval aorto הניתוח (AC-מחלף), צנתור לב תקין, והערכה איכותית וכמותית של histomorphology וסקולרית.
Protocol
הנהלים הקשורים בנושאים בעלי חיים אושרו על ידי הוועד המרכזי ההולנדי לניסויים בבעלי חיים וועדת טיפול בבעלי חיים בבית חרונינגן המרכז הרפואי האוניברסיטאי (NL). חולדות Wistar ולואיס שניהם עם משקולות בין 180 ו -300 גרם שימשו.
שיכון התאקלמות 1.
- לאחר הגעה במתקן בעלי החיים המרכזי, חולדות בית בקבוצות של 5 בכל כלוב. במהלך תקופת התאקלמות 7-יום, להרגיל את חולדות הטיפול אנושי, אבל לא לבצע כל פרוצדורות.
הכנת הזרקה 2. סטרילי Monocrotalin
- עבור 1 מ"ל של 60 מ"ג / מ"ל monocrotalin (MCT) פתרון, שוקל 60 מ"ג של monocrotalin בתוך שפופרת 2 מ"ל. הוסף 700 μL של 0.9% NaCl. הוספת 200 μL של 1 M HCl. מומלץ לחמם את הפתרון בצינור מתחת למי מערבולת ברז חמימים זה. השתמש 6 N NaOH להביא את ה- pH לכיוון 7.0. השתמש בטכניקה סטרילית להכנת MCT להזרקה לתוך מכרסמים.
- להזריק 1 מ"ל של סטרילית 60 מ"ג / מ"ל פתרון MCT לק"ג תת עורית בצוואר (0.3 מ"ל של 60 מ"ג / מ"ל MCT עבור עכברוש 300 גרם). הערה: אנחנו מעדיפים שלא להשתמש בכמויות קטנות יותר בשל כך גוברים הסיכויים מהחומר המוזרק לא יהיה מתאים.
כירורגיה 3. אבי העורקים-caval שאנט
- הַרדָמָה.
- ממלא את חדר האינדוקציה עם 5% isoflurane / 100% O 2 (זרימה: 1 L / min) ומקום החולדה בתא. בדקו עומק נאות של ההרדמה על ידי ביצוע קמצוץ בוהן אחורי. לשקול את העכברוש.
- לגלח ולנקות את הבטן על שטח הוא כ 8 ס"מ ו -3 ס"מ. מניחים את החולדה על גבו על מחצלת חום (37 מעלות צלזיוס) מכוסה מחצלת סטרילי.
- מניח את החוטם עם מסכה / ברדס אוורור עם 2 - 3% isoflurane / 100% O 2 (זרימה: 1 L / min). בדוק את עומק ההרדמה על ידי ביצוע קמצוץ בוהן אחורי. החל העין משחה למניעת יובש לאחר הרדמה.
- Sur שאנטגרי.
- לשפשף את העור עם כלוריד-hexidine לחיטוי. להזריק 0.01 מ"ג / ק"ג עצירות תת עורי על שיכוך כאבים שלאחר הניתוח.
- השתמש בכלים סטריליים לניתוחים. עושים חתך בסכין אזמל # 10 בבטן על קו האמצע, החל מיום 1 ס"מ מתחת לסרעפת הארכת למטה כדי בדיוק מעל איברי המין.
- הרם את המעי עם מקלון צמר גפן, מכסים את המעיים גזה סטרילי, רטוב (0.9% NaCl), ומניחים אותם אל הצד השמאלי של החיה.
- השתמש צמר גפן כדי להפריד את הקרומים המחברים את אב העורקים בבטן ואת הווריד הנבוב הנח אל הרקמות הסובבות.
הערה: אין לנתח את הקרומים בין אבי העורקים ואת הווריד הנבוב. - בעזרת מלקחיים קיסם, להסיר את השומן אבי העורקים perivascular רק מעל הסתעפות, רק בצד ימין של האאורטה ורק באתר שבו המחט תוכנס.
- השתמש צמר גפן להפריד את הווריד הנבוב האאורטה מ Supe מ"מ 2rior לאתר שבו המחט תוכנס כדי ליצור מרחב מלחציים Biemer.
- באזור זה, המקום הראשון ליגטורה רופף (5-0 תפר) סביב האאורטה. ליצור מתח על ליגטורה ידי צבת מהדק קוצ'ר עליו, ולאחר מכן למקם את קוצ'ר עדיפה על (איור 1 א) החתך. מניחים את Biemer מהדק פשוט מעולה המיתר (1A דואר Figur).
- באמצעות מקלון צמר גפן, לדחוס את הווריד הנבוב כמו distally ככל האפשר כדי לחסום את זרימת (איור 1 א). מחט בנד (18 G בפרוטוקול זה) לתוך בזווית של 45 מעלות, עם הצבעה פתח כלפי חוץ (איור 1 א).
- בזווית של 90 מעלות, להכניס את המחט באב העורקים, רק מעל ההסתעפות, עם הפתח של מחט מצביע לשמאל (איור 1 א). לתפעל את קצה המחט שמאלה ולהכניס אותו לתוך הווריד הנבוב.
הערה: חוד המחט אמור להיות visible ב הווריד הנבוב (איור 1B). - השתמש מקלון צמר גפן שני כדי לדחוף את הדם שנותר האאורטה מחוץ לאתר ההכנסה כדי למנוע פקקו. יבש את האזור סביב המחלף עם גזה סטרילית על מנת דבק להיצמד כראוי.
- משוך את המחט כולו מתוך האאורטה ומיד להחיל טיפת דבק רקמות על גבי האתר לנקב האאורטה. ודא שלא דבק המקלון לרקמה. Unclamp האאורטה.
- בדוק את המחלף באופן ידני על ידי משיכת ושחרור ליגטורה על הפרוקסימלי אבי העורקים אל המחלף. התרופפות צריכה לצבוע את דיסטלי הווריד הנבוב לצינורית באדום בוהק וליצור מערבולת באתר המחלף.
הערה: החמרה תהפוך את דם הווריד הנבוב חזרה לאדום כהה. - מניחים את המעיים בחזרה החיה. סגור את שכבת השריר ואת העור עם 4-0 התפרים resorbable. לאוורר את חיה עם 100% O 2 להתאושש מההרדמה.
הערה: אין להשאיר ani mal ללא השגחה עד שהוא שב להכרתו מספיק כדי לשמור שכיבה sternal.
- ניתוח דמה.
- לבצע את כל התהליך המתואר לעיל למעט החדרת המחט לתוך אבי העורקים.
- טיפול לאחר ניתוח.
- מניחים את החולדה בכלוב יחיד לתוך באינקובטור ב 37 מעלות צלזיוס עד למחרת בבוקר.
- בסביבות 6 שעות לאחר הניתוח, מזריקים 0.01 מ"ג / ק"ג עצירות תת עורי על שיכוך כאבים שלאחר הניתוח. חזור למחרת בבוקר אם החולדה מראה סימנים של אי נוחות.
הערה: 3 הימים הראשונים לאחר הניתוח, חולדות נוטים לאכול ולשתות פחות (זה חשוב במיוחד כאשר האוכל או מי שתייה מעורבבים עם תרופות). רוב החולדות להראות נורמלית התנהגות 3 ימים לאחר הניתוח. אם לא, לעקוב מקרוב. הרזיה העולה על 15% ב 1 בשבוע נחשב נורמלי, וחולדות כזה צריך להיות מורדמים על ידי מיצוי של נפח הדם במחזור לאחר הרדמה.
"Jove_title"> 4. פיתוח של PAH
הערה: בפרוטוקול זה, החיה מורדמת על ידי המיצוי של נפח דם במחזור לאחר הרדמה.
- להקריב 1 יום לאחר הניתוח (MF8) עבור התגובות הסלולר ופונקציונלי מוקדם לזרימת דם ריאתי מוגבר (למשל, עד-רגולציה של גנים או גורמי שעתוק מוקדם).
- להקריב 1 שבוע לאחר הניתוח (MF14) עבור פנוטיפ כלי הדם PAH בשלב מוקדם (היפרטרופיה המדיאלי ללא נגעים neointimal).
- להקריב 2 שבועות לאחר הניתוח (MF21) עבור פנוטיפ כלי הדם PAH בשלב מתקדם (מסומן היפרטרופיה המדיאלי והיווצרות neointimal) עם הגבהה קלה RVP ו mPAP.
- להקריב 3 שבועות לאחר הניתוח (MF28) עבור פנוטיפ כלי דם סופנית PAH (חסימת neointimal מסומנת) וההעלאה חזקה RVP ו mPAP. סימנים קליניים של אי ספיקת החדר הימני נפוצים בשלב זה.
- הקורבן לאחר 28 יום (MF-RVF) עקב חוסר החדר הימני הקשורים PAH (RVF), מוגדר קלינית כמו קוצר נשימה, עייפות קשה, וירידה במשקל (<10% ב 1 בשבוע). לסיים חולדות כאשר אחד הסימנים הללו הוא ההווה. לעתים קרובות, חולדות לפתח תסמינים אלו בין ימים 28 ו -35 ו, אם נותר ללא שמירה, למות באופן ספונטני במהלך מרווח הזמן הזה.
5. ימין לב צנתור
- הַרדָמָה.
- ממלאים את החדר אינדוקציה עם 5% isoflurane / 100% O 2 (זרימת: 1 L / min) ומניחים את העכברוש בתיבה. בדקו עומק נאות של ההרדמה על ידי ביצוע קמצוץ בוהן אחורי. לשקול את העכברוש.
- לגלח ולנקות את הצוואר בחלק הימני-הגחון של חולדה, עבור פרוטוקול אקוקרדיוגרפיה, בית החזה והבטן העליונה.
- מניח את החולדה על גבה על מחצלת חום (37 מעלות צלזיוס) ומקום חוטם במנדף אוורור מסכה / עם 2 - 3% isoflurane / 100% O 2 (זרימה: 1 L / min). החוטם צריך להיות מתמודד כלפי החוקר.
- בדוק עומק ההרדמה. תיזהר עם חולדות עם PH חמור. אם קצב הלב פוחתת, להפחית את עומק ההרדמה. עדיף, לבצע את כל המדידות בתוך 20 דקות. החל העין משחה למניעת יובש לאחר הרדמה.
- פרוטוקול אקו.
- בצעו את אקו לפי הפרוטוקול שתואר על ידי בריטן et al. ב יופיטר 13.
- פרוטוקול צנתור.
הערה: פרוטוקול זה משתמש צינורית נוקשה עם טיפ מתבצע כפופה 20 מעלות כדי להנחות את הקטטר סיליקון 15 סנטימטר עם מ"מ כדור 2 מהקצה. מחט 20-G עם הפתח שלה כפוף מעט לחלק הפנימי משמשת להוספת הצינורית לוריד הצוואר הימני (ראה רשימת חומרים). חולדות בכל שלב של התקדמות ושליטה PAH ניתן להשתמש בפרוטוקול זה.- לחטא את הצוואר עם כלוריד-hexidine. ביצוע חתך 1.5 ס"מ עם להב אזמל # 10 בצד הימני-הגחוןשל הצוואר, מלשד עצם צווארון זכות העצם בלסת התחתון,.
- מורחים את רקמות באמצעות מספריים. בעזרת פינצטה, למשוך את הרקמות בעדינות בנפרד עד וריד הצוואר מופיע. לנתח את הקרומים סביב וריד הצוואר באמצעות מלקחיים קיסם.
- שים מתח על וריד הצוואר על ידי הצבת ליגטורה רופפת (5-0 תפר) ברחבי הספינה. הגדל את המתח ואת קלטת המיתר על מסכת אוורור (איור 2 א).
- Downstream של הכניסה לאתר, למקם ליגטורה רופף סביב הכלי להדק לאחר הקנייה היא באתרו כדי למנוע דליפה ואובדן לחץ.
- באמצעות הידיות של מלקחיים, מעט לכופף את קצה מחט 20-G עם פתח לחלק הפנימי לנהל את הצינורית עם קטטר.
- הצג את קצה מחט 20-G לווריד ובמהירות למקם את הצינורית המכילה את הקטטר בתוך הכלי. משוך את המחט, ולאחר מכן לסגור את ליגטורהכי היה מוכן בשלב 5.3.4.
- לנהל את הצינורית המכילה קטטר לתוך וריד הצוואר. הטיפ של הצינורית הוא בעיקול של 20 מעלות (ראה שלב 5.3.5). לתמרן את הצינורית תחת עצם הבריח ולקדם קצת להיכנס אטריום ימין (איור 2 ג).
- כדי להזין את החדר הימני, תכוון את קצה של צינורית שמאלה, לכיוון הלב (איור 2 ד). על צג המיטה, עקומת לחץ RV אמורה להופיע, התאמת איור 2 ד.
- כאשר עקומת הלחץ RV הוא קבוע, לרשום את הלחץ החדר הימני הסיסטולי והדיאסטולי 1 (sRVP1 / dRVP1).
- לתפעל את הקצה של הצינורית שמאלה ולמעלה. לקדם את הקטטר בתוך צינורית (איור 2E).
- לקדם את קטטר לתוך עורק הריאה הראשי (PA). אין התנגדות צריכה להיות מורגשת כאשר עובר את שסתום ריאתי.
הערה: כאשר הקטטר נכנס עורק הריאה הראשי, דלחץ iastolic יעלה. על צג המיטה, עקומת לחץ הרשות אמורה להופיע, התאמת האיור 2E. - כאשר עקומת הלחץ הרשות הוא קבוע, לרשום את סיסטולי, דיאסטולי, ולהתכוון הרשות בלחץ 1 (sPAP1, dPAP1, mPAP1).
- בהמשך לקדם את הקטטר בתוך הצינורית עד הכדור על קצה הצנתר מקבל תקוע בתוך עורק ריאה. שים את עקומת הלחץ על ירידת צג המיטה ולהתאים את העקומה לחץ טריז באיור 2F.
- כאשר עקומת לחץ טריז הוא קבוע, לרשום את סיסטולי, דיאסטולי, ולהתכוון לחץ טריז.
- משוך לאחור את הקטטר לאט ולאחר מכן למדוד ולרשום את הערכים עבור sPAP2, dPAP2, mPAP2, sRVP2, ו dRVP2, כמו בצג המיטה.
- כאשר ב RV, מעט למשוך בחזרה את הצינורית ואת קטטר כדי למדוד את מתכוון ברגע לחץ פרוזדורים (RAP). העקומה צריכה להתאים את עקומת RAP באיור 2A.
לאTE: בפרוטוקול זה, החולדות מומתות לאחר פרוטוקול הצנתור על ידי המיצוי של נפח דם במחזור לאחר הרדמה.
6. הערכת מורפולוגיה Morphometry
הערה: בפרוטוקול זה, החיה מורדמת על ידי המיצוי של נפח דם במחזור לאחר הרדמה. חולדות בכל שלב של התקדמות ושליטה PAH ניתן להשתמש בפרוטוקול זה.
- אחרי הקרבה, להוציא את הריאות על ידי חיתוך קנה הנשימה על 5 מ"מ מעל הסתעפות הסימפונות ואת כלי המתחברים מהריאות אל הלב. מכניס את הריאות מלוחות קר. לנתח את הריאה השמאלית. חותך את הסמפונות בכירים עזבו ב ההסתעפות.
- ממלאים מזרק 50 מ"ל עם paraformaldehyde 4%, לצרף צינור עם צינורית כדי המזרק, ולתלות את המזרק כמטר מעל שולחן העבודה. התאימו את הצינורית של הסמפונות השמאלי הראשי כדי למלא את הריאות באופן פסיבי עם paraformaldehyde.טפל paraformaldehyde בזהירות.
- דגירת הריאה השמאלית ב paraformaldehyde למשך 48 שעות.
- מייבשים את הריאה השמאלית ידי דוגרים אותו ברצף באתנול 70% (1 ח), 80% אתנול (1 ח), 90% אתנול (1 ח), 100% אתנול (3 שעות), xylol (2 ח), וכן פרפין ( 2 h).
- שבץ הריאה השמאלית פרפין, עם hilum של הריאה מול הקלטת.
- הכתם מוטבע פרפין, 4-מיקרומטר סעיפים הריאות באמצעות מכתים Gieson Verhoeff או Elastica-ואן, לפי הוראות היצרן 29. ודאו רבדי אלסטי הם מובחנים היטב (כמו באיור 3). סרוק את הסעיפים מוכתמים בהגדלה 40X.
- מחלק את הריאות לתוך 4 רביעים. בכל רבע, למצוא 10 כלי בקוטר חיצוני <50 מיקרומטר (-acinar התוך) ו -10 כלי בקוטר חיצוני> 50 מיקרומטר (-acinar מראש). קח תמונה (2 x 40 תמונות לכל ריאה). זום פנימה באופן אקראי עד 20x הגדלה ולצלם כל כליבתחום של השקפה זו כדי למזער את הטית בחירה.
- אל תכלול כלי שיש להם יחס קוטר ארוך / קצר> 2, צורה מעגלית שלמה, או קריסה של יותר מרבע בדפנות כלי הדם.
הערה: דוגמא כלי נשלל מוצגת באיור 3 ב להפוך כל תמונה על אותו הגדלה (40X) וכולל סרגל קנה מידה. - ImageJ פתח את התמונה הראשונה. צייר קו ישר על בר המידה בתמונה להגדיר הסולם באמצעות "נתח" ו "קבע בקנה מידה." לקבלת "מרחק ידוע," להשתמש בערך על סרגל קנה המידה של התמונה. השתמש מיקרומטר (מיקרומטר) כיחידת אורך. הגדר את קנה המידה הגלובלי.
- באמצעות "בחירות חופשיות," למתוח קו על הגבול הפנימי של האזור לומינל (איור 3), ולהשתמש "למדוד" (Crtl מ ') כדי למדוד את שטח זה. ואז, למתוח קו סביב Elast החיצוניic lamina (איור 3) כדי למדוד את שטח הכלי הכולל.
- חשב את luminal ו קוטר חיצוני (
 ) באמצעות
) באמצעות  .
. - לחשב את עובי הקיר באמצעות
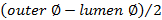 .
. - חשב את היחס קיר / לומן באמצעות
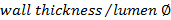 .
. - לחשב את ציון החסימה באמצעות
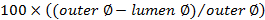 .
. - ציון על כלי השיט muscularization (לא, חלקית, או מלאה muscularization) (איור 3 ב).
הערה: כלי עם lamina כפול אלסטי יותר ממחצית ההיקף מוגדר לחלוטין muscularized. ספינות עם lamina כפול אלסטי פחות ממחצית ההיקף מוגדרות חלקית muscularized. - ציון הספינה על הנוכחות של neointima (כן או לא) (איור 3 ג).
הערה: כלי ללא lamina אלסטי פנימי מוגדר היטב בשילוב עם (לעתים קרובות האקסצנטרי) חסימת luminal מוגדר נגעי neointimal.
תוצאות
תוצאות נציגים מוצגות באיור 4. התוצאות המוצגות להראות מאפיינים של MCT + FLOW בחולדות לואיס הקבוצות הבאות: בקרת (n = 3), MF8 (n = 5), MF14 (n = 5), MF28 (n = 5), ו MF-RVF ( n = 10). ניתוחים סטטיסטיים בוצעו באמצעות ANOVA חד כיווני עם תיקון בונפרוני.
Discussion
שיטה זו מתארת את הליך כירורגי של המחלף aorto-caval בחולדות טרום שטופלו MCT ליצור PAH זרימה המושרה ואת טכניקות כדי להעריך את המודינמי העיקרון ונקודות קצה histopathological המאפיינות PAH ודגם זה.
צעדים קריטיים בתוך הפרוטוקול ופתרון הבעיות
Disclosures
The authors have nothing to disclose.
Acknowledgements
This study was supported by the Netherlands Cardiovascular Research Initiative, the Dutch Heart Foundation, the Dutch Federation of University Medical Centers, the Netherlands Organization for Health Research and Development, and the Royal Netherlands Academy of Sciences (CVON nr. 2012-08, PHAEDRA, The Sebald fund, Stichting Hartekind).
Materials
| Name | Company | Catalog Number | Comments |
| Shunt Surgery | |||
| Sterile surgical gloves | |||
| Duratears Eye ointment | Alcon | 10380 | |
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Histoacryllic tissue glue | B. Braun Medical | 1050052 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Safil 4-0 sutures violet resorbable | B. Braun Medical | ||
| 18 G needle | Luer | NN1838R BD | tip bent in 45 degrees orifice to the outside |
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Temgesic Buprenorphine | RB Pharmaceuticals | 5429 | subcutaneous injection |
| Sodium Chloride 0.9% | |||
| Ventilation mask Rat | |||
| Scalple blade | |||
| Biemer clamp 18 mm, 5 mm opening | AgnTho | 64-562 | |
| Heat mat | |||
| Kocher Clamp | |||
| Shaving machine | |||
| Microscope | Leica | ||
| Right Heart Catheterization | |||
| Sterile surgical gloves | |||
| Eye ointment | Duratears | ||
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Needle 20 G | Luer | Tip slightly bent to the inside | |
| Cannula 20 G | Luer | to introduce catheter, tip pre-formed in 20 degrees | |
| Silastic Catheter 15 cm long | 0.5 mm ball 2 mm from tip | ||
| Pressure transducer | Ailtech | ||
| Bedside monitor Cardiocap/5 | Datex-Ohmeda | ||
| Shaving machine | |||
| 10 mL Syringe | |||
| Sodium Chloride 0.9% | for flushing | ||
| Vascular Morphology | |||
| 50 mL Syringe | |||
| 4% Formaldehyde | |||
| 18 G cannula with tube | |||
| Verhoef staining kit | Sigma-Aldrich | HT254 | http://www.sigmaaldrich.com/catalog/product/sigma/ht254?lang=en®ion=US |
| Digital slide scanner | Hamamatsu | C9600 | |
| ImageJ | |||
| Elastic (Connective Tissue Stain) | Abcam | ab150667 | http://www.abcam.com/elastic-connective-tissue-stain-ab150667.html http://www.abcam.com/ps/products/150/ab150667/documents/ab150667-Elastic%20Stain%20Kit%20(website).pdf |
References
- Hoeper, M. M., Bogaard, H. J., Condliffe, R., et al. Definitions and diagnosis of pulmonary hypertension. J Am Coll Cardiol. 62, D42-D50 (2013).
- Stacher, E., Graham, B. B., Hunt, J. M., et al. Modern age pathology of pulmonary arterial hypertension. Am J Respir Crit Care Med. 186 (3), 261-272 (2012).
- Levy, M., Maurey, C., Celermajer, D. S., et al. Impaired apoptosis of pulmonary endothelial cells is associated with intimal proliferation and irreversibility of pulmonary hypertension in congenital heart disease. J Am Coll Cardiol. 49 (7), 803-810 (2007).
- Sakao, S., Tatsumi, K., Voelkel, N. F. Reversible or irreversible remodeling in pulmonary arterial hypertension. Am J Respir Cell Mol Biol. 43 (6), 629-634 (2010).
- Gomez-Arroyo, J. G., Farkas, L., Alhussaini, A. A., et al. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 302 (4), L363-L369 (2012).
- Jones, J. E. Serial noninvasive assessment of progressive pulmonary hypertension in a rat model. Am J Physiol - Heart Circ Physiol. 283 (1), 364-371 (2002).
- Hoffman, J. I., Rudolph, A. M., Heymann, M. A. Pulmonary vascular disease with congenital heart lesions: Pathologic features and causes. Circulation. 64 (5), 873-877 (1981).
- van Albada, M. E., Berger, R. M. Pulmonary arterial hypertension in congenital cardiac disease--the need for refinement of the evian-venice classification. Cardiol Young. 18 (1), 10-17 (2008).
- Dickinson, M. G., Bartelds, B., Borgdorff, M. A., Berger, R. M. The role of disturbed blood flow in the development of pulmonary arterial hypertension: Lessons from preclinical animal models. Am J Physiol Lung Cell Mol Physiol. 305 (1), L1-L14 (2013).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovasc Res. 24 (5), 430-432 (1990).
- Okada, K., Tanaka, Y., Bernstein, M., Zhang, W., Patterson, G. A., Botney, M. D. Pulmonary hemodynamics modify the rat pulmonary artery response to injury. A neointimal model of pulmonary hypertension. Am J Pathol. 151 (4), 1019-1025 (1997).
- van Albada, M. E., Schoemaker, R. G., Kemna, M. S., Cromme-Dijkhuis, A. H., van Veghel, R., Berger, R. M. The role of increased pulmonary blood flow in pulmonary arterial hypertension. Eur Respir J. 26 (3), 487-493 (2005).
- Brittain, E. Echocardiographic assessment of the right heart in mice. JVis Exp. (e81), (2013).
- Dickinson, M. G., Bartelds, B., Molema, G., et al. Egr-1 expression during neointimal development in flow-associated pulmonary hypertension. Am J Pathol. 179 (5), 2199-2209 (2011).
- Borgdorff, M. A., Bartelds, B., Dickinson, M. G., Steendijk, P., de Vroomen, M., Berger, R. M. Distinct loading conditions reveal various patterns of right ventricular adaptation. Am J Physiol Heart Circ Physiol. 305 (3), H354-H364 (2013).
- Ruiter, G., de Man, F. S., Schalij, I., et al. Reversibility of the monocrotaline pulmonary hypertension rat model. Eur Respir J. 42 (2), 553-556 (2013).
- van Albada, M. E., Bartelds, B., Wijnberg, H., et al. Gene expression profile in flow-associated pulmonary arterial hypertension with neointimal lesions. Am J Physiol Lung Cell Mol Physiol. 298 (4), L483-L491 (2010).
- Dickinson, M. G., Kowalski, P. S., Bartelds, B., et al. A critical role for egr-1 during vascular remodelling in pulmonary arterial hypertension. Cardiovasc Res. 103 (4), 573-584 (2014).
- van der Feen, D. E., Dickinson, M. G., Bartelds, M. G., et al. Egr-1 identifies neointimal remodeling and relates to progression in human pulmonary arterial hypertension. Jheart lung transplant. 35 (4), 481-490 (2016).
- Rungatscher, A. Chronic overcirculation-induced pulmonary arterial hypertension in aorto-caval shunt. Microvasc Res. 94, 73-79 (2014).
- O'Blenes, S. B., Fischer, S., McIntyre, B., Keshavjee, S., Rabinovitch, M. Hemodynamic unloading leads to regression of pulmonary vascular disease in rats. J Thorac Cardiovasc Surg. 121 (2), 279-289 (2001).
- Sakao, S., Taraseviciene-Stewart, L., Lee, J. D., Wood, K., Cool, C. D., Voelkel, N. F. Initial apoptosis is followed by increased proliferation of apoptosis-resistant endothelial cells. FASEB J. 19 (9), 1178-1180 (2005).
- Spiekerkoetter, E. FK506 activates BMPR2, rescues endothelial dysfunction, and reverses pulmonary hypertension. J Clin Invest. 123 (8), 3600-3613 (2013).
- Nickel, N. P., Spiekerkoetter, E., Gu, M., et al. Elafin reverses pulmonary hypertension via caveolin-1-dependent bone morphogenetic protein signaling. Am J Respir Crit Care Med. 191 (11), 1273-1286 (2015).
- Meloche, J., Potus, F., Vaillancourt, M., et al. Bromodomain-containing protein 4: The epigenetic origin of pulmonary arterial hypertension. Circ Res. 117 (6), 525-535 (2015).
- Happé, C. M. Pneumonectomy combined with SU5416 induces severe pulmonary hypertension in rats. Am J Physiol Lung Cell Mol Physiol. 310 (11), L1088-L1097 (2016).
- Ranchoux, B., Antigny, F., Rucker-Martin, C., et al. Endothelial-to-mesenchymal transition in pulmonary hypertension. Circulation. 131 (11), 1006-1018 (2015).
- de Raaf, M. A. SuHx rat model: Partly reversible pulmonary hypertension and progressive intima obstruction. Eur Respy J. 44 (1), 160-168 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved