Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Шунтов, катетеризация правых отделов сердца, и сосудистому Морфометрия в крысиной модели для Flow-индуцированной легочной артериальной гипертензии
В этой статье
Резюме
This protocol describes a surgical procedure to create a model for flow-induced pulmonary arterial hypertension (PAH) in rats and the procedures to analyze the principle hemodynamic and histological end-points in this model.
Аннотация
In this protocol, PAH is induced by combining a 60 mg/kg monocrotalin (MCT) injection with increased pulmonary blood flow through an aorto-caval shunt (MCT+Flow). The shunt is created by inserting an 18-G needle from the abdominal aorta into the adjacent caval vein. Increased pulmonary flow has been demonstrated as an essential trigger for a severe form of PAH with distinct phases of disease progression, characterized by early medial hypertrophy followed by neointimal lesions and the progressive occlusion of the small pulmonary vessels. To measure the right heart and pulmonary hemodynamics in this model, right heart catheterization is performed by inserting a rigid cannula containing a flexible ball-tip catheter via the right jugular vein into the right ventricle. The catheter is then advanced into the main and the more distal pulmonary arteries. The histopathology of the pulmonary vasculature is assessed qualitatively, by scoring the pre- and intra-acinar vessels on the degree of muscularization and the presence of a neointima, and quantitatively, by measuring the wall thickness, the wall-lumen ratios, and the occlusion score.
Введение
Цель этого метода заключается в создании воспроизводимой модели для тяжелой, течения индуцированной легочной артериальной гипертензии у крыс и измерить его принцип гемодинамические и гистопатологические конечные точки.
Легочной артериальной гипертензии (ЛАГ) является клиническим синдромом, который охватывает прогрессивное увеличение легочного сосудистого сопротивления, ведущего к правожелудочковой недостаточности и смерти. В вышестоящем спектра заболеваний легочных гипертонической болезни (PH), ЛАГ является самой тяжелой формой и тот , который остается без лечения 1. Основополагающей артериопатия в PAH характеризуется типичной формой ремоделирования сосудов, что закупоривает просвет сосуда. Muscularization нормальных , не muscularized сосудов и гипертрофии медиальной слоя сосуда рассматриваются как ранние явления болезни при ЛАГ, наблюдаются также в других формах ЛГ 2, и , как полагают, быть обратимым 3. Как ПАГ аdvances, интимы слой начинает перестраивать, в конце концов , образуя характерные неоинтимального поражения 2. Неоинтимального типа легочного сосудистого ремоделирования является эксклюзивным для ЛАГ и в настоящее время считается необратимым 4.
Как PAH является редким заболеванием, прогресс в его pathobiological понимания и разработка новых методов лечения уже в значительной степени полагались на животных моделях. Monocrotalin (MCT) модели у крыс простой одиночный удар модель , которая была, и до сих пор, часто используется. МСТ является токсин , который вызывает повреждение легочных артериол и региональное воспаление 5. 60 мг / кг МСТ приводит к увеличению среднего давления в легочной артерии (MPAP), легочное сосудистое сопротивление (PVR), и гипертрофия правого желудочка (РВГ) через 3 - 4 недели 6. Histomorphology характеризуется изолированной медиальной гипертрофии без неоинтимы поражений 5. МСТТаким образом, модель крысы представляет собой умеренную форму PH, а не PAH, хотя обычно представляется как последний.
У детей с ЛАГ , связанной с врожденным слева направо шунта (PAH-КБС), увеличение легочного кровотока считается существенным триггером для развития неоинтимы поражений 7, 8, 9. У крыс, усиление легочного кровотока может быть индуцирована путем создания шунта между брюшной аортой и полой веной, методика впервые была описана в 1990 году 10. Альтернативы создают повышенную легочную потока являются односторонними пневмонэктомии либо подключичную к анастомоза легочной артерии 11. Концептуальные недостатки этих моделей состоит из потенциальной компенсационного роста оставшегося легкого и адаптивной активации пути, вызванного пневмонэктомии или ятрогенного повреждения легочной сосудистой сети из-зак анастомозом легочной артерии, как путая последствия увеличения легочного кровотока.
Когда аорто-кавальной шунт создается и усиление легочного кровотока индуцируется в качестве второго попадания в МСТ крыс, характерные неоинтимального поражения происходят, и тяжелая форма ЛАГ и связанных с ними недостаточность правого желудочка (ФВР) развиваются через 3 недели после того, как увеличение 12 потока. Прогрессирование гемодинамика ЛАГ в этой модели можно оценить в естественных условиях с помощью эхокардиографии и катетеризации правых отделов сердца. Сосудистый histomorphology, толщина стенки сосуда, степень артериол окклюзии, а также параметры для правого желудочка неудачи образуют устои экс естественных характеристик ЛАГ.
Этот метод описывает подробные протоколы для операции аорто-кавальной шунта (AC-шунт), катетеризация правых отделов сердца, а также качественную и количественную оценку сосудистого histomorphology.
протокол
Процедуры с участием субъектов животных были одобрены ЦК Голландской Эксперименты на животных и Комитетом по уходу животных в университетском медицинском центре Гронингена (Нидерланды) с помощью. Оба были использованы Wistar и крыс Льюиса с весом от 180 до 300 г.
1. Корпус и акклиматизации
- После прибытия в центральном виварии, крыс в домашних группах по 5 животных на клетку. В период акклиматизации 7-дневного, приучить крыс к человеческому обращению, но не выполняют никаких экспериментальных процедур.
2. Подготовка и инъекция стерильного Monocrotalin
- Для получения 1 мл 60 мг / мл monocrotalin (MCT) раствор, взвешивают 60 мг monocrotalin в трубе 2-мл. Добавить 700 мкл 0,9% NaCl. Добавить 200 мкл 1 М HCl. Нагреть раствор в трубке под струей горячей водопроводной воды и вихря его. С помощью 6 N NaOH, чтобы довести рН 7,0 в сторону. Использование стерильной техники для приготовления МСТ для инъекций в грызунов.
- Вводят 1 мл стерильного 60 мг / мл МСТ раствора на кг подкожно в шею (0,3 мл 60 мг / мл МСТ для 300-г на крысу). Примечание: Мы предпочитаем не использовать меньшие объемы в связи с большей вероятностью, что впрыскивается доза не будет уместен.
3. аорто-кавальной шунтированием
- Обезболивание.
- Заполните индукционную камеру с 5% изофлуран / 100% O 2 (расход: 1 л / мин) и помещают крысу в камере. Проверьте наличие адекватной глубины анестезии, выполняя носок щепотку задних. Взвесьте крысы.
- Бритье и очистить живот на площади, которая имеет длину приблизительно 8 см и шириной 3 см. Поместите крысу на спине на циновке тепла (37 ° C), охватываемый стерильную мата.
- Поместите мордой в маске вентиляции / капот с 2 - 3% изофлуран / 100% O 2 (расход: 1 л / мин). Проверьте глубину анестезии, выполняя носок щепотку задних. Нанесите мазь для глаз, чтобы предотвратить сухость под наркозом.
- Шунт SurГери.
- Скраб кожу с хлоридно-hexidine для дезинфекции. Вводят 0,01 мг / кг подкожно бупренорфин для послеоперационного обезболивания.
- Используйте стерильные инструменты для хирургии. Сделайте надрез с # 10 лезвие скальпеля в животе по средней линии, начиная с 1 см ниже диафрагмы выступающую вниз чуть выше половых органов.
- Поднимите кишечник с помощью ватного тампона, покрывают кишечник в стерильной, влажной марлей (0,9% NaCl), и поместить их в левую сторону животного.
- Используйте ватные тампоны, чтобы отделить мембраны, которые крепят брюшной аорты и нижней полой вены в окружающие ткани.
ПРИМЕЧАНИЕ: Не вскрывать мембраны между аортой и полой вене. - Используя Пинцет, удалите периваскулярное аортального жира чуть выше развилки, только на правой стороне аорты и только на месте, где будет вставлена игла.
- Используйте ватные тампоны, чтобы отделить аорта и полая вена от 2 мм супермаркеRIOR к месту, где игла будет вставлена для того, чтобы создать пространство для зажима Бимер.
- В этой области, первое место рыхлую лигатуры (5-0 шовный) вокруг аорты. Создание напряженности на лигатуры, помещая зажим Кохера на нем, а затем поместить Кохер выше разреза (рис 1А). Поместите Бимер зажим как раз превосходит лигатуры (Figur е 1А).
- Используя ватный тампон, сжимать полую вену , как дистально , насколько это возможно , чтобы воспрепятствовать потоку (Рис . 1А) Изгиб иглы (18 G в данном протоколе) в угол 45 градусов, с отверстием , указывающей в направлении наружу (рис 1А).
- Под углом 90 градусов, вставить иглу в аорте, как раз над бифуркацией, с отверстием иглы , указывающей влево (Рис . 1А) Манипулирование кончик иглы влево и вставьте его в полую вену.
ПРИМЕЧАНИЕ: Теперь кончик иглы должен быть VisiBLE в полую вену (рис 1B). - Используйте второй ватный тампон, чтобы подтолкнуть оставшуюся кровь в аорту из места введения, чтобы предотвратить тромбоз. Сушат область вокруг шунта с стерильную марлю для того, чтобы клей надлежащим образом придерживаться.
- Вытащите всю иглу из аорты и сразу же нанесите каплю клея ткани на месте прокола в аорте. Убедитесь в том, чтобы не приклеить ватный тампон к ткани. Освободить аорту.
- Проверьте шунт вручную, потянув и отпустить лигатуры на аорте проксимальнее шунта. Рыхление должен цвет полая вена дистальнее шунта в ярко-красный и создают турбулентность на месте шунта.
ПРИМЕЧАНИЕ: затяжка превратит кровь в полую вену обратно до темно-красного. - Поместите кишок обратно в животное. Закройте мышечный слой и кожу с рассасывающихся 4-0 швами. Проветривайте животное с 100% O 2 , чтобы оправиться от наркоза.
ПРИМЕЧАНИЕ: Не оставляйте ЭниMAL без присмотра, пока он не пришел в сознание достаточное для поддержания грудины лежачее.
- Sham хирургии.
- Выполнение всех вышеуказанных процедур для введения иглы в аорту за исключением.
- Послеоперационный уход.
- Поместите крысу в одной клетке, и в инкубаторе при 37 ° С до следующего утра.
- Около 6 часов после операции, вводят 0,01 мг / кг подкожно бупренорфин для послеоперационного обезболивания. Повторите следующее утро, если крыса показывает признаки дискомфорта.
Примечание: Первые 3 дня после операции, у крыс, как правило, есть и пить меньше (это особенно важно, когда чау или питьевой воды смешиваются с наркотиками). Большинство крыс показывают нормальное поведение 3 дня после операции. Если нет, то внимательно следить. Потеря веса более чем на 15% в течение 1 недели считается ненормальным, и такие крысы должны быть подвергнуты эвтаназии путем экстракции объема циркулирующей крови в то время как под анестезией.
4. Развитие ЛАГ
Примечание: В этом протоколе животное эвтаназии путем экстракции объема циркулирующей крови в то время как под анестезией.
- Жертвоприношение 1 день после операции (MF8) для ранних клеточных и функциональных реакций к увеличению потока легочной крови (например, ген , повышающей регуляции или ранних факторов транскрипции).
- Жертвоприношение через 1 неделю после операции (MF14) для ранней стадии PAH сосудистого фенотипа (медиальная гипертрофия без неоинтимы поражений).
- Жертвоприношение через 2 недели после операции (MF21) для запущенной стадии PAH сосудистого фенотипа (помечено медиальной гипертрофии и образование неоинтимы) с мягким повышением в РВП и MPAP.
- Жертвоприношение через 3 недели после операции (MF28) для терминальной стадии PAH сосудистого фенотипа (отмечен неоинтимы окклюзия) и сильного подъема в РВП и MPAP. Клинические признаки недостаточности правого желудочка обычны в данной стадии.
- Жертвоприношение после того, как 28-й день (MF-ЛРВ) Для ПАГ-ассоциированной недостаточности правого желудочка (ФВР), клинически определяется как одышка, сильная вялость и потеря веса (<10% в течение 1 недели). Terminate крыс, когда один из этих признаков присутствует. Часто, крысы развиваются эти симптомы между днями 28 и 35 и, если оставить без присмотра, умирают спонтанно в течение этого интервала времени.
5. катетеризация правых отделов сердца
- Обезболивание.
- Заполните индукционную камеру с 5% изофлуран / 100% O 2 (расход: 1 л / мин) и поместить крысу в коробку. Проверьте наличие адекватной глубины анестезии, выполняя носок щепотку задних. Взвесьте крысы.
- Бритье и очистить шеи в правой вентральной стороне крысы и, для протокола эхокардиографии, грудной клетки и верхней части живота.
- Поместите крысу на его спине на циновке тепла (37 ° C) и поместите морду в вентиляционной маски / капот с 2 - 3% изофлуран / 100% O 2 (расход: 1 л / мин). Морда должна быть обращены вверх к исследователю.
- Проверьте глубину анестезии. Будьте осторожны с крысами с тяжелой ЛГ. Если частота сердечных сокращений уменьшается, уменьшить глубину анестезии. Предпочтительнее, выполнять все измерения в течение 20 мин. Нанесите мазь для глаз, чтобы предотвратить сухость под наркозом.
- Протокол эхокардиографии.
- Выполните эхокардиографию в соответствии с протоколом , описанным Бриттан и соавт. в Jove 13.
- Протокол Катетеризации.
Примечание: Этот протокол использует жесткую канюлю с предварительно наконечником согнуты на 20 градусов , чтобы направлять кремния катетера 15 см с мячом 2 мм от кончика. 20-G иглы с отверстием слегка согнуты внутрь используется для вставки канюлю в правую яремную вену (см перечень материалов). Крысы в любой фазе PAH прогрессии и контроля могут быть использованы в данном протоколе.- Лечить шею с хлоридно-hexidine. Сделать 1,5 см разрез в с # 10 лезвие скальпеля в правой вентральной сторонешеи, от правой ключицы к нижнечелюстной кости.
- Распространение ткани с помощью ножниц. С помощью пинцета, осторожно потяните ткань друг от друга до тех пор, пока не появится яремной вены. Рассеките мембраны вокруг яремной вены с помощью Пинцет.
- Помещенный напряжение на шейную вену, помещая рыхлую лигатуры (5-0 шовный) вокруг судна. Увеличьте натяжение и ленты лигатуры на вентиляционную маску (рис 2А).
- Вниз по течению от места введения, поместите свободную лигатуру вокруг сосуда , чтобы затянуть после того, как канюля на месте для того , чтобы предотвратить утечку и потерю давления.
- С помощью ручки пинцета, слегка согнуть кончик 20-G иглы с отверстием на внутренней части, чтобы провести полую иглу с катетером.
- Ввести наконечник 20-G иглы в вену и быстро поместить канюли, содержащий катетер внутри сосуда. Вытащите иглу, а затем закройте лигатурыкоторый был подготовлен в шаге 5.3.4.
- Провести канюли, содержащий катетер в яремную вену. Кончик канюли на кривой 20 градусов (этап 5.3.5). Маневр канюлю под ключицы и заранее немного , чтобы войти в правое предсердие (рис 2C).
- Для входа в правый желудочек, направьте кончик полой иглы влево, в сторону сердца (рис 2D). На мониторе прикроватная, кривая давления RV должна появиться, сопоставив Рисунок 2D.
- Когда кривая давления RV постоянна, запишите систолическое и диастолическое давление правого желудочка 1 (sRVP1 / dRVP1).
- Манипулирование кончик полой иглы влево и вверх. Продвигать катетер внутри канюли (рис 2E).
- Предварительный катетер в легочной артерии (ПА). Ни один сопротивление не должно ощущаться при прохождении клапана легочной артерии.
ПРИМЕЧАНИЕ: Когда катетер входит в основной легочной артерии, Дiastolic давление будет расти. На мониторе прикроватная, кривая давления PA должна появиться, сопоставив Рисунок 2E. - Когда кривая давления PA постоянна, запишите систолическое, диастолическое и среднее давление PA 1 (sPAP1, dPAP1, mPAP1).
- Дальнейшее продвижение катетера внутри канюли, пока мяч на кончик катетера не застрянет в легочной артерии. Обратите внимание на кривую давления на перепад монитора прикроватного и соответствует кривой давления клина на рисунке 2F.
- Когда кривая клин давления постоянна, запишите систолическое, диастолическое и среднее давление клина.
- Отойдите катетер медленно, а затем измеряют и записывают значения для sPAP2, dPAP2, mPAP2, sRVP2 и dRVP2, как показано на мониторе прикроватный.
- Когда в RV, слегка оттяните канюлю и катетер для измерения средней давление в правом предсердии (RAP). Кривая должна соответствовать кривой RAP на рисунке 2А.
НЕТTE: В этом протоколе крыс умерщвляли после протокола катетеризационную путем экстракции объема циркулирующей крови в то время как под наркозом.
6. Морфология и морфометрия Оценка
Примечание: В этом протоколе животное эвтаназии путем экстракции объема циркулирующей крови в то время как под анестезией. Крысы в любой фазе PAH прогрессии и контроля могут быть использованы в данном протоколе.
- После того, как жертва, вынимают легкие путем разрезания трахеи около 5 мм над бронхиальной развилки и сосудов, которые соединяют легкие к сердцу. Помещенный легкие в холодном солевом растворе. Рассеките левое легкое. Вырезать левого главного бронха на развилке.
- Заполнить 50-мл шприц с 4% параформальдегида, присоедините трубку с канюлю шприца, и повесить шприц около метра над рабочим столом. Установить канюлю в левом главном бронха пассивно заполнить легкие с параформальдегидом.Ручка параформальдегида с осторожностью.
- Выдержите левое легкое в параформальдегидом в течение 48 часов.
- Обезвоживают левое легкое путем инкубирования его последовательно в 70% -ном этаноле (1 ч), 80% этанола (1 ч), 90% этанола (1 ч), 100% этанола (3 ч), ксилола (2 ч) и парафина ( 2 ч).
- Встраивание левое легкое в парафин, с рубчиком легкого, обращенной к кассету.
- Пятно залитых парафином, 4 мкм срезах легких с помощью окрашивания Verhoeff или Elastica-ван Гизону, в соответствии с инструкциями изготовителя 29. Убедитесь , что упругое Пластинки хорошо дифференцированы (как показано на рисунке 3). Сканирование окрашенных срезов при 40-кратном увеличении.
- Разделите легких на 4 квадранта. В каждом квадранте, найти 10 судов с наружным диаметром <50 мкм (интра-ацинарные) и 10 судов с наружным диаметром> 50 мкм (предварительно ацинарные). Сфотографируйте (2 х 40 кадров в легких). Увеличение случайным образом до 20x увеличением и фотография каждого суднав этом поле зрения, чтобы минимизировать смещение отбора.
- Исключено сосуды, которые имеют самый длинный / короткий соотношение диаметра> 2, неполную круглую форму, или крах более чем на одну четверть стенки сосуда.
ПРИМЕЧАНИЕ: Пример исключенного судна показан на рисунке 3b Сделайте каждое изображение на том же увеличении (40х) и включают в себя масштабную линейку. - Открыть ImageJ и первая картина. Нарисуйте прямую линию на шкале дистанций на картинке , чтобы установить масштаб с помощью "Analyse" и "Установить масштаб" . Для "известном расстоянии" использовать значение по шкале бара картинки. Используйте микрометров (мкм) в качестве единицы длины. Установите масштаб глобальной.
- Использование "выборы от руки" нарисовать линию на внутренней границе зоны просвету (рисунок 3), и использовать "измерения" (Crtl м), чтобы измерить эту область. Затем проведите линию вокруг внешнего ELASTIC пластинкой (рис 3) для измерения общей площади сосуда.
- Вычислить полостную и наружный диаметр (
 ) с помощью
) с помощью  ,
, - Рассчитать толщину стенки с помощью
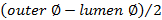 ,
, - Вычислить соотношение стенки / светового потока с помощью
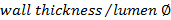 ,
, - Вычислить счет закупорки, используя
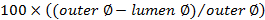 ,
, - Оценка судна на muscularization (нет, частичная или общая muscularization) (рис 3B).
ПРИМЕЧАНИЕ: Суда с двойной эластичной пластинки для более половины окружности определяются как полностью muscularized. Сосуды с двойной эластичной оболочкой менее половины окружности определяются как частично muscularized. - Оценка судна на присутствии Неине ntima (да или нет) (рис 3C).
ПРИМЕЧАНИЕ: Суда без четко определенной внутренней упругой пластинки в сочетании с (часто эксцентричный) полостной окклюзии определяются как неоинтимы поражений.
Результаты
Типичные результаты представлены на рисунке 4. Представленные результаты показывают характеристики МСТ + FLOW у крыс Льюиса в следующих группах: Контроль (n = 3), MF8 (п = 5), MF14 (п = 5), MF28 (п = 5) и MF-ФВР ( п = 10). Статистический анализ проводили с использованием односторонне?...
Обсуждение
Этот метод описывает хирургическую процедуру с аорто-кавальной шунта у крыс, предварительно обработанных МСТ для создания индуцированной движением PAH и методики оценки принцип гемодинамические и гистопатологические конечные точки, которые характеризуют PAH и эту модель.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This study was supported by the Netherlands Cardiovascular Research Initiative, the Dutch Heart Foundation, the Dutch Federation of University Medical Centers, the Netherlands Organization for Health Research and Development, and the Royal Netherlands Academy of Sciences (CVON nr. 2012-08, PHAEDRA, The Sebald fund, Stichting Hartekind).
Материалы
| Name | Company | Catalog Number | Comments |
| Shunt Surgery | |||
| Sterile surgical gloves | |||
| Duratears Eye ointment | Alcon | 10380 | |
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Histoacryllic tissue glue | B. Braun Medical | 1050052 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Safil 4-0 sutures violet resorbable | B. Braun Medical | ||
| 18 G needle | Luer | NN1838R BD | tip bent in 45 degrees orifice to the outside |
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Temgesic Buprenorphine | RB Pharmaceuticals | 5429 | subcutaneous injection |
| Sodium Chloride 0.9% | |||
| Ventilation mask Rat | |||
| Scalple blade | |||
| Biemer clamp 18 mm, 5 mm opening | AgnTho | 64-562 | |
| Heat mat | |||
| Kocher Clamp | |||
| Shaving machine | |||
| Microscope | Leica | ||
| Right Heart Catheterization | |||
| Sterile surgical gloves | |||
| Eye ointment | Duratears | ||
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Needle 20 G | Luer | Tip slightly bent to the inside | |
| Cannula 20 G | Luer | to introduce catheter, tip pre-formed in 20 degrees | |
| Silastic Catheter 15 cm long | 0.5 mm ball 2 mm from tip | ||
| Pressure transducer | Ailtech | ||
| Bedside monitor Cardiocap/5 | Datex-Ohmeda | ||
| Shaving machine | |||
| 10 mL Syringe | |||
| Sodium Chloride 0.9% | for flushing | ||
| Vascular Morphology | |||
| 50 mL Syringe | |||
| 4% Formaldehyde | |||
| 18 G cannula with tube | |||
| Verhoef staining kit | Sigma-Aldrich | HT254 | http://www.sigmaaldrich.com/catalog/product/sigma/ht254?lang=en®ion=US |
| Digital slide scanner | Hamamatsu | C9600 | |
| ImageJ | |||
| Elastic (Connective Tissue Stain) | Abcam | ab150667 | http://www.abcam.com/elastic-connective-tissue-stain-ab150667.html http://www.abcam.com/ps/products/150/ab150667/documents/ab150667-Elastic%20Stain%20Kit%20(website).pdf |
Ссылки
- Hoeper, M. M., Bogaard, H. J., Condliffe, R., et al. Definitions and diagnosis of pulmonary hypertension. J Am Coll Cardiol. 62, D42-D50 (2013).
- Stacher, E., Graham, B. B., Hunt, J. M., et al. Modern age pathology of pulmonary arterial hypertension. Am J Respir Crit Care Med. 186 (3), 261-272 (2012).
- Levy, M., Maurey, C., Celermajer, D. S., et al. Impaired apoptosis of pulmonary endothelial cells is associated with intimal proliferation and irreversibility of pulmonary hypertension in congenital heart disease. J Am Coll Cardiol. 49 (7), 803-810 (2007).
- Sakao, S., Tatsumi, K., Voelkel, N. F. Reversible or irreversible remodeling in pulmonary arterial hypertension. Am J Respir Cell Mol Biol. 43 (6), 629-634 (2010).
- Gomez-Arroyo, J. G., Farkas, L., Alhussaini, A. A., et al. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 302 (4), L363-L369 (2012).
- Jones, J. E. Serial noninvasive assessment of progressive pulmonary hypertension in a rat model. Am J Physiol - Heart Circ Physiol. 283 (1), 364-371 (2002).
- Hoffman, J. I., Rudolph, A. M., Heymann, M. A. Pulmonary vascular disease with congenital heart lesions: Pathologic features and causes. Circulation. 64 (5), 873-877 (1981).
- van Albada, M. E., Berger, R. M. Pulmonary arterial hypertension in congenital cardiac disease--the need for refinement of the evian-venice classification. Cardiol Young. 18 (1), 10-17 (2008).
- Dickinson, M. G., Bartelds, B., Borgdorff, M. A., Berger, R. M. The role of disturbed blood flow in the development of pulmonary arterial hypertension: Lessons from preclinical animal models. Am J Physiol Lung Cell Mol Physiol. 305 (1), L1-L14 (2013).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovasc Res. 24 (5), 430-432 (1990).
- Okada, K., Tanaka, Y., Bernstein, M., Zhang, W., Patterson, G. A., Botney, M. D. Pulmonary hemodynamics modify the rat pulmonary artery response to injury. A neointimal model of pulmonary hypertension. Am J Pathol. 151 (4), 1019-1025 (1997).
- van Albada, M. E., Schoemaker, R. G., Kemna, M. S., Cromme-Dijkhuis, A. H., van Veghel, R., Berger, R. M. The role of increased pulmonary blood flow in pulmonary arterial hypertension. Eur Respir J. 26 (3), 487-493 (2005).
- Brittain, E. Echocardiographic assessment of the right heart in mice. JVis Exp. (e81), (2013).
- Dickinson, M. G., Bartelds, B., Molema, G., et al. Egr-1 expression during neointimal development in flow-associated pulmonary hypertension. Am J Pathol. 179 (5), 2199-2209 (2011).
- Borgdorff, M. A., Bartelds, B., Dickinson, M. G., Steendijk, P., de Vroomen, M., Berger, R. M. Distinct loading conditions reveal various patterns of right ventricular adaptation. Am J Physiol Heart Circ Physiol. 305 (3), H354-H364 (2013).
- Ruiter, G., de Man, F. S., Schalij, I., et al. Reversibility of the monocrotaline pulmonary hypertension rat model. Eur Respir J. 42 (2), 553-556 (2013).
- van Albada, M. E., Bartelds, B., Wijnberg, H., et al. Gene expression profile in flow-associated pulmonary arterial hypertension with neointimal lesions. Am J Physiol Lung Cell Mol Physiol. 298 (4), L483-L491 (2010).
- Dickinson, M. G., Kowalski, P. S., Bartelds, B., et al. A critical role for egr-1 during vascular remodelling in pulmonary arterial hypertension. Cardiovasc Res. 103 (4), 573-584 (2014).
- van der Feen, D. E., Dickinson, M. G., Bartelds, M. G., et al. Egr-1 identifies neointimal remodeling and relates to progression in human pulmonary arterial hypertension. Jheart lung transplant. 35 (4), 481-490 (2016).
- Rungatscher, A. Chronic overcirculation-induced pulmonary arterial hypertension in aorto-caval shunt. Microvasc Res. 94, 73-79 (2014).
- O'Blenes, S. B., Fischer, S., McIntyre, B., Keshavjee, S., Rabinovitch, M. Hemodynamic unloading leads to regression of pulmonary vascular disease in rats. J Thorac Cardiovasc Surg. 121 (2), 279-289 (2001).
- Sakao, S., Taraseviciene-Stewart, L., Lee, J. D., Wood, K., Cool, C. D., Voelkel, N. F. Initial apoptosis is followed by increased proliferation of apoptosis-resistant endothelial cells. FASEB J. 19 (9), 1178-1180 (2005).
- Spiekerkoetter, E. FK506 activates BMPR2, rescues endothelial dysfunction, and reverses pulmonary hypertension. J Clin Invest. 123 (8), 3600-3613 (2013).
- Nickel, N. P., Spiekerkoetter, E., Gu, M., et al. Elafin reverses pulmonary hypertension via caveolin-1-dependent bone morphogenetic protein signaling. Am J Respir Crit Care Med. 191 (11), 1273-1286 (2015).
- Meloche, J., Potus, F., Vaillancourt, M., et al. Bromodomain-containing protein 4: The epigenetic origin of pulmonary arterial hypertension. Circ Res. 117 (6), 525-535 (2015).
- Happé, C. M. Pneumonectomy combined with SU5416 induces severe pulmonary hypertension in rats. Am J Physiol Lung Cell Mol Physiol. 310 (11), L1088-L1097 (2016).
- Ranchoux, B., Antigny, F., Rucker-Martin, C., et al. Endothelial-to-mesenchymal transition in pulmonary hypertension. Circulation. 131 (11), 1006-1018 (2015).
- de Raaf, M. A. SuHx rat model: Partly reversible pulmonary hypertension and progressive intima obstruction. Eur Respy J. 44 (1), 160-168 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены