Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Chirurgie Shunt, droite Cathétérisme cardiaque et vasculaire Morphometry dans un modèle de rat pour Flow-induite Hypertension artérielle pulmonaire
Dans cet article
Résumé
This protocol describes a surgical procedure to create a model for flow-induced pulmonary arterial hypertension (PAH) in rats and the procedures to analyze the principle hemodynamic and histological end-points in this model.
Résumé
In this protocol, PAH is induced by combining a 60 mg/kg monocrotalin (MCT) injection with increased pulmonary blood flow through an aorto-caval shunt (MCT+Flow). The shunt is created by inserting an 18-G needle from the abdominal aorta into the adjacent caval vein. Increased pulmonary flow has been demonstrated as an essential trigger for a severe form of PAH with distinct phases of disease progression, characterized by early medial hypertrophy followed by neointimal lesions and the progressive occlusion of the small pulmonary vessels. To measure the right heart and pulmonary hemodynamics in this model, right heart catheterization is performed by inserting a rigid cannula containing a flexible ball-tip catheter via the right jugular vein into the right ventricle. The catheter is then advanced into the main and the more distal pulmonary arteries. The histopathology of the pulmonary vasculature is assessed qualitatively, by scoring the pre- and intra-acinar vessels on the degree of muscularization and the presence of a neointima, and quantitatively, by measuring the wall thickness, the wall-lumen ratios, and the occlusion score.
Introduction
Le but de cette méthode est de créer un modèle reproductible sévère, l'hypertension artérielle pulmonaire induite par l'écoulement chez le rat et de mesurer son principe hémodynamique et le point final histopathologiques.
L'hypertension artérielle pulmonaire (HTAP) est un syndrome clinique qui englobe une augmentation progressive de la résistance vasculaire pulmonaire conduisant à une insuffisance ventriculaire droite et la mort. Dans le spectre de la maladie superordinate des maladies hypertensives pulmonaires (PH), les HAP est la forme la plus grave et qui reste sans traitement 1. L'artériopathie sous-jacente dans l'HTAP se caractérise par une forme typique de remodelage vasculaire qui obstrue la lumière du vaisseau. Muscularisation des navires et l' hypertrophie de la couche de vaisseau médial non muscularized normales sont considérés comme des phénomènes précoces de la maladie dans les HAP, sont également observées dans d' autres formes de PH 2, et sont pensés pour être réversibles 3. Comme les HAP unees progrès, la couche intimale commence à remodeler, pour finalement former des lésions néointima caractéristiques 2. De type néo - intimale vasculaire pulmonaire remodelage est exclusive aux HAP et est actuellement considérée comme irréversible 4.
Comme les HAP est une maladie rare, les progrès dans sa compréhension pathobiologique et le développement de nouvelles thérapies se sont fortement appuyés sur des modèles animaux. Le monocrotalin (MCT) modèle chez le rat est un modèle simple à succès unique qui a été, et est toujours, utilisé fréquemment. MCT est une toxine qui provoque des lésions aux artérioles pulmonaires et une inflammation régionale 5. 60 mg / kg MCT conduit à une augmentation de la pression moyenne de l' artère pulmonaire (PAPm), la résistance vasculaire pulmonaire (PVR), et l' hypertrophie ventriculaire droite (HRV) après 3 - 4 semaines 6. Le histomorphologie se caractérise par une hypertrophie isolée médiane sans lésions néointima 5. Le MCTmodèle de rat représente donc une forme modérée de PH, et non les HAP, mais il est communément présenté comme celui-ci.
Chez les enfants atteints d'HTAP associée à un shunt congénitale de gauche à droite (PAH-CHD), augmentation du débit sanguin pulmonaire est considéré comme le déclencheur essentiel pour le développement des lésions néointima 7, 8, 9. Chez le rat, une augmentation du débit sanguin pulmonaire peut être induite par la mise en place d'un shunt entre l'aorte abdominale et la veine cave, une première technique décrite en 1990 10. Alternatives pour créer un flux pulmonaire accrue sont par pneumonectomie unilatérale ou par clavière anastomose de l' artère pulmonaire 11. inconvénients conceptuels de ces modèles se composent de croissance compensatoire potentiel du poumon restant et activation de la voie adaptative induite par la pneumonectomie ou de blessure iatrogène de la vascularisation pulmonaire dueanastomose de l'artère pulmonaire, à la fois confondant les effets de l'augmentation du débit sanguin pulmonaire.
Quand un shunt aorto-caval est créé et une augmentation du flux sanguin pulmonaire est induite en tant que deuxième succès chez les rats MCT-traités, des lésions néointima caractéristiques se produisent, et une forme sévère de l'HTAP et insuffisance ventriculaire droite associée (RVF) développent 3 semaines après l'augmentation débit 12. La progression hémodynamique des HAP dans ce modèle peut être évaluée in vivo par échocardiographie et cathétérisme cardiaque droit. Le histomorphologie vasculaire, l' épaisseur de la paroi de la cuve, le degré d'artérioles occlusion, et les paramètres de l' insuffisance ventriculaire droite forment les piliers de l'ex vivo caractérisation des HAP.
Cette méthode décrit des protocoles détaillés pour la chirurgie aorto-caval shunt (AC-shunt), cathétérisme cardiaque droit, et l'évaluation qualitative et quantitative des histomorphologie vasculaire.
Protocole
Les procédures impliquant des sujets animaux ont été approuvés par le Comité central néerlandais pour l'expérimentation animale et le soin des animaux Comité à l'Université Medical Center Groningen (NL). Les deux rats Wistar Lewis et ayant un grammage compris entre 180 et 300 g ont été utilisés.
1. Logement et Acclimatation
- Après l'arrivée à l'animalerie centrale, les rats des maisons en groupes de 5 par cage. Au cours d'une période d'acclimatation de 7 jours, accoutumer les rats à la manipulation humaine, mais ne pas effectuer toutes les procédures expérimentales.
2. Préparation et injection de stérile Monocrotalin
- Pour 1 ml de 60 mg / ml monocrotalin (TCM) en solution, peser 60 mg d'monocrotalin dans un tube de 2 ml. Ajouter 700 ul de NaCl à 0,9%. Ajouter 200 ul de 1 M HCl. Réchauffer la solution dans le tube sous l'eau courante chaude du robinet et le vortex il. Utiliser NaOH 6 N pour amener le pH vers 7,0. Utiliser une technique stérile pour la préparation du MCT pour l'injection dans les rongeurs.
- Injecter 1 mL de 60 mg de solution stérile / ml de TCM par kg par voie sous cutanée dans le cou (0,3 ml de 60 mg / ml de MCT pour 300 g de rat). NOTE: Nous préférons ne pas utiliser de plus petits volumes en raison de la plus grande chance que la dose injectée ne sera pas appropriée.
Chirurgie Shunt 3. Aorte-caval
- Anesthésie.
- Remplir la chambre d'induction avec 5% d' isoflurane / 100% O 2 (débit: 1 L / min) et placer le rat dans la chambre. Vérifiez la profondeur adéquate de l'anesthésie en effectuant un pincement de l'orteil arrière. Peser le rat.
- Rasage et nettoyer l'abdomen sur une zone qui est d'environ 8 cm de long et 3 cm de large. Placez le rat sur le dos sur un tapis de chaleur (37 ° C) couverte par un tapis stérile.
- Placez le museau dans une ventilation masque / hotte avec 2 - 3% d' isoflurane / 100% O 2 (débit: 1 L / min). Vérifiez la profondeur de l'anesthésie en effectuant un pincement de l'orteil arrière. Appliquer une pommade oculaire pour prévenir la sécheresse sous anesthésie.
- Shunt Surgery.
- Frotter la peau avec du chlorure-hexidine pour la désinfection. Injecter 0,01 mg / kg par voie sous cutanée buprénorphine pour l'analgésie post-opératoire.
- Utiliser des instruments stériles pour la chirurgie. Faire une incision avec une lame de scalpel # 10 dans l'abdomen sur la ligne médiane, à partir de 1 cm en dessous du diaphragme un descendant juste au-dessus des organes génitaux.
- Soulever l'intestin avec un coton-tige, couvrir les intestins dans une gaze stérile, humide (NaCl à 0,9%), et les placer sur le côté gauche de l'animal.
- Utiliser des tampons de coton pour séparer les membranes qui retiennent l'aorte abdominale et la veine cave inférieure aux tissus environnants.
REMARQUE: Ne pas disséquer les membranes entre l'aorte et la veine cave. - En utilisant des pinces dissidents, enlever la graisse aortique périvasculaire juste au-dessus de la bifurcation, que sur le côté droit de l'aorte et uniquement sur le site où l'aiguille sera insérée.
- Utilisez des cotons-tiges pour séparer l'aorte et la veine cave de 2 mm supeRior sur le site où l'aiguille sera insérée dans le but de créer un espace pour une pince Biemer.
- A ce domaine, la première place une ligature lâche (5-0 de suture) autour de l'aorte. Créer la tension sur la ligature en plaçant une pince de Kocher sur elle, puis placez le Kocher supérieur à l'incision (figure 1A). Placez le Biemer pince juste au- dessus de la ligature (Figur e 1A).
- En utilisant un coton - tige, comprimer la veine cave comme distalement que possible pour gêner la circulation (figure 1A). Pliez une aiguille (18 G dans ce protocole) dans un angle de 45 degrés, avec le pointage de l' orifice vers l'extérieur (figure 1A).
- Sous un angle de 90 degrés, insérer l'aiguille dans l'aorte juste au- dessus de la bifurcation, avec l'orifice de l'aiguille pointant vers la gauche (figure 1A). Manipuler la pointe de l'aiguille vers la gauche et l'insérer dans la veine cave.
NOTE: La pointe de l'aiguille doit maintenant être visible dans la veine cave (figure 1B). - Utiliser un second coton-tige pour pousser le sang restant dans l'aorte hors du site d'insertion pour prévenir la thrombose. Sécher la zone autour du shunt avec une gaze stérile pour que la colle pour coller de manière adéquate.
- Retirez l'aiguille entière de l'aorte et appliquer immédiatement une goutte de colle de tissu sur le site de ponction dans l'aorte. Assurez-vous de ne pas coller le coton-tige sur le tissu. Débrider l'aorte.
- Vérifier le shunt manuellement en tirant sur et en relâchant la ligature proximale aorte au shunt. Relâchement devrait colorer la partie distale de la veine cave du shunt en rouge vif et créer des turbulences sur le site de shunt.
NOTE: Serrage tournera le sang dans la veine cave retour au rouge foncé. - Placez les intestins de retour chez l'animal. Fermez la couche musculaire et la peau avec résorbables 4-0 sutures. Aérer l'animal avec 100% O 2 pour récupérer de l' anesthésie.
REMARQUE: Ne pas laisser un animal sans surveillance jusqu'à ce qu'il ait repris connaissance suffisante pour maintenir décubitus sternale.
- Chirurgie Sham.
- Effectuer toutes les procédures ci-dessus, sauf pour l'insertion de l'aiguille dans l'aorte.
- Les soins post-chirurgicaux.
- Placer le rat dans une cage unique et dans un incubateur à 37 ° C jusqu'au lendemain matin.
- Vers 6 h après la chirurgie, injecter 0,01 mg / kg par voie sous cutanée buprénorphine pour l'analgésie post-opératoire. Répétez le lendemain matin si le rat montre des signes d'inconfort.
NOTE: Les 3 premiers jours après la chirurgie, les rats ont tendance à manger et à boire moins (ce qui est particulièrement important lorsque chow ou de l'eau potable sont mélangés avec des médicaments). La plupart des rats montrent un comportement normal 3 jours après la chirurgie. Sinon, suivre de près. La perte de poids supérieure à 15% en 1 semaine est considérée comme anormale et ces rats doivent être euthanasiés par l'extraction du volume de sang en circulation sous anesthésie.
4. Développement de l'HTAP
REMARQUE: Dans ce protocole, l'animal est euthanasie par l'extraction du volume de sang en circulation sous anesthésie.
- Sacrifiez 1 jour après l'intervention chirurgicale (MF8) pour les réponses cellulaires et fonctionnelles précoces à l' augmentation du débit sanguin pulmonaire (par exemple, le gène de régulation à la hausse ou à des facteurs de transcription précoce).
- Sacrifiez 1 semaine après la chirurgie (MF14) pour un phénotype PAH vasculaire stade précoce (hypertrophie médiale sans lésions néointima).
- Sacrifiez 2 semaines après la chirurgie (MF21) pour une HTAP vasculaire phénotype à un stade avancé (marqué hypertrophie médiale et la formation néointimale) avec une légère élévation dans RVP et PAPm.
- Sacrifiez 3 semaines après la chirurgie (MF28) pour une HTAP vasculaire phénotype stade terminal (occlusion néointimale marquée) et une forte élévation de la RVP et PAPm. Les signes cliniques d'insuffisance ventriculaire droite sont courantes dans ce stade.
- Sacrifice après jour 28 (MF-RVF) Pour insuffisance ventriculaire droite HTAP associée (RVF), cliniquement définie comme la dyspnée, léthargie sévère, et la perte de poids (<10% en 1 semaine). Terminate rats lorsque l'un de ces signes est présent. Souvent, les rats développent ces symptômes entre les jours 28 et 35 et, si on les laisse sans surveillance, meurent spontanément pendant cet intervalle de temps.
5. Droit Coeur cathétérisme
- Anesthésie.
- Remplir la chambre d'induction avec 5% d' isoflurane / 100% O 2 (débit: 1 L / min) et placer le rat dans la boîte. Vérifiez la profondeur adéquate de l'anesthésie en effectuant un pincement de l'orteil arrière. Peser le rat.
- Rasage et nettoyer le cou sur le côté droit-ventral du rat et, pour le protocole échocardiographie, le thorax et l'abdomen supérieur.
- Placez le rat sur le dos sur un tapis de chaleur (37 ° C) et placer le museau dans une ventilation masque / hotte avec 2 - 3% d' isoflurane / 100% O 2 (débit: 1 L / min). Le museau doit être orienté vers le chercheur.
- Contrôler la profondeur de l'anesthésie. Soyez prudent avec les rats avec PH sévère. Si la fréquence cardiaque diminue, réduire la profondeur de l'anesthésie. Préférable, effectuer toutes les mesures dans les 20 min. Appliquer une pommade oculaire pour prévenir la sécheresse sous anesthésie.
- protocole échocardiographie.
- Effectuer l'échocardiographie selon le protocole décrit par Brittain et al. dans JoVE 13.
- protocole de cathétérisme.
NOTE: Ce protocole utilise une canule rigide avec une pointe préformée plié à 20 degrés pour guider le cathéter de silicium de 15 cm avec un ballon de 2 mm de la pointe. Une aiguille de 20 G avec son orifice légèrement plié vers l'intérieur est utilisé pour insérer la canule dans la veine jugulaire droite (voir la liste des matériaux). Rats à toute phase de progression et de contrôle des HAP peuvent être utilisés dans ce protocole.- Désinfecter le cou avec du chlorure-hexidine. Faire une incision de 1,5 cm avec une lame de scalpel # 10 dans la partie droite-ventraledu cou, de la clavicule droite à l'os mandibulaire.
- Étaler le tissu avec des ciseaux. En utilisant une pince à épiler, retirez délicatement le tissu en dehors jusqu'à la veine jugulaire apparaît. Disséquer les membranes autour de la veine jugulaire en utilisant une pince à échardes.
- Mettez la tension sur la veine jugulaire en plaçant une ligature lâche (5-0 de suture) autour de la cuve. Augmenter la tension et la bande de la ligature sur le masque de ventilation (figure 2A).
- En aval du site d'insertion, placer une ligature lâche autour du récipient à serrer après que la canule est en place afin d'éviter les fuites et les pertes de pression.
- En utilisant les poignées d'une pince à cintrer légèrement la pointe d'une aiguille 20 G avec l'orifice à l'intérieur pour diriger la canule avec le cathéter.
- Introduire la pointe de l'aiguille de 20 G dans la veine et placer rapidement la canule contenant le cathéter à l'intérieur du navire. Retirez l'aiguille, puis fermez la ligaturequi a été préparé à l'étape 5.3.4.
- Procéder à la canule contenant le cathéter dans la veine jugulaire. La pointe de la canule est à une courbe de 20 degrés (voir étape 5.3.5). Manœuvrer la canule sous la clavicule et de faire avancer un peu pour entrer dans l'oreillette droite (figure 2C).
- Pour entrer dans le ventricule droit, pointer le bout de la canule vers la gauche, vers le cœur (figure 2D). Sur le moniteur de chevet, une courbe de pression de RV devrait apparaître, correspondant à la figure 2D.
- Lorsque la courbe de pression de RV est constante, notez la pression ventriculaire droite systolique et diastolique 1 (sRVP1 / dRVP1).
- Manipuler la pointe de la canule vers la gauche et vers le haut. Faire avancer le cathéter dans la canule (figure 2E).
- Faire avancer le cathéter dans l'artère pulmonaire (PA). Aucune résistance doit être ressentie lors du passage de la valve pulmonaire.
REMARQUE: Lorsque le cathéter pénètre dans l'artère pulmonaire, le dla pression iastolic va augmenter. Sur le moniteur de chevet, une courbe de pression PA devrait apparaître, correspondant à la figure 2E. - Lorsque la courbe de pression PA est constante, notez la pression systolique, diastolique et moyenne pression PA 1 (sPAP1, dPAP1, mPAP1).
- Faire progresser le cathéter dans la canule jusqu'à ce que la balle à la pointe du cathéter vient se coincer dans une artère pulmonaire. Observez la courbe de pression sur le moniteur chute de chevet et correspondre à la courbe de pression de coin à la figure 2F.
- Lorsque la courbe de pression de coin est constante, notez la pression systolique, diastolique et moyenne pression de coin.
- Tirez lentement le cathéter, puis mesurer et noter les valeurs pour sPAP2, dPAP2, mPAP2, sRVP2 et dRVP2, tel qu'il est affiché sur le moniteur de chevet.
- Lorsque dans le RV, légèrement retirer la canule et le cathéter pour mesurer la pression auriculaire droite (RAP) signifie. La courbe doit correspondre à la courbe de RAP dans la figure 2A.
NONTE: Dans ce protocole, les rats sont euthanasiés après le protocole de cathétérisation par l'extraction du volume de sang en circulation sous anesthésie.
6. Évaluation Morphologie et morphométrie
REMARQUE: Dans ce protocole, l'animal est euthanasie par l'extraction du volume de sang en circulation sous anesthésie. Rats à toute phase de progression et de contrôle des HAP peuvent être utilisés dans ce protocole.
- Après le sacrifice, sortez les poumons en coupant la trachée à environ 5 mm au-dessus de la bifurcation des bronches et les vaisseaux qui relient les poumons vers le cœur. Mettez les poumons dans une solution saline froide. Disséquer le poumon gauche. Couper la bronche principale gauche à la bifurcation.
- Remplir une seringue de 50 ml avec 4% de paraformaldehyde, fixez un tube avec une canule à la seringue, et accrocher la seringue d'un mètre au-dessus de la table de travail. Monter la canule dans la bronche principale gauche pour remplir passivement le poumon avec du paraformaldéhyde.Poignée paraformaldéhyde avec prudence.
- Laisser incuber le poumon gauche dans le paraformaldehyde pendant 48 h.
- Déshydrater le poumon gauche en l'incubant successivement dans 70% d'éthanol (1 h), 80% d'éthanol (1 h), 90% d'éthanol (1 h), 100% d'éthanol (3 h), le xylol (2 h) et de la paraffine ( 2 h).
- Incorporer le poumon gauche dans de la paraffine, à l'hile du poumon en regard de la cassette.
- Colorer les sections pulmonaires 4 um paraffine en utilisant une coloration Verhoeff ou Elastica van Gieson, selon les instructions du fabricant 29. Assurez - vous que les lames élastiques sont bien différenciés (comme dans la figure 3). Balayez les coupes colorées à un grossissement de 40X.
- Divisez le poumon en 4 quadrants. Dans chaque quadrant, trouver 10 navires avec un diamètre extérieur <50 pm (intra-acineuses) et 10 navires avec un diamètre extérieur> 50 pm (pré-acineuses). Prenez une photo (2 x 40 images par poumon). Zoom au hasard jusqu'à un grossissement de 20x et photographier tous les naviresdans ce domaine en vue de minimiser les biais de sélection.
- Exclure les navires qui ont un plus long le plus court rapport qualité / diamètre> 2, une forme circulaire incomplète, ou un effondrement de plus d'un quart de la paroi du vaisseau.
NOTE: Un exemple d'un navire exclu est représenté sur la figure 3b Faire de chaque image sur le même grossissement (40X) et inclure une barre d'échelle. - Ouvrir ImageJ et la première image. Tracer une ligne droite sur la barre d'échelle dans l'image pour définir l'échelle via "Analyse" et "Définir l' échelle." Pour "distance connue," utiliser la valeur sur la barre d'échelle de l'image. Utiliser micromètres (um) comme unité de longueur. Réglez l'échelle mondiale.
- Utilisation de "sélections à main levée," tracer une ligne sur la bordure intérieure de la zone luminale (figure 3), et utiliser "mesure" (Ctrl m) pour mesurer ce domaine. Ensuite, tracer une ligne autour de la elast extérieureic lamina (Figure 3) pour mesurer la zone de navires total.
- Calculer le luminal et le diamètre extérieur (
 ) en utilisant
) en utilisant  .
. - Calculer l'épaisseur de la paroi à l'aide
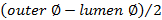 .
. - Calculer le rapport paroi / lumière en utilisant
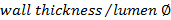 .
. - Calculer le score d'occlusion en utilisant
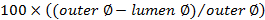 .
. - Note du navire sur muscularisation (non, muscularisation partielle ou totale) (figure 3B).
NOTE: Les navires ayant une limitante élastique double pour plus de la moitié de la circonférence sont définies comme totalement muscularized. Les navires ayant une lame élastique à double moins de la moitié de la circonférence sont définies comme partiellement muscularized. - Marquer le navire en présence d'un Neointima (oui ou non) (figure 3C).
NOTE: Les navires sans limitante élastique interne clairement définie combinée avec (souvent excentrique) luminal occlusion sont définis comme des lésions néointima.
Résultats
Les résultats représentatifs sont présentés dans la figure 4. Les résultats présentés montrent des caractéristiques de MCT + FLOW chez des rats Lewis dans les groupes suivants: contrôle (n = 3), MF8 (n = 5), MF14 (n = 5), MF28 (n = 5), et MF-FVR ( n = 10). Des analyses statistiques ont été réalisées à l'aide d'une ANOVA avec correction de Bonferroni.
60 mg / kg de MCT et l'augmentatio...
Discussion
Cette méthode décrit la procédure chirurgicale d'un shunt aorto-caval chez les rats pré-traités avec MCT pour créer HTAP induite par le flux et les techniques pour évaluer l'hémodynamique principe et la fin histopathologiques qui caractérisent les HAP et ce modèle.
Étapes critiques au sein du Protocole et de dépannage
La chirurgie et post-chirurgie. Au cours de la chirurgie de shunt aorto-caval, l'étape la plus critique est la dissection de ...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This study was supported by the Netherlands Cardiovascular Research Initiative, the Dutch Heart Foundation, the Dutch Federation of University Medical Centers, the Netherlands Organization for Health Research and Development, and the Royal Netherlands Academy of Sciences (CVON nr. 2012-08, PHAEDRA, The Sebald fund, Stichting Hartekind).
matériels
| Name | Company | Catalog Number | Comments |
| Shunt Surgery | |||
| Sterile surgical gloves | |||
| Duratears Eye ointment | Alcon | 10380 | |
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Histoacryllic tissue glue | B. Braun Medical | 1050052 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Safil 4-0 sutures violet resorbable | B. Braun Medical | ||
| 18 G needle | Luer | NN1838R BD | tip bent in 45 degrees orifice to the outside |
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Temgesic Buprenorphine | RB Pharmaceuticals | 5429 | subcutaneous injection |
| Sodium Chloride 0.9% | |||
| Ventilation mask Rat | |||
| Scalple blade | |||
| Biemer clamp 18 mm, 5 mm opening | AgnTho | 64-562 | |
| Heat mat | |||
| Kocher Clamp | |||
| Shaving machine | |||
| Microscope | Leica | ||
| Right Heart Catheterization | |||
| Sterile surgical gloves | |||
| Eye ointment | Duratears | ||
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Needle 20 G | Luer | Tip slightly bent to the inside | |
| Cannula 20 G | Luer | to introduce catheter, tip pre-formed in 20 degrees | |
| Silastic Catheter 15 cm long | 0.5 mm ball 2 mm from tip | ||
| Pressure transducer | Ailtech | ||
| Bedside monitor Cardiocap/5 | Datex-Ohmeda | ||
| Shaving machine | |||
| 10 mL Syringe | |||
| Sodium Chloride 0.9% | for flushing | ||
| Vascular Morphology | |||
| 50 mL Syringe | |||
| 4% Formaldehyde | |||
| 18 G cannula with tube | |||
| Verhoef staining kit | Sigma-Aldrich | HT254 | http://www.sigmaaldrich.com/catalog/product/sigma/ht254?lang=en®ion=US |
| Digital slide scanner | Hamamatsu | C9600 | |
| ImageJ | |||
| Elastic (Connective Tissue Stain) | Abcam | ab150667 | http://www.abcam.com/elastic-connective-tissue-stain-ab150667.html http://www.abcam.com/ps/products/150/ab150667/documents/ab150667-Elastic%20Stain%20Kit%20(website).pdf |
Références
- Hoeper, M. M., Bogaard, H. J., Condliffe, R., et al. Definitions and diagnosis of pulmonary hypertension. J Am Coll Cardiol. 62, D42-D50 (2013).
- Stacher, E., Graham, B. B., Hunt, J. M., et al. Modern age pathology of pulmonary arterial hypertension. Am J Respir Crit Care Med. 186 (3), 261-272 (2012).
- Levy, M., Maurey, C., Celermajer, D. S., et al. Impaired apoptosis of pulmonary endothelial cells is associated with intimal proliferation and irreversibility of pulmonary hypertension in congenital heart disease. J Am Coll Cardiol. 49 (7), 803-810 (2007).
- Sakao, S., Tatsumi, K., Voelkel, N. F. Reversible or irreversible remodeling in pulmonary arterial hypertension. Am J Respir Cell Mol Biol. 43 (6), 629-634 (2010).
- Gomez-Arroyo, J. G., Farkas, L., Alhussaini, A. A., et al. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 302 (4), L363-L369 (2012).
- Jones, J. E. Serial noninvasive assessment of progressive pulmonary hypertension in a rat model. Am J Physiol - Heart Circ Physiol. 283 (1), 364-371 (2002).
- Hoffman, J. I., Rudolph, A. M., Heymann, M. A. Pulmonary vascular disease with congenital heart lesions: Pathologic features and causes. Circulation. 64 (5), 873-877 (1981).
- van Albada, M. E., Berger, R. M. Pulmonary arterial hypertension in congenital cardiac disease--the need for refinement of the evian-venice classification. Cardiol Young. 18 (1), 10-17 (2008).
- Dickinson, M. G., Bartelds, B., Borgdorff, M. A., Berger, R. M. The role of disturbed blood flow in the development of pulmonary arterial hypertension: Lessons from preclinical animal models. Am J Physiol Lung Cell Mol Physiol. 305 (1), L1-L14 (2013).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovasc Res. 24 (5), 430-432 (1990).
- Okada, K., Tanaka, Y., Bernstein, M., Zhang, W., Patterson, G. A., Botney, M. D. Pulmonary hemodynamics modify the rat pulmonary artery response to injury. A neointimal model of pulmonary hypertension. Am J Pathol. 151 (4), 1019-1025 (1997).
- van Albada, M. E., Schoemaker, R. G., Kemna, M. S., Cromme-Dijkhuis, A. H., van Veghel, R., Berger, R. M. The role of increased pulmonary blood flow in pulmonary arterial hypertension. Eur Respir J. 26 (3), 487-493 (2005).
- Brittain, E. Echocardiographic assessment of the right heart in mice. JVis Exp. (e81), (2013).
- Dickinson, M. G., Bartelds, B., Molema, G., et al. Egr-1 expression during neointimal development in flow-associated pulmonary hypertension. Am J Pathol. 179 (5), 2199-2209 (2011).
- Borgdorff, M. A., Bartelds, B., Dickinson, M. G., Steendijk, P., de Vroomen, M., Berger, R. M. Distinct loading conditions reveal various patterns of right ventricular adaptation. Am J Physiol Heart Circ Physiol. 305 (3), H354-H364 (2013).
- Ruiter, G., de Man, F. S., Schalij, I., et al. Reversibility of the monocrotaline pulmonary hypertension rat model. Eur Respir J. 42 (2), 553-556 (2013).
- van Albada, M. E., Bartelds, B., Wijnberg, H., et al. Gene expression profile in flow-associated pulmonary arterial hypertension with neointimal lesions. Am J Physiol Lung Cell Mol Physiol. 298 (4), L483-L491 (2010).
- Dickinson, M. G., Kowalski, P. S., Bartelds, B., et al. A critical role for egr-1 during vascular remodelling in pulmonary arterial hypertension. Cardiovasc Res. 103 (4), 573-584 (2014).
- van der Feen, D. E., Dickinson, M. G., Bartelds, M. G., et al. Egr-1 identifies neointimal remodeling and relates to progression in human pulmonary arterial hypertension. Jheart lung transplant. 35 (4), 481-490 (2016).
- Rungatscher, A. Chronic overcirculation-induced pulmonary arterial hypertension in aorto-caval shunt. Microvasc Res. 94, 73-79 (2014).
- O'Blenes, S. B., Fischer, S., McIntyre, B., Keshavjee, S., Rabinovitch, M. Hemodynamic unloading leads to regression of pulmonary vascular disease in rats. J Thorac Cardiovasc Surg. 121 (2), 279-289 (2001).
- Sakao, S., Taraseviciene-Stewart, L., Lee, J. D., Wood, K., Cool, C. D., Voelkel, N. F. Initial apoptosis is followed by increased proliferation of apoptosis-resistant endothelial cells. FASEB J. 19 (9), 1178-1180 (2005).
- Spiekerkoetter, E. FK506 activates BMPR2, rescues endothelial dysfunction, and reverses pulmonary hypertension. J Clin Invest. 123 (8), 3600-3613 (2013).
- Nickel, N. P., Spiekerkoetter, E., Gu, M., et al. Elafin reverses pulmonary hypertension via caveolin-1-dependent bone morphogenetic protein signaling. Am J Respir Crit Care Med. 191 (11), 1273-1286 (2015).
- Meloche, J., Potus, F., Vaillancourt, M., et al. Bromodomain-containing protein 4: The epigenetic origin of pulmonary arterial hypertension. Circ Res. 117 (6), 525-535 (2015).
- Happé, C. M. Pneumonectomy combined with SU5416 induces severe pulmonary hypertension in rats. Am J Physiol Lung Cell Mol Physiol. 310 (11), L1088-L1097 (2016).
- Ranchoux, B., Antigny, F., Rucker-Martin, C., et al. Endothelial-to-mesenchymal transition in pulmonary hypertension. Circulation. 131 (11), 1006-1018 (2015).
- de Raaf, M. A. SuHx rat model: Partly reversible pulmonary hypertension and progressive intima obstruction. Eur Respy J. 44 (1), 160-168 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon