È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Chirurgia Shunt, Destra cuore cateterizzazione, e Vascolare Morfometria in un modello di ratto per Flow-indotta ipertensione arteriosa polmonare
In questo articolo
Riepilogo
This protocol describes a surgical procedure to create a model for flow-induced pulmonary arterial hypertension (PAH) in rats and the procedures to analyze the principle hemodynamic and histological end-points in this model.
Abstract
In this protocol, PAH is induced by combining a 60 mg/kg monocrotalin (MCT) injection with increased pulmonary blood flow through an aorto-caval shunt (MCT+Flow). The shunt is created by inserting an 18-G needle from the abdominal aorta into the adjacent caval vein. Increased pulmonary flow has been demonstrated as an essential trigger for a severe form of PAH with distinct phases of disease progression, characterized by early medial hypertrophy followed by neointimal lesions and the progressive occlusion of the small pulmonary vessels. To measure the right heart and pulmonary hemodynamics in this model, right heart catheterization is performed by inserting a rigid cannula containing a flexible ball-tip catheter via the right jugular vein into the right ventricle. The catheter is then advanced into the main and the more distal pulmonary arteries. The histopathology of the pulmonary vasculature is assessed qualitatively, by scoring the pre- and intra-acinar vessels on the degree of muscularization and the presence of a neointima, and quantitatively, by measuring the wall thickness, the wall-lumen ratios, and the occlusion score.
Introduzione
L'obiettivo di questo metodo è quello di creare un modello riproducibile per grave ipertensione arteriosa polmonare indotto dal flusso in ratti e misurare il suo principio emodinamico e finale istopatologici.
Arteriosa polmonare (PAH) è una sindrome clinica che comprende un progressivo aumento della resistenza vascolare polmonare che porta a insufficienza ventricolare destra e di morte. All'interno dello spettro malattia sovraordinata malattie ipertensive polmonari (PH), PAH è la forma più grave e uno che rimane senza cura 1. L'arteriopatia sottostante PAH è caratterizzata da una forma tipica di rimodellamento vascolare che occlude il lume del vaso. Muscolarizzazione delle navi e l'ipertrofia dello strato nave mediale normali non muscularized sono considerati come fenomeni malattia precoce in PAH, sono visti anche in altre forme di PH 2, e si pensa di essere reversibile 3. Come PAH undvances, lo strato intimale inizia a rimodellare, eventualmente formando caratteristiche lesioni neointimale 2. Neointimale-tipo rimodellamento vascolare polmonare è esclusivo di PAH ed è attualmente considerato essere irreversibili 4.
Come PAH è una malattia rara, i progressi nella sua comprensione patobiologico e lo sviluppo di nuove terapie hanno fatto affidamento su modelli animali. L'(MCT) modello monocrotalin nei ratti è un semplice modello singolo di successo che è stato, ed è tuttora, utilizzato di frequente. MCT è una tossina che provoca lesioni alle arteriole polmonari e infiammazione regionale 5. 60 mg / kg MCT porta ad un aumento nella pressione media arteriosa polmonare (mPAP), resistenza vascolare polmonare (PVR), e ipertrofia ventricolare destra (RVH) dopo 3 - 4 settimane 6. Il istomorfologia è caratterizzata da ipertrofia isolato mediale senza lesioni neointimale 5. la MCTratto rappresenta quindi una forma moderata di PH, e non PAH, anche se è comunemente presentato come quest'ultimo.
Nei bambini con PAH associata con uno shunt congenito sinistra a destra (PAH-CHD), aumento del flusso sanguigno polmonare è considerato come trigger essenziale per lo sviluppo di lesioni neointima 7, 8, 9. Nei ratti, aumento del flusso sanguigno polmonare può essere indotta dalla creazione di uno shunt tra l'aorta addominale e la vena cava, una tecnica descritta nel 1990 10. Alternative per la creazione di un aumento del flusso polmonare sono da pneumonectomia unilaterali o succlavia di arteria polmonare anastomosi 11. svantaggi concettuali di questi modelli sono composti da un potenziale di crescita compensatoria del restante polmone e l'attivazione della via adattativa indotta dalla pneumonectomia, o di danni iatrogeni del sistema vascolare polmonare dovutaper anastomosi arteria polmonare, sia confondendo gli effetti di aumento del flusso sanguigno polmonare.
Quando si crea uno shunt aorto-cavale e aumento del flusso sanguigno polmonare è indotta da un secondo colpo in ratti MCT-trattati, lesioni neointimale caratteristici si verificano, e una grave forma di IPA e insufficienza del ventricolo destro associato (RVF) sviluppano 3 settimane dopo l'aumento flusso 12. La progressione emodinamica della PAH in questo modello può essere valutata in vivo mediante ecocardiografia e cateterizzazione cardiaca destra. Il istomorfologia vascolare, spessore parete del vaso, il grado di arteriolare dell'occlusione, ed i parametri della disfunzione ventricolare destra costituiscono i pilastri della ex vivo caratterizzazione dei PAH.
Questo metodo descrive i protocolli dettagliati per la chirurgia aorto-cavale shunt (AC-shunt), il cateterismo cardiaco destro, e la valutazione qualitativa e quantitativa dei istomorfologia vascolare.
Protocollo
Le procedure che coinvolgono soggetti animali sono stati approvati dal Comitato Centrale olandese per la sperimentazione animale e il Comitato Animal Care presso University Medical Center di Groningen (NL). Entrambi sono stati utilizzati ratti Wistar e Lewis con pesi tra 180 e 300 g.
1. Corpo e acclimatazione
- Dopo l'arrivo presso l'impianto di animale centrale, ratti casa in gruppi di 5 per gabbia. Nel corso di un periodo di acclimatazione di 7 giorni, abituare i ratti per la manipolazione umana, ma non eseguire alcuna procedura sperimentale.
2. Preparazione e l'iniezione di sterile Monocrotalin
- Per 1 ml di 60 mg / mL monocrotalin (MCT) soluzione, pesare 60 mg di monocrotalin in una provetta 2 mL. Aggiungere 700 microlitri di 0.9% NaCl. Aggiungere 200 ml di 1 M HCl. Riscaldare la soluzione della provetta sotto acqua corrente calda e vortex esso. Utilizzare 6 N NaOH per portare il pH verso 7.0. Utilizzare una tecnica sterile per la preparazione di MCT per iniezione in roditori.
- Iniettare 1 ml di sterile 60 mg / mL soluzione MCT per kg per via sottocutanea nel collo (0,3 ml di 60 mg / mL MCT per 300 g ratto). NOTA: Non preferiamo usare volumi più piccoli a causa della maggiore probabilità che la dose iniettata non sarà opportuno.
3. Aorta-Caval Chirurgia Shunt
- Anestesia.
- Riempire la camera di induzione con 5% isoflurano / 100% O 2 (flusso: 1 L / min) e posizionare il topo nella camera. Verificare la presenza di un'adeguata profondità dell'anestesia eseguendo un pizzico dito posteriore. Pesare il ratto.
- Shave e pulire l'addome su una superficie che è di circa 8 cm e larga 3 cm. Posizionare il topo sul dorso su una stuoia di calore (37 ° C) coperta da una stuoia sterile.
- Posizionare il muso in una ventilazione in maschera / cappuccio con 2 - 3% isoflurano / 100% O 2 (flusso: 1 L / min). Controllare la profondità di anestesia eseguendo un pizzico dito posteriore. Applicare una pomata oculare per prevenire la secchezza mentre sotto anestesia.
- shunt Surgery.
- Macchia la pelle con cloruro-hexidine per la disinfezione. Iniettare 0,01 mg / kg per via sottocutanea di buprenorfina per l'analgesia post-operatoria.
- Utilizzare strumenti sterili per la chirurgia. Fare un'incisione con un # 10 bisturi nell'addome sulla linea mediana, a partire da 1 cm al di sotto del diaframma una che si estende verso il basso per appena sopra i genitali.
- Sollevare l'intestino con un tampone di cotone, coprire l'intestino in una sterile, garza bagnata (0,9% NaCl), e metterli al lato sinistro dell'animale.
- Usare tamponi di cotone per separare le membrane che fissano l'aorta addominale e la vena cava inferiore ai tessuti circostanti.
NOTA: Non sezionare le membrane tra l'aorta e la vena cava. - Utilizzando pinze scheggia, rimuovere il grasso aortica perivascolare appena sopra la biforcazione, solo sul lato destro dell'aorta e solo nel luogo in cui viene inserito l'ago.
- Usare tamponi di cotone per separare l'aorta e vena cava da mm supe 2rior al sito in cui verrà inserito l'ago in modo da creare lo spazio per un morsetto Biemer.
- In questa zona, il primo posto una legatura sciolto (5-0 di sutura) intorno all'aorta. Creare tensione legatura posizionando un morsetto Kocher su di esso, e quindi inserire il Kocher superiore all'incisione (Figura 1A). Posizionare il morsetto Biemer appena superiore alla legatura (Figur e 1A).
- Usando un tampone di cotone, comprimere la vena cava più distalmente possibile ostruire il flusso (Figura 1A). Bend un ago (18 G in questo protocollo) in un angolo di 45 gradi, con la punta dell'orifizio verso l'esterno (Figura 1A).
- Ad un angolo di 90 gradi, inserire l'ago in aorta, appena sopra la biforcazione, con l'orifizio della punta dell'ago a sinistra (Figura 1A). Manipolare la punta dell'ago a sinistra e inserirla nella vena cava.
NOTA: La punta dell'ago deve ora essere visiBLE nella vena cava (Figura 1B). - Utilizzare un secondo tampone di cotone per spingere il sangue rimanente nell'aorta fuori del sito di inserimento per prevenire la trombosi. Essiccare la zona intorno al shunt con una garza sterile affinché depositi di colla adeguatamente.
- Estrarre l'intero ago dal aorta e immediatamente applicare una goccia di colla tessuto sul sito di puntura in aorta. Assicurarsi di non incollare il tampone di cotone per il tessuto. Sganciare l'aorta.
- Verifica shunt manualmente tirando e rilasciando la legatura sul prossimale dell'aorta allo shunt. Allentamento dovrebbe colorare il distale della vena cava per lo shunt in rosso e creare turbolenze nel sito shunt.
NOTA: serraggio diventerà il sangue nella vena cava torna al rosso scuro. - Inserire l'intestino indietro nell'animale. Chiudere lo strato di muscolo e pelle con riassorbibili 4-0 punti di sutura. Ventilare l'animale con il 100% O 2 per recuperare da anestesia.
NOTA: Non lasciare un aniMal incustodito fino a quando non ha ripreso conoscenza sufficiente a mantenere decubito sternale.
- Chirurgia Sham.
- Eseguire tutte le procedure di cui sopra, tranne per l'inserimento dell'ago in aorta.
- la cura post-chirurgica.
- Posizionare il ratto in una singola gabbia e in un incubatore a 37 ° C fino alla mattina seguente.
- Intorno a 6 ore dopo l'intervento chirurgico, iniettare 0,01 mg / kg per via sottocutanea di buprenorfina per l'analgesia post-operatoria. Ripetere la mattina successiva se il ratto mostra segni di disagio.
NOTA: I primi 3 giorni dopo l'intervento chirurgico, i ratti tendono a mangiare e bere meno (questo è particolarmente importante quando chow o acqua potabile sono mescolati con la droga). La maggior parte dei ratti mostrano un comportamento normale 3 giorni dopo l'intervento. In caso contrario, seguire da vicino. La perdita di peso superiore al 15% in 1 settimana è considerato anormale, e tali ratti dovrebbe essere eutanasia per estrazione del volume di sangue circolante mentre sotto anestesia.
4. Sviluppo della PAH
NOTA: In questo protocollo, l'animale è eutanasia per l'estrazione del volume del sangue circolante mentre sotto anestesia.
- Sacrificio 1 giorno dopo l'intervento chirurgico (MF8) per le prime risposte cellulari e funzionale per aumento del flusso sanguigno polmonare (ad esempio, geni up-regolazione o fattori di trascrizione precoce).
- Sacrificio 1 settimana dopo l'intervento chirurgico (MF14) per un fenotipo PAH vascolare in stadio precoce (ipertrofia mediale senza lesioni neointimale).
- Sacrificio 2 settimane dopo l'intervento chirurgico (MF21) per un fenotipo PAH vascolare in stadio avanzato (marcata ipertrofia mediale e formazione neointimale) con un lieve aumento nel RVP e mPAP.
- Sacrificio 3 settimane dopo l'intervento chirurgico (MF28) per un fenotipo PAH vascolare allo stadio terminale (contrassegnato occlusione neointimale) e forte elevazione RVP e mPAP. I segni clinici di insufficienza ventricolare destra sono comuni in questa fase.
- Sacrificio dopo giorno 28 (MF-RVF) Per l'insufficienza del ventricolo destro PAH associata (RVF), clinicamente definita come la dispnea, grave letargia, e perdita di peso (<10% in 1 settimana). Termina ratti quando è presente uno di questi segni. Spesso, i ratti sviluppano questi sintomi tra i giorni 28 e 35 e, se lasciato incustodito, muoiono spontaneamente durante questo intervallo di tempo.
5. Diritto Cuore Catheterization
- Anestesia.
- Riempire la camera di induzione con il 5% isoflurano / 100% O 2 (flusso: 1 L / min) e posizionare il topo nella scatola. Verificare la presenza di un'adeguata profondità dell'anestesia eseguendo un pizzico dito posteriore. Pesare il ratto.
- Shave e pulire il collo a destra-ventrale del ratto e, per il protocollo ecocardiografia torace e dell'addome superiore.
- Posizionare il ratto sulla sua schiena su una stuoia di calore (37 ° C) e posizionare il muso in una ventilazione in maschera / cappuccio con 2 - 3% isoflurano / 100% O 2 (flusso: 1 L / min). Il muso deve essere affrontato verso il ricercatore.
- Controllare la profondità dell'anestesia. Fate attenzione con i ratti con grave PH. Se la frequenza cardiaca diminuisce, ridurre la profondità dell'anestesia. Preferibile, eseguire tutte le misure entro 20 min. Applicare una pomata oculare per prevenire la secchezza mentre sotto anestesia.
- protocollo ecocardiografia.
- Eseguire l'ecocardiografia secondo il protocollo descritto da Brittain et al. in JoVE 13.
- protocollo cateterizzazione.
NOTA: Questo protocollo utilizza una cannula rigida con una punta preformata piegato 20 gradi per guidare il catetere di silicio 15 cm con una sfera 2 mm dalla punta. Un ago 20-G con suo orifizio leggermente piegato verso l'interno viene utilizzato per inserire la cannula nella vena giugulare destra (vedere l'elenco dei materiali). Ratti in ogni fase della PAH progressione e di controllo possono essere utilizzati in questo protocollo.- Disinfettare il collo con il cloruro-hexidine. Fare un 1,5 cm incisione con un # 10 bisturi nella parte destra-ventraledel collo, dalla clavicola fino all'osso mandibolare.
- Stendere il tessuto con le forbici. Utilizzando una pinzetta, tirare delicatamente il tessuto a parte fino a quando appare la vena giugulare. Sezionare le membrane intorno alla vena giugulare con pinze scheggia.
- Mettere tensione sulla vena giugulare posizionando una legatura allentata (5-0 sutura) intorno al vaso. Aumentare la tensione e il nastro la legatura sulla maschera di ventilazione (Figura 2A).
- A valle del sito di inserimento, inserire una legatura allentata intorno al vaso per stringere dopo la cannula è in situ, per evitare perdite e la perdita di pressione.
- Utilizzando le maniglie di una pinza, piegare leggermente la punta di un ago 20-G con l'orifizio all'interno di condurre la cannula con il catetere.
- Introdurre la punta dell'ago 20-G nella vena e posizionare rapidamente la cannula contenente il catetere all'interno del vaso. Estrarre l'ago, e quindi chiudere la legaturache è stato preparato nel passaggio 5.3.4.
- Effettuare la cannula contenente il catetere nella vena giugulare. La punta della cannula è in una curva di 20 gradi (vedi punto 5.3.5). Manovra la cannula sotto la clavicola e far avanzare un po 'per entrare nell'atrio destro (Figura 2C).
- Per entrare nel ventricolo destro, puntare la punta della cannula verso sinistra, verso il cuore (Figura 2D). Sul monitor posto letto, una curva di pressione RV dovrebbe comparire, corrispondenti figura 2D.
- Quando la curva di pressione RV è costante, annotare la pressione del ventricolo destro sistolica e diastolica 1 (sRVP1 / dRVP1).
- Manipolare la punta della cannula e verso l'alto a sinistra. Far avanzare il catetere all'interno della cannula (Figura 2E).
- Avanzare il catetere nell'arteria polmonare principale (PA). Nessuna resistenza deve essere sentito quando si passa la valvola polmonare.
NOTA: Quando il catetere entra l'arteria polmonare principale, la dpressione iastolic aumenterà. Sul monitor posto letto, una curva di pressione PA dovrebbe comparire, corrispondenti Figura 2E. - Quando la curva di pressione PA è costante, annotare la pressione sistolica, diastolica e pressione media PA 1 (sPAP1, dPAP1, mPAP1).
- Ulteriori avanzare il catetere all'interno della cannula fino a quando la palla sulla punta del catetere viene incastrata in una arteria polmonare. Osservare la curva di pressione sulla goccia monitor al posto letto e abbinare la curva di pressione a cuneo in Figura 2F.
- Quando la curva di pressione cuneo è costante, annotare la pressione sistolica, diastolica e pressione media cuneo.
- Tirare indietro il catetere lentamente e successivamente misurare e annotare i valori per sPAP2, dPAP2, mPAP2, sRVP2, e dRVP2, come visualizzato sul monitor al posto letto.
- Quando, nel camper, un po 'tirare indietro la cannula e il catetere per misurare la pressione atriale destra (RAP) dire. La curva deve corrispondere alla curva di RAP in figura 2A.
NOTE: In questo protocollo, i topi sono eutanasia dopo il protocollo di cateterizzazione per l'estrazione del volume del sangue circolante mentre sotto anestesia.
6. Valutazione Morfologia e Morfometria
NOTA: In questo protocollo, l'animale è eutanasia per l'estrazione del volume del sangue circolante mentre sotto anestesia. Ratti in ogni fase della PAH progressione e di controllo possono essere utilizzati in questo protocollo.
- Dopo il sacrificio, estrarre i polmoni tagliando la trachea circa 5 mm al di sopra della biforcazione bronchiale ed i vasi che collegano i polmoni al cuore. Mettere i polmoni in soluzione salina fredda. Sezionare il polmone sinistro. Tagliare il bronco principale di sinistra alla biforcazione.
- Riempire una siringa da 50 ml con 4% paraformaldeide, collegare un tubo con una cannula alla siringa, e appendere la siringa circa un metro dal piano di lavoro. Montare la cannula nel bronco principale di sinistra per riempire passivamente il polmone con paraformaldeide.Maneggiare con cautela paraformaldeide.
- Incubare polmone sinistro in paraformaldeide per 48 h.
- Disidratare il polmone sinistro incubando consecutivamente in etanolo al 70% (1 h), 80% di etanolo (1 h), 90% di etanolo (1 h), 100% di etanolo (3 h), xilolo (2 h), e paraffine ( 2 h).
- Incorporare polmone sinistro in paraffina, con l'ilo del polmone di fronte alla cassetta.
- Macchiare le sezioni polmonari 4 micron inclusi in paraffina utilizzando una colorazione Verhoeff o Elastica-van Gieson, secondo le istruzioni del produttore 29. Assicurarsi che le lamine elastiche sono ben differenziate (come in figura 3). Eseguire la scansione delle sezioni colorate a 40X di ingrandimento.
- Dividere il polmone in 4 quadranti. In ogni quadrante, trovare 10 navi con un diametro esterno <50 micron (intra-acinose) e 10 navi con un diametro esterno> 50 micron (pre-acinose). Scatta una foto (2 x 40 immagini al polmone). Zoom in maniera casuale fino a 20x e fotografare ogni vasoin questo campo di vista per minimizzare errori di selezione.
- Esclusione navi che hanno / minor rapporto più lungo diametro> 2, di forma circolare incompleta, o un crollo di più di un quarto della parete del vaso.
NOTA: Un esempio di un recipiente escluso è mostrato in Figura 3b Rendere ogni immagine sullo stesso ingrandimento (40X) e comprendono una barra di scala. - Aprire ImageJ e la prima immagine. Tracciare una linea retta sulla barra di scala nella foto per impostare la scala tramite "Analyse" e "Set scala." Per "distanza nota," utilizzare il valore sulla barra della scala dell'immagine. Utilizzare micrometri (micron) come unità di lunghezza. Impostare la scala al globale.
- L'utilizzo di "selezioni a mano libera," disegnare una linea sul bordo interno della superficie luminale (Figura 3), e l'uso "su misura" (Crtl m) per misurare questa zona. Poi, tracciare una linea intorno al elast esternoic lamina (figura 3) per misurare l'area totale recipiente.
- Calcolare il luminale e diametro esterno (
 ) usando
) usando  .
. - Calcolare lo spessore della parete utilizzando
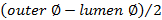 .
. - Calcolare il rapporto parete / lume utilizzando
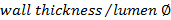 .
. - Calcolare il punteggio di occlusione tramite
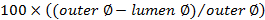 .
. - Punteggio l'imbarcazione su muscolarizzazione (no, parziale o totale muscolarizzazione) (Figura 3B).
NOTA: imbarcazioni con una doppia lamina elastica per più della metà della circonferenza sono definiti come totalmente muscularized. Le navi con una doppia lamina elastica inferiore alla metà della circonferenza sono definite come parzialmente muscularized. - Punteggio l'imbarcazione sulla presenza di un Neointima (sì o no) (Figura 3C).
NOTA: le navi senza lamina elastica interna ben definita in combinazione con occlusione (spesso eccentrico) luminale sono definiti come lesioni neointimale.
Risultati
Risultati rappresentativi sono presentati nella Figura 4. I risultati presentati mostrano caratteristiche di MCT + FLOW nei ratti di Lewis nei seguenti gruppi: controllo (n = 3), MF8 (n = 5), MF14 (n = 5), MF28 (n = 5), e MF-RVF ( n = 10). Le analisi statistiche sono state eseguite utilizzando il one-way ANOVA con correzione di Bonferroni.
60 mg / kg MCT e aumenta polmonare vantaggio il flusso di sangue ad un ...
Discussione
Questo metodo descrive la procedura chirurgica di uno shunt aorto-cavale nei ratti pre-trattati con MCT per creare PAH indotto dal flusso e le tecniche per valutare il principio emodinamico e punti finali istopatologici che caratterizzano PAH e questo modello.
I passaggi critici all'interno del protocollo e risoluzione dei problemi
Chirurgia e post-operatorio. Durante l'intervento shunt aorto-cavale, la fase più critica è la dissezione dell'aorta e ven...
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
This study was supported by the Netherlands Cardiovascular Research Initiative, the Dutch Heart Foundation, the Dutch Federation of University Medical Centers, the Netherlands Organization for Health Research and Development, and the Royal Netherlands Academy of Sciences (CVON nr. 2012-08, PHAEDRA, The Sebald fund, Stichting Hartekind).
Materiali
| Name | Company | Catalog Number | Comments |
| Shunt Surgery | |||
| Sterile surgical gloves | |||
| Duratears Eye ointment | Alcon | 10380 | |
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Histoacryllic tissue glue | B. Braun Medical | 1050052 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Safil 4-0 sutures violet resorbable | B. Braun Medical | ||
| 18 G needle | Luer | NN1838R BD | tip bent in 45 degrees orifice to the outside |
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Temgesic Buprenorphine | RB Pharmaceuticals | 5429 | subcutaneous injection |
| Sodium Chloride 0.9% | |||
| Ventilation mask Rat | |||
| Scalple blade | |||
| Biemer clamp 18 mm, 5 mm opening | AgnTho | 64-562 | |
| Heat mat | |||
| Kocher Clamp | |||
| Shaving machine | |||
| Microscope | Leica | ||
| Right Heart Catheterization | |||
| Sterile surgical gloves | |||
| Eye ointment | Duratears | ||
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Needle 20 G | Luer | Tip slightly bent to the inside | |
| Cannula 20 G | Luer | to introduce catheter, tip pre-formed in 20 degrees | |
| Silastic Catheter 15 cm long | 0.5 mm ball 2 mm from tip | ||
| Pressure transducer | Ailtech | ||
| Bedside monitor Cardiocap/5 | Datex-Ohmeda | ||
| Shaving machine | |||
| 10 mL Syringe | |||
| Sodium Chloride 0.9% | for flushing | ||
| Vascular Morphology | |||
| 50 mL Syringe | |||
| 4% Formaldehyde | |||
| 18 G cannula with tube | |||
| Verhoef staining kit | Sigma-Aldrich | HT254 | http://www.sigmaaldrich.com/catalog/product/sigma/ht254?lang=en®ion=US |
| Digital slide scanner | Hamamatsu | C9600 | |
| ImageJ | |||
| Elastic (Connective Tissue Stain) | Abcam | ab150667 | http://www.abcam.com/elastic-connective-tissue-stain-ab150667.html http://www.abcam.com/ps/products/150/ab150667/documents/ab150667-Elastic%20Stain%20Kit%20(website).pdf |
Riferimenti
- Hoeper, M. M., Bogaard, H. J., Condliffe, R., et al. Definitions and diagnosis of pulmonary hypertension. J Am Coll Cardiol. 62, D42-D50 (2013).
- Stacher, E., Graham, B. B., Hunt, J. M., et al. Modern age pathology of pulmonary arterial hypertension. Am J Respir Crit Care Med. 186 (3), 261-272 (2012).
- Levy, M., Maurey, C., Celermajer, D. S., et al. Impaired apoptosis of pulmonary endothelial cells is associated with intimal proliferation and irreversibility of pulmonary hypertension in congenital heart disease. J Am Coll Cardiol. 49 (7), 803-810 (2007).
- Sakao, S., Tatsumi, K., Voelkel, N. F. Reversible or irreversible remodeling in pulmonary arterial hypertension. Am J Respir Cell Mol Biol. 43 (6), 629-634 (2010).
- Gomez-Arroyo, J. G., Farkas, L., Alhussaini, A. A., et al. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 302 (4), L363-L369 (2012).
- Jones, J. E. Serial noninvasive assessment of progressive pulmonary hypertension in a rat model. Am J Physiol - Heart Circ Physiol. 283 (1), 364-371 (2002).
- Hoffman, J. I., Rudolph, A. M., Heymann, M. A. Pulmonary vascular disease with congenital heart lesions: Pathologic features and causes. Circulation. 64 (5), 873-877 (1981).
- van Albada, M. E., Berger, R. M. Pulmonary arterial hypertension in congenital cardiac disease--the need for refinement of the evian-venice classification. Cardiol Young. 18 (1), 10-17 (2008).
- Dickinson, M. G., Bartelds, B., Borgdorff, M. A., Berger, R. M. The role of disturbed blood flow in the development of pulmonary arterial hypertension: Lessons from preclinical animal models. Am J Physiol Lung Cell Mol Physiol. 305 (1), L1-L14 (2013).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovasc Res. 24 (5), 430-432 (1990).
- Okada, K., Tanaka, Y., Bernstein, M., Zhang, W., Patterson, G. A., Botney, M. D. Pulmonary hemodynamics modify the rat pulmonary artery response to injury. A neointimal model of pulmonary hypertension. Am J Pathol. 151 (4), 1019-1025 (1997).
- van Albada, M. E., Schoemaker, R. G., Kemna, M. S., Cromme-Dijkhuis, A. H., van Veghel, R., Berger, R. M. The role of increased pulmonary blood flow in pulmonary arterial hypertension. Eur Respir J. 26 (3), 487-493 (2005).
- Brittain, E. Echocardiographic assessment of the right heart in mice. JVis Exp. (e81), (2013).
- Dickinson, M. G., Bartelds, B., Molema, G., et al. Egr-1 expression during neointimal development in flow-associated pulmonary hypertension. Am J Pathol. 179 (5), 2199-2209 (2011).
- Borgdorff, M. A., Bartelds, B., Dickinson, M. G., Steendijk, P., de Vroomen, M., Berger, R. M. Distinct loading conditions reveal various patterns of right ventricular adaptation. Am J Physiol Heart Circ Physiol. 305 (3), H354-H364 (2013).
- Ruiter, G., de Man, F. S., Schalij, I., et al. Reversibility of the monocrotaline pulmonary hypertension rat model. Eur Respir J. 42 (2), 553-556 (2013).
- van Albada, M. E., Bartelds, B., Wijnberg, H., et al. Gene expression profile in flow-associated pulmonary arterial hypertension with neointimal lesions. Am J Physiol Lung Cell Mol Physiol. 298 (4), L483-L491 (2010).
- Dickinson, M. G., Kowalski, P. S., Bartelds, B., et al. A critical role for egr-1 during vascular remodelling in pulmonary arterial hypertension. Cardiovasc Res. 103 (4), 573-584 (2014).
- van der Feen, D. E., Dickinson, M. G., Bartelds, M. G., et al. Egr-1 identifies neointimal remodeling and relates to progression in human pulmonary arterial hypertension. Jheart lung transplant. 35 (4), 481-490 (2016).
- Rungatscher, A. Chronic overcirculation-induced pulmonary arterial hypertension in aorto-caval shunt. Microvasc Res. 94, 73-79 (2014).
- O'Blenes, S. B., Fischer, S., McIntyre, B., Keshavjee, S., Rabinovitch, M. Hemodynamic unloading leads to regression of pulmonary vascular disease in rats. J Thorac Cardiovasc Surg. 121 (2), 279-289 (2001).
- Sakao, S., Taraseviciene-Stewart, L., Lee, J. D., Wood, K., Cool, C. D., Voelkel, N. F. Initial apoptosis is followed by increased proliferation of apoptosis-resistant endothelial cells. FASEB J. 19 (9), 1178-1180 (2005).
- Spiekerkoetter, E. FK506 activates BMPR2, rescues endothelial dysfunction, and reverses pulmonary hypertension. J Clin Invest. 123 (8), 3600-3613 (2013).
- Nickel, N. P., Spiekerkoetter, E., Gu, M., et al. Elafin reverses pulmonary hypertension via caveolin-1-dependent bone morphogenetic protein signaling. Am J Respir Crit Care Med. 191 (11), 1273-1286 (2015).
- Meloche, J., Potus, F., Vaillancourt, M., et al. Bromodomain-containing protein 4: The epigenetic origin of pulmonary arterial hypertension. Circ Res. 117 (6), 525-535 (2015).
- Happé, C. M. Pneumonectomy combined with SU5416 induces severe pulmonary hypertension in rats. Am J Physiol Lung Cell Mol Physiol. 310 (11), L1088-L1097 (2016).
- Ranchoux, B., Antigny, F., Rucker-Martin, C., et al. Endothelial-to-mesenchymal transition in pulmonary hypertension. Circulation. 131 (11), 1006-1018 (2015).
- de Raaf, M. A. SuHx rat model: Partly reversible pulmonary hypertension and progressive intima obstruction. Eur Respy J. 44 (1), 160-168 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon