A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس واحد من HDAC1 والنشاط HDAC6 في الحلة الخلايا باستخدام أوهبلك--مرض التصلب العصبي المتعدد
* These authors contributed equally
In This Article
Summary
الأسلوب الحالي يساعد على تحديد isoform خاصة مثبطات هيستون ديسيتيلاسيس (هداك) في خلايا هيلا بتحليل أوهبلك--مرض التصلب العصبي المتعدد من ركائز متعددة. هذا أسلوب خال من الأجسام المضادة ليعكس النشاط HDAC1 و HDAC6 في المعيشة البيئة الخلية، على النقيض من فحوصات خالية من خلية واحدة-إيسوفورم.
Abstract
البحث عن جديد هيستون deacetylase (هداك) مثبطات زيادة الاهتمام باكتشاف العقاقير. تم الانتقائية Isoform في دائرة الضوء منذ الموافقة على روميديبسين، فئة أنا هداك مثبط لعلاج السرطان، والتحقيق السريرية من مثبطات HDAC6 محددة للورم النخاعي المتعدد. يتم استخدام الأسلوب الحالي لتحديد النشاط المثبطة لاختبار المركبات في HDAC1 و HDAC6 في الخلايا. ويقاس النشاط isoform استخدام فائقة الأداء اللوني السائل – تحليل الطيف الكتلي (أوهبلك مللي ثانية) من ركائز محددة المحتضنة مع خلايا هيلا المعالجة وغير المعالجة. ويمتاز الأسلوب يعكس النشاط هداك الذاتية داخل بيئة الخلية، على عكس الخلية الحرة البيوكيميائية فحوصات أجريت على isoforms معزولة. وعلاوة على ذلك، لأنه يقوم على التحديد الكمي لركائز الاصطناعية، الطريقة لا تتطلب الاعتراف بالضد من البروتينات أسيتيلاتيد الذاتية. أنها قابلة للتكيف بسهولة إلى عدة خطوط الخلايا وعملية تلقائية. وقد أثبتت الأسلوب مفيداً في إيجاد مركبات HDAC6 انتقائية في نيوروبلاستس. وترد النتائج الممثلة هنا بمعيار هداك مثبطات تريتشوستاتين (غير محددة)، MS275 (HDAC1 الخاصة)، وتوباستاتين (HDAC6-محدد) باستخدام خلايا هيلا.
Introduction
هداكس تنتمي إلى عائلة من الإنزيمات قادرة على ديسيتيلاتي هيستونيس داخل الهيكل الكروماتين. كما لدى غيرها ركائز البروتين سيتوسول وتقع في مختلف أقسام الخلية. إجمالي 18 هداك isoforms أنه تم التعرف حتى الآن وقد تم تتصل عدة آليات الخلية، بما في ذلك تنظيم عوامل النسخ والتعبير الجيني، فضلا عن إشارات الخلية والنقل1،2،3،،من45،،من67. مثبطات الحفاز هداك ظهرت كالعقاقير العلاجية المحتملة لعلاج السرطان. معظم مثبطات هداك معتمدة حاليا من قبل إدارة الأغذية والعقاقير لعلاج الأورام اللمفاوية تي خلية والورم النخاعي المتعدد، ومثبطات هداك غير محددة، مثل فورينوستات (ساها) وبيلينوستات وبانوبينوستات،من89. ومع ذلك، سلسلة من الآثار الجانبية ارتبطت مثبطات عموم، والبحث عن جزيئات صغيرة محددة isoform موضوع ساخن في اكتشاف الكيمياء والعقاقير الطبية. وبناء على ذلك، الفئة أنا روميديبسين مثبط انتقائي (HDAC1 3 و HDAC8) هو المخدرات معتمدة بالفعل10، بينما مثبطات HDAC6 محددة حاليا قيد التجارب السريرية، مع زيادة الإمكانات العلاجية في المايلوما11،،من1213،،من1415.
مثبطات تستند في الحضانة الركيزة هداك مع مصدر الانزيمية (isoform واحد، واستخراج النووية، أو خلية ليستي) فحص فحوصات لتوصيف هداك. الركيزة عادة تسلسل ببتيد صغيرة التي تحتوي على بقايا يسين أسيتيل بالإضافة فلوروفوري كليفابل (مثل الكومارين)، مثل N-(4-methyl-7-aminocoumarinyl)-Nα-(t-butoxycarbonyl)-Nω-acetyllysineamide (مال)16. للتمييز بين الأنشطة الخاصة isoform، فحوصات منفصلة الخلية الحرة التي تشمل كل isoform ضرورية، وقد لا تعكس نشاط isoform الحقيقية في الخلايا الحية. ركائز Isoform محددة متاحة تجارياً، مثل البنزيل (S)-[1-(4-methyl-2-oxo-2H-chromen-7-ylcarbamoyl)-5-propionylaminopentyl]carbamate (موكباك، HDAC1 الركازة محددة) و (إستر حامض ثالثي-بوتيل S)-[5-acetylamino-1-(2-oxo-4-trifluoromethyl-2H-chromen-7-ylcarbamoyl)pentyl]carbamic (باتكب، الركيزة محددة HDAC6) (الشكل 1B). ومع ذلك، خليط متعدد الركيزة التي تحتوي على القانون النموذجي للتحكيم، موكباك، ونظرا لأن الخلايا الحية باتكب لن يسمح الكشف عن المنتجات ديسيتيلاتيد الفردية بالقياس فلوروميتريك، نظراً لأن تتحمل فلوروفوري كليفابل نفس.
الأسلوب الموصوفة هنا يسمح للكشف والتحديد الكمي النسبي لكل الركيزة ومنتجاتها ديسيتيلاتيد في خلايا هيلا باستخدام مقايسة الركازة متعدد متبوعاً أوهبلك-ESI-MS/MS تحليل17. ويجري مقايسة هداك على خلايا هيلا للتمكين من التعرف مباشرة النشاط المثبطة هداك والخصوصية لاختبار المركبات على هداكس الذاتية. هناك تركيز على HDAC1 و HDAC6، والتي يتم تقييمها في وقت واحد. لتحقيق هذه القياسات الانزيمية في مقايسة حضانة واحدة، يتم إضافة خليط ركائز هداك غير محددة ومعينة إلى المعالجة وخلايا هيلا مطلي على لوحة 96-جيدا. في أعقاب خطوة حضانة، يتم تفكيك الخلايا على الإفراج ركائز ومنتجاتها رد فعل كل منهما، التي يتم فصلها والكشف عن استخدام أسلوب أوهبلك--مرض التصلب العصبي المتعدد (الشكل 1). منتجات ديسيتيلاتيد من ركائز القانون النموذجي للتحكيم، وموكباك، وباتكب هي مال ديسيتيلاتيد (دمال)، موكباك ديسيتيلاتيد (دموكباك) وباتكب ديسيتيلاتيد (دباتكب)، على التوالي. ويمكن بناء منحنيات الاستجابة للجرعة مع المركبات النشطة.
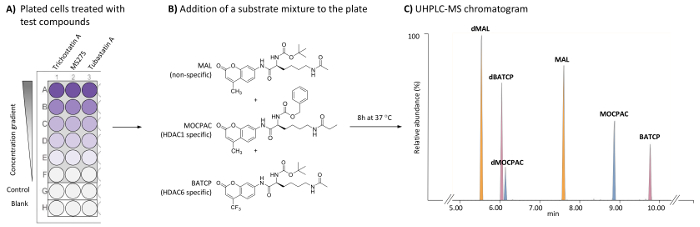
رقم 1: المخطط العام للمقايسة هداك يستند إلى الخلية لتحديد مثبطات محددة HDAC1 و HDAC6 بتحليل أوهبلك--مرض التصلب العصبي المتعدد من ركائز متعددة. (أ) مخطط نموذجي 96-جيدا لوحة يتضمن معاملة (اختبار المركبات) وخلايا هيلا غير المعالجة (مراقبة)، فضلا عن الفراغات خالية من الخلية. (ب) التركيب الكيميائي لركائز إضافة إلى أن ديسيتيلاتيد هداكس الذاتية كخليط (21 ميكرومتر في كل). (ج) chromatogram MS أوهبلك نموذجية تظهر القمم من ركائز المضافة (القانون النموذجي للتحكيم وموكباك وباتكب) ومنتجاتها ديسيتيلاتيد (دمال، دموكباك، ودباكتب، على التوالي). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Access restricted. Please log in or start a trial to view this content.
Protocol
1-خلية ثقافة
ملاحظة: يتم تنفيذ الخطوات التالية في غطاء زراعة الأنسجة قياسية. ومن المتوقع الإلمام بتقنية العقيمة.
- الثقافة خلايا هيلا إلى كونفلوينسي 80% في قارورة ثقافة الخليوي T75 في MEM تستكمل مع 10% مصل بقرى الجنين، البنسلين G (100 U/mL)، وستربتوميسين (100 مغ/مل).
ملاحظة: الخلية الثقافة والعلاج، وتحلل خطوات تجري تحت الاندفاق الصفحي، مع الخلية خطوات الحضانة عند 37 درجة مئوية في جو هوميديفيد من 5% CO2 تحت ظروف معقمة. - تغسل الخلايا مرتين مع 5 مل دببس ونضح في دببس وإضافة 1 مل كاشف تفكك الخلية. احتضان في 37 درجة مئوية لمدة 5 دقائق لفصل الخلايا.
- إضافة 9 مل من ذاكرة الثقافة المتوسطة ودقة ريسوسبيند تعليق خلية وعد الخلايا باستخدام هيموسيتوميتير.
- ضبط كثافة تعليق خلية إلى 6 × 104 خلايا/مل في ذاكرة.
- إضافة 100 ميليلتر من تعليق خلية لمراقبة واختبار الآبار لصفيحة 96-جيدا العقيمة، مسطحة القاع، والمعالجة بزراعة الأنسجة (الشكل 1A).
- إضافة 100 ميليلتر من مستنبت MEM للآبار فارغة من لوحة 96-جيدا (الشكل 1A).
- احتضان لوحة 96-جيدا في 37 درجة مئوية ح 24.
ملاحظة: حضانة 24 ساعة وقت مناسب لاختبار النشاط هداك الذاتية في خلايا هيلا. قد تحتاج أنواع الخلايا المختلفة مع النشاط هداك غير معروف بتقييم تيميكورسي لمراقبة الخلايا.
2-خلية العلاج مع اختبار المركبات وركائز هداك
- نضح المتوسطة من الآبار التي بليت 96-جيدا.
- إضافة 25 ميليلتر من 2 × اختبار مركبات (مثلاً، تريتشوستاتين، MS275، وتوباستاتين أ) في الذاكرة لاختبار الآبار. إضافة 25 ميليلتر من MEM لمراقبة وآبار فارغة.
ملاحظة: تركيز المركبات الاختبار إلى تعديل لتقديم طائفة من تركيزات الاختبار النهائي على الأقل 5 (تركيز واحد كل بئر). التركيز [دمس] النهائية في اختبار المركب لا ينبغي أن تتجاوز 0.5% وينبغي أن تكون هي نفسها في كل بئر، بما في ذلك الفراغات وعناصر التحكم. حجم حاضنات النهائي هو 50 ميليلتر كل بئر. يتم اختبار تريتشوستاتين بتركيزات 5 تتراوح من 500 إلى 1.95 نيوتن متر (1:4 إضعاف). يتم اختبار MS275 وتوباستاتين بتركيزات 5 تتراوح بين 8,000 إلى 6.17 نانومتر (تخفيف 1:6). وينبغي أن يحدده كل مستخدم على حدة تركيز الاختبار النهائي المطلوب لكل اختبار المركب بإنشاء منحنى استجابة لجرعة. - إضافة 25 ميليلتر من خليط الركازة (ميكرومتر 42 من القانون النموذجي للتحكيم وميكرومتر 42 من موكباك مكم 42 من باتكب في MEM) لمراقبة واختبار الآبار. إضافة 25 ميليلتر من MEM للآبار فارغة.
ملاحظة: يتم تركيز كل الركيزة النهائية 21 ميكرون. موكباك وباتكب التمييز بين النشاط HDAC1 و HDAC6، على التوالي (الشكل 1B). عندما يلاحظ أي نشاط مع ركائز تلك، يمكن أن يؤدي استخدام القانون النموذجي للتحكيم لتحديد النشاط ضد آخر هداك isoform. - احتضان لوحة 96-جيدا في 37 درجة مئوية ح 8 في 5% هوميديفيد CO2 حاضنة.
ملاحظة: هذه المرة حضانة مناسبة لخلايا هيلا ويسمح هداك الذاتية للتفاعل مع المواد الاصطناعية. خطوط الخلايا المختلفة قد تتطلب تعديلات في تركيز الوقت و/أو الركيزة الحضانة.
3-خلية تفسخ وإعداد نموذج أوهبلك-ESI-MS/MS
تنبيه: خطوات إعداد نموذج استخدام المواد الكيميائية العضوية، وشديدة الاشتعال والسمية بابتلاع أو استنشاق. ملابس الحماية الشخصية المناسبة، مثل القفازات ونظارات السلامة.
- إضافة 10 ميليلتر من 6 x RIPA المخزن المؤقت (المخفف من المخزن المؤقت x RIPA 10) تستكمل مع مثبط البروتياز لكل بئر من لوحة 96-جيدا.
- وقف رد الفعل بإضافة 160 ميليلتر من الاسيتو الانيتريل الباردة لكل بئر ومزيج من بيبيتينج صعودا وهبوطاً.
ملاحظة: الاحتفاظ الاسيتو الانيتريل في-20 درجة مئوية قبل هذه الخطوة. - ضع اللوحة في ثلاجة-80 درجة مئوية لمدة 10 دقائق.
- إزالة اللوحة من الثلاجة ونقل ميليلتر 220 المحتوى لكل بئر لصفيحة 96-جيدا مخروطية الشكل السفلي (الخامس-أسفل) غير معقمة،. الطرد المركزي لوحة مبلغ 000 5 × ز و 4 درجة مئوية لمدة 10 دقائق.
ملاحظة: هذه الخطوة تهدف إلى إزالة البروتينات والأملاح. إذا لزم الأمر، يمكن تحويلها إلى أنابيب الطرد المركزي المخروطية الفردية قبل الطرد المركزي الحلول أو تصفيتها من خلال مجموعة من 96-حسنا، 0.65 ميكرون PVDF لوحات عامل التصفية. مطلوب إزالة ترسبات نجاح قبل التحليل أوهبلك. - نقل 200 ميليلتر من المادة طافية (أو فيلتراتي) في لوحة 96-جيدا متوافقة مع نظام أوهبلك، وختم ذلك بإحباط بلابل، ايثلين باستخدام السدادة لوحة.
ملاحظة: تجنب بيبيتينج الكريات عند إزالة في سوبيرناتانتس. إذا كان لا يمكن إجراء تحليل أوهبلك فورا، يمكن تخزين اللوحة عند 4 درجة مئوية لمدة أقصاها 24 ساعة حتى التحليل.
4-أوهبلك/مرض التصلب العصبي المتعدد-MS التحليل
- إعداد نظام أوهبلك بملئه بنظام المرحلة المتنقلة (95% A:5% ب):
ج: ح2س، [هبلك]-الصف، تحتوي على حمض الفورميك 0.1% (تحضير 1 لتر)
باء: الاسيتو الانيتريل, [هبلك]-الصف الذي يحتوي على حمض الفورميك 0.1% (تحضير 1 لتر).
تنبيه: المرحلة المحمول يحتوي على المواد الكيميائية العضوية، وشديدة الاشتعال والسمية بابتلاع أو استنشاق. ملابس الحماية الشخصية المناسبة، مثل القفازات ونظارات السلامة. - ضع لوحة 96-جيدا في إدارة نموذج يحتوي على حامل لوحة. تشغيل العينات وفقا للشروط أوهبلك-ESI-MS/MS المنصوص عليها في الجدول 1.
ملاحظة: كل عمود من لوحة 96-جيدا التحليلية ينبغي أن يكون عنصر تحكم واحد جيدا وبئر فارغة واحدة (كما هو مبين في مخطط لوحة الشكل 1A). عناصر التحكم هي الممثل للنشاط الأنزيمي 100% في خط الخلية المختبرة، بينما هناك فراغات للتحقق ما إذا كان مصدر مرض التصلب العصبي المتعدد توفير خلفية متسقة. وينبغي التحقيق غير عادية من قمم MS اكتشفت في فراغ معين لمنع التغييرات الحساسية مرض التصلب العصبي المتعدد.
5-بيانات التحليل
- إدراج منطقة ذروة كل الركيزة ومنتجاتها ديسيتيلاتيد مع برنامج تكامل أوهبلك مناسبة.
ملاحظة: استخدم المعلمات التكامل التلقائي مع أسلوب التنعيم (يعني وحجم الإطار 3 عدد 2، على نحو سلس على سبيل المثال). استخدام الكروماتوغرافي الشروط المنصوص عليها في الجدول 1، شطف أمر دمال (5.8 دقيقة)، دباتكب (6.0 دقيقة)، دموكباك (6.2 دقيقة)، والقانون النموذجي للتحكيم (7.6 دقيقة)، موكباك (8.9 دقيقة) وباتكب (9.8 دقيقة)، كما هو مبين في الشكل 1. - لكل الركازة، حساب نسبة منطقة الذروة (ديسيتيلاتيد/أسيتيلاتيد) في كل تشروماتوجرام (عينات الاختبار والمراقبة).
- حساب تثبيط هداك النسبة المئوية لكل عينة الاختبار:
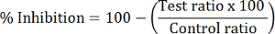
ملاحظة: يحسب تثبيط HDAC1 باستخدام نسبة منطقة ذروة دموكباك/موكباك؛ يتم حساب تثبيط HDAC6 مع دباتكب/باتكب. يمكن استخدام نسبة دمال/القانون النموذجي للتحكيم للتعبير عن تثبيط هداك العام.
Access restricted. Please log in or start a trial to view this content.
النتائج
تثبت تطبيق الأسلوب على تحديد مثبطات انتقائية وغير انتقائي ل HDAC1 (الفئة الأولى) و HDAC6 (الفئة IIb)، خلايا هيلا تعامل مع المركبات القياسية المعروفة: تريتشوستاتين A (غير انتقائية بين HDAC1 و HDAC6)18، MS275 (HDAC1-الانتقائية المانع)19، وتوباستاتين (مثبط انتقائي HDAC6)
Access restricted. Please log in or start a trial to view this content.
Discussion
تثبيط هداك موضوع ساخن في اكتشاف المخدرات، مع تركيز الحالي على مثبطات HDAC6 الانتقائي ل علاج السرطان21. عادة ما يتم تقييم الانتقائية هداك بسلسلة من فحوصات الفائق، والخلية الحرة، التي تنوي تحديد فاعلية مثبطة نحو الفردية هداك isoforms21. ولكن انتقائية المانع يجب بالإضافة إ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
الكتاب نعترف بتكلفة العمل CM1406 (البيولوجيا الكيميائية جينية). وأيد البحث عنها في هذا المنشور الأساس ميرسييه بيير.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| BATCP | Sigma-Aldrich | B4061 | |
| MAL | Sigma-Aldrich | SCP0168 | Synonym: BOC-Ac-Lys-AMC |
| MOCPAC | Sigma-Aldrich | M2195 | |
| MS275 | Sigma-Aldrich | EPS002 | |
| Trichostatin A | Sigma-Aldrich | T8552 | |
| Tubastatin A | Sigma-Aldrich | SML0044 | |
| Acetonitrile, HPLC grade | Fisher Scientific | 10660131 | |
| Formic acid, LC/MS grade | Fisher Scientific | 10596814 | |
| H2O, HPLC grade | distilled H2O filtered through a Milli-Q purification system | ||
| HeLa cells | ATCC | ATCC CRM-CCL-2 | |
| Cell dissociation reagent TrypLE Express | ThermoFisher Scientific | 12604013 | |
| DMSO, cell culture grade | Applichem | 146463 | |
| DPBS | ThermoFisher Scientific | 14190144 | |
| Fetal bovine serum | Biowest | S1810 | |
| MEM | ThermoFisher Scientific | 22561021 | |
| Penicillin-Streptomycin | Bioconcept | 4-01F00-H | |
| 10x RIPA buffer | Abcam | ab156034 | |
| SigmaFast protease inhibitor tablets | Sigma-Aldrich | S8820 | |
| 96-well plates, sterile, flat-bottom, tissue culture treated Corning | VWR | 29442-058 | |
| 96-well plates, non-sterile, V-bottom Corning | VWR | 29442-404 | used in the centrifugation step |
| 96-well plate, conical bottom, Nunc | ThermoFisher Scientific | 249944 | compatible with the Acquity UHPLC system |
| T75 cell culture flasks Corning | Sigma-Aldrich | CLS430641 | |
| Peelable heat sealing foil | Waters | 186002789 | |
| Acquity UPLC system | Waters | ||
| Eppendorf Centrifuge 5810 R | Fisher Scientific | 05-413-323 | |
| Integration software: MassLynx V4.1 | Waters | Catalog number not available | |
| Combi thermo-sealer SP-0669/240 | Waters | Catalog number not available | |
| Quattro micro API Tandem Quadrupole System | Waters | Catalog number not available |
References
- Arrowsmith, C. H., Bountra, C., Fish, P. V., Lee, K., Schapira, M. Epigenetic protein families: a new frontier for drug discovery. Nat Rev Drug Discov. 11 (5), 384-400 (2012).
- Henikoff, S., Greally, J. M. Epigenetics, cellular memory and gene regulation. Curr Biol. 26 (14), R644-R648 (2016).
- Kim, C., et al. HDAC6 inhibitor blocks amyloid beta-induced impairment of mitochondrial transport in hippocampal neurons. PLoS One. 7 (8), (2012).
- Kawaguchi, Y., et al. The deacetylase HDAC6 regulates aggresome formation and cell viability in response to misfolded protein stress. Cell. 115 (6), 727-738 (2003).
- Zhao, Y., et al. Acetylation of p53 at lysine 373/382 by the histone deacetylase inhibitor depsipeptide induces expression of p21(Waf1/Cip1). Mol Cell Biol. 26 (7), 2782-2790 (2006).
- Berger, S. L. Histone modifications in transcriptional regulation. Curr Opin Genet Dev. 12 (2), 142-148 (2002).
- Simões-Pires, C., et al. HDAC6 as a target for neurodegenerative diseases: what makes it different from the other HDACs? Mol Neurodegener. 8 (7), 1-16 (2013).
- Mottamal, M., Zheng, S., Huang, T. L., Wang, G. Histone deacetylase inhibitors in clinical studies as templates for new anticancer agents. Molecules. 20 (3), 3898-3941 (2015).
- Manal, M., Chandrasekar, M. J., Gomathi Priya, J., Nanjan, M. J. Inhibitors of histone deacetylase as antitumor agents: A critical review. Bioorg Chem. 67, 18-42 (2016).
- Mack, G. S. To selectivity and beyond. Nat Biotech. 28 (12), 1259-1266 (2010).
- U.S. National Institutes of Health. Study of ACY-1215 alone and in combination with bortezomib and dexamethasone in multiple myeloma (ACY-1215). , Available from: https://clinicaltrials.gov/ct2/show/NCT01323751 (1211).
- U.S. National Institutes of Health. Study of ACY-1215 in combination with lenalidomide, and dexamethasone in multiple myeloma. , Available from: https://clinicaltrials.gov/ct2/show/NCT01583283 (2012).
- U.S. National Institutes of Health. 13ACY-1215 (ricolinostat) in combination with pomalidomide and low-dose dex in relapsed-and-refractory multiple myeloma. , Available from: https://clinicaltrials.gov/ct2/show/NCT01997840 (2013).
- U.S. National Institutes of Health. Study of ACY-241 alone and in combination with pomalidomide and dexamethasone in multiple myeloma. , Available from: https://clinicaltrials.gov/ct2/show/NCT02400242 (2015).
- Yee, A. J., et al. Ricolinostat plus lenalidomide, and dexamethasone in relapsed or refractory multiple myeloma: a multicentre phase 1b trial. Lancet Oncol. 17 (11), 1569-1578 (2016).
- Jung, M. Homogenous non-isotopic assays for histone deacetylase activity. Expert Opin Ther Pat. 13 (6), 935(2003).
- Zwick, V., Simões-Pires, C., Cuendet, M. Cell-based multi-substrate assay coupled to UHPLC-ESI-MS/MS for a quick identification of class-specific HDAC inhibitors. J Enzyme Inhibi Med Chem. 31 (1), 209-214 (2016).
- Khan, N., et al. Determination of the class and isoform selectivity of small-molecule histone deacetylase inhibitors. Biochem J. 409 (2), 581-589 (2008).
- Glaser, K. B., et al. Differential protein acetylation induced by novel histone deacetylase inhibitors. Biochem Biophys Res Commun. 325 (3), 683-690 (2004).
- Butler, K. V., et al. Rational design and simple chemistry yield a superior, neuroprotective HDAC6 inhibitor, tubastatin A. J Am Chem Soc. 132 (31), 10842-10846 (2010).
- Jung, M., Yong, K. -J., Velena, A., Lee, S. Cell-Based Assays for HDAC Inhibitor Hit Validation. Epigenetic Targets in Drug Discovery. Sippl, W., Jung, M. , Wiley-VCH. (2010).
- Milli, A., et al. Proteomic analysis of cellular response to novel proapoptotic agents related to atypical retinoids in human IGROV-1 ovarian carcinoma cells. J Proteome Res. 10 (3), 1191-1207 (2011).
- Zwick, V., et al. Synthesis of a selective HDAC6 inhibitor active in neuroblasts. Bioorg Med Chem Lett. 26 (20), 4955-4959 (2016).
- Ciossek, T., Julius, H., Wieland, H., Maier, T., Beckers, T. A homogeneous cellular histone deacetylase assay suitable for compound profiling and robotic screening. Anal Biochem. 372 (1), 72-81 (2008).
- Heltweg, B., Dequiedt, F., Marshall, B. L., Brauch, C., Yoshida, M., et al. Subtype selective substrates for histone deacetylases. J Med Chem. 47 (21), 5235-5243 (2004).
- Copeland, R. A. Evaluation of enzyme inhibitors in drug discovery. , Wiley. (2005).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved