このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
HDAC1 と HDAC6 hela 細胞活性の同時測定セルを用いたクロマト MS
要約
本手法は複数基板の UHPLC MS 解析によるヒストン脱アセチル化酵素 (HDAC) HeLa 細胞でのアイソ フォーム特異阻害剤を識別するために提供しています。これは生活 HDAC1 と HDAC6 の活動を反映するように開発された抗体無料メソッド セル環境、単一アイソ フォーム細胞アッセイとは対照的。
要約
創薬における関心は高くなり新しいヒストン脱アセチル化酵素 (HDAC) 阻害剤の検索では。アイソ フォーム選択性ロミデプシン、クラス成立以来脚光を浴びている私は HDAC 阻害剤癌治療の多発性骨髄腫の特定の HDAC6 阻害剤の臨床的検討。現在のメソッドを使用して、HDAC1 とセルに HDAC6 試験化合物の阻害活性を決定します。アイソ フォームの活動は、超高速液体クロマトグラフィー-質量分析法 (クロマト ・ MS) 解析処理と未処理の HeLa 細胞と培養の特定の基板を使用して測定されます。メソッドには、分離のアイソ フォームで実施無料の細胞生化学的アッセイとは対照的、細胞環境で内因性 HDAC 活動を反映しての利点があります。さらに、それは合成基板の定量化に基づくが、ためメソッドは内生アセチル化タンパク質の抗体認識を必要ありません。それはいくつかの細胞株および自動化されたプロセスに容易に適応です。メソッドはすでに神経 HDAC6 選択的化合物を見つけることに有用な証明されています。典型的な結果をここに示します標準 HDAC 阻害剤トリコスタチン、(非特定の)、MS275 (HDAC1 固有の)、tubastatin (HDAC6 固有) を用いた HeLa 細胞と。
概要
Hdacs をしたはクロマチン構造中のヒストンを deacetylate することができる酵素の家族に属しています。また、細胞質で他の蛋白質の基質がある、細胞の様々 な区分であります。18 HDAC アイソ フォームの合計これまで同定されている細胞シグナル伝達し同様に、転写因子や遺伝子発現の調節など、いくつかの細胞メカニズムに関連しているし、1,2,3,4,5,6,7を輸送します。触媒の HDAC 阻害剤はがん治療のための潜在的な治療薬として浮上しています。ほとんど HDAC の抑制剤は、現在 FDA によって承認されて T 細胞リンパ腫、多発性骨髄腫の治療のため、ボリノスタット (サハ)、belinostat、パノビノスタット8,9などの非特異的 HDAC 阻害剤です。しかし、副作用のシリーズはパン阻害薬に関連付けられている、アイソ フォーム特異的小さな分子の検索は、薬効がある化学および薬剤の発見のホットな話題。したがって、クラス私 (HDAC1 3 と見られる HDAC8) の選択的阻害剤ロミデプシンは既に承認された薬10特定の HDAC6 阻害剤は、現在多発性骨髄腫11,12,13,14,15に高められた治療の可能性と、臨床試験中。
スクリーニング アッセイ HDAC を特徴づける阻害剤は酵素ソース (1 つのアイソ フォーム、核エキスまたは細胞ライセート) と HDAC 基板のインキュベーションに基づいています。基材は通常 N-(4-methyl-7-aminocoumarinyl)-Nα-(t-butoxycarbonyl)-Nω-acetyllysineamide (マル)16など分解蛍光体 (例えばクマリン) と結合したアセチル リジン残基を含む小さいペプチッド シーケンスです。アイソ フォーム固有のアクティビティを区別するために各アイソ フォームを含む別の無料のセル アッセイが必要と細胞内本物のアイソ フォームの活動を反映していないこと。アイソ フォーム固有の基板ベンジルなど、市販されている (S)-[1-(4-methyl-2-oxo-2H-chromen-7-ylcarbamoyl)-5-propionylaminopentyl]carbamate (MOCPAC、HDAC1 特異的基質) と (S)-[5-acetylamino-1-(2-oxo-4-trifluoromethyl-2H-chromen-7-ylcarbamoyl)pentyl]carbamic 酸 tert-ブチル エステル (BATCP、HDAC6 特異的基質) (図 1 b)。ただし、マルを含む複数基質混合物、MOCPAC、および BATCP 細胞に与えられるを許可しません個々 されたきちん製品の検出蛍光測定による同じ分解蛍光体を抱くことを考える。
ここで説明する方法は、検出と各基板とそのされたきちん製品 UHPLC-ESI ・ MS/MS 分析17続いてマルチ基板アッセイを用いた HeLa 細胞での相対的な定量化のためことができます。HDAC 阻害活性と内因性 hdacs をした試験化合物の特異性の直接同定法を有効に HeLa 細胞に HDAC アッセイを行ったHDAC1 と HDAC6 が同時に評価の焦点があります。単一培養の試金でこれらの酵素の測定を達成するため、96 ウェル プレートにメッキ処理と未処理の HeLa 細胞を非特異的, 特異 HDAC の基板上の混合物を追加します。インキュベーションのステップでは、次のセルは基板と区切られ、UHPLC-質量分析法 (図 1) を使用して検出された彼らのそれぞれの反応製品を解放する服従に分離します。マル、MOCPAC、および BATCP の基板のされたきちんの製品は、それぞれされたきちん MAL (dMAL)、されたきちん MOCPAC (dMOCPAC) とされたきちん BATCP (dBATCP) です。用量反応曲線は、活性化合物を構築できます。
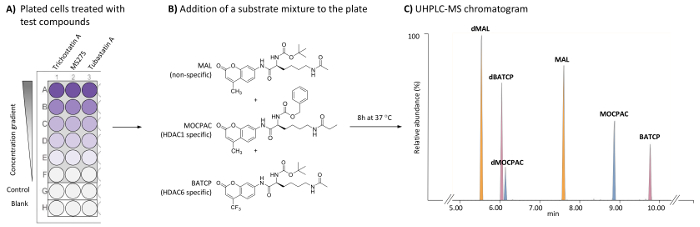
図 1: 複数基板の UHPLC MS 解析による HDAC1 固有、HDAC6 阻害剤を識別するために細胞を用いた HDAC 試金のための一般的な方式です。(A) 方式、標準の 96 ウェル プレート治療 (試験化合物を含む) の (無処理) HeLa 細胞と無細胞ブランク。(B) 混合物 (各 21 μ M) として内因性 hdacs をした、されたきちんするのに追加基板の化学構造。(C) (マル、MOCPAC、および BATCP) の追加基板とされたきちん製品のピークを示す典型的なクロマト ・ MS クロマト グラム (dMAL、dMOCPAC と dBACTP、それぞれ)。この図の拡大版を表示するのにはここをクリックしてください。
プロトコル
1. 細胞培養
注: 次の手順は、標準のティッシュ文化フードで実行されます。生殖不能の技術に精通するいるとされます。
- 10% 牛胎児血清ペニシリン G を添加した MEM でコート t75 フラスコ細胞培養用フラスコの 80% の confluency に HeLa 細胞の培養 (100 U/mL) とストレプトマイシン (100 mg/mL)。
注: セル文化、治療、および換散の手順は 5% CO2無菌条件下での加湿雰囲気で 37 ° C で細胞培養手順を伴う層流の下で行われます。 - DPBS 5 mL で 2 回洗浄、吸引、DPBS 細胞解離試薬 1 mL を加えます。セルをデタッチする 5 分の 37 ° C で孵化させなさい。
- MEM 培地の 9 mL を追加し、徹底的に細胞懸濁液を再懸濁します、診断を使用してセルをカウントします。
- 6 × 104セル/ml MEM に細胞懸濁液の密度を調整します。
- コントロールに細胞懸濁液 100 μ L を追加し、(図 1 a)、滅菌、平底、組織培養治療 96 ウェル プレートの井戸をテストします。
- 96 ウェル プレート (図 1 a) の空井戸に MEM 培地の 100 μ L を追加します。
- 24 h の 37 ° C で 96 ウェル プレートを孵化させなさい。
注: 24 時間培養は、HeLa 細胞の内因性 HDAC アクティビティをテストする適切な時間です。不明な HDAC 活動と異なるセル型は、制御の細胞の経時的評価を必要があります。
2 テスト混合物と HDAC 基板細胞治療
- 96 ウェル プレートの井戸から培地を吸引します。
- テスト混合物 x 2 を 25 μ l 添加(例えば、トリコスタチン A、MS275、tubastatin、) 井戸をテストする MEM で。コントロールと空白の井戸に MEM の 25 μ L を追加します。
注: テスト混合物の濃度は、少なくとも 5 の最終的な試験濃度 (ウェルあたり 1 つ濃度) の範囲を提供するために調整することです。化合物のテストで DMSO 最終濃度 0.5% を超えないようにする必要があります、空白やコントロールを含む、各ウェルで同じである必要があります。最終的なインキュベーション ボリュームは、ウェルあたり 50 μ L です。トリコスタチン A は 500 から 1.95 に至るまで 5 の濃度テスト nM (1:4 希釈)。6.17 8,000 に至る 5 濃度テストする MS275 と tubastatin A nM (希釈 1:6)。各々 のユーザーが目的の最終的なテスト各試験化合物濃度を決定して用量反応曲線を作成してください。 - コントロールとテスト井戸に基板の混合物 (マル、MOCPAC の 42 μ M と MEM で BATCP の 42 μ M 42 μ M) の 25 μ L を追加します。空井戸に MEM の 25 μ L を追加します。
注: 各基板の最終濃度は 21 μ M. MOCPAC と BATCP がそれぞれ HDAC1 と HDAC6 の活動の区別 (図 1 b)。エピウエハーと活動は認められなかったと、マルの使用可能性別 HDAC アイソ フォームに対する活動の id。 - 加湿 5% で 8 h の 37 ° C で 96 ウェル プレートを孵化させなさい CO2インキュベーター。
注: このインキュベーション時間は HeLa 細胞に適しており、合成の基質と対話する内因性 HDAC をことができます。細胞は培養時間および/または基板濃度の調整を必要があります。
3. 細胞換散およびクロマト ・ MS/MS のサンプル準備
注意: サンプルの準備の手順は非常に可燃性、摂取または吸入によって有害有機化学物質を使用します。呼吸用保護具、手袋、保護メガネなどを着用してください。
- X RIPA バッファーを 6 (10 x RIPA バッファーから希釈) 96 ウェル プレートの各ウェルにプロテアーゼ阻害剤を添加したの 10 μ L を追加します。
- 冷たいアセトニ トリルの 160 μ L を各ウェルに追加によって反作用を停止し、上下にピペッティングで混ぜます。
注: この手順の前に-20 ° C で、アセトニ トリルを続けます。 - 10 分間-80 ° C のフリーザーにプレートを配置します。
- 冷凍庫からプレートを削除し、各ウェルの内容の 220 μ L を生殖不能、円錐底 (V 下) 96 ウェル プレートに転送します。5,000 × g と 10 分のための 4 ° C でプレートを遠心します。
注: この手順は、蛋白質および塩の取り外しを目指しています。必要に応じて、ソリューションを遠心分離前に個々 の円錐形遠心チューブに転送または 0.65 μ m PVDF フィルター プレート 96 ウェルのセットをフィルター処理できます。沈殿物の成功の除去は、クロマト分析の前に必要です。 - UHPLC システムと互換性のある 96 ウェル プレートに上清 (または濾液) の 200 μ L を転送し、プレートのシーラーを使用して剥離、ヒートシールの箔シールします。
メモ: は、培養上清を削除する場合は、ペレットをピペッティングしないでください。クロマト分析を即座に実行できない場合は、分析まで 24 h 最大 4 ° C でプレートに格納できます。
4. UHPLC/MS-質量分析
- 移動相システム (95% A:5 %b) で塗りつぶすことにより UHPLC システムを準備します。
A: H2O、HPLC グレード 0.1% ギ酸を含む (1 L を準備)
B: アセトニ トリル、HPLC グレード, 0.1% ギ酸を含む (1 L の準備)。
注意: 移動相には、非常に可燃性、摂取または吸入によって有毒な有機化学物質が含まれています。呼吸用保護具、手袋、保護メガネなどを着用してください。 - 96 ウェル プレートは、プレート ホルダーを含むサンプル マネージャーに。表 1にクロマト ・ MS/MS 条件に従ってサンプルを実行します。
注: 分析の 96 ウェル プレートのすべての列も、よく 1 つのコントロールと 1 つの空白も (図 1 aのプレート方式で描かれている) です。コントロールが、ブランクがある MS ソースは一貫性のある背景を提供するかどうかを確認するテスト細胞の酵素活性を 100% の代表。指定された空白で検出された異常な MS ピークスは、MS 感度変更を防ぐために調べる必要があります。
5. データの解析
- 各基板とそのされたきちん製品のピーク面積を適切なの UHPLC 統合ソフトウェアに統合します。
注: は、平滑化手法 (平均、ウィンドウ サイズ 3 と 2 を例えば滑らかの数) と自動統合パラメーターを使用します。表1 クロマトグラフィー条件を使用して、溶出順序は、dMAL (5.8 分)、dBATCP (6.0 分)、dMOCPAC (6.2 分)、マル (7.6 分)、MOCPAC (8.9 分)、BATCP (9.8 分)、図 1に示されています。 - 各基板 (されたきちん/アセチル化) (テストおよび制御サンプル) 各クロマト グラムのピーク面積比を計算します。
- 各テスト サンプルのパーセント HDAC 阻害を計算します。
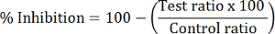
注: HDAC1 阻害は、dMOCPAC/MOCPAC; のピーク面積比を使用して、計算します。HDAC6 阻害は、dBATCP/BATCP と計算されます。比 dMAL/マルは、一般的な HDAC 阻害を表現する使用できます。
結果
メソッドの HDAC1 の非選択性選択的阻害物質の識別への応用を実証する (クラス I)、HDAC6 (IIb クラス)、HeLa 細胞は知られている標準的な化合物と扱われた: トリコスタチン A (非選択的 HDAC1 と HDAC6)18MS275 (HDAC1 選択的阻害剤)19、および tubastatin (HDAC6 選択的阻害剤)20。本法 (図 1) を使用して、IC5...
ディスカッション
HDAC 阻害は、がん療法21HDAC6 阻害の現在のフォーカスの創薬におけるホットな話題です。HDAC の選択性は通常個々 HDAC アイソ フォーム21に向けて抑制効力を判断する高スループット、携帯無料の試金のシリーズによって評価されます。しかし、阻害の選択性またによって確認されなければならない細胞のヒストンなどの内因性のタンパク質の基質のアセチル?...
開示事項
著者が明らかに何もありません。
謝辞
著者認めるコスト アクション CM1406 (エピジェネティックな化学生物学)。この出版物で報告された研究は、ピエール ・ メルシエ財団によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| BATCP | Sigma-Aldrich | B4061 | |
| MAL | Sigma-Aldrich | SCP0168 | Synonym: BOC-Ac-Lys-AMC |
| MOCPAC | Sigma-Aldrich | M2195 | |
| MS275 | Sigma-Aldrich | EPS002 | |
| Trichostatin A | Sigma-Aldrich | T8552 | |
| Tubastatin A | Sigma-Aldrich | SML0044 | |
| Acetonitrile, HPLC grade | Fisher Scientific | 10660131 | |
| Formic acid, LC/MS grade | Fisher Scientific | 10596814 | |
| H2O, HPLC grade | distilled H2O filtered through a Milli-Q purification system | ||
| HeLa cells | ATCC | ATCC CRM-CCL-2 | |
| Cell dissociation reagent TrypLE Express | ThermoFisher Scientific | 12604013 | |
| DMSO, cell culture grade | Applichem | 146463 | |
| DPBS | ThermoFisher Scientific | 14190144 | |
| Fetal bovine serum | Biowest | S1810 | |
| MEM | ThermoFisher Scientific | 22561021 | |
| Penicillin-Streptomycin | Bioconcept | 4-01F00-H | |
| 10X RIPA buffer | Abcam | ab156034 | |
| SigmaFast protease inhibitor tablets | Sigma-Aldrich | S8820 | |
| 96-well plates, sterile, flat-bottom, tissue culture treated Corning | VWR | 29442-058 | |
| 96-well plates, non-sterile, V-bottom Corning | VWR | 29442-404 | used in the centrifugation step |
| 96-well plate, conical bottom, Nunc | ThermoFisher Scientific | 249944 | compatible with the Acquity UHPLC system |
| T75 cell culture flasks Corning | Sigma-Aldrich | CLS430641 | |
| Peelable heat sealing foil | Waters | 186002789 | |
| Acquity UPLC system | Waters | ||
| Eppendorf Centrifuge 5810 R | Fisher Scientific | 05-413-323 | |
| Integration software: MassLynx V4.1 | Waters | Catalog number not available | |
| Combi thermo-sealer SP-0669/240 | Waters | Catalog number not available | |
| Quattro micro API Tandem Quadrupole System | Waters | Catalog number not available |
参考文献
- Arrowsmith, C. H., Bountra, C., Fish, P. V., Lee, K., Schapira, M. Epigenetic protein families: a new frontier for drug discovery. Nat Rev Drug Discov. 11 (5), 384-400 (2012).
- Henikoff, S., Greally, J. M. Epigenetics, cellular memory and gene regulation. Curr Biol. 26 (14), R644-R648 (2016).
- Kim, C., et al. HDAC6 inhibitor blocks amyloid beta-induced impairment of mitochondrial transport in hippocampal neurons. PLoS One. 7 (8), (2012).
- Kawaguchi, Y., et al. The deacetylase HDAC6 regulates aggresome formation and cell viability in response to misfolded protein stress. Cell. 115 (6), 727-738 (2003).
- Zhao, Y., et al. Acetylation of p53 at lysine 373/382 by the histone deacetylase inhibitor depsipeptide induces expression of p21(Waf1/Cip1). Mol Cell Biol. 26 (7), 2782-2790 (2006).
- Berger, S. L. Histone modifications in transcriptional regulation. Curr Opin Genet Dev. 12 (2), 142-148 (2002).
- Simões-Pires, C., et al. HDAC6 as a target for neurodegenerative diseases: what makes it different from the other HDACs?. Mol Neurodegener. 8 (7), 1-16 (2013).
- Mottamal, M., Zheng, S., Huang, T. L., Wang, G. Histone deacetylase inhibitors in clinical studies as templates for new anticancer agents. Molecules. 20 (3), 3898-3941 (2015).
- Manal, M., Chandrasekar, M. J., Gomathi Priya, J., Nanjan, M. J. Inhibitors of histone deacetylase as antitumor agents: A critical review. Bioorg Chem. 67, 18-42 (2016).
- Mack, G. S. To selectivity and beyond. Nat Biotech. 28 (12), 1259-1266 (2010).
- . Study of ACY-1215 alone and in combination with bortezomib and dexamethasone in multiple myeloma (ACY-1215) Available from: https://clinicaltrials.gov/ct2/show/NCT01323751 (1211)
- . Study of ACY-1215 in combination with lenalidomide, and dexamethasone in multiple myeloma Available from: https://clinicaltrials.gov/ct2/show/NCT01583283 (2012)
- . 13ACY-1215 (ricolinostat) in combination with pomalidomide and low-dose dex in relapsed-and-refractory multiple myeloma Available from: https://clinicaltrials.gov/ct2/show/NCT01997840 (2013)
- . Study of ACY-241 alone and in combination with pomalidomide and dexamethasone in multiple myeloma Available from: https://clinicaltrials.gov/ct2/show/NCT02400242 (2015)
- Yee, A. J., et al. Ricolinostat plus lenalidomide, and dexamethasone in relapsed or refractory multiple myeloma: a multicentre phase 1b trial. Lancet Oncol. 17 (11), 1569-1578 (2016).
- Jung, M. Homogenous non-isotopic assays for histone deacetylase activity. Expert Opin Ther Pat. 13 (6), 935 (2003).
- Zwick, V., Simões-Pires, C., Cuendet, M. Cell-based multi-substrate assay coupled to UHPLC-ESI-MS/MS for a quick identification of class-specific HDAC inhibitors. J Enzyme Inhibi Med Chem. 31 (1), 209-214 (2016).
- Khan, N., et al. Determination of the class and isoform selectivity of small-molecule histone deacetylase inhibitors. Biochem J. 409 (2), 581-589 (2008).
- Glaser, K. B., et al. Differential protein acetylation induced by novel histone deacetylase inhibitors. Biochem Biophys Res Commun. 325 (3), 683-690 (2004).
- Butler, K. V., et al. Rational design and simple chemistry yield a superior, neuroprotective HDAC6 inhibitor, tubastatin A. J Am Chem Soc. 132 (31), 10842-10846 (2010).
- Jung, M., Yong, K. -. J., Velena, A., Lee, S., Sippl, W., Jung, M. Cell-Based Assays for HDAC Inhibitor Hit Validation. Epigenetic Targets in Drug Discovery. , (2010).
- Milli, A., et al. Proteomic analysis of cellular response to novel proapoptotic agents related to atypical retinoids in human IGROV-1 ovarian carcinoma cells. J Proteome Res. 10 (3), 1191-1207 (2011).
- Zwick, V., et al. Synthesis of a selective HDAC6 inhibitor active in neuroblasts. Bioorg Med Chem Lett. 26 (20), 4955-4959 (2016).
- Ciossek, T., Julius, H., Wieland, H., Maier, T., Beckers, T. A homogeneous cellular histone deacetylase assay suitable for compound profiling and robotic screening. Anal Biochem. 372 (1), 72-81 (2008).
- Heltweg, B., Dequiedt, F., Marshall, B. L., Brauch, C., Yoshida, M., et al. Subtype selective substrates for histone deacetylases. J Med Chem. 47 (21), 5235-5243 (2004).
- Copeland, R. A. . Evaluation of enzyme inhibitors in drug discovery. , (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved